7-8. tbl. 107. árg. 2021
Fræðigrein
Óráð og hiti – sjaldgæf en hættuleg orsök. Sjúkratilfelli
Delirium and fever – a rare but dangerous cause - Case report
doi 10.17992/lbl.2021.0708.646
Höfundar fengu samþykki sjúklingsins fyrir þessari umfjöllun og birtingu.
Ágrip
Sótthiti með óráði er algengt vandamál á bráðamóttökum og legudeildum sjúkrahúsa. Mismunagreiningar eru fjöldamargar og við uppvinnslu þessara sjúklinga er mikilvægt að hafa þær allar í huga. Sýkingar eru ofarlega á lista vegna bráð- og alvarleika en aðrar mismunagreiningar geta einnig verið hættulegar heilsu og þarfnast skjótrar greiningar og meðferðar.
Hér er rakin sjúkrasaga 58 ára gamals manns sem kom á bráðamóttöku með hækkaðan líkamshita og óráð. Vönduð sögutaka og skoðun ásamt hnitmiðuðum rannsóknum gaf sjúkdómsgreiningu sem leiddi til viðeigandi meðferðar.
Sjúkratilfelli
Sjúklingurinn er 58 ára karlmaður sem var sendur á bráðamóttöku Landspítala í fylgd lögreglu vegna ruglástands. Litlar upplýsingar fengust um aðdraganda veikindanna frá sjúklingi sjálfum. Samkvæmt upplýsingum frá lögreglu hafði ruglástand verið til staðar í einhverja daga og einnig var lýst einkennilegri hegðun sjúklings. Sjúklingur sagðist hafa sofið lítið dagana fyrir komu á bráðamóttöku og hafði neytt áfengis í litlu magni. Aðspurður neitaði sjúklingur sögu um hósta, hita, hroll, höfuðverk, nefstíflu, hálsbólgu, einkennum frá þvagfærum, niðurgangi, ógleði og uppköstum.
Sjúklingur var með fyrri sögu um geðhvarfaröskun gerð 1 og var því á meðferð með litíum, klórprótixen og ólansapín. Auk þess tók sjúklingur zópíklón við svefntruflunum. Vegna litíum-meðferðar var sjúklingur með langvinnan skjálfta en við því tók hann própranólól.
Við fyrstu skoðun á bráðamóttöku var sjúklingur vakandi og áttaður á stað, stund og persónu. Hann var hitalaus, með hækkaðan blóðþrýsting og með merki um þurrk en öndunartíðni, súrefnismettun og hjartsláttartíðni voru eðlileg. Líkamsskoðun var án athugasemda og ekki mátti greina skjálfta eða stirðleika í útlimum. Gefinn var vökvi í æð ásamt þíamíni. Blóðrannsóknir sýndu verulega hækkun á sermisgildi litíum (3,0 mmól/L, efri meðferðarmörk 1,2 mmól/L), hækkun á kreatiníni og vægan natríumskort. Ekki mældist etanól í blóði. Hjartalínurit (EKG) sýndi sínustakt án bráðra breytinga.
Óskað var eftir áliti geðlækna. Þegar sú skoðun fór fram var sjúklingur illa áttaður, gaf óskýra sögu og athygli var slitrótt. Talþrýstingur var eðlilegur, geðslag lækkað og geðbrigði (affect) flöt. Ekki komu fram vísbendingar um ranghugmyndir, of- eða misskynjanir. Sjúklingur muldraði talsvert í samtalinu en svaraði spurningum.
Sjúklingur var greindur með litíum-eitrun og verulegan þurrk ásamt fylgikvillum þessa, það er bráðan nýrnaskaða og brátt rugl án geðrofs. Hann var lagður inn á geðdeild, litíum og zópíklón stöðvað en gjöf klórprótixen og ólansapín var haldið áfram. Klórdíasepoxíð var gefið í stuttan tíma vegna hættu á áfengisfráhvörfum. Nóttina eftir komu á bráðamóttöku var sjúklingur verulega illa áttaður, mikið á ferli og bar á talsverðu rugli. Þá fór skjálfti í útlimum vaxandi. Um kvöldið næsta dag fékk hann háan hita (39,3 °C) og fór að hósta. Tekið var háls- og nefkoksstrok í veiruleit og var hann sendur á bráðamóttökuna að nýju.
Þegar sjúklingur kom á bráðamóttöku frá geðdeild, innan við sólarhring frá innlögn, var meðvitund hans áberandi skert (9 til 11 stig á Glasgow Coma Scale (GCS)). Sjúklingur var áfram með háan hita (39-40 °C) og hraðan hjartslátt og nú var áberandi tannhjólastirðleiki í útlimum en engir kippir komu fram við skoðun. Lungnamynd sýndi daufa íferð í hægra lunga en tölvusneiðmynd (TS) af höfði sýndi engar bráðar breytingar. Hjartalínurit var án athugasemda. Hækkun var á hvítum blóðkornum (HBK) í blóðrannsókn með vægri fækkun á eitilfrumum, eðlilegum kreatín-kínasa (CK) og eðlilegri skjaldkirtilsstarfsemi. Litíumgildi í blóði var þá komið niður í 0,3 mmól/L.
Sjúklingur fékk flúmaseníl og nalóxón án breytinga. Hann var settur á seftríaxón við mögulegri bakteríulungnabólgu og asíklóvír vegna hugsanlegrar veiruheilabólgu (azítrómýsín var bætt við síðar). Hann fékk parasetamól, ríkulegt magn vökva í æð, klórdíasepoxíð við áfengisfráhvörfum og þíamín í æð. Ástand sjúklings batnaði lítið og hann lagðist í kjölfarið inn á lyflækningadeild. Stuttu síðar var sjúklingur með áberandi mikla þvaglosun. Teknar voru blóðprufur sem sýndu hækkandi natríum (150 mmól/L, efri mörk 145 mmól/L) og því vaknaði upp grunur um flóðmigu á stigi nýrna (nephrogenic diabetes insipidus), sem er þekktur fylgikvilli litíum-eitrunar. Öll geðlyf voru stöðvuð tímabundið og hafin var meðferð með 5% glúkósa í æð.
Um tveimur dögum síðar fór meðvitundarástand sjúklings versnandi. Hann gaf sjálfur enga sögu, var illa áttaður, umlaði og svaraði ekki skýrt spurningum, metinn með 9 stig á GCS. Við skoðun var hann fölur en heitur viðkomu, áfram með háan blóðþrýsting og með hraðslátt (100-120 slög á mínútu) ásamt hækkun á öndunartíðni (22 andardrættir á mínútu). Hiti var 37,9 °C á hitalækkandi meðferð með parasetamóli. Sjáöldur voru eðlilega víð, samhverf og brugðust eðlilega við ljósi. Lítil sjálfsprottin hreyfing var til staðar en við óvirka hreyfingu var mjög mikill stífleiki í útlimum, á víxl með og án tannhjólamynsturs. Enginn hvíldarskjálfti og engir kippir voru greinanlegir við skoðun en hann var með dreifð þreifieymsli í vöðvum. Teknar voru blóðprufur sem sýndu hækkandi HBK, lækkandi eitilfrumur, vægt blóðleysi með eðlilegri stærð rauðra blóðkorna, lækkandi natríum (146 mmól/L) en talsvert hækkaður CK (883 U/L, efri mörk 280 U/L), D-dímer og mýóglóbín. Blóðrannsókn sýndi einnig lækkað járn með ferritín innan marka.
Sjúklingurinn var með hækkaðan hita, stíf-leika í vöðvum, minnkandi meðvitund, viðvarandi háþrýsting og sínushraðslátt af óþekktri orsök. Jafnframt hafði sjúklingur verið nýlega á meðferð með tveimur geðrofslyfjum (ólansapín og klórprótixen), hafði klínísk teikn um þurrk og mældist með litíum yfir eitrunarmörkum. Blóðrannsóknir sýndu marktæka bólgusvörun og merki um rákvöðvarof (rhabdomyolysis). Sterkur grunur vaknaði um illkynja heilkenni af völdum sefandi lyfja (neuroleptic malignant syndrome eða NMS). Á þeim tíma var vökvagjöf í æð aukin (Ringer asetat 200 mL/klukkustund) í ljósi þurrks og vöðvaniðurbrots. Gefið var lórasepam 1 mg fjórum sinnum á sólarhring í æð en klór-díasepoxíð stöðvað.
Næsta dag var meðvitund minnkandi, metin þrjú til 5 stig á GCS en stífleiki í vöðvum var minnkandi. Í samstarfi við taugalækna var gerð mænuástunga og mænuvökvi sendur í rannsóknir sem sýndu eðlilegt magn af HBK, glúkósa og prótínum en rauð blóðkorn voru í miklum mæli (talin tengjast ástungunni sjálfri); sýklarannsóknir voru eðlilegar. Segulómskoðun af heila var án athugasemda en nýjar blóðrannsóknir sýndu áfram hækkandi natríum (149 mmól/L), eðlilegt trópónín T, eðlileg lifrargildi og blóð-gös án breytinga.
Sjúklingur var í kjölfarið klínískt greindur með NMS (neuroleptic malignant syndrome). Tilfelli var rætt ítarlega við gjörgæslulækna, sem töldu ekki þörf á gjörgæsluinnlögn á þeim tímapunkti en það yrði fljótt endurmetið ef klínískt ástand versnaði. Ákveðið var í samráði við tauga- og gjörgæslulækna að gefa ekki dantrólen eða brómókriptín en halda áfram stuðningsmeðferð með vökva í æð og lórasepam. Haldið var áfram með dalteparín, seftríaxón og azítrómýsín, en sýklalyfjameðferð var þó stöðvuð stuttu síðar. Ákveðið var að fá heilalínurit til að útiloka flogavirkni en sú rannsókn sýndi verulega aukningu á ósértækri útbreiddri hægbylgjuvirkni.
Haldið var áfram með endurteknar gjafir lórasepam í æð ásamt almennri stuðningsmeðferð og lífsmörk urðu fljótt stöðug. Natríum var vægt hækkað í nokkra daga en náði loks eðlilegum gildum um viku eftir að vökvameðferð var hafin. Fjórum dögum frá greiningu NMS fór hann að opna augun við ávarp og gaf frá sér einföld hljóð. Lórasepam-gjöfum var fækkað samhliða batnandi meðvitundarástandi og var hann í daglegri sjúkraþjálfun á legudeild. Rúmlega mánuði eftir að hann lagðist fyrst inn á sjúkrahúsið var hann farinn að ganga með lágri göngugrind og fluttist yfir á endurhæfingardeild til frekari meðferðar. Á þeirri deild var batinn hægur en stígandi og eftir tveggja mánaða endurhæfingu var hann farinn að geta gengið um án gönguhjálpartækja.
Vegna vaxandi kvíða var hafin meðferð með escitalopram. Í endurhæfingunni bar á áberandi hvíldarskjálfta, mest í vinstri handlegg. Hann var einnig með tannhjólastirðleika í vinstri handlegg. Eftir ráðgjöf taugalækna vaknaði grunur um Parkinson-sjúkdóm en sjúklingur hafði lengri sögu um skjálfta, sem var talinn tengjast litíum-meðferð. Í framhaldi af því var hafin meðferð með levódópa ásamt benserasíði sem sjúklingur svaraði einungis lítillega. Eftir frekara mat voru einkenni hans einnig talin geta samræmst utanstrýtueinkennum vegna fyrri geðrofslyfjameðferðar og því var að lokum ákveðið að stöðva meðferðina með levódópa/benserasíði. Á næstu mánuðum fóru þessi einkenni minnkandi án frekari inngripa. Í samráði við geðlækni hans byrjaði hann síðan aftur á litíum við geðhvarfaröskun en ákveðið var að bíða með dópamínhemjandi geðrofslyf.
Umræða
Þetta sjúkratilfelli lýsir birtingarmynd, greiningu og meðferð sjaldgæfs en alvarlegs fylgikvilla lyfjameðferðar með dópa-mín-hemjandi lyfjum. Í ljósi þess hve alvarlegur þessi fylgi-kvilli er, ásamt nauðsyn skjótrar greiningar og meðhöndlunar, er umfjöllun mikilvæg.
Geðrofslyfjameðferð getur valdið margs konar aukaverkunum til skemmri og lengri tíma. Alvarlegasta aukaverkunin er þó illkynja heilkenni af völdum sefandi lyfja (NMS). Það er sjaldgæft en lífshættulegt taugaheilkenni sem tengist aðallega notkun geðrofslyfja, en öll lyf sem valda NMS eiga það sameiginlegt að hafa áhrif á boðskipti dópamíns.1,2 Dánarhlutfall er metið í kringum 5-20% og þó um sé að ræða sjaldgæfan fylgikvilla ber að hafa hann í huga ef samræmanleg einkenni koma fram.1-4
Nákvæm orsök NMS er ekki þekkt; hins vegar er ljóst að hömlun á virkni dópamínviðtaka er nauðsynlegur liður í þróun heilkennisins. Til að mynda getur minnkuð virkni dópamínviðtaka í miðtaugakerfi valdið hita og stífleika í vöðvum ein og sér. Einnig getur þessi minnkaða virkni truflað stjórn á ósjálfráða taugakerfinu, sem getur um leið valdið brenglun á hitadreifingu, auknum efnaskiptum í vöðvum, auknum samdrætti vöðva og óstöðugleika á blóðþrýstingi og hjartslætti.1
Talið er að NMS geti komið fram við notkun allra lyfja sem hindra dópamínviðtaka en þar eru geðrofslyf mest áberandi.1,2 NMS er frekar tengt við notkun dæmigerðra geðrofslyfja (til dæmis halóperidól, klórprómasín, flúfenasín og klórprótixen) en getur einnig komið við notkun ódæmigerðra geðrofslyfja (til dæmis ólansapín, klósapín, risperidón, quetíapín, zíprasidón, aripiprasól og amisúlpríð). Auk þessara lyfja hefur NMS verið tengt við ógleðilyf (dróperidól, domperidón, metóklópramíð, prómetasín og próklórperasín) og nokkur önnur lyf (tetrabenasín, reserpín, amoxapín, litíum, trimipramín) sem öll eiga það sameiginlegt að geta truflað virkni dópamíns.1,2
Þrátt fyrir ofangreint er NMS háð séreigind (idiosyncratic) hvers og eins lyfs fyrir sig og getur þannig sést í hvaða skömmtum sem er og hvenær sem er í meðferðarferli einstaklings.3 Það eru þó vissir þættir sem eru taldir auka á líkur NMS en þar ber helst að nefna notkun dæmigerðra geðrofslyfja og þegar hærri skammtar eru gefnir. Algengast er að sjá NMS á fyrstu tveimur vikum meðferðar. Aðrir þættir hafa verið tengdir NMS, til dæmis notkun margra dópamínhemjandi lyfja saman, inntaka litíum, þurrkur og bráð veikindi af margvíslegum toga, en ekki hefur verið sýnt fram á skýrt orsakasamhengi.1,2
NMS einkennist af fjórum einkennum eða teiknum, sem hvert og eitt er til staðar í yfir 97% tilfella heilkennisins:1,2,6-9
- Breyting á geðslagi er algengasta upphafseinkennið og byrjar gjarnan sem pirringur og óáttun sem þróast síðan yfir í meðvitundarleysi.
- Stífleiki í vöðvum sem er dreifður, oftast án tannhjólamynsturs. Önnur taugaeinkenni geta verið skjálfti, tannhjólastífleiki, vöðvaspennutruflun, fettikrampi (opisthotonus), kjálkastjarfi (trismus), rykkjabrettur (chorea), aukin munnvatnsmyndun, tal- og kyngingartruflun.
- Hiti sem oftast er hærri en 38 °C og getur farið upp fyrir 40 °C í allt að 40% tilfella.
- Óstöðugleiki í ósjálfráða taugakerfi, en hann birtist sem hraður hjartsláttur (algengast), hár blóðþrýstingur sem er sveiflukenndur, aukin öndunartíðni og svitamyndun eða hjartsláttartruflanir. Þessi birtingarmynd NMS er talin vera hættulegust og getur valdið dauða sjúklings.
Margvíslegir fylgikvillar geta komið fram í NMS, bæði sem bein afleiðing eða óbein vegna samverkandi sjúkdóma. Nokkur dæmi koma fyrir í töflu I.1-4,7-9
 NMS er klínísk greining sem byggir á góðri sjúkrasögu og líkamsskoðun sjúklings.1,2 Engin rannsókn er nægilega næm eða sértæk til greiningar á NMS, hins vegar geta rann-sóknir stutt við greiningu og útilokað aðrar mismuna-greiningar. Blóðrannsóknir geta sýnt eftirfarandi:1,2,7,8
NMS er klínísk greining sem byggir á góðri sjúkrasögu og líkamsskoðun sjúklings.1,2 Engin rannsókn er nægilega næm eða sértæk til greiningar á NMS, hins vegar geta rann-sóknir stutt við greiningu og útilokað aðrar mismuna-greiningar. Blóðrannsóknir geta sýnt eftirfarandi:1,2,7,8
- Hækkað CK helst í hendur við stífleika í vöðvum.
- Hækkun á HBK er algeng og þá oftar hækkun á daufkyrningum (neutrophils).
- Hækkun á laktat-dehýdrógenasa (LDH), alkalískum fosfatasa (ALP), alanín-amínótransferasa (ALAT) og aspartat-amínótransferasa (ASAT).
- Saltbrenglanir eru oft til staðar, algengastar eru kalk- og magnesíumskortur, hækkun eða lækkun á natríum, hækkun á kalíum eða blóðsýring.
- Hækkun á kreatiníni sést oft vegna bráðs nýrnaskaða í kjölfar rákvöðvarofs og útskilnaðar á mýóglóbíni í þvagi.
- Lækkun á járni getur verið til staðar en er ósértæk breyting.
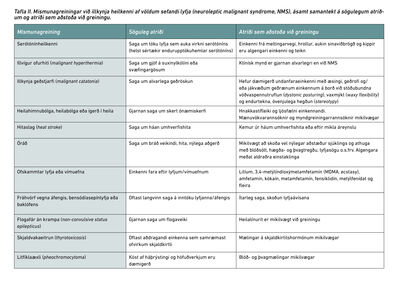
Frekari uppvinnsla er í takt við hugsanlegar mismunagreiningar og afleiðingar NMS. Sérstaklega er mat á truflunum á saltbúskap og sjúkdómum í miðtaugakerfi mikilvægt. Mikilvægasta mismunagreiningin í þessu tilfelli er serótónínheilkenni í ljósi þess að sjúklingurinn var einnig á serótónínvirkum lyfjum. Hiti, vöðvastífleiki og óstöðugleiki í ósjálfráða taugakerfinu sjást bæði í NMS og serótónínheilkenni. Almennt eru hiti og vöðvastífleiki vægari í serótónínheilkenni og algengara er að sjá þar einkenni frá meltingarfærum, ofvirk sinaviðbrögð og ósjálfráða kippi í vöðvum (myoclonus). Í ljósi þeirra einkenna og teikna sem voru mest áberandi hér var talið líklegra að um NMS væri að ræða. Helstu mismunagreiningar NMS má sjá í töflu II.1,2,7-10
 Mikilvægasta meðferðin við NMS er að stöðva öll dópa-mín-hemjandi lyf og veita stuðningsmeðferð. Í bráðafasanum ætti einnig að stöðva öll samverkandi lyf, til dæmis andkólínvirk lyf, litíum og serótónínvirk lyf. Þörf er á öflugri stuðningsmeðferð og eftirliti og því er mælt með innlögn á gjörgæslu. Gefa þarf ríkulega af vökva í æð og lækka sótthita eins og hægt er. Stundum er þörf á að beita aðferðum til ytri eða innri kælingar ef hiti er mjög hár. Mikilvægt er að viðhalda eðlilegum blóðþrýstingi og er meðferð með klónidín eða öðrum blóðþrýstingslækkandi lyfjum gjarnan gefin. Einnig ber að gefa blóðþynningu til að fyrirbyggja segamyndun í djúpum bláæðum og blóðsegarek til lungna. Gjöf slakandi lyfja, oftast í formi bensódíasepínlyfja, er gefin til að minnka æsing (lórasepam, mídasólam eða díasepam).1,2,11
Mikilvægasta meðferðin við NMS er að stöðva öll dópa-mín-hemjandi lyf og veita stuðningsmeðferð. Í bráðafasanum ætti einnig að stöðva öll samverkandi lyf, til dæmis andkólínvirk lyf, litíum og serótónínvirk lyf. Þörf er á öflugri stuðningsmeðferð og eftirliti og því er mælt með innlögn á gjörgæslu. Gefa þarf ríkulega af vökva í æð og lækka sótthita eins og hægt er. Stundum er þörf á að beita aðferðum til ytri eða innri kælingar ef hiti er mjög hár. Mikilvægt er að viðhalda eðlilegum blóðþrýstingi og er meðferð með klónidín eða öðrum blóðþrýstingslækkandi lyfjum gjarnan gefin. Einnig ber að gefa blóðþynningu til að fyrirbyggja segamyndun í djúpum bláæðum og blóðsegarek til lungna. Gjöf slakandi lyfja, oftast í formi bensódíasepínlyfja, er gefin til að minnka æsing (lórasepam, mídasólam eða díasepam).1,2,11
Sértækari lyfjameðferð, eins og meðferð með dantrólen, brómókriptín og amantadín, er umdeild en af þessum þremur lyfj-um er gjöf dantrólens algengust. Dantrólen binst við og hindrar virkni rýanódínviðtaka í vöðvafrymisneti rákóttra vöðvafrumna. Þetta hindrar kalklosun úr vöðvafrymisneti og hvetur þannig til slökunar á vöðvum líkamans. Miðað er við notkun þess í miðlungsalvarlegum og alvarlegum tilfellum NMS þar sem vöðvastífleiki er áberandi mikill. Skammtar eru 1,5-2,5 mg/kg í æð í stakri gjöf en gefa má allt að 10 mg/kg á einum sólarhring. Þó þessari meðferð sé víða beitt í áðurgreindum aðstæðum er endanleg virkni þess umdeild. Mestur árangur virðist vera í tilfellum NMS tengdum notkun eins geðrofslyfs, þar sem meðferðin styttir sjúkdómstíma. Hægt er að nota brómókriptín og/eða amantadín í tilfellum þar sem svörun við dantrólen er óviðunandi, en möguleg virkni þeirra er háð dópamínvirkum áhrifum þessara lyfja.1,2,11
Einnig vaknaði upp grunur um flóðmigu á stigi nýrna sem fylgikvilli litíum-eitrunar. Dæmigerð einkenni eru mikil þvaglát, þorsti og mikil inntaka á vökva. Einkenni eru þó mismikil og fara meðal annars eftir lengd meðferðar og styrks litíums í sermi. Almennt er ráðlagt að íhuga stöðvun litíummeðferðar ef þessi fylgikvilli kemur fram, sérstaklega ef hann kemur brátt fram. Íhuga má meðferð með amiloríð í svæsnari tilfellum.12
Með viðunandi stuðningsmeðferð og stöðvun dópamínhemjandi lyfja ná flestir sjúklingar með NMS sér innan tveggja vikna. Hins vegar geta langtímafylgikvillar komið fram, sér í lagi við alvarlegan sjúkdóm. Einkenni NMS geta komið aftur fram við endurnýjun meðferðar með geðrofslyfjum en fyrri rannsóknir sýna að það geti gerst í 10-90% tilfella. Talið er að endurkoma sé líklegri ef meðferð er hafin snemma og því ætti að bíða í að minnsta kosti tvær vikur frá lokum einkenna áður en meðferð er hafin, en þá er ráðlagt að hefja meðferð í lágum skammti og forðast samhliða gjöf litíum. Reglulegt eftirlit er nauðsynleg forsenda frekari meðferðar með geðrofslyfjum.1-4,6,8
Heimildir
| 1. Velamoor R. Neuroleptic malignant syndrome: A neuro-psychiatric emergency: Recognition, prevention, and management. Asian J Psychiatry 2017; 29: 106-9. https://doi.org/10.1016/j.ajp.2017.05.004 PMid:29061403 |
||||
| 2. Simon LV, Hashmi MF, Callahan AL. Neuroleptic Malignant Syndrome. StatPearls 2021. | ||||
| 3. Shalev A, Hermesh H, Munitz H. Mortality from neuroleptic malignant syndrome. J Clin Psychiatry 1989; 50: 18-25. https://doi.org/10.1016/0006-3223(89)90275-8 |
||||
| 4. Modi S, Dharaiya D, Schultz L, et al. Neuroleptic Malignant Syndrome: Complications, Outcomes, and Mortality. Neurocrit Care 2016; 24: 97-103. https://doi.org/10.1007/s12028-015-0162-5 PMid:26223336 |
||||
| 5. Pope HG, Aizley HG, Keck PE, et al. Neuroleptic malignant syndrome: long-term follow- up of 20 cases. J Clin Psychiatry 1991; 52: 208-12. | ||||
| 6. Velamoor VR. Neuroleptic malignant syndrome. Recognition, prevention and management. Drug Saf 1998; 19: 73-82. https://doi.org/10.2165/00002018-199819010-00006 PMid:9673859 |
||||
| 7. Koch M, Chandragiri S, Rizvi S, et al. Catatonic signs in neuroleptic malignant syndrome. Compr Psychiatry 2000; 41: 73-5. https://doi.org/10.1016/S0010-440X(00)90135-4 |
||||
| 8. Caroff SN, Mann SC. Neuroleptic malignant syndrome. Med Clin North Am 1993; 77: 185-202. https://doi.org/10.1016/S0025-7125(16)30278-4 |
||||
| 9. Levenson JL. Neuroleptic malignant syndrome. Am J Psychiatry 1985; 142: 1137-45. https://doi.org/10.1176/ajp.142.10.1137 PMid:2863986 |
||||
| 10. Carbone JR. The neuroleptic malignant and serotonin syndromes. Emerg Med Clin North Am 2000; 18: 317-25. https://doi.org/10.1016/S0733-8627(05)70127-9 |
||||
| 11. Reulbach U, Dütsch C, Biermann T, et al. Managing an effective treatment for neuroleptic malignant syndrome. Crit Care 2007; 11: R4. https://doi.org/10.1186/cc5148 PMid:17222339 PMCid:PMC2151884 |
||||
| 12. Schoot TS, Molmans THJ, Grootens KP, et al. Systematic review and practical guideline for the prevention and management of the renal side effects of lithium therapy. Eur Neuropsychopharmacol 2020; 31: 16-32. https://doi.org/10.1016/j.euroneuro.2019.11.006 PMid:31837914 |
||||

