12. tbl. 108. árg. 2022
Fræðigrein
Veitti mataræði fyrr á öldum vernd gegn arfgengri heilablæðingu í arfberum cystatin L68Q stökkbreytingarinnar?
Ágrip
Arfgeng heilablæðing (hereditary cystatin C amyloid angiopathy, HCCAA) er ríkjandi erfðasjúkdómur sem stafar af stökkbreytingu í cystatin C-geninu, CST3. Stökkbreytt cystatin C safnast upp í smáslagæðum heilans sem mýlildi og veldur síendurteknum heilablæðingum og dauða ungra arfbera.
Nýlega birtist grein um rannsókn á mögulegu meðferðarúrræði fyrir arfbera arfgengrar heilablæðingar sem byggist á inntöku á NAC (N-acetyl-cystein) til þess að auka magn glútathíons í arfberum en glútathíon leysir upp útfellingar af stökkbreyttu cystatin C. Áður hafði birst grein um lækkun í ævilengd arfbera, á seinni hluta 19. aldar. Á sömu áratugum varð gjörbylting á mataræði Íslendinga. Í byrjun aldarinnar var matur mjög kolvetnasnauður og kolvetni komu aðallega úr mjólkurmat. Innflutningur á mjöli og sykri var óverulegur en átti eftir að aukast mjög mikið samkvæmt innflutningsskýrslum. Vegna skorts á salti var matur geymdur í gallsúrri mysu en smám saman kom salt í stað mysu sem aðferð til að geyma matvæli.
Í þessari grein er kannað hvort breyting í fæðuinnihaldi á 19. öld gæti hafa haft áhrif á glútathíon-magn arfbera.
Greinin barst til blaðsins 1. apríl 2022, samþykkt til birtingar 7. nóvember 2022.
Inngangur
Arfgeng heilablæðing er alíslenskur erfðasjúkdómur sem finnst eingöngu hérlendis. Sjúkdómurinn erfist ríkjandi.1,2
Sjúkdómurinn stafar af stökkbreytingu í cystatin C (L68Q) geni, CST3, á 20. litningi mannsins.3 Þessi stökkbreyting veldur upp-söfnun á stökkbreyttu cystatin C sem mýlildi og það leiðir til síendurtekinna heilablæðinga sem enda í fötlun og dauða hjá ungu fólki.1 Bandvefsuppsöfnun einkennir smáslagæðaveggi í heilum sjúklinga með arfgenga heilablæðingu og mögulega á sú uppsöfnun þátt í sjúkdómsmyndinni.4-6
Talið er að L68Q-stökkbreytingin hafi orðið til fyrir 18 kynslóðum, eða um 1500.7 Allir arfberar á Íslandi hafa sömu stökkbreytinguna sem bendir á sameiginlegan forföður. Þegar ættartré nútímaarfbera eru skoðuð aftur í tímann sést að skylduarfberar í byrjun 19. aldar lifðu jafn lengi og makar að meðaltali. Í rúm 300 ár hafði L68Q-stökkbreytingin í cystatin C-geninu engin áhrif á heilsu og lífslíkur arfbera. Þar sem ekkert náttúruval virðist hafa verið til staðar, fjölgaði einstaklingum með stökkbreytinguna og þeir dreifðu sér. Síðari helming 19. aldar styttist meðalævilengd arfbera stöðugt þar til hún var komin niður í 30 ár og hefur haldist þannig síðan um 1900. Þessi lækkun var mjög tölfræðilega marktæk.7 Þessi áhrif til lækkunar ævilengdar voru svo sterk að oft lét-ust foreldrar og afkvæmi á sama áratug.7 Árni Árnason læknir, sem fyrstur lýsti sjúkdómnum,8 tók eftir þessu og lýsti í doktorsritgerð sinni og einnig aðrir sem töldu þetta ekki tölfræðilega marktækt enda lýstu þeir aðeins einni ætt.9
Upprunalega voru 16 undirættir þekktar, dreifðar um Vestfirði, Vesturland og Suðurland. Elsti sameiginlegi þekkti forfaðir var Þórður Þórðarson frá Ingjaldshóli á Snæfellsnesi, fæddur 1684, sem flutti í Þykkvabæinn og er forfaðir Suðurlandsætta. Tekist hefur að rekja sumar ættir saman svo nú eru þær 14. Í aðeins 5 ættum, að þekkt er, eru arfberar á lífi árið 2022. Í hinum ættunum hefur stökkbreytta genið dáið út vegna þess að arfberar létust ungir áður en þeir eignuðust afkvæmi. Mögulega eru óþekktar arfberaættir ófundnar. Nú eru í gagnagrunni 384 einstaklingar sem hafa nær örugglega erft L68Q-stökkbreytinguna frá upphafi. Ætla má að álíka margir einstaklingar séu líklegir arfberar en hafa ekki verið prófaðir eða staðfestir.
Foreldraáhrif
Við athugun á ættum kom í ljós að þeir sem erfðu stökkbreytta genið frá móður lifðu að meðaltali 9,4 árum skemur en þeir sem fengu stökkbreytingu frá föður. Þessi munur kom fram um miðja 19. öldina, jókst út öldina og varð tölfræðilega marktækur.7 Mögulega eru foreldraáhrifin einnig tengd fæðunni.
Þessi breyting í ævilengd varð samtímis í öllum undirættum á öllum svæðum þar sem sjúkdómurinn fannst, sem bendir til almennra umhverfisþátta.7 Þó lækkaði ævilengd arfbera á Barðaströnd um það bil 20 árum seinna en annars staðar.7
Engin meðferð hefur verið til við arfgengri heilablæðingu en nýjar rannsóknir hafa gefið vonir um að meðferð geti verið við sjóndeildarhringinn. Í vísindatímaritinu Nature Communications (NC) birtist grein sem lýsir mögulegu meðferðarúrræði fyrir arfbera með L68Q-stökkbreytinguna í cystatin C geninu. Glútathíon og N-acetyl cystein (NAC), sem er forveri glútathíons, hindrar uppsöfnun cystatin C og brýtur fáliður (oligomers) L68Q-Cystatin C niður í einliður (monomers).10 Það er mikilvægt því fáliður eru taldar grunnbyggingaeiningar stærra mýlildis sem er þekkt að því að falla út í æðar og aðra líkamsvefi, sem einliður gera ekki. Hægt er að kanna ástand uppsöfnunar á cystatin C í húð arfbera með því að ónæmislita fyrir cystatin C uppsöfnun í stungusýni úr húð þeirra.6 Vegna nýrrar vitneskju var athyglisvert að kanna hvort glútathíon gæti mögulega tengst breytingum í fæðu á 19. öld.
Aðferðir
Í byrjun 19. aldar var mataræði Íslendinga mjög einhæft.11 Fyrir utan fiskveiðar snerist landbúnaður aðallega um mjólkurafurðir, smjör, skyr og mysu. Salt var illfáanlegt og því var matur geymdur í súrri mysu. Þynnt mysa var einnig notuð til drykkjar. Harðfiskur (skreið) var stór hluti af fæðunni, étinn með súru, gerjuðu smjöri. Kornmeti var allt innflutt, svo og sykur. Stuðst var við innflutningsskýrslur sem eru ítarlegar frá 1840. Innflutningur kolvetnaríks fæðis, sykurs, síróps og mjöls var skoðaður sérstaklega.12
Ævilengd arfbera (384), ættingja og maka (173) var fengin úr kirkjubókum, gögnum úr Blóðbanka og Íslendingabók Íslenskrar erfðagreiningar.
Stundum var dánarorsök einstaklings skráð í kirkjubók. Eftir 1911 var farið að gefa út dánarvottorð lækna. Þau er nú hægt að nálgast hjá Embætti landlækni með leyfi frá vísindasiðanefnd. Einstaklingur í áhættu fékk skilgreininguna arfberi eingöngu ef dánarorsök var skráð sem slag eða heilablóðfall í kirkjubók eða dánarvottorði.
Niðurstöður
Ævilengd
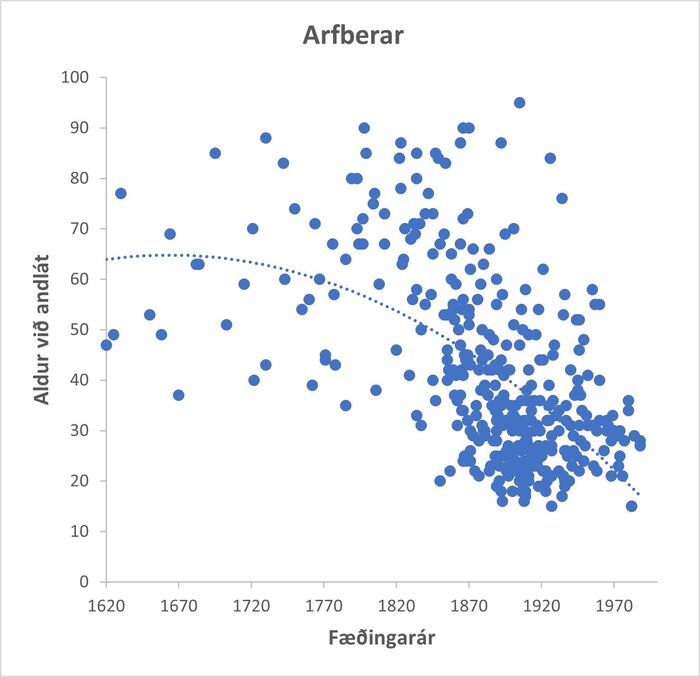 Mynd 1. Ævilengd arfbera með L68Q-stökkbreytinguna miðað við fæðingarár.
Mynd 1. Ævilengd arfbera með L68Q-stökkbreytinguna miðað við fæðingarár.
Mynd 1 sýnir lækkun í ævilengd 384 arfbera yfir langt tímabil miðað við fæðingarár. Skylduarfberar voru skilgreindir sem einstaklingar sem vegna stöðu sinnar í ættartré voru mjög líklegir til að hafa erft L68Q-stökkbreytinguna. Þarna sést að ævilengd arfbera styttist hratt eftir miðja 19. öld. Til samanburðar var ævilengd maka arfberanna á sama tímabili könnuð (mynd 2).
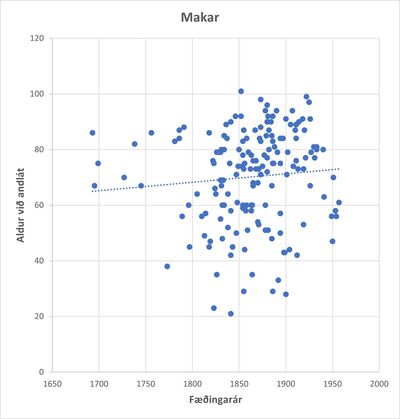 Mynd 2. Ævilengd maka arfbera miðað við fæðingarár.
Mynd 2. Ævilengd maka arfbera miðað við fæðingarár.
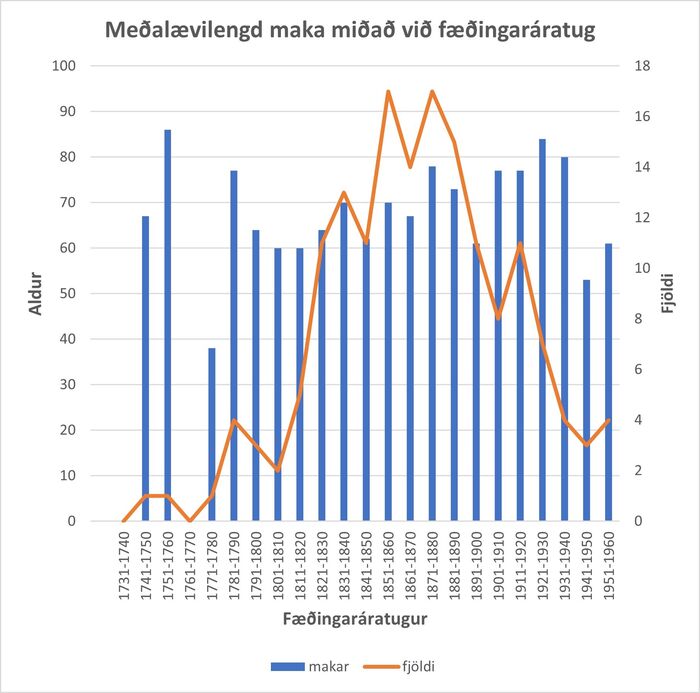
Makar voru valdir sem viðmið því þeir bjuggu í sömu húsum og ekki óvarlegt að ætla að mataræði maka og arfbera hafi því yfirleitt verið mjög svipað. Það sést að í upphafi tímabilsins er ekki munur á ævilengd þessara tveggja hópa en um miðja 19. öld helst ævilengd maka stöðug á meðan ævilengd arfbera lækkar hratt. Sé meðalævilengd arfbera á hverjum fæðingaráratug skoðuð, sést greinilega hvernig ævilengd þeirra styttist hratt upp úr 1840 (mynd 3) en ævilengd maka þeirra stendur svo til í stað á sama tímabili (mynd 4).
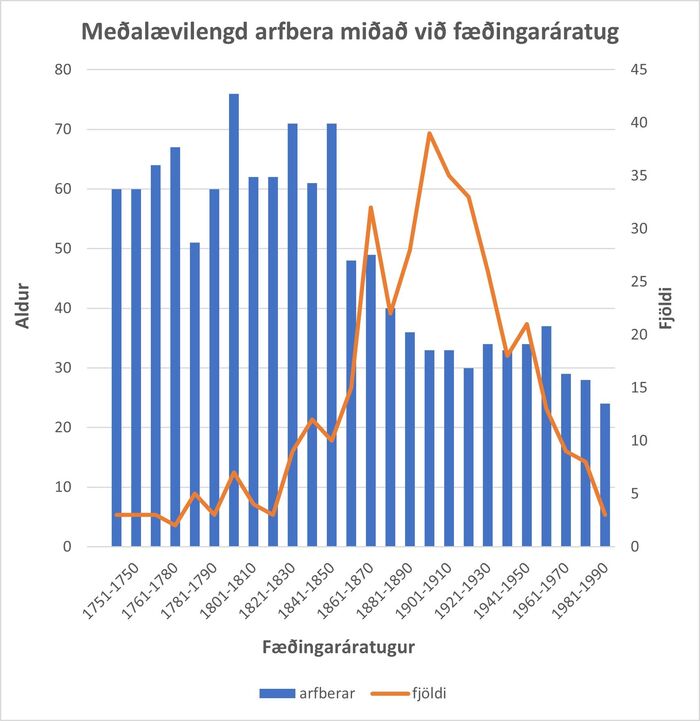
Mynd 3. Meðalævilengd arfbera miðað við fæðingaráratug og fjöldi arfbera á áratug.
Mynd 4. Meðalævilengd maka miðað við fæðingaráratug og fjöldi maka á áratug.
Breyting í mataræði
Fæðuvenjur þjóðarinnar breyttust gríðarlega á 19. öld. Í upphafi aldarinnar var bændasamfélag á Íslandi þar sem flestir störfuðu við öflun matar. Kornyrkja lagðist af á 15. öld og eftir það þurfti að flytja inn allt kornmeti. Það má álykta að innflutningstölur gefi nokkuð góða mynd af neyslunni. Í heild má segja að aðalfæði fólks hafi verið harðfiskur (skreið), súrt smjör og aðrar mjólkurafurðir, aðallega skyr og mysa.11 Sé leiðrétt fyrir fólksfjölda sést að sykurinnflutningur, sem væntanlega endurspeglar innanlandsneyslu, 50-faldaðist frá 1840 til 1940 (mynd 5).
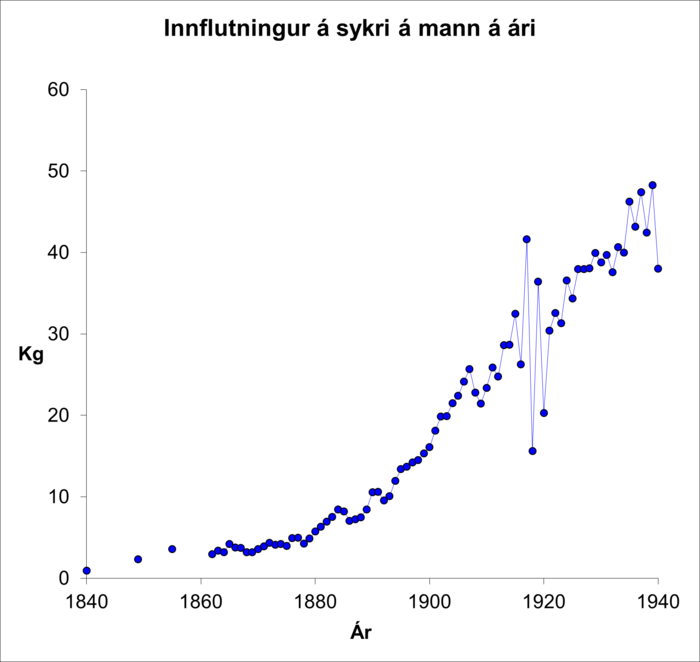
Mynd 5. Sykurinnflutningur á mann/ári.
Í kringum 1840 var innflutningur á sykri/sírópi 900 g á mann á ári en var orðinn 50 kg í lok tímabilsins.12 Á 19. öld jókst innflutningur kolvetnaríkrar fæðu (mynd 5 og 6).11,12 Innflutningur á korni þrefaldaðist milli 1840 og 1940 (mynd 6) og fólk tók smám saman einnig að rækta sínar eigin kartöflur og kál. Hlutfall orku úr kolvetni jókst úr um það bil 25% um 1795 í um það bil 50% um 1940. Þar hefur mjólkursykur skipt mestu máli í upphafi tímabils. Samtímis minnkaði orka úr dýraafurðum jafnframt úr um það bil 85% í um það bil 50% á sama tíma.11
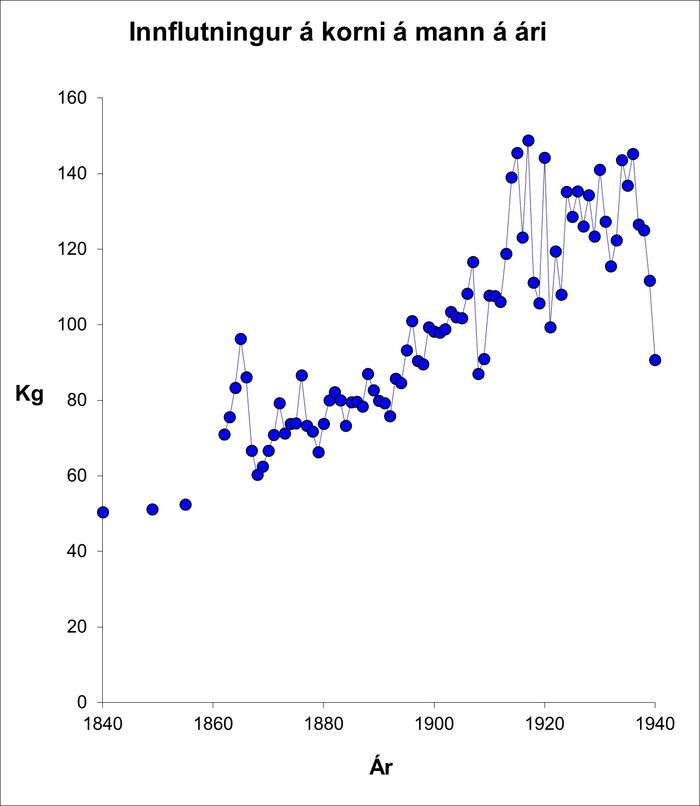
Mynd 6. Korninnflutningur á mann á mann/ári.
Því má áætla að Íslendingar hafi breytt kolvetnisneyslu sinni meira á tímabilinu en aðrar þjóðir sem ræktuðu korntegundir, grænmeti og ávexti.
Umfjöllun
Nærtækasta skýringin á umhverfisáhrifunum er breyting á mataræði á Íslandi á sama tíma og ævilengd arfbera fór að styttast.
Í mænuvökva sjúklinga með arfgenga heilablæðingu er magn cystatin C lægra en í heilbrigðum einstaklingum13 og var það notað til sjúkdómsgreiningar áður en DNA-greiningarpróf fyrir sjúkdóminum kom til.3 Þar sem cystatin C temprar virkni TGFb vaxtarþáttar með því að bindast viðtaka þess (TGFbRII)14 gæti lækkun á cystatin C-magni valdið þeirri auknu bandvefsuppsöfnun sem sést í heilaæðum og húð arfbera.4,6 Önnur afleiðing af ofvirkum TGFb-vaxtarþætti er lækkun glútathíons.15,16 Á hinn bóginn minnkar glútathíon bandvefsuppsöfnun af völdum TGFb og Smad315,17 (mynd 7). Smad 2/3 ónæmislitun er áberandi í húðsýnum arfbera6 sem bendir til að virkjun á TGFb-ferlum sé að verki í heilaæðum og húð hjá sjúklingum með arfgenga heilablæðingu.
Glútathíon-magn í arfberum hefur ekki verið mælt en mögulega var það hærra á fyrri hluta 19. aldar áður en mataræði á Íslandi varð „evrópskara“. Tvennt gæti hafa stuðlað að því. Í fyrsta lagi var þessi lágkolvetnafæða ketógenísk (ketogenic) vegna skorts á sykri og lítilli neyslu kolvetna. Slíkt mataræði eykur glúta-thíon-framleiðslu.18 Jafnframt lækkar sykur glútathíon framleiðslu í frumum.19 Annað líklega mjög mikilvægt atriði var hin almenna notkun á súrri mysu við varðveislu matar áður en salt varð útbreiddara. Mysa er mjög rík af amínósýrunni cystein, sem er ein þriggja amínósýra í glútathíon og mysuprótein auka magn glútathíons.20 Mysa var drukkin, þynnt með vatni. Nýmjólk var ekki drukkin. Til þess var hún of dýrmæt fyrir smjör- og skyrframleiðslu og til að framleiða súra mysu. Það er mögulegt að nútímamataræði, sem varð algengt á 19. öld, hafi aukið sýnd stökkbreytingarinnar á tvennan hátt. Í fyrsta lagi dró mikið úr notkun mysu til þess að geyma mat og notkun mysu til drykkjar. Í öðru lagi jókst sykur og mjölinnflutningur hratt og við það lækkaði glútathíon í frumum þegar mataræðið var ekki lengur ketógenískt.15 Þegar magn glútathíons hafði lækkað hamlaði það ekki lengur bandvefsuppsöfnun.20
Slíkt fæði gæti hafa haft í för með sér áhrif á glútathíon-gildi í blóði þar sem neysla sykurs veldur lækkun á glútathíon-framleiðslu í frumum.19 Þar sem cystatin C er þekkt að því að tempra virkni TGFb-vaxtarþáttarins, sem veldur aukinni bandvefsuppsöfnun,14 má áætla að slík bandvefs- og millifrumuefni (mynd 7) geti sest í heilaæðar og aðra líkamsvefi arfbera.
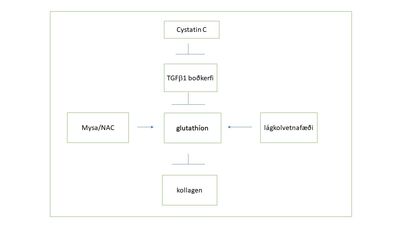 Mynd 7. Mögulegt samband glútathíons, fæðu og lækkkunar í cystatin C-magni.
Mynd 7. Mögulegt samband glútathíons, fæðu og lækkkunar í cystatin C-magni.
Samantekt
Það er áhugavert að sjá að breyting frá ketógenísku mataræði Íslendinga yfir í kolvetnaríkt fæði gæti hafa haft þessi miklu áhrif á sýnd L68Q-arfgerðarinnar, sem leiddi til þess að lífslíkur arfbera urðu nær helmingi minni yfir nær tveggja alda tímabil frá miðri 19. öld til dagsins í dag. Þessar upplýsingar styðja þá kenningu að aukning á glútathíoni, sem er ketógenískur miðill, geti snúið þessu ferli við, að minnsta kosti að hluta til. Fyrstu niðurstöður þess efnis voru nýlega birtar af March,10 og sýna að N-acetylcystein, forveri glútathíons, dregur úr útfellingum á mýlildi í húð og má telja líklegt að sú niðurstaða endurspegli líka minnkun á útfellingum í heilaæðum og heilavef og geti komið í veg fyrir heilablæðingar og tengd áföll og aukið lífslíkur þessara einstaklinga.
Þakkir
Starfsfólki Þjóðskjalasafns er þökkuð hjálp við að lesa kirkjubækur og Birki Þór Bragasyni og Bjarnheiði Guðmundsdóttur þakkaður yfirlestur.
Heimildir
| 1.
Palsdottir A, Snorradottir AO, Thorsteinsson L. Hereditary cystatin C
amyloid angiopathy: genetic, clinical, and pathological aspects. Brain
Pathol 2006; 16: 55-9. https://doi.org/10.1111/j.1750-3639.2006.tb00561.x PMid:16612982 PMCid:PMC8095917 | ||||
| | ||||
| 2.
Olafsson I, Thorsteinsson L, Jensson O. The molecular pathology of
hereditary cystatin C amyloid angiopathy causing brain hemorrhage. Brain
Pathol 1996; 6: 121-6. https://doi.org/10.1111/j.1750-3639.1996.tb00795.x PMid:8737928 | ||||
| | ||||
| 3.
Palsdottir A, Abrahamson M, Thorsteinsson L, et al. Mutation in
cystatin C gene causes hereditary brain haemorrhage. Lancet 1988; 2:
603-4. https://doi.org/10.1016/S0140-6736(88)90641-1 PMid:2900981 | ||||
| | ||||
| 4.
Snorradottir AO, Isaksson HJ, Kaeser SA, et al. Deposition of collagen
IV and aggrecan in leptomeningeal arteries of hereditary brain
haemorrhage with amyloidosis. Brain Res 2013; 1535: 106-14. https://doi.org/10.1016/j.brainres.2013.08.029 PMid:23973860 | ||||
| | ||||
| 5.
Snorradottir AO, Isaksson HJ, Kaeser SA, et al. Parenchymal cystatin C
focal deposits and glial scar formation around brain arteries in
Hereditary Cystatin C Amyloid Angiopathy. Brain Res 2015; 1622: 149-62. https://doi.org/10.1016/j.brainres.2015.06.019 PMid:26115583 | ||||
| | ||||
| 6.
Snorradottir AO, Isaksson HJ, Ingthorsson S, et al. Pathological
changes in basement membranes and dermal connective tissue of skin from
patients with hereditary cystatin C amyloid angiopathy. Lab Invest 2017;
97: 383-94. https://doi.org/10.1038/labinvest.2016.133 PMid:28067897 | ||||
| | ||||
| 7.
Palsdottir A, Helgason A, Palsson S, et al. A drastic reduction in the
life span of cystatin C L68Q carriers due to life-style changes during
the last two centuries. PLoS Genet 2008; 4: e1000099. https://doi.org/10.1371/journal.pgen.1000099 PMid:18566660 PMCid:PMC2409978 | ||||
| | ||||
| 8. Arnason A 1935. Acta Psychiat Neurol Suppl VII | ||||
| | ||||
| 9. Gudmundsson G, Hallgrimsson J, Jonasson TA, et al. Hereditary cerebral haemorrhage with amyloidosis. Brain 1972; 95: 387-404. https://doi.org/10.1093/brain/95.2.387 PMid:4655034 | ||||
| | ||||
| 10.
March ME, Gutierrez-Uzquiza A, Snorradottir AO, et al. NAC blocks
Cystatin C amyloid complex aggregation in a cell system and in skin of
HCCAA patients. Nat Commun 2021; 12: 1827. https://doi.org/10.1038/s41467-021-22120-4 PMid:33758187 PMCid:PMC7988011 | ||||
| | ||||
| 11. Jonsson G. Changes in food consumption in Iceland 1770-1940. Scand History Re 1997; XLVI: 24-41. https://doi.org/10.1080/03585522.1998.10414677 | ||||
| | ||||
| 12. Jonsson G, Magnusson M. Hagskinna: Icelandic historic statistics. Statistics Iceland. 1998. | ||||
| | ||||
| 13.
Jensson O, Guðmundsson G, Arnason A, et al. Hereditary cystatin C
(gamma-trace) amyloid angiopathy of the CNS causing cerebral hemorrhage.
Acta Neurol Scand 1987; 2: 102-14. https://doi.org/10.1111/j.1600-0404.1987.tb03553.x PMid:3673496 | ||||
| | ||||
| 14.
Sokol JP, Schiemann WP. Cystatin C antagonizes transforming growth
factor beta signaling in normal and cancer cells. Mol Cancer Res 2004;
2: 183-95. https://doi.org/10.1158/1541-7786.183.2.3 | ||||
| | ||||
| 1.5
Liu RM, Liu Y, Forman HJ, et al. Glutathione regulates transforming
growth factor-beta-stimulated collagen production in fibroblasts. Am J
Physiol Lung Cell Mol Physiol 2004; 286: L121-8. https://doi.org/10.1152/ajplung.00231.2003 PMid:12959930 | ||||
| | ||||
| 16.
Liu RM, Gaston Pravia KA. Oxidative stress and glutathione in
TGF-beta-mediated fibrogenesis. Free Radic Biol Med 2010; 48: 1-15. https://doi.org/10.1016/j.freeradbiomed.2009.09.026 PMid:19800967 PMCid:PMC2818240 | ||||
| | ||||
| 17.
Ono A, Utsugi M, Masubuchi K, et al. Glutathione redox regulates
TGF-beta-induced fibrogenic effects through Smad3 activation. FEBS Lett
2009; 583: 357-62. https://doi.org/10.1016/j.febslet.2008.12.021 PMid:19101551 | ||||
| | ||||
| 18.
Jarrett SG, Milder JB, Liang LP, et al. The ketogenic diet increases
mitochondrial glutathione levels. J Neurochem 2008; 106: 1044-51. https://doi.org/10.1111/j.1471-4159.2008.05460.x PMid:18466343 | ||||
| | ||||
| 19.
Urata Y, Yamamoto H, Goto S, et al. Long exposure to high glucose
concentration impairs the responsive expression of
gamma-glutamylcysteine synthetase by interleukin-1beta and tumor
necrosis factor-alpha in mouse endothelial cells. J Biol Chem 1996; 271:
15146-52. https://doi.org/10.1074/jbc.271.25.15146 PMid:8662965 | ||||
| | ||||
| 20.
Kent KD, Harper WJ, Bomser JA. Effect of whey protein isolate on
intracellular glutathione and oxidant-induced cell death in human
prostate epithelial cells. Toxicol In Vitro 2003; 17: 27-33. https://doi.org/10.1016/S0887-2333(02)00119-4 PMid:12537959 | ||||
| | ||||
