01. tbl. 108. árg. 2022
Fræðigrein
Nýjungar í greiningu og meðferð lungnakrabbameins
Ágrip
Lungnakrabbamein er annað algengasta krabbameinið á Íslandi hjá konum og þriðja hjá körlum. Þótt hægt hafi á nýgengi sjúkdómsins á undanförnum árum dregur ekkert krabbamein fleiri Íslendinga til dauða. Einkenni lungnakrabbameins geta verið staðbundin en eru oftar almenns eðlis og á það stóran þátt í hversu margir sjúklingar greinast með útbreiddan sjúkdóm. Á síðustu árum hafa orðið miklar framfarir í greiningu og meðferð lungnakrabbameins. Tilkoma jáeindaskanna og berkjuómspeglunar hafa bætt stigun sjúkdómsins og gert meðferð markvissari. Lungnaskurðaðgerðir með brjóstholssjá hafa stytt legutíma og fækkað fylgikvillum, auk þess sem nýjungar í geislameðferð nýtast betur sjúklingum sem ekki er treyst í skurðaðgerð. Mestar nýjungar hafa þó orðið í lyfjameðferð útbreidds lungnakrabbameins. Þar hafa öflug líftæknilyf komið til sögunnar sem gera kleift að klæðskerasauma meðferðina út frá mælingum á stökkbreytingum og lífmörkum í æxlunum. Loks hafa nýlegar skimunarrannsóknir með lágskammta tölvusneiðmyndum sýnt marktæka lækkun á dánartíðni. Hér eru helstu nýjungar í greiningu og meðferð lungnakrabbameins reifaðar með hliðsjón af þeim framförum sem orðið hafa og er sérstaklega vísað til íslenskra rannsókna.
Greinin barst til blaðsins 8. júní 2021, samþykkt til birtingar 1. desember 2021.
Inngangur
Á Íslandi greinast í kringum 170 einstaklingar með lungnakrabbamein ár hvert og eru flestir í kringum sjötugt við greiningu.1,2 Reykingar eru langveigamesta orsök lungnakrabbameins en mikið hefur áunnist í reykingaforvörnum síðastliðna áratugi hér á landi. Ýmis eiturefni í umhverfi geta einnig aukið áhættu á lungnakrabbameini, til dæmis asbest og mengun frá umferð,3 enda þótt óljóst sé hversu sterkir þeir áhættuþættir eru hérlendis. Nýgengi sjúkdómsins hefur farið lækkandi síðasta áratug hjá báðum kynjum, sem skýrist aðallega af minni reykingum.4 Dánartíðni af völdum lungnakrabbameins fer minnkandi, en er engu að síður hæst allra krabbameina hérlendis og leggur um 130 einstaklinga að velli árlega.1 Lífshorfur sjúklinga hafa batnað og í dag má gera ráð fyrir að í kringum 20% þeirra séu á lífi 5 árum eftir greiningu, sem er ívið hærra en í mörgum nágrannalöndum okkar.5 Ein helsta áskorunin í meðferð lungnakrabbameins er hversu margir sjúklingar greinast með meinvörp í miðmætiseitlum eða í fjarlægum líffærum en þá kemur læknandi skurðaðgerð ekki til greina. Við útbreiddum sjúkdómi er í staðinn beitt krabbameinslyfja- og/eða geislameðferð. Á slík meðferð við hjá næstum öllum sem greinast með smáfrumukrabbamein (small cell lung carcinoma, SCLC) en þau eru í kringum 15% lungnakrabbameina, og hjá tveimur þriðju sjúklinga með önnur lungnakrabbamein (non-small cell lung carcinoma, NSCLC).
Þessi yfirlitsgrein er skrifuð með breiðan hóp lækna í huga en einnig aðra heilbrigðisstarfsmenn og nema í heilbrigðisvísindum. Hún er töluvert breytt frá eldri yfirlitsgrein um lungnakrabbamein sem birtist 2008 í Læknablaðinu,6 og er nú aðallega fjallað um nýjungar í greiningu og meðferð. Textinn byggist á nýjustu heimildum sem fundust á PubMed, MEDLINE og í heimildaskrám nýlegra yfirlitsgreina, auk þess sem vísað er sérstaklega til íslenskra rannsókna.
Snemmgreining og skimun
Lengi hefur verið ljóst að árangur í meðferð lungnakrabbameins er bestur þegar sjúkdómurinn greinist snemma og unnt er að beita skurðaðgerð til lækningar. Því hefur verið áleitin spurning hvort snemmgreining áhættuhópa með skimun gæti bætt horfur verulega. Fyrstu skimunarrannsóknir með röntgenmyndum og frumurannsóknum á hráka á 8. áratug síðustu aldar sýndu ekki fram á lækkun á dánartíðni borið saman við venjulegt eftirlit.7 Greindum tilfellum fjölgaði í skimunarhópi og 5 ára lifun batnaði, en dánartíðni hélst hins vegar óbreytt. Á síðustu áratugum hefur verið efnt til stórra framskyggnra samstarfsverkefna í Bandaríkjunum og Evrópu. Fyrstu rannsóknir á skimun með tölvusneiðmyndum (TS) voru gerðar í Japan og fyrsta alþjóðlega rannsóknin benti til þess að unnt væri að finna um 80% lungnakrabbameina á byrjunarstigi.8,9 Þessar rannsóknir voru hins vegar ekki slembaðar og það rýrði gildi niðurstaðnanna. Á árunum 2005-2009 var stærsta rannsókn á TS-skimun fyrir lungnakrabbameini til þessa framkvæmd á vegum bandarísku röntgenlæknasamtakanna. Þar var 53.000 reykingamönnum/konum skipt í tvo slembihópa þar sem annar hópurinn var skimaður árlega með TS og hinn með röntgenmyndum. Rannsóknin sýndi 20,4% lækkun á dánartíðni vegna lungnakrabbameins í TS-hópnum (p<0,004).7 Skimunarrannsóknir með TS hafa einnig farið fram í Evrópu. Stærst þeirra er hollensk-belgíska NELSON-rannsóknin þar sem 15.822 þátt-takendum var skipt í skimunarhóp með TS sem fylgt var eftir í 6,5 ár og í viðmiðunarhóp án skimunar. Niðurstöður NELSON-rannsóknarinnar sýndu marktæka lækkun á dánartíðni sem reyndist meiri hjá konum en körlum, eða 36% lækkun borið saman við 26% hjá körlum.10,11
Ýmis vandamál geta þó tengst skimun, eins og óþarfa geislun á brjóst og brjóstholslíffæri, auk þess getur skimun valdið streitu og kvíða.7,11,12 Lungnakrabbamein greinist aðeins í 0,5-1% TS-rannsókna og falsk-jákvæðar rannsóknir eru algengar.7, 11 Kostir skimunar hafa þó víða verið taldir vega þyngra en vankantar og í Bandaríkjunum hefur skimun fyrir lungnakrabbameini með TS verið tekin inn í klínískar leiðbeiningar13 sem heilbrigðisyfirvöld mæla með. Í Evrópu var lengi beðið eftir niðurstöðum NELSON-rannsóknarinnar, en ýmis samtök, þar á meðal bresku lungnalæknasamtökin, hafa mælt með skimun áhættuhópa og birt ítarlegar klínískar leiðbeiningar um gagnsemi skimunar.13,14 Fyllilega er tímabært að tekin verði upp umræða á Íslandi um skimun fyrir lungnakrabbameini, en áhugi er fyrir hendi á hinum Norðurlöndunum.15 Slík starfsemi krefst mannafla og undirbúnings en ætla má að á Íslandi sé nú þegar til staðar nauðsynlegur tækjabúnaður og sjúkrahúsaðstaða. Þá gæti þekking á faraldsfræði og erfðum lungnakrabbameins hérlendis skapað okkur sérstöðu við skipulagningu skimunar fyrir lungnakrabbameini.16
Vefjaflokkun og sameindameinafræði
Til að vefjagreina lungnaæxli er fengið úr því sýni, oftast í berkjuspeglun eða með ástungu í gegnum brjóstvegg. Sýnið er skoðað í smásjá, gerðar eru á því mótefnalitanir og í völdum tilfellum sameindafræðilegar mælingar. Niðurstöður þessara rannsókna eru forsenda ráðlegginga um viðeigandi meðferð.
Vefjaflokkun og mótefnalitanir
Lungnakrabbamein eru flokkuð í tvo vefjaflokka eftir smásjárútliti, annars vegar smáfrumukrabbamein (SCLC), sem eru um 15% æxlanna, og hins vegar lungnakrabbamein af öðrum vefjagerðum (NSCLC) (84%) (mynd 1). Af síðarnefnda flokknum er kirtilkrabbamein (adenocarcinoma) og flöguþekjukrabbamein (squamous cell carcinoma) langalgengust en aðrar vefjagerðir sjaldgæfari (<2%). Með fullkomnari mótefnalitunum er mögulegt að flokka æxlin betur og það hefur leitt til þess að hlutfall illa þroskaðra meina eins og stórfrumuæxla (large cell carcinoma) og krabbalíkis (carcinoid) hefur fækkað.17
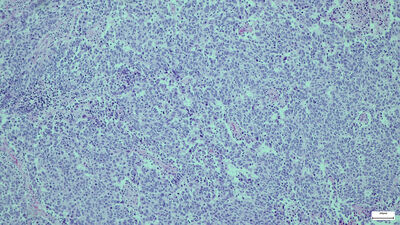
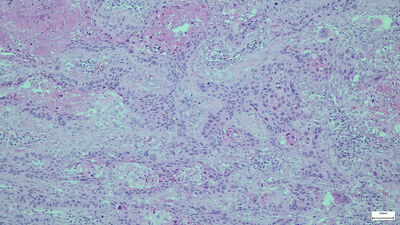
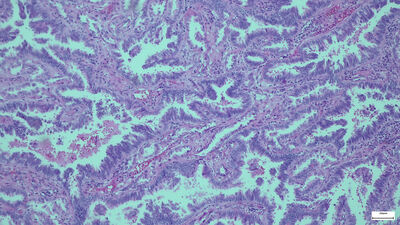
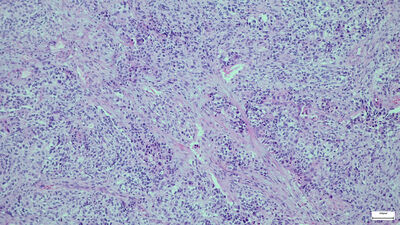
Mynd 1. Fjórar helstu vefjagerðir lungnakrabbameins. a. Smáfrumukrabbamein. Þéttar breiður smárra æxlisfrumna vaxa án mynsturs. Kjarnalitarefni er þétt, einsleitt og kjarnakorn sjást naumast eða ekki. b. Flöguþekjukrabbamein. Æxlisfrumur mynda hornefni og tengjast millifrumubrúm. c. Kirtilmyndandi krabbamein. Stórar æxlisfrumur með áberandi kjarnakorn mynda kirtilholrými. d. Stórfrumukrabbamein. Stórar æxlisfrumur vaxa í breiðum án sérhæfingar í átt til flögu- eða kirtilþekju.
Í síðustu uppfærslu á flokkun lungnakrabbameina (WHO, 2015)17 breyttist flokkun kirtilkrabbameina töluvert og eru þau nú flokkuð eftir ráðandi mynstri í ljóssmásjá. Nú eru til forstig illkynja breytinga ef stærðin er minni en 3 cm og einungis sést svokallað „lepidic“ vaxtarmynstur sem kemur í stað bronchoalveolar krabbameins (BAC). Ef slím finnst í slíkum æxlum eru þau hins vegar flokkuð sem ífarandi slímmyndandi krabbamein. Vegna nýjunga í krabbameinslyfjameðferð kirtilkrabbameina eru nú gerðar meiri kröfur um nákvæmari vefjaflokkun, enda eru komin til sögunnar líftæknilyf sem geta bælt vaxtarþætti með því að hemla sértæka yfirborðsviðtaka æxlisfrumnanna.18 Jafnframt eru mótefnalitanir gerðar á æxlisvef strax við greiningu til að staðfesta uppruna þeirra í lungum.
Frumugreining getur í völdum tilfellum komið í stað hefðbundinnar vefjagreiningar á æxlisvef. Með berkju- eða ómspeglun er fínnálar-frumusýni tekið úr eitlum eða frumæxli.19 Í þessum speglunum skoðar frumumeinafræðingur sýni jafnóðum á staðnum. Þannig er tryggt að fullnægjandi sýni liggi fyrir til að byggja á fljótgreiningu (rapid on-site evaluation). Lokagreining er síðan gefin út eftir ítarlegri skoðun. Frumugreiningu má einnig nýta við fínnálarástungu á lungnaæxli sem gerð er með aðstoð tölvusneiðmynda og hafa færri fylgikvilla en hefðbundin grófnálarstunga. Röntgenlæknir staðsetur þá nál í jaðri æxlis og frumumeinafræðingur tekur sýni sem strokið er á gler og er skoðað strax. Í þessum sýnatökum er hluti sýnisins hertur í alkóhóli og úr honum útbúinn frumumassi (cell block). Á honum má síðan gera mótefnalitanir sem í mörgum tilvikum eru sambærilegar þeim sem gerðar eru á hefðbundnu vefjasýni.20 Magn illkynja frumna í slíkum frumumassa nægir þó ekki alltaf til að hægt sé að gera sameindameinafræðilegar rannsóknir á æxlinu.
Sameindameinafræðirannsóknir
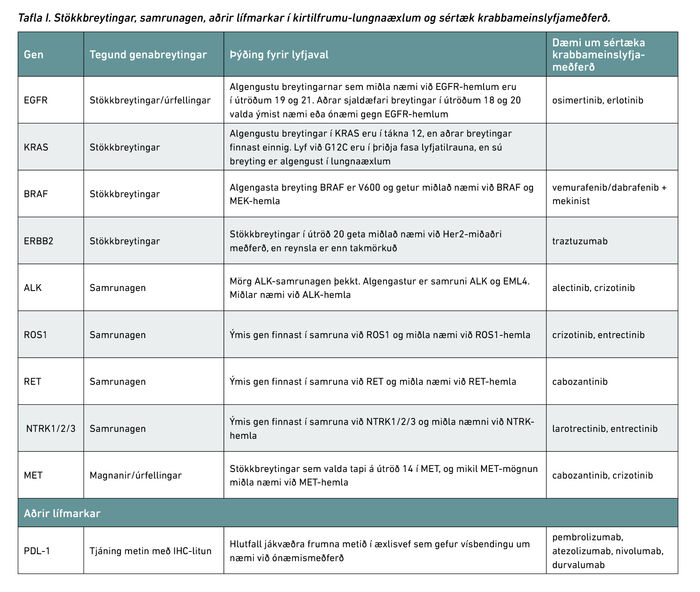
Á meinafræðideild Landspítala er háhraða-raðgreining (next generation sequencing, NGS) notuð til að leita að stökkbreytingum í æxlisvef. Í kirtilkrabbameinum úr lungum er leitað að stökkbreytingum í EGFR-, KRAS-, BRAF- og ERBB2-viðtökum, en þeir gefa til kynna hvort æxlið sé næmt fyrir meðferð með sértækum líftæknilyfjum. Mikilvægastar eru stökkbreytingar í EGFR-viðtökum en þær finnast í æxlum 10-15% sjúklinga af evrópskum uppruna með lungnakrabbamein af kirtilfrumugerð.21 Samrunagen geta einnig verið lyfjamark í kirtilfrumuæxlum og finnast í um 10% þeirra.21 Af þeim eru ALK- og ROS1-samrunagen algengust og eru þau nú greind með ónæmislitunum og jákvæð svör síðan staðfest með FISH (fluorescence in situ hybridization). Hér á landi er nú unnið að greiningu fleiri samrunagena sem teljast lyfjamörk líftæknilyfja, svo sem RET, NTRK1/2/3, auk ákveðinna splæsiafbrigða MET.22 Þegar notuð eru lífttæknilyf sem sniðin eru að ákveðnum genabreytingum geta krabbameinsfrumur myndað þol við lyfinu.23 Þá er fengið nýtt sýni úr æxlinu og gerð sameindameinafræðileg greining sem getur nýst við að ákveða hvaða meðferð hentar best. Í töflu l er yfirlit yfir helstu stökkbreytingar, samrunagen og aðra lífmarka í lungnakrabbameinum en framfarir á þessu sviði eru hraðar og nýjar mælingar bætast stöðugt við.
 Sumir sjúklingar með útbreitt lungnakrabbamein fá ónæmismeðferð og er tjáning PDL-1 viðtaka þá notuð sem lífmarki til að meta líkur á svörun meðferðar. Slík meðferð getur þó einnig komið til greina við lungnakrabbamein án PDL-1 tjáningar.24
Sumir sjúklingar með útbreitt lungnakrabbamein fá ónæmismeðferð og er tjáning PDL-1 viðtaka þá notuð sem lífmarki til að meta líkur á svörun meðferðar. Slík meðferð getur þó einnig komið til greina við lungnakrabbamein án PDL-1 tjáningar.24
Greining og stigun
Þegar grunur vaknar um lungnakrabbamein eru gerðar ýmsar rannsóknir til að staðfesta greininguna, en jafnframt til að meta útbreiðslu meinsins og almennt ástand sjúklingsins. Mikilvægt er að velja rannsóknir sem afla mestra upplýsinga með sem minnstri áhættu fyrir sjúklingana.25
Myndrannsóknir á lunga
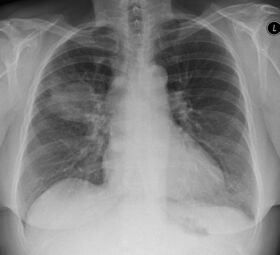
Tölvusneiðmyndir (TS) eru helsta rannsóknin, bæði til greiningar og stigunar á lungnakrabbameini, en í sumum tilvikum hafa sjúklingar áður greinst með íferð eða æxli á hefðbundinni lungnamynd (mynd 2a). Lungnabólga sem erfiðlega gengur að meðhöndla eða íferðir sem ekki hverfa á meðferð, ættu að vekja grun um lungnakrabbamein. Hluti lungnakrabbameina (5-10%) greinast fyrir tilviljun við myndrannsóknir hjá einkennalausum einstaklingum og er þá oftast um stakan hnút að ræða.26 Hnútur í lungum (<3 cm) getur verið þéttur eða hélulíkur án þétts hluta (ground glass), eða þéttur að hluta (mynd 2b).
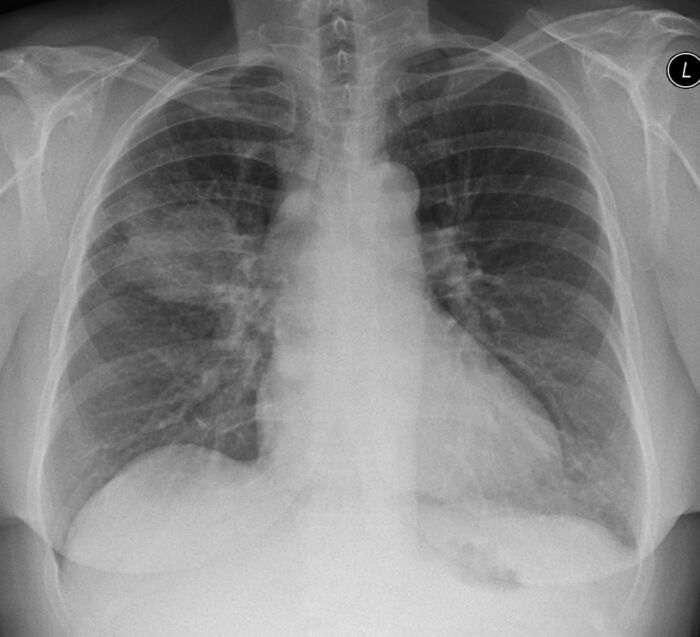
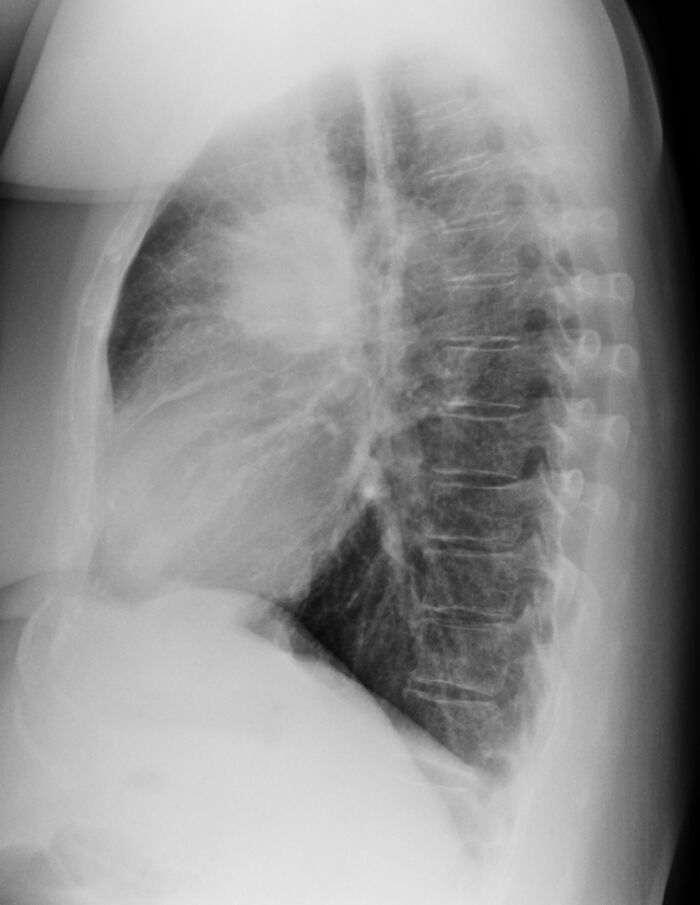
Mynd 2. Myndrannsóknir í uppvinnslu og stigun lungnakrabbameins a-f. 2a. Röntgenmynd sem sýnir þéttingu í efra lungnablaði hægra lunga sem reyndist eftir sýnatöku vera lungnakrabbamein.
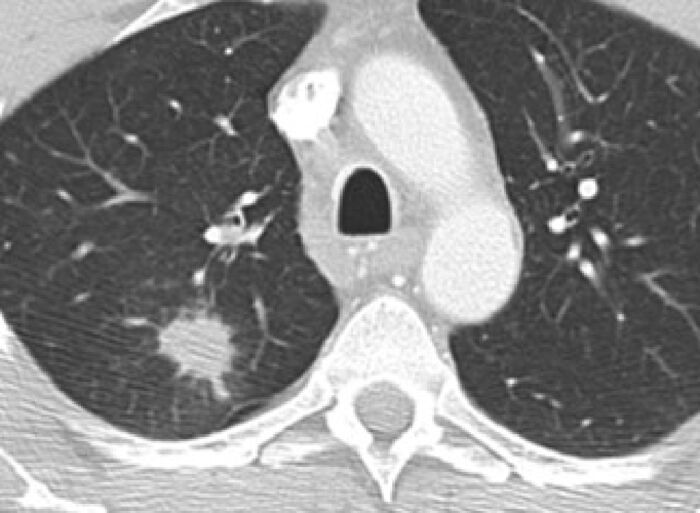
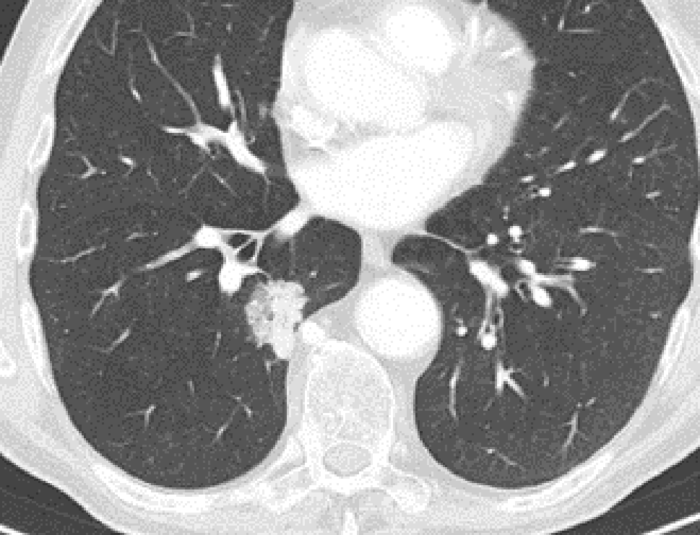
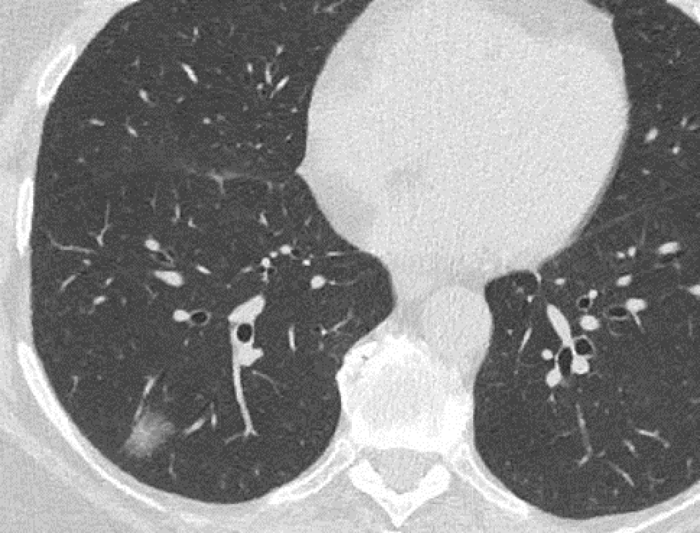
2b. Tölvusneiðmynd sem sýnir hnúta í lungum með mismiklum þéttleika sem eftir sýnatöku reyndust allir vera lungnakrabbamein; þéttur hnútur (i), hálfþéttur hnútur (ii), og hélulíkur hnútur (iii).
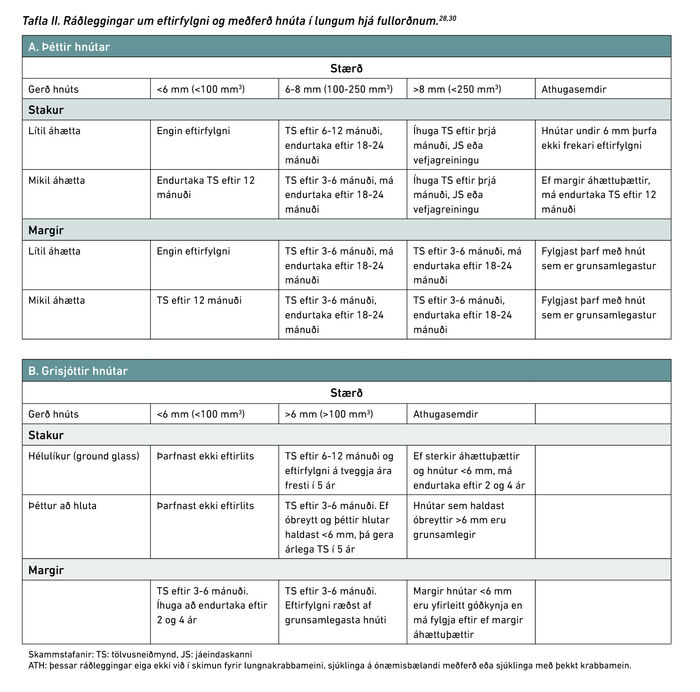
Eftirlit og uppvinnsla á hnútum fer eftir stærð þeirra, útliti og áhættuþáttum sjúklings, eins og aldri og reykingasögu. Líkur á krabbameini aukast með stærð og auknum þéttleika hnútsins. Óbreytt stærð í tvö ár er almennt talin merki um að þéttur hnútur sé ólíklega illkynja.27,28 Dreifðir hnútar í báðum lungum ættu að vekja grun um meinvörp frá illkynja æxlum utan brjósthols, en stakir hnútar geta einnig verið meinvörp.29 Alþjóðleg samtök röntgenlækna (Fleichner Society) gáfu nýlega út klínískar leiðbeiningar um eftirfylgni á hnútum í lungum sem sýndar eru í töflu II.28,30 Á síðustu árum hefur athygli beinst að vel afmörkuðum hélubreytingum en stór hluti þeirra reynist hægt vaxandi kirtilfrumukrabbamein eða forstig krabbameins (carcinoma in situ). Þess vegna er ráðlagt að fylgja hélubreytingum eftir lengi, eða í allt að 5 ár.28
 Jáeindaskanni (JS, jáeindasneiðmynd: PET/CT) er myndrannsókn sem notar sporefni (FDG) sem sýnir brennslu sykurs í frumum, og er gagnleg til að meta hvort hnútur í lungum sé ill- eða góðkynja (mynd 2c og d). JS er ekki áreiðanleg rannsókn við mat á hnútum undir 8 mm á stærð og nýtist sömuleiðis illa við mat á hélubreytingum.31 Fyrir stærri þétta hnúta er hún hins vegar áreiðanleg rannsókn og er jákvætt og neikvætt forspárgildi um 90%.31 Staðbundnar bólgubreytingar geta gefið falsk-jákvæðar niðurstöður á JS, en lítil æxli eða íferðir með lítilli efnaskiptavirkni, eins og kirtilfrumukrabbamein í formi hélubreytinga og krabbalíki, geta gefið falskt neikvætt svar.31 Yfirleitt er mælt með sýnatöku úr hnútum sem taka upp sporefni á JS til að staðfesta að um krabbamein sé að ræða.31 Á næstu árum má gera ráð fyrir að gervigreind verði í auknum mæli nýtt til að bæta myndgreiningu illkynja hnúta32 en einnig í meina- og ónæmisfræðirannsóknum lungnakrabbameins.33
Jáeindaskanni (JS, jáeindasneiðmynd: PET/CT) er myndrannsókn sem notar sporefni (FDG) sem sýnir brennslu sykurs í frumum, og er gagnleg til að meta hvort hnútur í lungum sé ill- eða góðkynja (mynd 2c og d). JS er ekki áreiðanleg rannsókn við mat á hnútum undir 8 mm á stærð og nýtist sömuleiðis illa við mat á hélubreytingum.31 Fyrir stærri þétta hnúta er hún hins vegar áreiðanleg rannsókn og er jákvætt og neikvætt forspárgildi um 90%.31 Staðbundnar bólgubreytingar geta gefið falsk-jákvæðar niðurstöður á JS, en lítil æxli eða íferðir með lítilli efnaskiptavirkni, eins og kirtilfrumukrabbamein í formi hélubreytinga og krabbalíki, geta gefið falskt neikvætt svar.31 Yfirleitt er mælt með sýnatöku úr hnútum sem taka upp sporefni á JS til að staðfesta að um krabbamein sé að ræða.31 Á næstu árum má gera ráð fyrir að gervigreind verði í auknum mæli nýtt til að bæta myndgreiningu illkynja hnúta32 en einnig í meina- og ónæmisfræðirannsóknum lungnakrabbameins.33
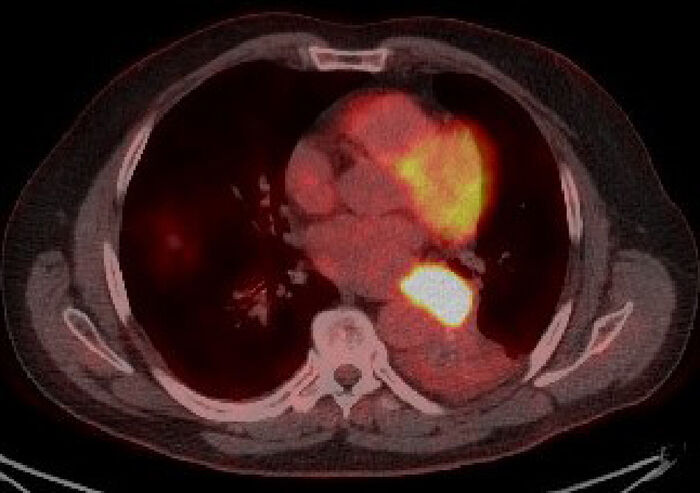
2c. Jáeindasneiðmynd (PET/CT) þar sem miðlægt æxli sem tekur upp sporefni veldur samfalli aftan til í vinstra lunga.
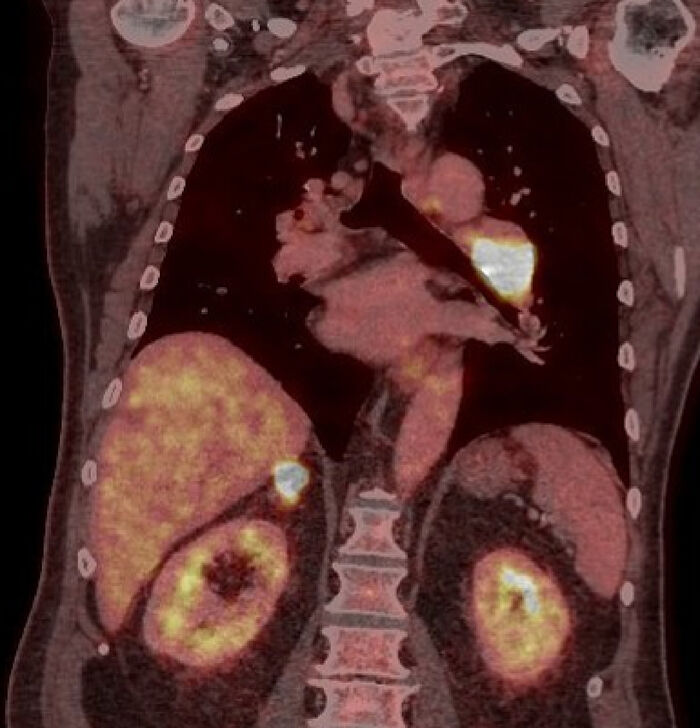
2d. Jáeindasneiðmynd (PET/CT) sem sýnir lungnakrabbamein í vinstra lunga og meinvarp í hægri nýrnahettu.
Rannsóknir til stigunar
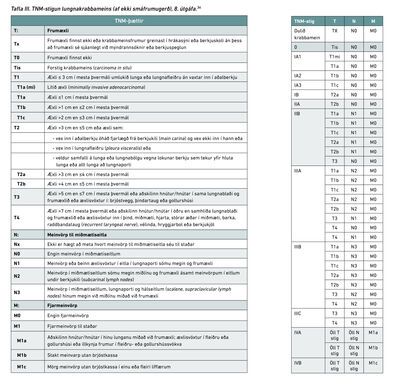
Lungnakrabbamein sem ekki er af smáfrumugerð er stigað samkvæmt TNM-stigunarkerfi Alþjóðaheilbrigðisstofnunarinnar.34 Kallast það klínísk stigun (cTNM) þegar eingöngu er byggt á myndrannsóknum og vefjasýnatökum, en meinafræðistigun (pTNM) þegar vefjaskoðun eftir brottnám æxlis liggur fyrir. Lagt er mat á stærð æxlis (T), útbreiðslu þess í eitla (N) og önnur líffæri (M). Í töflu III eru fjórir stigunarflokkar TNM-kerfisins sýndir en þessar upplýsingar eru síðan notaðar til að spá fyrir um horfur sjúklinga og ákvarða meðferð.34
 Stigunarkerfi smáfrumukrabbameins hefur löngum verið einfaldara og skiptist í tvö stig, takmarkaðan sjúkdóm og útbreiddan sjúkdóm.35 Í takmörkuðum sjúkdómi er krabbameinið bundið við lunga og brjósthol sömu megin og æxlið, auk miðmætiseitla og eitla ofan við viðbein, en miðað er við að svæðið geti rúmast innan eins geislasvæðis. Útbreiddur sjúkdómur greinist í 70% tilfella en þar eru fjarmeinvörp nær alltaf til staðar eins og í beinmerg, lifur, heila og hinu lunganu.36 Í alþjóðlegum leiðbeiningum um stigun lungnakrabbameina er þó ráðlögð TNM-stigun fyrir smáfrumukrabbamein, líkt og gert er við önnur lungnakrabbamein.37
Stigunarkerfi smáfrumukrabbameins hefur löngum verið einfaldara og skiptist í tvö stig, takmarkaðan sjúkdóm og útbreiddan sjúkdóm.35 Í takmörkuðum sjúkdómi er krabbameinið bundið við lunga og brjósthol sömu megin og æxlið, auk miðmætiseitla og eitla ofan við viðbein, en miðað er við að svæðið geti rúmast innan eins geislasvæðis. Útbreiddur sjúkdómur greinist í 70% tilfella en þar eru fjarmeinvörp nær alltaf til staðar eins og í beinmerg, lifur, heila og hinu lunganu.36 Í alþjóðlegum leiðbeiningum um stigun lungnakrabbameina er þó ráðlögð TNM-stigun fyrir smáfrumukrabbamein, líkt og gert er við önnur lungnakrabbamein.37
Óháð vefjagerð er TS af brjóst- og kviðarholi helsta stigunarrannsóknin. TS er mikilvægt við T- og M-hluta stigunar en hefur minna notagildi við stigun miðmætiseitla þar sem næmi og sértæki eru lítil, eða 55% og 81%.38 TS er einnig notað við mat á ífarandi vexti krabbameinsins, en í völdum tilvikum getur segul-ómun verið hjálpleg til að meta ífarandi vöxt í brjóstvegg og miðmæti, sérstaklega ef um er að ræða krabbamein í lungnatoppi (Pancoast-æxli) (mynd 2e).38,39
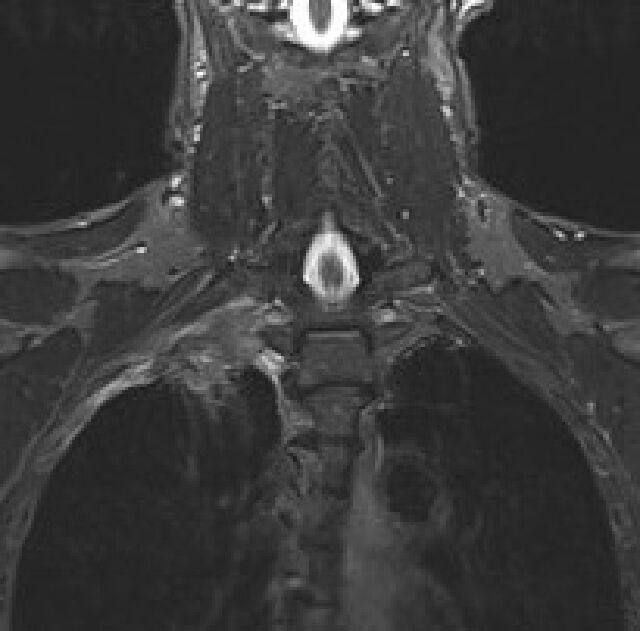
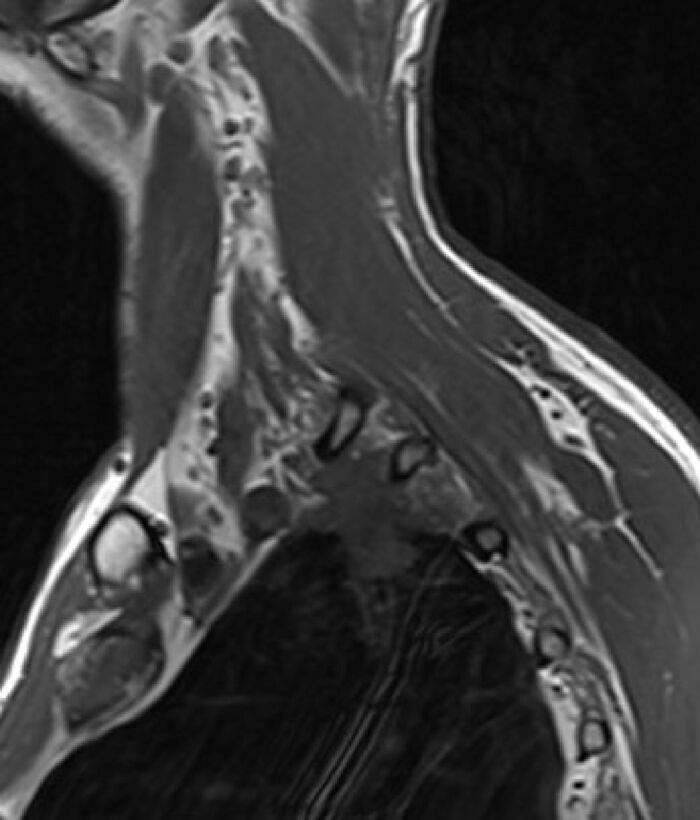 2e. Segulómmynd af brjóstholi sem sýnir Pancoast-æxli í hægra lunga með innvöxt inn í brjóstvegg.
2e. Segulómmynd af brjóstholi sem sýnir Pancoast-æxli í hægra lunga með innvöxt inn í brjóstvegg.
Rannsóknir á dreifingu sjúkdómsins í miðmætiseitla eru sérlega mikilvægar, enda val á meðferð undir niðurstöðum þeirra komin. Eitilstöðvum í miðmæti er skipt í svæði og þær númeraðar kerfisbundið (mynd 3).40 Á TS er oft miðað við að eitlar stærri en 10 mm í þvermál kallist „stækkaðir“, en næmi TS í þessu tilliti er lágt.38 Þannig hafa rannsóknir sýnt að smásæ meinvörp geti verið til staðar í miðmætiseitlum sem ekki eru stækkaðir, sérstaklega þegar um miðlæg æxli er að ræða, í kirtilmyndandi krabbameinum >3 cm að stærð, og þegar grunur leikur á eitlameinvörpum í lungnaporti (hilus).41 Neikvætt forspárgildi JS fyrir miðmætiseitla er hátt, og eru því frekari rannsóknir óþarfar ef sú rannsókn er neikvæð.41 Jákvætt forspárgildi JS við miðmætiseitla er lægra (80%) þar sem um getur verið að ræða ósértæka upptöku sporefnis í þeim, til dæmis vegna bólgu.31
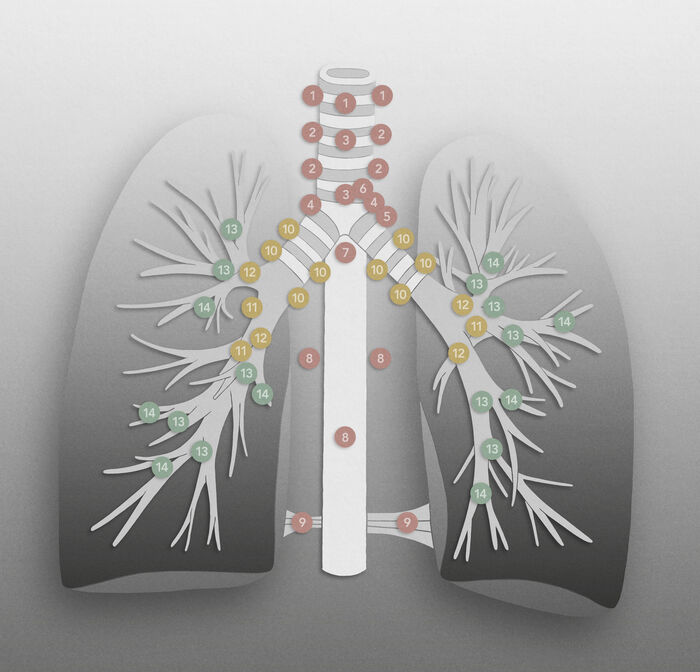
Mynd 3. Mynd með helstu eitlasvæðum í miðmæti og lungnaporti. (Mynd: Árni Þór Árnason)
Leit að meinvörpum utan brjósthols er mikilvægur hluti stigunar, enda hefur meirihluti lungnakrabbameinssjúklinga dreifðan sjúkdóm við greiningu. Meinvörp í heila, beinum, lifur og nýrnahettum eru algengust.39 Hefðbundin stigunarrannsókn í þessu tilliti er TS, en einnig JS, sérstaklega ef fyrirhuguð er læknandi meðferð. Hjá sjúklingum sem ekki eru augljóslega með dreifðan sjúkdóm, og þar sem stefnt er að læknandi meðferð, er nær alltaf mælt með JS. Sýnt hefur verið fram á að JS breyti meðferð hjá yfir 40% sjúklinga miðað við eldri stigunaraðferðir42 og geti fækkað óþarfa skurðaðgerðum um allt að 20%.43 Auk JS er einnig mælt með TS eða segulómun af heila þar sem JS greinir illa meinvörp í heila. JS hefur gott næmi og sértæki fyrir meinvörp í nýrnahettum, en nánari rannsóknir með TS eða segulómun geta verið hjálplegar til greiningar á góðkynja stækkun.39 Ef niðurstaða úr JS liggur fyrir þarf ekki beinaskann enda næmi og sértæki þessara rannsókna svipuð (mynd 2f).31
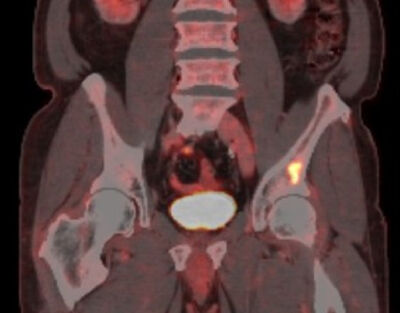
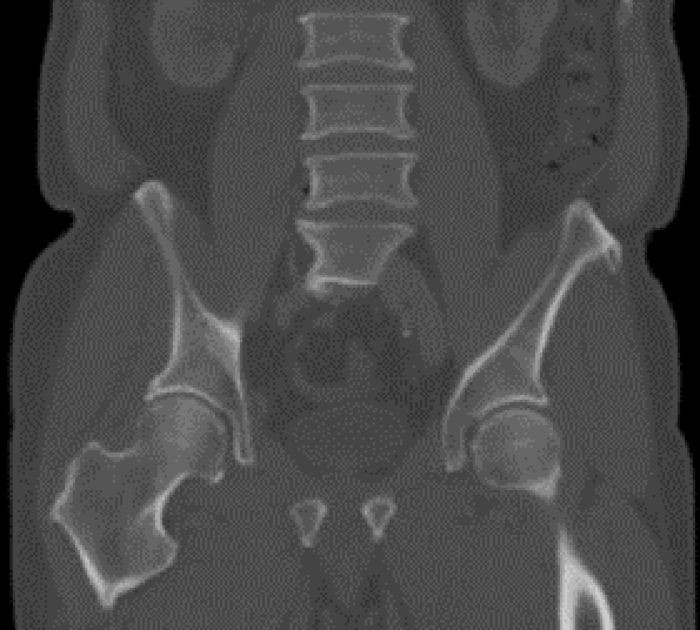
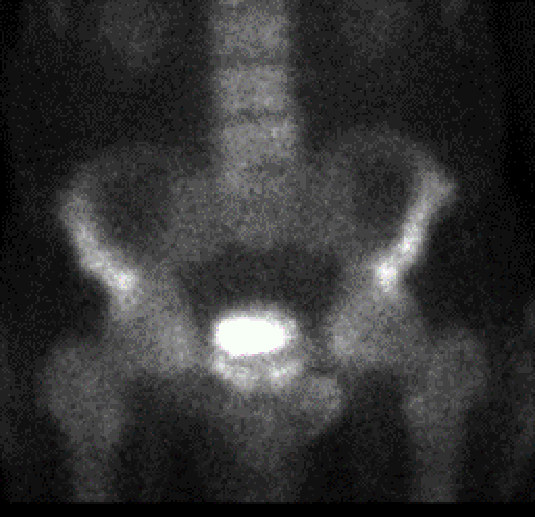 2f. Jáeindasneiðmynd (PET/CT) (i) sem sýnir meinvarp í mjaðmarkambi frá lungnakrabbameini. Meinvarpið greinist ekki á tölvusneiðmynd (ii) eða 99mTc beinaskanna (iii).
2f. Jáeindasneiðmynd (PET/CT) (i) sem sýnir meinvarp í mjaðmarkambi frá lungnakrabbameini. Meinvarpið greinist ekki á tölvusneiðmynd (ii) eða 99mTc beinaskanna (iii).
Sýnataka til frumu- og vefjagreiningar
Sýnataka úr æxli eða meinvarpi er nauðsynleg til greiningar á lungnakrabbameini. Auk hefðbundinnar vefjagreiningar er nauðsynlegt að sýnið sé nægilega mikið þannig að hægt sé að gera á því ónæmis-, sameinda- og stökkbreytingarannsóknir, sérstaklega ef fyrirhuguð er krabbameinslyfjameðferð.
Berkjuspeglun nýtist ekki aðeins til greiningar heldur einnig til stigunar (mynd 4). Er næmi hennar best við æxli miðlægt í lunganu,44 en þegar æxli liggur utarlega í lungnablaði og staðsett fjarri stærri berkjugreinum, getur verið erfitt að komast að því með hefðbundinni berkjuspeglun. Þá er oftast reynt að ná vefjasýni með nálarstungu í gegnum brjóstvegg, og er ástungan nær alltaf gerð með aðstoð TS. Eftir slíka ástungu næst sýni til greiningar í 70-90% tilfella, en fyrir hnúta undir 1 cm að stærð er hlutfallið lægra.45,46 Loftbrjóst er algengasti fylgikvillinn í kjölfar ástungu og sést í allt að 39% tilfella eftir ástungu með grófnál, en 24% með fínnálarástungu.47 Víða erlendis er farið að nota óm- (radial endobronchial ultrasound) og segulmiðun (navigational) við berkjuspeglun til að staðsetja betur og ná sýnum úr æxlum sem liggja utarlega í lungum.48
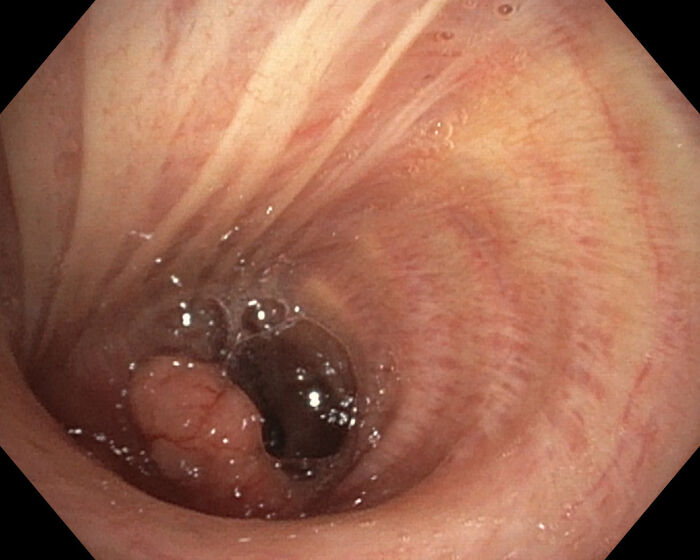
Mynd 4. Mynd tekin í berkjuspeglun sem sýnir lungnakrabbamein á mótum berkju út í miðblað og neðra blað hægra lunga. (Ljósmynd: Hrönn Harðardóttir)
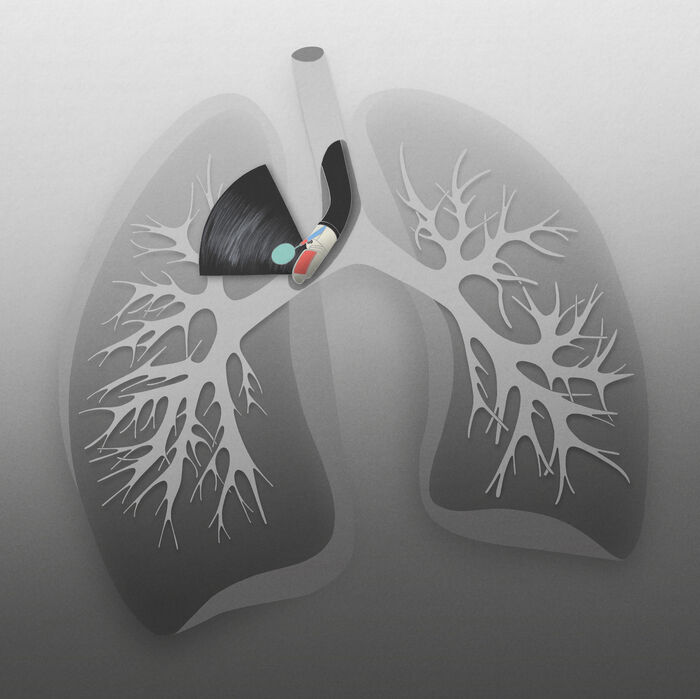
Sé læknandi meðferð talin möguleg hjá sjúklingi með stækkaða eða JS-jákvæða miðmætiseitla er gerð sýnataka til að staðfesta meinvarpið.41 Unnt er að taka sýni úr miðmætiseitlum með nál sem stungið er í gegnum berkju (berkjuómspeglun, endobronchial ultrasound = EBUS) eða vélinda (vélindaómspeglun, eosophageal ultrasound = EUS), og er í báðum tilfellum notuð ómstýring (mynd 5). Þetta er örugg aðferð við stigun miðmætiseitla, sérstaklega þeim sem liggja nálægt stærri loftvegum og eru >10 mm að stærð. Er berkjuómspeglun því ráðlögð sem fyrsta rannsóknaraðferð til sýnatöku úr miðmætiseitlum. Bæði berkju- og vélindaómspeglun má framkvæma í slævingu eða stuttri svæfingu, og er sértæki beggja rannsókna há (83-92%), og tíðni fylgikvilla (blæðing, sýking í miðmæti, loftbrjóst) lág (<1%).49
Mynd 5. Berkjuómspeglun með nálarsýnatöku úr miðmætiseitli.
(Mynd Árni Þór Árnason)
Eftir að berkju- og vélindaómspeglun kom til sögunnar hefur miðmætisspeglunum (mediastinoscopy) fækkað stórlega. Miðmætisspeglun getur þó komið til greina fáist greining ekki með öðrum hætti.41 Í svæfingu er gerður 2-3 cm skurður á neðanverðum hálsi og röri með ljósgafa rennt eftir framanverðum barka niður í miðmæti. Hægt er að ná sýnum úr miðmætiseitlum sömu megin og æxlið (N2-eitlastöð) eða gagnstæðu megin (N3-eitlastöð) (mynd 3). Næmi miðmætisspeglunar í greiningu eitilmeinvarpa er 90% og sértæki 100%,41,50 en hún nær þó ekki til eitla í neðanverðu miðmæti eða eitla í lungnaportum. Miðmætisspeglun er örugg aðgerð og eru fylgikvillar eins og blæðing, áverki á vinstri raddbandstaug og skurðsýkingar sjaldgæfar (<1%).41,50,51
Loks getur brjóstholsspeglun komið til greina þegar sterkur grunur leikur á meinvörpum í fleiðru, til dæmis ef endurtekin frumurannsókn á fleiðruvökva er neikvæð, og æxli ekki sjáanleg á TS.39
Meðferð
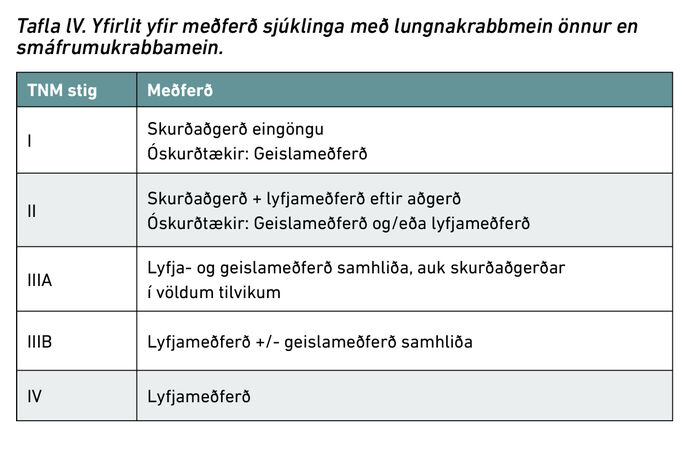
Helstu meðferðir við lungnakrabbameini eru sýndar í töflu lV, en þeim má skipta í skurðaðgerð, geisla- og lyfjameðferð.
Skurðmeðferð
Skurðaðgerð er helsta læknandi meðferðin við staðbundnu lungnakrabbameini.39 Hérlendis fer um þriðji hver sjúklingur sem greinist með lungnakrabbamein sem ekki eru smáfrumukrabbamein í skurðaðgerð þar sem lækning er markmiðið, og þykir það hátt hlutfall á heimsvísu.52 Langflestir þeirra eru á stigi I eða II, en þegar sjúkdómurinn hefur borist í miðmætiseitla sömu megin og lungnaæxlið (stig IIIA) er skurðaðgerð aðeins beitt í undantekningartilfellum53 og næstum aldrei þegar fjarmeinvörp eru til staðar (stig IV). Sama á við þegar miðmætiseitlameinvörp eru gagnstæðu megin við frumæxlið (stig IIIB).39
Algengasta aðgerðin við lungnakrabbameini er blaðnám (lobectomy), og er henni beitt í næstum 80% skurðtilfella.52,54 Þá er lungnablaðið í heild sinni fjarlægt ásamt eitlum í blaðinu og í lungnaporti næst blaðinu (N1 eitlar). Einnig eru eitlar í miðmæti sömu megin og lungnaæxlið fjarlægðir, fyrst og fremst til stigunar, en eitlatakan eykur óverulega tíðni fylgikvilla.55,56
Við fleygskurð (wedge resection) og geiraskurð (segmentectomy) er minna fjarlægt af lunga en við blaðnám, og eru þessar aðgerðir gerðar hjá 10-15% sjúklinga, aðallega sjúklingum sem ekki eru taldir þola blaðnám vegna skertrar lungnastarfsemi.57 Aðgerðirnar eru fljótlegri og tæknilega einfaldari borið saman við blaðnám, en tíðni endurtekins lungnakrabbameins er allt að þrefalt hærri.58 Skýrist það aðallega af því að við blaðnám eru allir N1-eitlar í blaðinu fjarlægðir, en þeir geta í allt að 15% tilfella innihaldið meinvörp.39,56 Ef æxli eru staðsett miðsvæðis í lunganu, eða teygja sig á milli blaða, getur þurft að gera lungnabrottnám (pneumonectomy), og á það við í 5-10% tilfella.59,60 Lungnabrottnám er stór aðgerð og sjúklingar lengur að jafna sig en eftir blaðnám, auk þess sem lífsgæði sjúklinga til langs tíma eru síðri.59,60
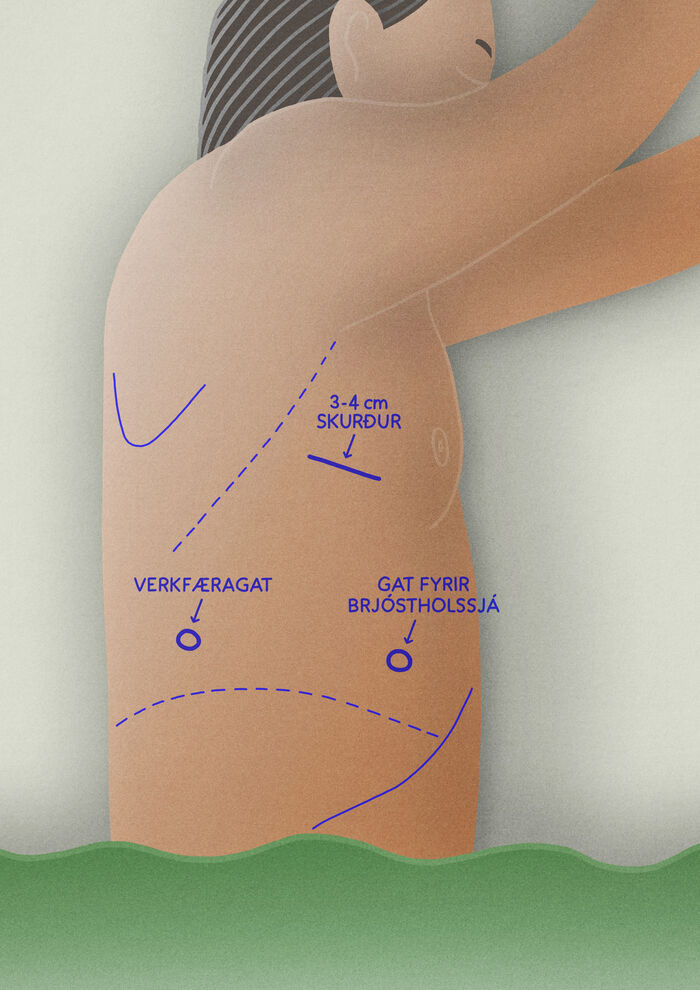
Mynd 6. Helstu skurðir til að framkvæma aðgerðir á lunga. 6a. Mynd sýnir skurði við brjóstholssjáraðgerð á lunga (VATS = video-assisted thoracoscopic surgery). (Mynd Árni Þór Árnasond). 6b. Hefðbundinn brjóstholsskurður. (Ljósmynd: Tómas Guðbjartsson)
Blaðnám, fleygskurðir og sumir geiraskurðir eru í dag oftast framkvæmdir með aðstoð brjóstholssjár og kallast á ensku VATS (video-assisted thoracicscopic surgery). Á mynd 6a sjást skurðir við slíka aðgerð. Lungað er þá fjarlægt í gegnum 3-4 cm langan skurð án þess að glenna rif í sundur líkt og við hefðbundinn brjóstholsskurð, sem aftur minnkar verki og styttir legutíma.61 Hefðbundinn brjóstholsskurður (mynd 6b) á þó enn við í um 15% tilfella, til dæmis við lungnabrottnám og stærri æxli (>8 cm), eða þau sem vaxin eru inn í miðlægar æðar og/eða berkju.62
Óháð aðgerðartækni eru fylgikvillar tíðari eftir blaðnám en fleyg- og geiraskurð og eru gróflega helmingi tíðari eftir lungnabrottnám en blaðnám.57,62 Oftast er um minniháttar fylgikvilla að ræða eins og gáttatif (6%) og yfirborðssýkingar (2%), en alvarlegar blæðingar (2%) og öndunarbilun (6%) geta komið fyrir.52,57 Alvarlegir fylgikvillar eru algengastir eftir lungnabrottnám, til dæmis fleiðruholssýking (5%) sem oftast tengist leka frá berkjustúf og getur valdið berkjufleiðrufistli.57 Annar tiltölulega sjaldgæfur (<5%) fylgikvilli eftir lungnabrottnám er hægri hjartabilun, en hún, líkt og berkjufleiðrufistill, á sinn þátt í að 30 daga dánartíðni er þre- til fjórfalt hærri eftir lungnabrottnám en blaðnám (3,2-12%).57 Hér á landi hefur 30 daga dánartíðni eftir lungnaaðgerðir vegna lungnakrabbameins verið lág, eða 4% eftir lungnabrottnám og <1% eftir blaðnám, sem er með því lægsta sem þekkist.57 63
Skurðmeðferð á stigum IIIA og IV og við smáfrumukrabbameini
Við miðlæg lungnakrabbamein í efra lungnablaði er stundum hægt að beita svokölluðu erma-blaðnámi (sleeve-lobectomy) í stað lungnabrottnáms.64 Er þá auk hefðbundins blaðnáms fjarlægður bútur úr meginberkju og berkjuendarnir saumaðir saman. Við skurðtæk Pancoast-æxli er oft gefin bæði geisla- og krabbameinslyfjameðferð fyrir blaðnám, enda sannað að slíkt bætir lífshorfur þeirra.65 Lungnakrabbamein sem vaxin eru út í brjóstvegg má í völdum tilfellum fjarlægja samtímis með blaðnámi og hluta brjóstveggjar.56 Svipað getur átt við um æxli vaxin í gollurshús eða þind, og er þá notuð bót úr gerviefni eins og Goretex® til að þekja götin. Er þá stundum beitt geisla- og eða lyfjameðferð fyrir aðgerð til að minnka þau (down-staging), en það er einnig stundum reynt við T4-æxli sem vaxin eru inn í miðmæti. Þetta er þó aðeins gert ef miðmætiseitlar eru án meinvarpa, og getur þá 5 ára lifun náð allt að 30% og enn hærra við skurðtæk T4-æxli.56
Skurðaðgerð kemur næstum aldrei til greina hjá sjúklingum á stigi IIIB, eða þeim með fjarmeinvörp (stig IV).34 Á þessu eru þó til undantekningar, til dæmis hjá ungum og annars hraustum einstaklingum á stigi IV með stakt meinvarp í heila eða nýrnahettu.34,66 Meinvarpið er þá fjarlægt fyrst og síðan æxlið í lunganu í annarri aðgerð.
Skurðaðgerð á nær aldrei við hjá sjúklingum með smáfrumukrabbamein, enda langflestir þeirra með útbreiddan sjúkdóm. Einstaka sjúklingar (<5%) greinast þó með staðbundinn skurðtækan sjúkdóm, þar sem 5 ára lifun er á bilinu 13-44%.37
Lyfjameðferð
Þessari meðferð er oft skipt í tvennt eftir því hvort um er að ræða smáfrumukrabbamein eða önnur lungnakrabbamein. Fyrir sjaldgæfa undirgerð lungnakrabbameins, stórfrumukrabbamein, er meðferð í stórum dráttum svipuð meðferð smáfrumukrabbameins.67,68
Lungnakrabbamein sem ekki er af smáfrumugerð
Eins og sést í töflu lV er lyfjameðferð aðallega beitt á stigi IV, en líka á stigum IIIA og IIIB, og sem viðbótarmeðferð eftir skurðaðgerð á stigum IIA og IIB. Lyfjameðferð hefur fleygt fram síðustu ár með tilkomu fleiri lyfja sem bætt hafa árangur meðferðar. Þetta á ekki síst við um sértæk lyf sem beint er gegn ákveðnum meinvaldandi stökkbreytingum og eru aðallega gefin sem töflur, ólíkt ósértækari lyfjum við krabbameini án þekktra stökkbreytinga sem gefin eru í æð. Ósértæku lyfin geta þó haft góða virkni á krabbamein með þekkta stökkbreytingu á meðan sértæku lyfin virka aðeins á krabbamein með meinvaldandi stökkbreytingu.
Sértæk lyfjameðferð
Krabbamein með þekkta stökkbreytingu eru nánast alltaf af kirtilmyndandi gerð og greinast oftar hjá konum, yngra fólki og þeim sem ekki hafa reykt.69,70 Sé stökkbreyting til staðar felst fyrsta meðferð oftast í gjöf sértæks lyfs gegn þeirri stökkbreytingu. Þessi lyf þolast almennt mjög vel en geta haft sértækar aukaverkanir eins og húðútbrot og hægðabreytingar, eða valdið bólgu í líffærum, þá helst í lifur eða lungum.71,72
Ósértæk lyfjameðferð
Þessum lyfjum má skipta annars vegar í hefðbundin krabbameinslyf og nýrri krabbameinslyf sem örva ónæmiskerfi einstaklingsins. Þau hefðbundnu hefta skiptingu krabbameinsfrumna og eru oft með fyrirsjáanlegar aukaverkanir eins og ógleði/lystarleysi, slappleika, hárlos, niðurgang og lækkun á hvítum blóðkornum og/eða blóðflögum. Ónæmisörvandi lyfin hjálpa ónæmiskerfinu að þekkja krabbameinsfrumur sem framandi. Hægt er að mæla próteinið PDL1 á yfirborði lungnakrabbameinsfrumna, sem getur sagt til um meðferðarsvörun, en svörunin er almennt betri eftir því sem meira mælist af próteininu.73 Aukaverkanir ónæmishvetjandi lyfja eru almennt vægari en hefðbundinna krabbameinslyfja, en þau geta þó valdið bólgu í nánast hvaða líffæri sem er, auk þess sem aðrar líkamsfrumur geta einnig orðið fyrir áhrifum þeirra.73,74
Meðferð við sjúkdómi á stigi II
Hjá sjúklingum sem reynast vera með sjúkdóm á stigi II eftir lungnaskurðaðgerð er oft mælt með krabbameinslyfjameðferð (adjuvant chemotherapy) til að minnka líkur á að krabbameinið taki sig upp.75 Yfirleitt eru gefin saman lyfin cisplatín og vinorelbín yfir 12 vikna tímabil, og eru aukaverkanir meðal annars ógleði, hárlos, heyrnarskerðing, skert nýrnastarfsemi og doði í fingrum og tám.75-77
Meðferð við sjúkdómi á stigi III
Hjá þessum sjúklingum kemur skurðaðgerð oftast ekki til greina og er þá reynd læknandi samtvinnuð lyfja- og geislameðferð. Gefin er geislameðferð daglega alla virka daga í 6 vikur og á sama tíma vikulega lyfjameðferð með carboplatín og paclitaxel. Sömu lyf eru síðan oft gefin í stærri skömmtum tvisvar sinnum, til dæmis þremur til fjórum vikum fyrir upphaf geislameðferðar eða í lok geislameðferðar.67
Meðferð á lungnakrabbameini með meinvörpum (á stigi IV)
Meðferð þessa stóra sjúklingahóps er oftast skipt eftir vefjagerð æxlisins.
Kirtilmyndandi krabbamein
Krabbamein án meinvaldandi stökkbreytinga
Flest kirtilmyndandi lungnakrabbamein tilheyra þessum flokki og eru meðhöndluð með ósértækum krabbameinslyfjum sem hafa mismunandi verkunarmáta og aukaverkanir. Má þar nefna carboplatín, pemetrexed, paclitaxel/docetaxel, gemcitabín og vinorelbín. Af ónæmisörvandi lyfjunum má nefna pembrolizumab, nivolumab, atezolizumab og durvalumab, sem öll hafa svipaða verkun og aukaverkanir. Ef heilsa sjúklings leyfir er upphafs-lyfjameðferð oftast gefin sem samsett meðferð, til dæmis með hefðbundnum krabbameinslyfjum eins og carboplatín og pemetrexed og jafnvel með ónæmisörvandi krabbameinslyfi eins og pembrolizumab.68 Meðferðin er gefin í æð á þriggja vikna fresti, í allt að fjögur til sex skipti. Ef meðferðarsvörun er góð tekur við viðhaldsmeðferð, til dæmis með pemetrexed eða pembrolizumab, eða báðum lyfjum saman.68
Krabbamein þar sem meinvaldandi stökkbreytingar eru til staðar
Sífellt fleiri lyf í þessum flokki (tafla I) eru í þróun við þekktum stökkbreytingum sem að öllum líkindum mun leiða til bættra horfa þessara sjúklinga.71,72,78-84 Ef um er að ræða EGFR stökkbreytingu, sem er algengust, eru notaðir svokallaðir EGFR-hemlar eins og erlotiníb eða osimertiníb. Við ALK-stökkbreytingu er beitt alectiníb en fleiri lyf koma til greina og við ROS1-stökkbreytingu crizotiníb eða entrectiníb. BRAF-hemlum eins og vemurafeníb/dabrafeníb og mekinist er beitt hjá sjúklingum með BRAF-stökkbreytingu, og bæta þeir meðferðarsvörun.80 Við RET-stökkbreytingu kemur cabozantiníb til greina, en það má einnig nota við MET-stökkbreytingum ásamt crizotiníb. Við HER2-stökkbreytingu er oftast notað trastuzumab og þá í æð ásamt ósértækum krabbameinslyfjum en fleiri lyf eru í farvatninu.82 Nýrri valkostur í meðferð sjúklinga með NTRK-stökkbreytingu eru lyfin larotrectiníb og entrectiníb.84
Flöguþekjukrabbamein
Lyfjameðferð flöguþekjukrabbameins er að flestu leyti svipuð þeirri sem gefin er við kirtilmyndandi lungnakrabbameini. Flöguþekjukrabbamein mælast þó nánast aldrei með meinvaldandi stökkbreytingar sem hægt er að nýta fyrir sértæka lyfjameðferð.85
Lungnakrabbamein sem er af smáfrumugerð
Smáfrumukrabbamein eru iðulega hratt vaxandi og hafa næstum alltaf dreift sér út fyrir lungað við greiningu. Skurðaðgerð kemur því næstum aldrei til greina. Við staðbundnum sjúkdómi er gefin samtvinnuð lyfja- og geislameðferð, og er lyfjameðferð hafin eins fljótt og hægt er eftir greiningu.86 Geislameðferð er gefin þegar mögulegt er að koma meininu fyrir á einum geislameðferðarreit, og er gefin þegar nokkrar vikur eru liðnar á lyfjameðferðina. Lyfin sem notuð eru í upphafi eru cisplatín og etoposíd í staðbundnum sjúkdómi,87 en carboplatín og etoposíd ef hann er dreifður.88 Lyfin eru gefin í æð á þriggja vikna fresti, allt að 4-6 sinnum. Ef meðferðarsvörun helst eftir að lyfjameðferð er lokið kemur til greina að gefa geislameðferð á heilann til að minnka líkur á að sjúkdómurinn taki sig upp þar.
Geislameðferð
Geislameðferð við lungnakrabbameini er beitt bæði í læknandi og líknandi tilgangi, og gefin ein sér eða samhliða lyfjameðferð. Við læknandi meðferð er markmiðið að ná háum geislaskammti á æxlið í lunganu ásamt eitlameinvörpum í miðmæti. Um leið er reynt að takmarka geislaskammt á nálæg líffæri, eins og mænu, vélinda, hjarta og aðra hluta lungans og þannig fækka fylgikvillum eins og geislalungnabólgu og vélindabólgu sem sjást í allt að 15-40% tilfella eftir geislameðferð.89 Með nýjustu geislatækjum er hægt að hlífa heilbrigðum vef betur án þess að draga úr geislun á sjálft æxlið. Vegur þar þyngst sneiðmyndatækni sem gerir kleift að útbúa þrívíddarlíkan af æxlinu og nálægum líffærum, en einnig markvissari geislaskömmtun (dosimetry) og svokallaðri þrívíddargeislameðferð (volumetric modulated arc therapy, VMAT).90 Á síðasta áratug hefur hnitstýrð geislameðferð (stereotactic body radiotherapy, SBRT) einnig rutt sér til rúms við læknandi geislameðferð við æxlum í lunga. Þá er geislum beint á æxlið með mun hærri skammti og færri skiptum en við hefðbundna geislameðferð, oft 22 Gy í senn í þrjú skipti. Hnitstýrð geislameðferð krefst mikillar nákvæmni í staðsetningu sjúklings, myndstýringu og myndvinnslu, ekki síst vegna áhrifa öndunarhreyfinga á staðsetningu æxlisins.91 Vonir standa til að hnitstýrð geislameðferð verði tekin upp á Landspítala á næstu misserum.
Læknandi geislameðferð
Lungnakrabbamein önnur en smáfrumukrabbamein
Við óskurðtæk lungnakrabbamein á stigi III er oftast gefin hefðbundin geislameðferð daglega 5 daga vikunnar, oftast 2 Gy í senn þar til að 60-66 Gy heildarskammti hefur verið náð.92 Samhliða geislameðferðinni er gefin meðferð með krabbameinslyfjum.92 Meðferðarsvæðið er æxlið sjálft ásamt þeim eitlum sem sterkur grunur er um að innihaldi meinvörp.93
Sjúklinga með æxli á stigi I og II sem ekki er treyst í skurðaðgerð er hægt að meðhöndla með læknandi hnitmiðaðri geislameðferð.94,95 Ekki liggja fyrir slembaðar rannsóknir þar sem árangur er borinn saman við skurðaðgerð. Rannsóknir hafa þó sýnt fram á allt að 41% 5 ára lífshorfur,95 jafnvel þótt geislameðferðarhópurinn sé eldri og með fleiri langvinna sjúkdóma en sjúklingar sem gengust undir skurðaðgerð.96 Geislameðferð fyrir skurðaðgerð getur komið til greina í völdum tilvikum sjúklinga með stig lllA sjúkdóm,97 en geislameðferð eftir skurðaðgerð, eins og hjá þeim sem eru með æxli í skurðbrúnum, er næstum aldrei beitt, enda sýnt fram á að lifun er verri eftir slíka geislameðferð.98
Smáfrumukrabbamein
Smáfrumukrabbamein sem bundið er við annan helming brjósthols er alla jafna meðhöndlað bæði með krabbameinslyfjum og geislameðferð samhliða í læknandi skyni.35 Geislaskammtar eru sambærilegir og fyrir önnur lungnakrabbamein, en oft eru gefnar tvær meðferðir daglega á skemmra tímabili. Ef svörun við upphafsmeðferð er góð næst oft betri lifun með því að gefa fyrirbyggjandi geislameðferð á heilavef í kjölfarið.35
Líknandi geislameðferð
Líknandi geislameðferð er beitt þegar lækningu við lungnakrabbameini verður ekki komið við, og þá oftast vegna einkenna frá meinvörpum eða frumæxli. Geislaskammtur og lengd meðferðar veltur á almennu ástandi sjúklings, einkennum og staðsetningu æxlis, allt frá stakri meðferð í allt að 10 skipti.99
Líknandi meðferð önnur en geislameðferð er afar mikilvægur þáttur í meðferð sjúklinga með ólæknandi lungnakrabbamein, en er ekki til nánari umfjöllunar hér.
Lífshorfur og forspárþættir
Stigun er sterkasti forspárþáttur lífshorfa fyrir sjúklinga með lungnakrabbamein, bæði smáfrumukrabbamein og önnur lungnakrabbamein. Aðrir mikilvægir forspárþættir eru frumugerð,100 innvöxtur í æðar og sogæðar,101 en einnig aldur, almennt ástand sjúklings (hrumleiki), þyngdartap og starfsgeta.102 Nýlega hefur þekking á sameindaerfðaþáttum eins og stökkbreytingum í EGFR, ALK, PDL1, ROS1 í æxli sjúklinga opnað fyrir nýja meðferðarmöguleika hjá sjúklingum með dreifðan sjúkdóm, og geta verið forspárþættir lifunar.103,104 Þannig hafa nýlegar rannsóknir sýnt að ónæmisörvandi meðferð getur allt að tvöfaldað lifun sjúklinga með kirtilkrabbamein á stigi IV þar sem æxlin eru án sértækra stökkbreytinga,105 þrefaldað lifun þeirra sem eru með EGFR-stökkbreytingu71 og allt að sjöfaldað lifun sjúklinga með ALK-stökkbreytingu.106
Lokaorð
Á síðasta áratug hafa orðið miklar framfarir í greiningu og meðferð lungnakrabbameins og hafa þær flestar verið teknar upp hér á landi. Þar vegur þyngst tilkoma nýrra líftækni- og krabbameins-lyfja hjá sjúklingum með útbreiddan sjúkdóm en einnig notkun jáeindaskanna og ómsjárspeglana sem bætt hafa umtalsvert stigun miðmætiseitla. Loks hefur tilkoma brjóstholsspeglunar-aðgerða gjörbreytt skurðmeðferð sjúklinga með staðbundinn sjúkdóm og framfarir í geislameðferð auðveldað meðferð þeirra sem ekki er treyst í aðgerð. Skimun við lungnakrabbameini hefur enn ekki verið tekin upp en ljóst er að ákjósanlegar aðstæður eru til slíkrar leitar vegna þekkingar á faraldsfræði sjúkdómsins hérlendis og erfðum hans. Ánægjulegustu fréttirnar í baráttunni við lungnakrabbamein er hversu mikið dregið hefur úr reykingum á Íslandi og vekur það vonir um að snúa megi niður þennan illskæða faraldur sem lungnakrabbamein er enn.
Þakkir
Þakkir fær Sigríður Oddný Marinósdóttir verkefnastjóri lungnalækninga á Landpítala fyrir aðstoð við uppsetningu á töflum og heimildum.
Heimildir
| 1. Tryggvadóttir L, EJÓoHB. Krabbameinsskrá Íslands hjá Krabbameinsfélagi Íslands mars 2021 | ||||
| 2. Harðardóttir H, Valdimarsdóttir UA, Guðbjartsson T, et al. Greiningarferli lungnakrabbameins á Landspítala: sjúklingamiðuð nálgun. Læknablaðið 2017; 103: 171-7. https://doi.org/10.17992/lbl.2017.04.130 PMid:28401873 |
||||
| 3. Zhang Z, Zhu D, Cui B, et al. Association between particulate matter air pollution and lung cancer. Thorax 2020; 75: 85-7. https://doi.org/10.1136/thoraxjnl-2019-213722 PMid:31727788 |
||||
| 4. Talnabrunnur, fréttabréf landlæknis um heilbrigðisupplýsingar. landlaeknir.is/servlet/file/store93/item39682/Talnabrunnur_Mars_2020.pdf - maí 2021. | ||||
| 5. Danckert B FJ, Engholm G, Hansen HL, et al. NORDCAN. Version 8.2 (26.03.2019). | ||||
| 6. Guðbjartsson T, Smáradóttir A, Skúladóttir H, et al. Lungnakrabbamein - yfirlitsgrein. Læknablaðið 2008; 94: 297-311. | ||||
| 7. Aberle DR, Adams AM, Berg CD, al. Reduced lung-cancer mortality with low-dose computed tomographic screening. N Engl J Med 2011; 365: 395-409. https://doi.org/10.1056/NEJMoa1102873 PMid:21714641 PMCid:PMC4356534 |
||||
| 8. Kaneko M, Kusumoto M, Kobayashi T, et al. Computed tomography screening for lung carcinoma in Japan. Cancer 2000; 89 (11 Suppl): 2485-8. https://doi.org/10.1002/1097-0142(20001201)89:11+<2485::AID-CNCR28>3.0.CO;2-T |
||||
| 9. Henschke CI, Yankelevitz DF, Libby DM, et al. Survival of patients with stage I lung cancer detected on CT screening. N Engl J Med 2006; 355: 1763-71. https://doi.org/10.1056/NEJMoa060476 PMid:17065637 |
||||
| 10. Field JK, Marcus MW, Oudkerk M. Risk assessment in relation to the detection of small pulmonary nodules. Transl Lung Cancer Res 2017; 6: 35-41. https://doi.org/10.21037/tlcr.2017.02.05 PMid:28331822 PMCid:PMC5344838 |
||||
| 11. de Koning HJ, van der Aalst CM, de Jong PA, et al. Reduced Lung-Cancer Mortality with Volume CT Screening in a Randomized Trial. N Engl J Med 2020; 382: 503-13. https://doi.org/10.1056/NEJMoa1911793 PMid:31995683 |
||||
| 12. Chad-Friedman E, Coleman S, Traeger LN, et al. Psychological distress associated with cancer screening: A systematic review. Cancer 2017; 123: 3882-94. https://doi.org/10.1002/cncr.30904 PMid:28833054 PMCid:PMC8116666 |
||||
| 13. Katki HA, Kovalchik SA, Berg CD, et al. Development and Validation of Risk Models to Select Ever-Smokers for CT Lung Cancer Screening. JAMA 2016; 315: 2300-11. https://doi.org/10.1001/jama.2016.6255 PMid:27179989 PMCid:PMC4899131 |
||||
| 14. Tobacco smoke and involuntary smoking. IARC Monogr Eval Carcinog Risks Hum 2004; 83: 1-1438. | ||||
| 15. Pedersen JH, Sørensen JB, Saghir Z, et al. Implementation of lung cancer CT screening in the Nordic countries. Acta Oncol 2017; 56: 1249-57. https://doi.org/10.1080/0284186X.2017.1329592 PMid:28571524 |
||||
| 16. Jonsson S, Thorsteinsdottir U, Gudbjartsson DF, et al. Familial risk of lung carcinoma in the Icelandic population. JAMA 2004; 292: 2977-83. https://doi.org/10.1001/jama.292.24.2977 PMid:15613665 |
||||
| 17. Travis WD, Brambilla E, Nicholson AG, et al. The 2015 World Health Organization Classification of Lung Tumors: Impact of Genetic, Clinical and Radiologic Advances Since the 2004 Classification. J Thorac Oncol 2015; 10: 1243-60. https://doi.org/10.1097/JTO.0000000000000630 PMid:26291008 |
||||
| 18. Comprehensive molecular profiling of lung adenocarcinoma. Nature 2014; 511: 543-50. https://doi.org/10.1038/nature13385 PMid:25079552 PMCid:PMC4231481 |
||||
| 19. Annema JT, Versteegh MI, Veseliç M, et al. Endoscopic ultrasound-guided fine-needle aspiration in the diagnosis and staging of lung cancer and its impact on surgical staging. J Clin Oncol 2005; 23: 8357-61. https://doi.org/10.1200/JCO.2005.01.1965 PMid:16219935 |
||||
| 20. Dong Z, Li H, Zhou J, et al. The value of cell block based on fine needle aspiration for lung cancer diagnosis. J Thorac Dis 2017; 9: 2375-82. https://doi.org/10.21037/jtd.2017.07.91 PMid:28932542 PMCid:PMC5594150 |
||||
| 21. Hirsch FR, Scagliotti GV, Mulshine JL, et al. Lung cancer: current therapies and new targeted treatments. Lancet 2017; 389: 299-311. https://doi.org/10.1016/S0140-6736(16)30958-8 |
||||
| 22. Zugazagoitia J, Molina-Pinelo S, Lopez-Rios F, et al. Biological therapies in nonsmall cell lung cancer. Eur Respir J 2017; 49: 1601520. https://doi.org/10.1183/13993003.01520-2016 PMid:28254765 |
||||
| 23. Asao T, Takahashi F, Takahashi K. Resistance to molecularly targeted therapy in non-small-cell lung cancer. Respir Investig 2019; 57: 20-6. https://doi.org/10.1016/j.resinv.2018.09.001 PMid:30293943 |
||||
| 24. Ancevski Hunter K, Socinski MA, Villaruz LC. PD-L1 Testing in Guiding Patient Selection for PD-1/PD-L1 Inhibitor Therapy in Lung Cancer. Mol Diagn Ther 2018; 22: 1-10. https://doi.org/10.1007/s40291-017-0308-6 PMid:29119407 PMCid:PMC5773410 |
||||
| 25. NICE guidelines on Lung cancer (NG122): diagnosis and management, march 2019. | ||||
| 26. Orrason AW, Sigurdsson MI, Baldvinsson K, et al. T. Incidental detection by computed tomography is an independent prognostic factor for survival in patients operated for nonsmall cell lung carcinoma. ERJ Open Res 2017; 3: 00106-2016. https://doi.org/10.1183/23120541.00106-2016 PMid:28462235 PMCid:PMC5406653 |
||||
| 27. Jeong YJ, Yi CA, Lee KS. Solitary pulmonary nodules: detection, characterization, and guidance for further diagnostic workup and treatment. AJR Am J Roentgenol 2007; 188: 57-68. https://doi.org/10.2214/AJR.05.2131 PMid:17179346 |
||||
| 28. MacMahon H, Naidich DP, Goo JM, et al. Guidelines for Management of Incidental Pulmonary Nodules Detected on CT Images: From the Fleischner Society 2017. Radiology 2017; 284: 228-43. https://doi.org/10.1148/radiol.2017161659 PMid:28240562 |
||||
| 29. Wahbah M, Boroumand N, Castro C, et al. Changing trends in the distribution of the histologic types of lung cancer: a review of 4,439 cases. Ann Diagn Pathol 2007; 11: 89-96. https://doi.org/10.1016/j.anndiagpath.2006.04.006 PMid:17349566 |
||||
| 30. Guðmundsson G, Jónsson HM. Hnútar í lungum og eftirfylgni þeirra. Læknablaðið 2020; 106: 214. https://doi.org/10.17992/lbl.2020.04.575 PMid:32234972 |
||||
| 31. Groheux D, Quere G, Blanc E, et al. FDG PET-CT for solitary pulmonary nodule and lung cancer: Literature review. Diagn Interv Imaging 2016; 97: 1003-17. https://doi.org/10.1016/j.diii.2016.06.020 PMid:27567555 |
||||
| 32. Ardila D, Kiraly AP, Bharadwaj S, et al. End-to-end lung cancer screening with three--dimensional deep learning on low-dose chest computed tomography. Nat Med 2019; 25: 954-61. https://doi.org/10.1038/s41591-019-0536-x https://doi.org/10.1038/s41591-019-0447-x PMid:31110349 |
||||
| 33. AbdulJabbar K, Raza SEA, Rosenthal R, et al. Geospatial immune variability illuminates differential evolution of lung adenocarcinoma. Nat Med 2020; 26: 1054-62. https://doi.org/10.1038/s41591-020-0900-x PMid:32461698 PMCid:PMC7610840 |
||||
| 34. Goldstraw P, Chansky K, Crowley J, et al. The IASLC Lung Cancer Staging Project: Proposals for Revision of the TNM Stage Groupings in the Forthcoming (Eighth) Edition of the TNM Classification for Lung Cancer. J Thorac Oncol 2016; 11: 39-51. https://doi.org/10.1016/j.jtho.2015.09.009 PMid:26762738 |
||||
| 35. Simon GR, Turrisi A. Management of small cell lung cancer: ACCP evidence-based clinical practice guidelines (2nd edition). Chest 2007; 132 (3 Suppl): 324s-39s. https://doi.org/10.1378/chest.07-1385 PMid:17873178 |
||||
| 36. Elliott JA, Osterlind K, Hirsch FR, et al. Metastatic patterns in small-cell lung cancer: correlation of autopsy findings with clinical parameters in 537 patients. J Clin Oncol 1987; 5: 246-54. https://doi.org/10.1200/JCO.1987.5.2.246 PMid:3027269 |
||||
| 37. Früh M, De Ruysscher D, Popat S, et al. Small-cell lung cancer (SCLC): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2013; 24 (Suppl 6): vi99-105. https://doi.org/10.1093/annonc/mdt178 PMid:23813929 |
||||
| 38. Rami-Porta R, Call S, Dooms C, et al. Lung cancer staging: a concise update. Eur Respir J 2018; 51: 1800190. https://doi.org/10.1183/13993003.00190-2018 PMid:29700105 |
||||
| 39. Silvestri GA, Gonzalez AV, Jantz MA, et al. Methods for staging non-small cell lung cancer: Diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest 2013; 143 (5 Suppl): e211S-e50S. | ||||
| 40. Naruke T, Tsuchiya R, Kondo H, et al. Lymph node sampling in lung cancer: how should it be done? Eur J Cardiothorac Surg 1999; 16 Suppl 1: S17-24. https://doi.org/10.1016/S1010-7940(99)00178-5 |
||||
| 41. De Leyn P, Dooms C, Kuzdzal J, et al. Revised ESTS guidelines for preoperative mediastinal lymph node staging for non-small-cell lung cancer. Eur J Cardiothorac Surg 2014; 45: 787-98. https://doi.org/10.1093/ejcts/ezu028 PMid:24578407 |
||||
| 42. Gregory DL, Hicks RJ, Hogg A, et al. Effect of PET/CT on management of patients with non-small cell lung cancer: results of a prospective study with 5-year survival data. J Nucl Med 2012; 53: 1007-15. https://doi.org/10.2967/jnumed.111.099713 PMid:22677701 |
||||
| 43. Verboom P, van Tinteren H, Hoekstra OS, et al. Cost-effectiveness of FDG-PET in staging non-small cell lung cancer: the PLUS study. Eur J Nucl Med Mol Imaging 2003; 30: 1444-9. https://doi.org/10.1007/s00259-003-1199-9 PMid:14579081 |
||||
| 44. Schreiber G, McCrory DC. Performance characteristics of different modalities for diagnosis of suspected lung cancer: summary of published evidence. Chest 2003; 123(1 Suppl): 115s-28s. https://doi.org/10.1378/chest.123.1_suppl.115S PMid:12527571 |
||||
| 45. Rivera MP, Mehta AC, Wahidi MM. Establishing the diagnosis of lung cancer: Diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest 2013; 143 (5 Suppl): e142S-e65S. https://doi.org/10.1378/chest.12-2353 PMid:23649436 |
||||
| 46. Li H, Boiselle PM, Shepard JO, et al. Diagnostic accuracy and safety of CT-guided percutaneous needle aspiration biopsy of the lung: comparison of small and large pulmonary nodules. AJR Am J Roentgenol 1996; 167: 105-9. https://doi.org/10.2214/ajr.167.1.8659351 PMid:8659351 |
||||
| 47. Heerink WJ, de Bock GH, de Jonge GJ, et al. Complication rates of CT-guided transthoracic lung biopsy: meta-analysis. Eur Radiol 2017; 27: 138-48. https://doi.org/10.1007/s00330-016-4357-8 PMid:27108299 PMCid:PMC5127875 |
||||
| 48. Ma L, Fang Y, Zhang T, et al. Comparison in efficacy and safety of forceps biopsy for peripheral lung lesions guided by endobronchial ultrasound-guided sheath (EBUS-GS) and electromagnetic navigation bronchoscopy combined with EBUS (ENB-EBUS). Am J Transl Res 2020; 12: 4604-11. | ||||
| 49. Zhang R, Ying K, Shi L, et al. Combined endobronchial and endoscopic ultrasound-guided fine needle aspiration for mediastinal lymph node staging of lung cancer: a meta-analysis. Eur J Cancer 2013; 49: 1860-7. https://doi.org/10.1016/j.ejca.2013.02.008 PMid:23481511 |
||||
| 50. Detterbeck FC, Jantz MA, Wallace M, et al. Invasive mediastinal staging of lung cancer: ACCP evidence-based clinical practice guidelines (2nd edition). Chest 2007; 132 (3 Suppl): 202s-20s. https://doi.org/10.1378/chest.07-1362 PMid:17873169 |
||||
| 51. Ólafsdóttir TS, Guðmundsson G, Björnsson J, et al. Miðmætisspeglanir á Íslandi: Árangur og ábendingar. Læknablaðið 2010; 96: 399-403. https://doi.org/10.17992/lbl.2010.06.299 PMid:20519769 |
||||
| 52. Thorsteinsson H, Alexandersson A, Oskarsdottir GN, et al. Resection rate and outcome of pulmonary resections for non-small-cell lung cancer: a nationwide study from Iceland. J Thorac Oncol 2012; 7: 1164-9. https://doi.org/10.1097/JTO.0b013e318252d022 PMid:22592213 |
||||
| 53. Ramnath N, Dilling TJ, Harris LJ, et al. Treatment of stage III non-small cell lung cancer: Diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest 2013; 143 (5 Suppl): e314S-e40S. https://doi.org/10.1378/chest.12-2360 PMid:23649445 |
||||
| 54. Oskarsdottir GN, Halldorsson H, Sigurdsson MI, et al. Lobectomy for non-small cell lung carcinoma: a nationwide study of short- and long-term survival. Acta Oncol 2017; 56: 936-42. https://doi.org/10.1080/0284186X.2017.1304652 PMid:28325129 |
||||
| 55. Whitson BA, Groth SS, Maddaus MA. Surgical assessment and intraoperative management of mediastinal lymph nodes in non-small cell lung cancer. Ann Thorac Surg 2007; 84: 1059-65. https://doi.org/10.1016/j.athoracsur.2007.04.032 PMid:17720443 |
||||
| 56. Detterbeck FC, Lewis SZ, Diekemper R, et al. Executive Summary: Diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest 2013; 143 (5 Suppl): 7s-37s. https://doi.org/10.1378/chest.12-2377 PMid:23649434 |
||||
| 57. Halldorsson H, Orrason AW, Oskarsdottir GN, et al. Improved long-term survival following pulmonary resections for non-small cell lung cancer: results of a nationwide study from Iceland. Ann Transl Med 2019; 7: 88. https://doi.org/10.21037/atm.2019.01.10 PMid:31019938 PMCid:PMC6462663 |
||||
| 58. Ginsberg RJ, Rubinstein LV. Randomized trial of lobectomy versus limited resection for T1 N0 non-small cell lung cancer. Lung Cancer Study Group. Ann Thorac Surg 1995; 60: 615-22; discussion 22-3. https://doi.org/10.1016/0003-4975(95)00537-U |
||||
| 59. Þorsteinsson H, Jónsson S, Alfreðsson H, et al. Árangur lungnabrottnámsaðgerða við lungnakrabbameini á Íslandi. Læknablaðið 2009; 95: 823-9. | ||||
| 60. Gudbjartsson T, Gyllstedt E, Pikwer A, Early surgical results after pneumonectomy for non-small cell lung cancer are not affected by preoperative radiotherapy and chemotherapy. Ann Thorac Surg 2008; 86: 376-82. https://doi.org/10.1016/j.athoracsur.2008.04.013 PMid:18640300 |
||||
| 61. Hansen HJ, Petersen RH, Christensen M. Video-assisted thoracoscopic surgery (VATS) lobectomy using a standardized anterior approach. Surg Endosc 2011; 25: 1263-9. https://doi.org/10.1007/s00464-010-1355-9 PMid:20927543 |
||||
| 62. Wang Z, Pang L, Tang J, t al. Video-assisted thoracoscopic surgery versus muscle-sparing thoracotomy for non-small cell lung cancer: a systematic review and meta-analysis. BMC Surg 2019; 19: 144. https://doi.org/10.1186/s12893-019-0618-1 PMid:31615490 PMCid:PMC6794906 |
||||
| 63. Oskarsdottir GN, Bjornsson J, Jonsson S, et al. Primary adenocarcinoma of the lung--histological subtypes and outcome after surgery, using the IASLC/ATS/ERS classification of lung adenocarcinoma. Apmis 2016; 124: 384-92. https://doi.org/10.1111/apm.12522 PMid:26957057 |
||||
| 64. Andersson SE, Rauma VH, Sihvo EI, et al. Bronchial sleeve resection or pneumonectomy for non-small cell lung cancer: a propensity-matched analysis of long-term results, survival and quality of life. J Thorac Dis 2015; 7: 1742-8. | ||||
| 65. Friðriksson BM, Jónsson S, Óskarsdóttir GN, et a. Árangur skurðmeðferðar við Pancoast-lungnakrabbameini á Íslandi. Læknablaðið 2015; 101: 351-5. https://doi.org/10.17992/lbl.2015.0708.35 PMid:26158627 |
||||
| 66. Pfannschmidt J, Dienemann H. Surgical treatment of oligometastatic non-small cell lung cancer. Lung Cancer 2010; 69: 251-8. https://doi.org/10.1016/j.lungcan.2010.05.003 PMid:20537426 |
||||
| 67. Belani CP, Choy H, Bonomi P, et al. Combined chemoradiotherapy regimens of paclitaxel and carboplatin for locally advanced non-small-cell lung cancer: a randomized phase II locally advanced multi-modality protocol. J Clin Oncol 2005; 23: 5883-91. https://doi.org/10.1200/JCO.2005.55.405 PMid:16087941 |
||||
| 68. Gandhi L, Rodríguez-Abreu D, Gadgeel S, et al. Pembrolizumab plus Chemotherapy in Metastatic Non-Small-Cell Lung Cancer. N Engl J Med 2018; 378: 2078-92. https://doi.org/10.1056/NEJMoa1801005 PMid:29658856 |
||||
| 69. Rodig SJ, Mino-Kenudson M, Dacic S, et al. Unique clinicopathologic features characterize ALK-rearranged lung adenocarcinoma in the western population. Clin Cancer Res 2009; 15: 5216-23. https://doi.org/10.1158/1078-0432.CCR-09-0802 PMid:19671850 PMCid:PMC2865649 |
||||
| 70. Shaw AT, Yeap BY, Mino-Kenudson M, et al. Clinical features and outcome of patients with non-small-cell lung cancer who harbor EML4-ALK. J Clin Oncol 2009; 27: 4247-53. https://doi.org/10.1200/JCO.2009.22.6993 PMid:19667264 PMCid:PMC2744268 |
||||
| 71. Ramalingam SS, Vansteenkiste J, Planchard D, et al. Overall Survival with Osimertinib in Untreated, EGFR-Mutated Advanced NSCLC. N Engl J Med 2020; 382: 41-50. https://doi.org/10.1056/NEJMoa1913662 PMid:31751012 |
||||
| 72. Yang JC, Ou SI, De Petris L, et al. Pooled Systemic Efficacy and Safety Data from the Pivotal Phase II Studies (NP28673 and NP28761) of Alectinib in ALK-positive Non-Small Cell Lung Cancer. J Thorac Oncol 2017; 12: 1552-60. https://doi.org/10.1016/j.jtho.2017.06.070 PMid:28689043 PMCid:PMC6886236 |
||||
| 73. Reck M, Rodríguez-Abreu D, Robinson AG, et al. Pembrolizumab versus Chemotherapy for PD-L1-Positive Non-Small-Cell Lung Cancer. N Engl J Med 2016; 375: 1823-33. https://doi.org/10.1056/NEJMoa1606774 PMid:27718847 |
||||
| 74. Mok TSK, Wu YL, Kudaba I, et al. Pembrolizumab versus chemotherapy for previously untreated, PD-L1-expressing, locally advanced or metastatic non-small-cell lung cancer (KEYNOTE-042): a randomised, open-label, controlled, phase 3 trial. Lancet 2019; 393: 1819-30. https://doi.org/10.1016/S0140-6736(18)32409-7 |
||||
| 75. Pignon JP, Tribodet H, Scagliotti GV, et al. Lung adjuvant cisplatin evaluation: a pooled analysis by the LACE Collaborative Group. J Clin Oncol 2008; 26: 3552-9. https://doi.org/10.1200/JCO.2007.13.9030 PMid:18506026 |
||||
| 76. Arriagada R, Bergman B, Dunant A, et al. Cisplatin-based adjuvant chemotherapy in patients with completely resected non-small-cell lung cancer. N Engl J Med 2004; 350: 351-60. https://doi.org/10.1056/NEJMoa031644 PMid:14736927 |
||||
| 77. Glendenning JL, Barbachano Y, Norman AR, et al. Long-term neurologic and peripheral vascular toxicity after chemotherapy treatment of testicular cancer. Cancer 2010; 116: 2322-31. https://doi.org/10.1002/cncr.24981 PMid:20225230 |
||||
| 78. Shaw AT, Ou SH, Bang YJ, et al. Crizotinib in ROS1-rearranged non-small-cell lung cancer. N Engl J Med 2014; 371: 1963-71. https://doi.org/10.1056/NEJMoa1406766 PMid:25264305 PMCid:PMC4264527 |
||||
| 79. Drilon A, Siena S, Dziadziuszko R, et al. Entrectinib in ROS1 fusion-positive non-small-cell lung cancer: integrated analysis of three phase 1-2 trials. Lancet Oncol 2020; 21: 261-70. https://doi.org/10.1016/S1470-2045(19)30690-4 |
||||
| 80. Planchard D, Besse B, Groen HJM, et al. Dabrafenib plus trametinib in patients with previously treated BRAF(V600E)-mutant metastatic non-small cell lung cancer: an open-label, multicentre phase 2 trial. Lancet Oncol 2016; 17: 984-93. https://doi.org/10.1016/S1470-2045(16)30146-2 https://doi.org/10.1016/S1470-2045(16)00077-2 |
||||
| 81. Drilon A, Rekhtman N, Arcila M, et al. Cabozantinib in patients with advanced RET-rearranged non-small-cell lung cancer: an open-label, single-centre, phase 2, single-arm trial. Lancet Oncol 2016; 16: 1653-60. https://doi.org/10.1016/S1470-2045(16)30562-9 |
||||
| 82. Mazières J, Barlesi F, Filleron T, t al. Lung cancer patients with HER2 mutations treated with chemotherapy and HER2-targeted drugs: results from the European EUHER2 cohort. Ann Oncol 2016; 27: 281-6. https://doi.org/10.1093/annonc/mdv573 PMid:26598547 |
||||
| 83. Hong DS, DuBois SG, Kummar S, et al. Larotrectinib in patients with TRK fusion-positive solid tumours: a pooled analysis of three phase 1/2 clinical trials. Lancet Oncol 2020; 21: 531-40. https://doi.org/10.1016/S1470-2045(19)30856-3 |
||||
| 84. Doebele RC, Drilon A, Paz-Ares L, et al. Entrectinib in patients with advanced or metastatic NTRK fusion-positive solid tumours: integrated analysis of three phase 1-2 trials. Lancet Oncol 2020; 21: 271-82. https://doi.org/10.1016/S1470-2045(19)30691-6 |
||||
| 85. Heist RS, Sequist LV, Engelman JA. Genetic changes in squamous cell lung cancer: a review. J Thorac Oncol 2012; 7: 924-33. https://doi.org/10.1097/JTO.0b013e31824cc334 PMid:22722794 PMCid:PMC3404741 |
||||
| 86. Sundstrøm S, Bremnes RM, Kaasa S, et al. Cisplatin and etoposide regimen is superior to cyclophosphamide, epirubicin, and vincristine regimen in small-cell lung cancer: results from a randomized phase III trial with 5 years' follow-up. J Clin Oncol 2002; 20: 4665-72. https://doi.org/10.1200/JCO.2002.12.111 PMid:12488411 |
||||
| 87. Mascaux C, Paesmans M, Berghmans T, et al. A systematic review of the role of etoposide and cisplatin in the chemotherapy of small cell lung cancer with methodology assessment and meta-analysis. Lung Cancer 2000; 30: 23-36. https://doi.org/10.1016/S0169-5002(00)00127-6 |
||||
| 88. Rossi A, Di Maio M, Chiodini P, et al. Carboplatin- or cisplatin-based chemotherapy in first-line treatment of small-cell lung cancer: the COCIS meta-analysis of individual patient data. J Clin Oncol 2012; 30: 1692-8. https://doi.org/10.1200/JCO.2011.40.4905 PMid:22473169 |
||||
| 89. Baker S, Fairchild A. Radiation-induced esophagitis in lung cancer. Lung Cancer (Auckl) 2016; 7: 119-27. https://doi.org/10.2147/LCTT.S96443 PMid:28210168 PMCid:PMC5310706 |
||||
| 90. Jiang X, Li T, Liu Y, et al. Planning analysis for locally advanced lung cancer: dosimetric and efficiency comparisons between intensity-modulated radiotherapy (IMRT), single-arc/partial-arc volumetric modulated arc therapy (SA/PA-VMAT). Radiat Oncol 2011; 6: 140. https://doi.org/10.1186/1748-717X-6-140 PMid:22014217 PMCid:PMC3207896 |
||||
| 91. Giraud P, Morvan E, Claude L, et al. Respiratory gating techniques for optimization of lung cancer radiotherapy. J Thorac Oncol 2011; 6: 2058-68. https://doi.org/10.1097/JTO.0b013e3182307ec2 PMid:22052228 |
||||
| 92. Spira A, Ettinger DS. Multidisciplinary management of lung cancer. N Engl J Med 2004; 350: 379-92. https://doi.org/10.1056/NEJMra035536 PMid:14736930 |
||||
| 93. Emami B, Mirkovic N, Scott C, et al. The impact of regional nodal radiotherapy (dose/volume) on regional progression and survival in unresectable non-small cell lung cancer: an analysis of RTOG data. Lung Cancer 2003; 41: 207-14. https://doi.org/10.1016/S0169-5002(03)00228-9 |
||||
| 94. Detillon D, Driessen EJM, Aarts MJ, et al. Changes in treatment patterns and survival in elderly patients with stage I non-small-cell lung cancer with the introduction of stereotactic body radiotherapy and video-assisted thoracic surgery. Eur J Cancer 2018; 101: 30-7. https://doi.org/10.1016/j.ejca.2018.06.016 PMid:30014972 |
||||
| 95. Rowell NP, Williams CJ. Radical radiotherapy for stage I/II non-small cell lung cancer in patients not sufficiently fit for or declining surgery (medically inoperable): a systematic review. Thorax 2001; 56: 628-38. https://doi.org/10.1136/thx.56.8.628 https://doi.org/10.1136/thorax.56.8.628 PMid:11462066 PMCid:PMC1746110 |
||||
| 96. Zheng X, Schipper M, Kidwell K, et al. Survival outcome after stereotactic body radiation therapy and surgery for stage I non-small cell lung cancer: a meta-analysis. Int J Radiat Oncol Biol Phys 2014; 90: 603-11. https://doi.org/10.1016/j.ijrobp.2014.05.055 PMid:25052562 |
||||
| 97. Robinson LA, Ruckdeschel JC, Wagner H, et al. Treatment of non-small cell lung cancer-stage IIIA: ACCP evidence-based clinical practice guidelines (2nd edition). Chest 2007; 132 (3 Suppl): 243s-65s. https://doi.org/10.1378/chest.07-1379 PMid:17873172 |
||||
| 98. Bogart JA, Aronowitz JN. Localized non-small cell lung cancer: adjuvant radiotherapy in the era of effective systemic therapy. Clin Cancer Res 2005; 11: 5004s-10s. https://doi.org/10.1158/1078-0432.CCR-05-9010 PMid:16000604 |
||||
| 99. Rodrigues G, Videtic GM, Sur R, et al. Palliative thoracic radiotherapy in lung cancer: An American Society for Radiation Oncology evidence-based clinical practice guideline. Pract Radiat Oncol 2011; 1: 60-71. https://doi.org/10.1016/j.prro.2011.01.005 PMid:25740118 PMCid:PMC3808743 |
||||
| 100. Gail MH, Eagan RT, Feld R, et al. Prognostic factors in patients with resected stage I non-small cell lung cancer. A report from the Lung Cancer Study Group. Cancer 1984; 54: 1802-13. https://doi.org/10.1002/1097-0142(19841101)54:9<1802::AID-CNCR2820540908>3.0.CO;2-4 |
||||
| 101. Kwiatkowski DJ, Harpole DH, Jr., Godleski J, et al. Molecular pathologic substaging in 244 stage I non-small-cell lung cancer patients: clinical implications. J Clin Oncol 1998; 16: 2468-77. https://doi.org/10.1200/JCO.1998.16.7.2468 PMid:9667266 |
||||
| 102. Pater JL, Loeb M. Nonanatomic prognostic factors in carcinoma of the lung: a multivariate analysis. Cancer 1982; 50: 326-31. https://doi.org/10.1002/1097-0142(19820715)50:2<326::AID-CNCR2820500227>3.0.CO;2-G |
||||
| 103. Arbour KC, Riely GJ. Systemic Therapy for Locally Advanced and Metastatic Non-Small Cell Lung Cancer: A Review. JAMA 2019; 322: 764-74. https://doi.org/10.1001/jama.2019.11058 PMid:31454018 |
||||
| 104. Howlader N, Forjaz G, Mooradian MJ, et al. The Effect of Advances in Lung-Cancer Treatment on Population Mortality. N Engl J Med 2020; 383: 640-9. https://doi.org/10.1056/NEJMoa1916623 PMid:32786189 PMCid:PMC8577315 |
||||
| 105. Reck M, Rodríguez-Abreu D, Robinson AG, et al. Updated Analysis of KEYNOTE-024: Pembrolizumab Versus Platinum-Based Chemotherapy for Advanced Non-Small-Cell Lung Cancer With PD-L1 Tumor Proportion Score of 50% or Greater. J Clin Oncol 2019; 37: 537-46. https://doi.org/10.1200/JCO.18.00149 PMid:30620668 |
||||
| 106. Duruisseaux M, Besse B, Cadranel J, et al. Overall survival with crizotinib and next-generation ALK inhibitors in ALK-positive non-small-cell lung cancer (IFCT-1302 CLINALK): a French nationwide cohort retrospective study. Oncotarget 2017; 8: 21903-17. https://doi.org/10.18632/oncotarget.15746 PMid:28423535 PMCid:PMC5400633 |
||||