05. tbl. 108. árg. 2022
Fræðigrein
Áhrif skertrar nýrnastarfsemi á snemmkominn árangur kransæðahjáveituaðgerða
Impact of renal dysfunction on early outcomes of coronary artery bypass grafting surgery
Ágrip
INNGANGUR
Skert nýrnastarfsemi eins og við langvinnan nýrnasjúkdóm er áhættuþáttur kransæðasjúkdóms og hefur verið tengd við aukna tíðni fylgikvilla og dánartíðni eftir kransæðahjáveituaðgerð. Árangur hjáveituaðgerða hjá þessum sjúklingahóp hefur ekki verið rannsakaður sérstaklega hér á landi og er markmið rannsóknarinnar að bæta úr því, með áherslu á snemmkomna fylgikvilla og 30 daga dánartíðni.
EFNIVIÐUR OG AÐFERÐIR
Afturskyggn ferilrannsókn á 2300 sjúklingum sem gengust undir kransæðahjáveitu á Landspítala 2001-2020. Sjúklingunum var skipt í fjóra hópa eftir áætluðum gaukulsíunarhraða (GSH) reiknuðum fyrir aðgerð og voru hóparnir bornir saman; GSH 45-59 mL/mín/1,73m2, GSH 30-44 mL/mín/1,73m2, GSH <30 mL/mín/1,73m2 og viðmiðunarhópur (GSH >60 mL/mín/1,73m2). Klínískar upplýsingar fengust úr sjúkraskrám og lógistísk aðhvarfsgreining notuð til að meta forspárþætti 30 daga dánartíðni.
NIÐURSTÖÐUR
Alls höfðu 429 sjúklingar (18,7%) skerta nýrnastarfsemi og voru þeir rúmlega sex árum eldri að meðaltali, einkennameiri, höfðu hærra meðal EuroSCORE II (5,0 á móti 1,9, p<0,001) og miðgildi legutíma þeirra var tveimur dögum lengra en hjá sjúklingum í viðmiðunarhópi. Auk þess var útfallsbrot vinstri slegils lægra, oftar þrengsli í vinstri höfuðstofni og tíðni alvarlegra snemmkominna fylgikvilla og 30 daga dánartíðni hærri. Tíðni fylgikvilla og dánartíðni hækkaði með lækkandi GSH. Í fjölþáttagreiningu reyndust hærri aldur og útfallsbrot vinstri slegils <30% vera sjálfstæðir forspárþættir hærri 30 daga dánartíðni, líkt og GSH <30 mL/mín/1,73m2, sem reyndist langsterkasta forspárgildið (OR=10,4; 95% ÖB: 3,98-25,46).
ÁLYKTANIR
Sjúklingar með skerta nýrnastarfsemi eru eldri og hafa alvarlegri kransæðasjúkdóm en þeir sem hafa eðlilega nýrnastarfsemi. Tíðni snemmkominna fylgikvilla og 30 daga dánartíðni í kjölfar kransæðahjáveituaðgerða reyndist marktækt hærri hjá sjúklingum með verstu nýrnastarfsemina sem jafnframt var sterkasti sjálfstæði forspárþáttur 30 daga dánartíðni.
Greinin barst til blaðsins 27. október 2021, samþykkt til birtingar 21. mars 2022.
Inngangur
Langvarandi skerðing á nýrnastarfsemi er þekktur áhættuþáttur kransæðasjúkdóms1,2 en sjúklingar með langvinnan nýrnasjúkdóm deyja hlutfallslega oftar úr hjarta- og æðasjúkdómum en þeir sem eru með eðlilega nýrnastarfsemi.1,3,4 Við langvinnan nýrnasjúkdóm er gaukulsíunarhraði (GSH) kominn undir 60 mL/mín/1,73m2 og/eða merki um nýrnaskaða samkvæmt þvag- eða myndgreiningarrannsóknum, til dæmis blóð- eða próteinmiga í að minnsta kosti þrjá mánuði.5 Á Íslandi eru helstu orsakir sjúkdómsins sykursýki og háþrýstingur en aðrar þekktar orsakir eru gauklabólga (glomerul-onephritis), millivefsnýrnabólga, stíflunýrnamein (obstructive kidney disease), æðakölkun, sýkingar, lyf og loks arfgengir sjúkdómar eins og blöðrunýrnasjúkdómur.6
Oftast er hægt að beita kransæðavíkkun við alvarlegum kransæðasjúkdómi en við dreifð kransæðaþrengsli getur þurft að framkvæma kransæðahjáveitu.7 Erlendar rannsóknir hafa sýnt að tíðni fylgikvilla eftir kransæðahjáveituaðgerð er hærri hjá sjúklingum með skerta nýrnastarfsemi eða langvinnan nýrnasjúkdóm og 30 daga dánartíðni þeirra er hærri. Hærri dánartíðni hefur aðallega verið rakin til hærri tíðni bráðs nýrnaskaða en einnig heilaáfalls og sýkinga.8,9
Hér á landi hefur árangur kransæðahjáveituaðgerða hjá sjúklingum með skerta nýrnastarfsemi fyrir aðgerð ekki verið kannaður sérstaklega og er markmið rannsóknarinnar að bæta úr því. Rannsóknin lýsir bakgrunnsþáttum sjúklinganna en einnig áhættuþáttum og alvarleika kransæðasjúkdóms, aðgerðartengdum þáttum og sérstaklega snemmkomnum fylgikvillum og 30 daga dánartíðni.
Efniviður og aðferðir
Áður en rannsóknin hófst lágu öll leyfi fyrir, meðal annars frá Vísindasiðanefnd (VSN 10-009-V9), Persónuvernd og framkvæmdastjóra lækninga á Landspítala.
Um er að ræða afturskyggna ferilrannsókn sem byggir á gagnagrunni hjarta- og lungnaskurðdeildar Landspítala sem starf-ræktur hefur verið frá árinu 2005 og inniheldur meðal annars klínískar upplýsingar um alla sjúklinga sem gengist hafa undir kransæðahjáveituaðgerð á Íslandi frá 1. janúar 2001 til 31. desember 2020. Til að tryggja að allir sjúklingar væru teknir með í rannsóknina var stuðst við aðgerðaskrá hjarta- og lungnaskurðdeildar og framkvæmd leit í rafrænu sjúkraskrárkerfi Landspítala eftir aðgerðanúmerum kransæðahjáveituaðgerðar (FNSA00, FNSC10, FNSC20, FNSC30) og aðgerðum þar sem notast var við hjarta- og lungnavél (FZSA00, FZSA10). Alls voru 2300 sjúklingar teknir með í rannsóknina en áður höfðu verið útilokaðir þeir sem gengust undir endurtekna kransæðahjáveituaðgerð eða þar sem önnur hjartaaðgerð var framkvæmd samhliða hjáveitu, svo sem lokuskipti.
Sjúklingum var skipt í fjóra hópa eftir nýrnastarfsemi fyrir aðgerð sem metin var út frá áætluðum gaukulsíunarhraða fyrir aðgerð. Síðasta kreatínín-mæling fyrir aðgerð var notuð til að reikna áætlaðan gaukulsíunarhraða með CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration) jöfnunni.10 Hópaskiptingin byggir í grunninn á skilgreiningu og stigun Kidney Disease: Improving Global Outcomes (KDIGO)5 á langvinnum nýrnasjúkdómi og hefur víða verið notuð í sambærilegum rannsóknum. Skert nýrnastarfsemi fyrir aðgerð var skilgreind sem gaukulsíunarhraði undir 60 mL/mín/1,73 m2 (KDIGO stig 3-5). Í þessari rannsókn var ákveðið að sameina KDIGO stig 1 og 2 (GSH >90 mL/mín/1,73 m2 og GSH 60-89 mL/mín/1,73 m2) í viðmiðunarhóp með eðlilega nýrnastarfsemi, og stig 4 og 5 (GSH 15-29 mL/mín/1,73 m2 og GSH <15 mL/mín/1,73 m2), til að einfalda tölfræðiúrvinnslu, enda fáir einstaklingar á stigum 4 og 5. KDIGO stig 3a (GSH 45-59 mL/mín/1,73 m2) og 3b (GSH 30-44 mL/mín/1,73 m2) voru höfð sem tveir aðskildir hópar en töluverður munur er á nýrnastarfsemi sjúklinga í efstu stigum 3a miðað við neðstu stig 3b. Þetta var meðal annars gert til þess að betur mætti sjá áhrif skertrar nýrnastarfsemi á hina ýmsu þætti. Hóparnir voru síðan bornir saman hvað varðar ýmsa aðgerðartengda þætti og fylgikvilla en einnig með tilliti til 30 daga lifunar.
Lýðfræðilegar og klínískar upplýsingar um sjúklinga fengust úr sjúkraskrám og aðgerðalýsingum. Í gagnagrunninn voru skráðar um 170 breytur fyrir hvern sjúkling í rafræna Excel-skrá (Microsoft Corp, Redmond, WA) en honum hefur verið lýst ítarlega í fyrri greinum rannsóknarhópsins.11,12 Má þar nefna upplýsingar um áhættuþætti kransæðasjúkdóms og ýmsa aðra bakgrunnsþætti sjúklinga, en einnig einkenni núverandi veikinda eins og hjartaöng sem var metin með CCS-flokkun (Canadian cardiovascular society)13 og einkenni hjartabilunar með NYHA (New York Heart Association) flokkun.14 Útbreiðsla kransæðasjúkdóms var metin út frá kransæðaþræðingaskýrslum og úr hjartaómunarsvörun fengust upplýsingar um útstreymisbrot vinstri slegils (left ventricular ejection fraction, LVEF). EuroSCORE II (European System for Cardiac Operative Risk Evaluation II) var reiknað fyrir hvern sjúkling, en það er alþjóðlega viðurkennt áhættulíkan sem metur dánarlíkur fyrstu 30 daga frá hjartaskurðaðgerð.15 Ýmsir aðgerðatengdir þættir voru skráðir, svo sem tangartími, tími á hjarta- og lungnavél, notkun æðaherpandi lyfja og ósæðardælu auk gjafar rauðkornaþykknis, legutíma á gjörgæslu og heildarlegutíma í heilum dögum.
Fylgikvillar eftir aðgerð voru kannaðir og var snemmkomnum fylgikvillum skipt í alvarlega (heilablóðfall, djúp sýking í bringubeini/miðmæti, blóðþurrð í hjarta, alvarlegur bráður nýrnaskaði, bringubeinslos, enduraðgerð vegna blæðingar og fjölkerfabilun) og minniháttar (gáttatif/gáttaflökt, yfirborðssýking í skurðsári, lungnabólga, þvagfærasýking og fleiðruvökvi sem þarfnaðist aftöppunar). Blóðþurrð í hjartavöðva var skilgreind sem nýtilkomnar ST-hækkanir á hjartalínuriti eða nýtilkomið vinstra greinrof ásamt hækkun á CKMB-gildi yfir 70 µg/L. Bráður nýrnaskaði var metinn samkvæmt kreatínín-hluta skilgreiningar KDIGO. Bráður nýrnaskaði af stigi 3 var talinn til alvarlegra fylgikvilla og var skilgreindur sem þreföldun á grunngildi kreatíníns í sermi, aukning á gildi þess í ≥354 mmól/L eða þörf á blóð- eða sískilun innan 7 daga eftir aðgerðina.16 Níu sjúklingar höfðu staðfesta lokastigs nýrnabilun fyrir aðgerð (GSH <15 mL/mín/1,73 m2) og voru 8 þeirra í blóðskilun og því undanskildir í útreikningum á bráðum nýrnaskaða sem fylgikvilla eftir aðgerðina. Að lokum var skráð í gagnagrunninn hverjir hefðu látist innan 30 daga frá aðgerð.
Tölfræði
Upplýsingar voru skráðar í tölvuforritið Excel og tölfræðileg úrvinnsla gerð í Excel og í tölfræðiforritinu R, útgáfu 1.4.1106. Flokkabreytum var lýst sem fjölda og prósentuhlutföllum og samfelldum breytum með meðaltali og staðalfráviki eða miðgildi og spönn eftir sem við átti. Flokkabreytur í GSH-flokkunum fjórum voru bornar saman með kí-kvaðrat prófi og samfelldar talnabreytur bornar saman með ANOVA (analysis of variance) prófi. Tölfræðileg marktækni miðaðist við p-gildi <0,05. Forspárþættir dauða innan 30 daga voru metnir með lógístískri aðhvarfsgreiningu (logistic regression). Voru þeir gefnir upp sem gagnlíkindahlutfall (odds ratio, OR) með 95% öryggisbilum (confidence interval, CI). Leiðrétt var fyrir eftirfarandi breytum: aldri, kyni, útfallsbroti vinstri slegils, sykursýki og bráðleika aðgerðar. Í fáeinum tilvikum (11 sjúklingar) vantaði gaukulsíunarhraðamælingu fyrir aðgerð og þá var sett inn meðaltal í staðinn við útreikninga, þar með talið við fjölbreytugreiningu.
Niðurstöður
Alls reyndust 429 af 2300 sjúklingum (18,7%) hafa skerta nýrnastarfsemi fyrir aðgerð. Mynd 1 sýnir skiptingu sjúklinga í hópa eftir gaukulsíunarhraða fyrir aðgerð með KDIGO-stigun til hliðsjónar, en 1871 (81,3%) voru í viðmiðunarhópi, 296 (12,9%) í GSH 45-59 hópi, 92 (4,0%) í GSH 30-44 hópi og 41 (1,8%) í GSH <30 hópi.
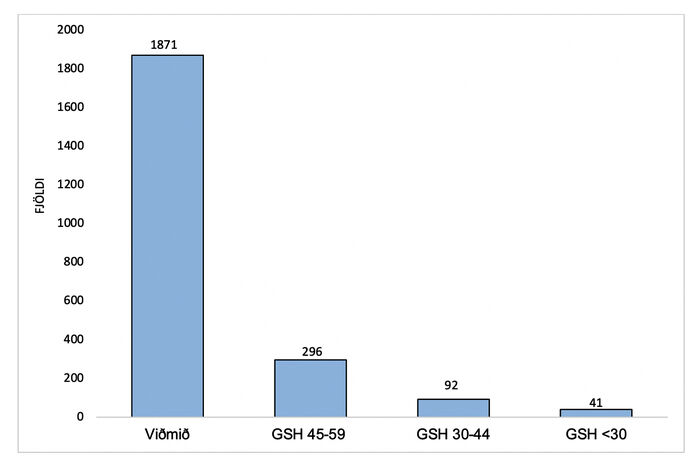 Mynd 1. Skipting sjúklingahópsins (n=2300) í fjóra hópa eftir gaukulsíunarhraða (mL/mín/1,73m2). Viðmiðunarhópur: GSH ≥60 mL/mín/1,73m2.
Mynd 1. Skipting sjúklingahópsins (n=2300) í fjóra hópa eftir gaukulsíunarhraða (mL/mín/1,73m2). Viðmiðunarhópur: GSH ≥60 mL/mín/1,73m2.
Í töflu I eru bakgrunnsþættir GSH-hópanna bornir saman. Sjúklingar með skerta nýrnastarfsemi reyndust marktækt eldri, oftar konur og EuroSCORE II hærra (10,3 í hópi 3 á móti 1,9 í viðmiðunarhópi) og hækkaði það með lægri gaukulsíunarhraða (p<0,001). Þessir sjúklingar voru einnig með útbreiddari kransæðasjúkdóm, oftar með vinstri höfuðstofnsþrengsl og höfðu meiri einkenni frá hjarta en sjúklingar í viðmiðunarhópi. Sést það meðal annars á hlutfalli sjúklinga í CCS-flokki 4 sem jókst með lækkandi gaukulsíunarhraða, (p<0,001). Útfallsbrot vinstri slegils reyndist einnig lækka með lækkandi gaukulsíunarhraða og blóðrauði var marktækt lægri hjá sjúklingum með skerta nýrnastarfsemi, eða 120 g/L að meðaltali borið saman við miðað við 142 g/L í viðmiðunarhópi. Áhættuþættir kransæðasjúkdóms voru sambærilegir í hópunum ef frá eru taldir háþrýstingur og sykursýki sem voru marktækt algengari hjá sjúklingum með skerta nýrnastarfsemi (sjá töflu II).
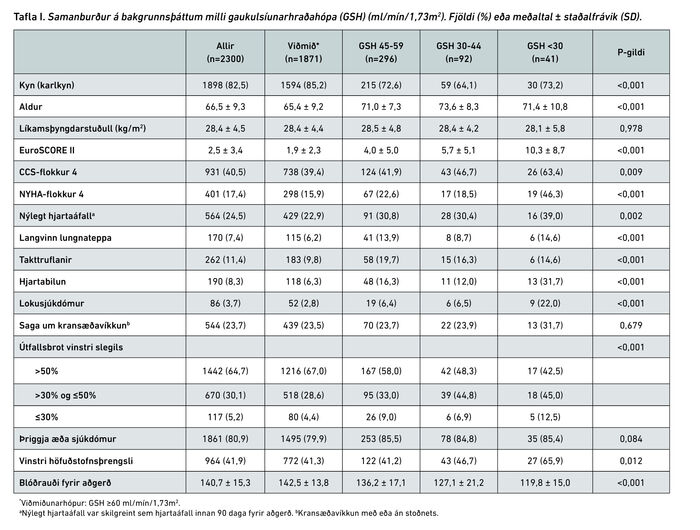
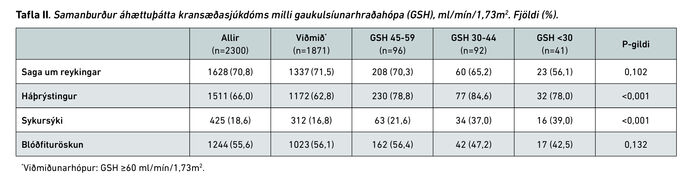 Samanburður á aðgerðartengdum þáttum, blóðgjöf og legutíma er sýndur í töflu III.
Samanburður á aðgerðartengdum þáttum, blóðgjöf og legutíma er sýndur í töflu III.
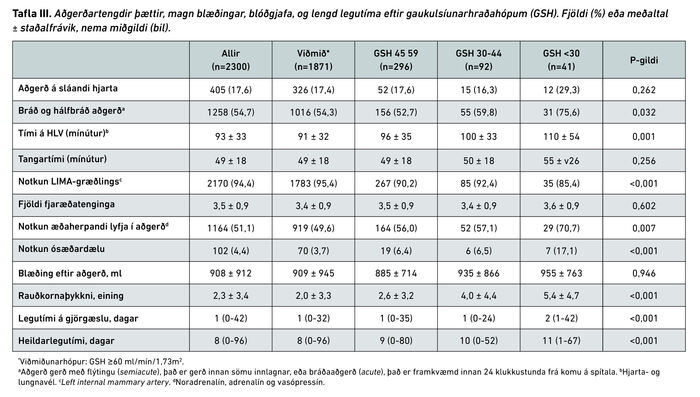 Sjúklingar með skerta nýrnastarfsemi voru lengur á hjarta- og lungnavél (HLV) og munaði 19 mínútum á GSH <30 hópi og viðmiðunarhópi (p=0,001). Í GSH <30 hópi var LIMA-græðlingur notaður sjaldnar en í öðrum hópum (p<0,001). Loks þurftu marktækt fleiri sjúklingar með verstu nýrnastarfsemina ósæðardælu (intra aortic balloon pump, IABP), þeir fengu fleiri einingar af rauðkornaþykkni og legutími þeirra á gjörgæslu og sjúkrahúsi var lengri en í viðmiðunarhópi (p<0,001).
Sjúklingar með skerta nýrnastarfsemi voru lengur á hjarta- og lungnavél (HLV) og munaði 19 mínútum á GSH <30 hópi og viðmiðunarhópi (p=0,001). Í GSH <30 hópi var LIMA-græðlingur notaður sjaldnar en í öðrum hópum (p<0,001). Loks þurftu marktækt fleiri sjúklingar með verstu nýrnastarfsemina ósæðardælu (intra aortic balloon pump, IABP), þeir fengu fleiri einingar af rauðkornaþykkni og legutími þeirra á gjörgæslu og sjúkrahúsi var lengri en í viðmiðunarhópi (p<0,001).
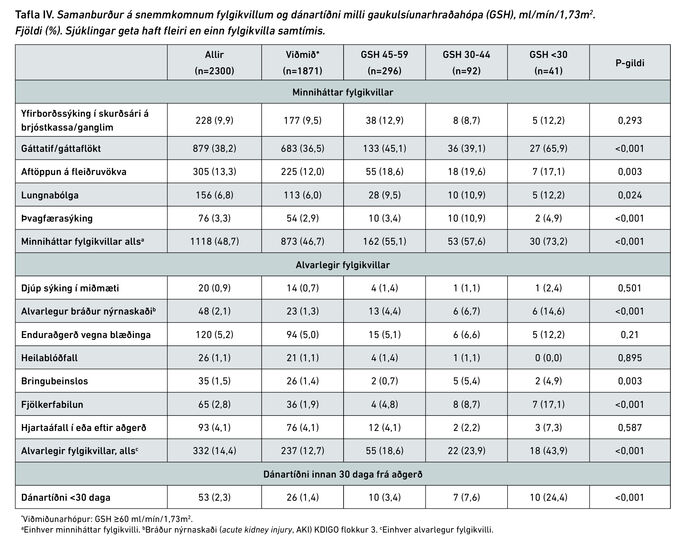 Í töflu IV er sýnd tíðni snemmkominna minniháttar og alvarlegra fylgikvilla, en tíðni þeirra hækkaði eftir því sem gaukul-síunarhraði lækkaði. Þannig greindust alvarlegir fylgikvillar í 43,9% tilvika í GSH <30 hópi en 12,7% í viðmiðunarhópi (p<0,001). Þar á meðal var tíðni alvarlegs bráðs nýrnaskaða 14,6% hjá sjúklingum í GSH <30 hópi borið saman við 1,3% í viðmiðunarhópi. Dánartíðni innan 30 daga frá aðgerð hækkaði með versnandi nýrnastarfsemi fyrir aðgerð (p<0,001), hjá GSH <30 hópi var hún 24,4% borið saman við 1,4% hjá viðmiðunarhópi en heildardánartíðni rannsóknarþýðisins var 2,3%.
Í töflu IV er sýnd tíðni snemmkominna minniháttar og alvarlegra fylgikvilla, en tíðni þeirra hækkaði eftir því sem gaukul-síunarhraði lækkaði. Þannig greindust alvarlegir fylgikvillar í 43,9% tilvika í GSH <30 hópi en 12,7% í viðmiðunarhópi (p<0,001). Þar á meðal var tíðni alvarlegs bráðs nýrnaskaða 14,6% hjá sjúklingum í GSH <30 hópi borið saman við 1,3% í viðmiðunarhópi. Dánartíðni innan 30 daga frá aðgerð hækkaði með versnandi nýrnastarfsemi fyrir aðgerð (p<0,001), hjá GSH <30 hópi var hún 24,4% borið saman við 1,4% hjá viðmiðunarhópi en heildardánartíðni rannsóknarþýðisins var 2,3%.
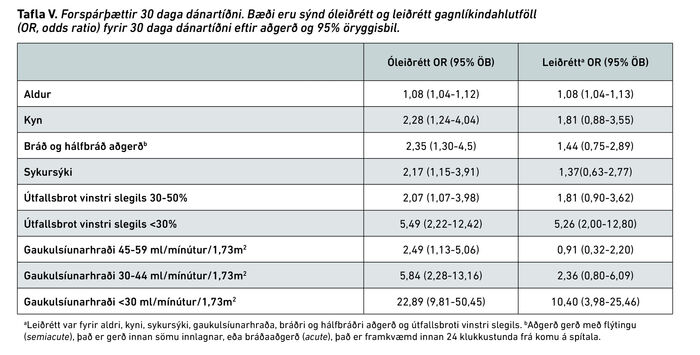 Tafla V sýnir lógistíska aðhvarfsgreiningu á forspárþáttum dánartíðni innan 30 daga frá aðgerð. Bæði eru sýnd gagnlíkindahlutföll (odds ratio, OR) fyrir og eftir að leiðrétt hafði verið fyrir ýmsum þáttum í líkaninu. Sjálfstæðir forspárþættir reyndust hækkandi aldur (OR = 1,08; 95% ÖB: 1,04-1,13) á ári og útfallsbrot vinstri slegils <30% miðað við yfir 30 (ÖB = 5,26; 95% ÖB: 2,00-12,80), en sterkasta forspárgildi dánartíðni innan 30 daga reyndist gaukul-síunarhraði <30 mL/mín/1,73m2 fyrir aðgerð sem rúmlega tífaldaði dánarlíkur (OR = 10,40; 95% ÖB: 3,98-25,46). Þegar gaukulsíunarhraði var notaður sem línuleg breyta í lógistíska módelinu fengust svipaðar niðurstöður og fyrir gaukulsíunarhraða sem flokkabreytu, en líkur á dauða innan 30 daga jukust um 3% fyrir hverja lækkun um 1 mL/mín/1,73m2 á GSH (OR = 1,03, 95% ÖB: 1,01-1,04) og 34% fyrir lækkun um hverja 10 mL/mín/1,73m2 (OR = 1,34, 95% ÖB: 1,15-1,57).
Tafla V sýnir lógistíska aðhvarfsgreiningu á forspárþáttum dánartíðni innan 30 daga frá aðgerð. Bæði eru sýnd gagnlíkindahlutföll (odds ratio, OR) fyrir og eftir að leiðrétt hafði verið fyrir ýmsum þáttum í líkaninu. Sjálfstæðir forspárþættir reyndust hækkandi aldur (OR = 1,08; 95% ÖB: 1,04-1,13) á ári og útfallsbrot vinstri slegils <30% miðað við yfir 30 (ÖB = 5,26; 95% ÖB: 2,00-12,80), en sterkasta forspárgildi dánartíðni innan 30 daga reyndist gaukul-síunarhraði <30 mL/mín/1,73m2 fyrir aðgerð sem rúmlega tífaldaði dánarlíkur (OR = 10,40; 95% ÖB: 3,98-25,46). Þegar gaukulsíunarhraði var notaður sem línuleg breyta í lógistíska módelinu fengust svipaðar niðurstöður og fyrir gaukulsíunarhraða sem flokkabreytu, en líkur á dauða innan 30 daga jukust um 3% fyrir hverja lækkun um 1 mL/mín/1,73m2 á GSH (OR = 1,03, 95% ÖB: 1,01-1,04) og 34% fyrir lækkun um hverja 10 mL/mín/1,73m2 (OR = 1,34, 95% ÖB: 1,15-1,57).
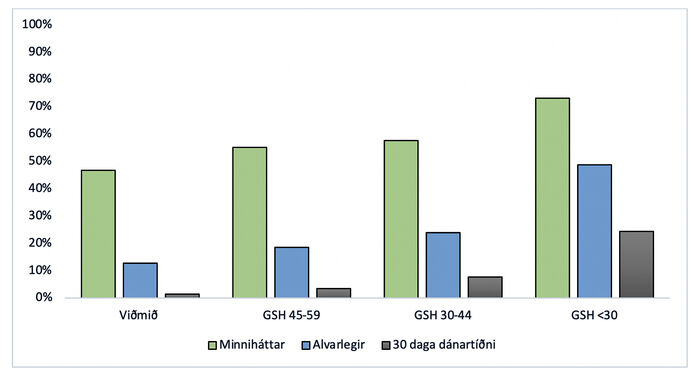
Mynd 2. Tíðni snemmkominna fylgikvilla og dánartíðni <30 daga frá aðgerð hjá sjúklingum eftir GSH-hópum (ml/mín/1,73m2). Viðmiðunarhópur: GSH ≥60 mL/mín/1,73m2.
Umræða
Þessi rannsókn sýnir hversu mikið vægi skert nýrnastarfsemi hefur þegar kemur að árangri kransæðahjáveitu, en tíðni snemmkominna fylgikvilla hjá þessum sjúklingum var marktækt aukin líkt og 30 daga dánartíðni.
Tæplega 19% rannsóknarhópsins höfðu skerta nýrnastarfsemi fyrir aðgerð sem miðaðist við gaukul-síunarhraða <60 ml/mín/1,73 m2. Það er umtalsvert hærri tíðni en sást í nýlegri íslenskri rannsókn á langvinnum nýrnasjúkdómi í almennu þýði6 en há tíðni skertrar nýrnastarfsemi var viðbúin í þessum hópi sjúklinga, enda þekktur áhættuþáttur kransæðasjúkdóms.1,2
Sjúklingar með skerta nýrnastarfsemi voru að meðaltali um 6 árum eldri en sjúklingar í viðmiðunarhópi auk þess sem áhættuþættirnir sykursýki og háþrýstingur voru marktækt algengari í þeirra hópi. Þessar niðurstöður koma heim og saman við fjölda sambærilegra rannsókna.6,9,17
Sjúklingar með skerta nýrnastarfsemi fengu fleiri einingar af rauðkornaþykkni í aðgerðinni, eða stuttu eftir hana (tafla III), og fjölgaði gefnum einingum eftir því sem nýrnastarfsemi versnaði. Þetta var viðbúið þar sem þessir sjúklingar höfðu lægra blóðrauðagildi fyrir aðgerð (tafla I), en blóðleysi tengist oft skertri nýrnastarfsemi, meðal annars vegna minni framleiðslu nýrna á rauðkornavaka (erythropoetin), aukinnar blæðingarhættu og járnskorts.1 Ekki kom á óvart að með lægri gaukulsíunarhraða lengdist bæði legutími á gjörgæslu og heildarlegutími, (tafla III), enda sýnir okkar rannsókn líkt og erlendar rannsóknir að tíðni alvarlegra fylgikvilla eftir aðgerðina hækkar hjá nýrnaveikum og krefjast sumir þeirra innlagnar á gjörgæslu.8,9 LIMA-græðlingur var sjaldnar notaður hjá sjúklingum með skerta nýrnastarfsemi (tafla III) og þá eingöngu notast við bláæðagræðlinga, sennilega til að stytta aðgerðartíma og um leið minnka áhættu á blæðingum. Lengri tíma tekur að losa LIMA-græðling en bláæðagræðling, auk þess sem blæðingarhætta er meiri.
Þrjátíu daga dánartíðni reyndist umtalsvert hærri hjá sjúklingum með skerta nýrnastarfsemi borið saman við viðmiðunarhóp, en hjá GSH <30 hópi létust 24,4% innan 30 daga borið saman við 1,4% hjá viðmiðunarhópi (tafla IV). Í fjölda erlendra rannsókna hefur verið lýst sambærilegum niðurstöðum á áhrifum skertrar nýrnastarfsemi á 30 daga dánartíðni eftir kransæðahjáveituaðgerð.8,9,18-20 Sama átti við um tíðni minniháttar fylgikvilla aðra en yfirborðssýkingar í skurðsári en þeir voru allir marktækt algengari hjá sjúklingum með skerta nýrnastarfsemi og jókst tíðni þeirra einnig marktækt eftir því sem gaukulsíunarhraði lækkaði. Heildartíðni alvarlegra fylgikvilla jókst einnig marktækt með versnandi nýrnastarfsemi og var marktækur munur á tíðni bráðs nýrnaskaða, bringubeinsloss og fjölkerfabilunar (tafla IV). Jafnframt kemur ekki á óvart að alvarlegur bráður nýrnaskaði greindist í 14,6% tilvika hjá sjúklingum í GSH <30 hópi borið saman við 1,3% í viðmiðunarhópi, en rannsóknir hafa sýnt fram á aukna dánartíðni við bráðan nýrnaskaða eftir kransæðahjáveitu.21 Auk þess var tangartími lengri og útfallsbrot vinstri slegils oftar skert hjá sjúklingum með skerta nýrnastarfsemi, en hvort tveggja eru áhættuþættir bráðs nýrnaskaða og versnunar á nýrnastarfsemi sem getur leitt til langvinns nýrnasjúkdóms.22
Langsterkasti forspárþáttur dauða innan 30 daga frá aðgerð var alvarleg skerðing á nýrnastarfsemi, eða gaukulsíunarhraði <30 ml/mín/1,73m2 fyrir aðgerð, og jukust líkurnar á dauða rúmlega tífalt borið saman við viðmiðunarhóp (tafla V). Í rannsókn Coopers og félaga reyndust líkurnar á dauða innan 30 daga frá aðgerð einnig aukast eftir því sem gaukulsíunarhraði lækkaði, og líkt og í okkar rannsókn höfðu sjúklingar með gaukulsíunarhraða <30 ml/mín/1,73 m2 verstar horfur.9 Aðrir sjálfstæðir forspárþættir í fjölbreytugreiningu voru hækkandi aldur og skert útfallsbrot vinstri slegils <30%, sem báðir eru þekktir sjálfstæðir forspárþættir dauða í tengslum við kransæðahjáveituaðgerðir.23,24
Ótvíræður styrkur þessarar rannsóknar er að hún nær til allra sjúklinga sem gengust undir kransæðahjáveituaðgerð á 20 ára tímabili hjá heilli þjóð. Auk þess telst styrkur að allar aðgerðirnar voru gerðar á sömu stofnun af tiltölulega fáum hjartaskurðlæknum, sem gerir rannsóknarhópinn einsleitari. Gagna-grunnurinn sem stuðst var við er mjög ítarlegur og þar eru skráðar næstum 200 breytur fyrir hvern sjúkling, þar á meðal hvernig þeim vegnaði eftir aðgerðina. Helsti veikleiki rannsóknarinnar er að hún er afturskyggn, en slíkar rannsóknir eru háðar því að upplýsingar séu rétt skráðar í sjúkraskrá sjúklings. Skráning upplýsinga eins og um einkenni, bakgrunnsþætti og fylgikvilla hefði þannig verið nákvæmari ef um væri að ræða framskyggna rannsókn. Einnig er veikleiki hversu fáir sjúklingar eru í sumum gaukulsíunarhraðahópunum, sem takmarkar tölfræðilegan styrk. Rannsóknarþýðinu var skipt í hópa samkvæmt stakri síðustu gaukulsíunarhraðamælingu fyrir aðgerð, en til þess að uppfylla greiningarskilyrði langvinns nýrnasjúkdóms þarf gaukulsíunarhraði að vera undir 60 mL/mín/1,73m2 og/eða merki um nýrnaskaða samkvæmt þvag- eða myndgreiningarrannsóknum í að minnsta kosti þrjá mánuði.25 Upplýsingar um gaukulsíunarhraða yfir þriggja mánaða tímabil eða lengur fyrir aðgerðina voru ekki aðgengilegar í öllum tilfellum. Því uppfylltu ekki allir sjúklingar okkar greiningarskilyrði langvinns nýrnasjúkdóms og því ekki hægt að yfirfæra niðurstöðurnar á aðra sjúklinga með slíkan nýrnasjúkdóm. Þó er ljóst að langflestir sjúklinganna sem höfðu skerta nýrnastarfsemi reyndust uppfylla greiningarskilmerkin. Loks er rétt að hafa í huga að í rannsókn sem þessari er viss hætta á valbjögun (selection bias), þannig að sjúklingar með verstu nýrnastarfsemina eru síður teknir til aðgerðar.
Þessi rannsókn sýnir að fylgni reyndist vera milli skertrar nýrnastarfsemi og tíðni snemmkominna fylgikvilla sem og 30 daga dánartíðni en árangur versnaði eftir því sem nýrnastarfsemi fyrir aðgerð versnaði. Slæmar horfur hjá sjúklingum með alvarlega skerðingu á nýrnastarfsemi má sennilega rekja til ýmissa samverkandi þátta en jafnframt hefur skert nýrnastarfsemi sterk tengsl við almennan hrumleika, sem aftur hefur tengsl við aukna dánaráhættu.26 Rannsókn okkar bætist við fjölda annarra rannsókna á árangri kransæðahjáveituaðgerða á Íslandi og fylgikvilla í kjölfar þeirra. Niðurstöðurnar munu vonandi stuðla að frekari rannsóknum á þessum sjúklingahópi og vekja athygli á mikilvægi nýrnastarfsemi hvað varðar árangur þessara algengu aðgerða.
Þakkir
Þakkir fær Eygló Guðmundsdóttir, verkefnastjóri á hagdeild Landspítala, fyrir aðstoð við leit að sjúkraskrám. Rannsóknin var styrkt af Vísindasjóði Landspítala, Rannsóknarsjóði Háskóla Íslands og Minningarsjóði Helgu Jónsdóttur og Sigurliða Kristjánssonar.
Heimildir
| 1. Webster AC, Nagler EV, Morton RL, et al. Chronic Kidney Disease. Lancet 2017; 389: 1238-52. https://doi.org/10.1016/S0140-6736(16)32064-5 |
||||
| 2. Levey AS, Eckardt K-U, Tsukamoto Y, et al. Definition and classification of chronic kidney disease: A position statement from Kidney Disease: Improving Global Outcomes (KDIGO). Kidney Int 2005; 67: 2089-100. https://doi.org/10.1111/j.1523-1755.2005.00365.x PMid:15882252 |
||||
| 3. Go AS, Chertow GM, Fan D, et al. Chronic Kidney Disease and the Risks of Death, Cardiovascular Events, and Hospitalization. N Engl J Med 2004; 351: 1296-305. https://doi.org/10.1056/NEJMoa041031 PMid:15385656 |
||||
| 4. Sarnak MJ, Amann K, Bangalore S, et al. Chronic Kidney Disease and Coronary Artery Disease: JACC State-of-the-Art Review. J Am Coll Cardiol 2019; 74: 1823-38. https://doi.org/10.1016/j.jacc.2019.08.1017 PMid:31582143 |
||||
| 5. Levey AS, de Jong PE, Coresh J, et al. The definition, classification, and prognosis of chronic kidney disease: a KDIGO Controversies Conference report. Kidney Int 2011; 80: 17-28. https://doi.org/10.1038/ki.2010.483 PMid:21150873 |
||||
| 6. Jonsson AJ, Lund SH, Eriksen BO, et al. The prevalence of chronic kidney disease in Iceland according to KDIGO criteria and age-adapted estimated glomerular filtration rate thresholds. Kidney Int 2020; 98: 1286-95. https://doi.org/10.1016/j.kint.2020.06.017 PMid:32622831 |
||||
| 7. Gudbjartsson T. Kransæðabókin. Ísafoldarprentsmiðja, Reykjavík 2016. | ||||
| 8. Minakata K, Bando K, Tanaka S, et al. Preoperative Chronic Kidney Disease as a Strong Predictor of Postoperative Infection and Mortality After Coronary Artery Bypass Grafting. Circulation J 2014; 78: 2225-31. https://doi.org/10.1253/circj.CJ-14-0328 PMid:25070504 |
||||
| 9. Cooper WA, O'Brien SM, Thourani VH, et al. Impact of renal dysfunction on outcomes of coronary artery bypass surgery: results from the Society of Thoracic Surgeons National Adult Cardiac Database. Circulation 2006; 113: 1063-70. https://doi.org/10.1161/CIRCULATIONAHA.105.580084 PMid:16490821 |
||||
| 10. Levey AS, Stevens LA, Schmid CH, et al. A new equation to estimate glomerular filtration rate. Ann Intern Med 2009; 150: 604-12. https://doi.org/10.7326/0003-4819-150-9-200905050-00006 PMid:19414839 PMCid:PMC2763564 |
||||
| 11. Gardarsdottir HR, Arnadottir LO, Adalsteinsson JA, et al. Árangur kransæðahjáveituaðgerða hjá konum á Íslandi. Læknablaðið 2018; 104: 335-40. https://doi.org/10.17992/lbl.2018.0708.192 PMid:29972134 |
||||
| 12. Sigurjónsson H, Helgadóttir S, Oddsson SJ, et al. Árangur kransæðahjáveituaðgerða á Íslandi 2002-2006. Læknablaðið 2012; 98: 451-6. https://doi.org/10.17992/lbl.2012.09.449 PMid:22947627 |
||||
| 13. Conti CR. Grading chronic angina pectoris (myocardial ischemia). Clin Cardiol 2010; 33: 124-5. https://doi.org/10.1002/clc.20766 PMid:20235212 PMCid:PMC6653772 |
||||
| 14. Bredy C, Ministeri M, Kempny A, et al. New York Heart Association (NYHA) classification in adults with congenital heart disease: relation to objective measures of exercise and outcome. Eur Heart J Qual Care Clin Outcomes 2017; 4: 51-8. https://doi.org/10.1093/ehjqcco/qcx031 PMid:28950356 |
||||
| 15. Noyez L, Kievit PC, van Swieten HA, et al. Cardiac operative risk evaluation: The EuroSCORE II, does it make a real difference? Neth Heart J 2012; 20: 494-8. https://doi.org/10.1007/s12471-012-0327-1 PMid:23055057 PMCid:PMC3515725 |
||||
| 16. Khwaja A. KDIGO Clinical Practice Guidelines for Acute Kidney Injury. Nephron Clin Pract 2012; 120: c179-c84. https://doi.org/10.1159/000339789 PMid:22890468 |
||||
| 17. Viktorsdottir O, Palsson R, Andresdottir MB, et al. Prevalence of chronic kidney disease based on estimated glomerular filtration rate and proteinuria in Icelandic adults. Nephrol Dialysis Transplant 2005; 20: 1799-807. https://doi.org/10.1093/ndt/gfh914 PMid:15928100 |
||||
| 18. Li X, Zhang S, Xiao F. Influence of chronic kidney disease on early clinical outcomes after off-pump coronary artery bypass grafting. J Cardiothorac Surg 2020; 15: 199. https://doi.org/10.1186/s13019-020-01245-5 PMid:32727495 PMCid:PMC7391501 |
||||
| 19. Kusu-Orkar TE, Kermali M, Oguamanam N, et al. Coronary artery bypass grafting: Factors affecting outcomes. J Card Surg 2020; 35: 3503-11. https://doi.org/10.1111/jocs.15013 PMid:32939803 |
||||
| 20. Chikwe J, Castillo JG, Rahmanian PB, et al. The impact of moderate-to-end-stage renal failure on outcomes after coronary artery bypass graft surgery. J Cardiothorac Vasc Anesth 2010; 24: 574-9. https://doi.org/10.1053/j.jvca.2009.10.017 PMid:20570181 |
||||
| 21. Helgadottir S, Sigurdsson MI, Palsson R, et al. Renal recovery and long-term survival following acute kidney injury after coronary artery surgery: a nationwide study. Acta Anaesthesiol Scand 2016; 60: 1230-40. https://doi.org/10.1111/aas.12758 https://doi.org/10.1111/aas.12782 |
||||
| 22. Sutherland L, Hittesdorf E, Yoh N, et al. Acute kidney injury after cardiac surgery: A comparison of different definitions. Nephrol (Carlton) 2020; 25: 212-8. https://doi.org/10.1111/nep.13669 PMid:31587419 |
||||
| 23. Baskett R, Buth K, Ghali W, et al. Outcomes in octogenarians undergoing coronary artery bypass grafting. CMAJ 2005; 172: 1183-6. https://doi.org/10.1503/cmaj.1041342 PMid:15851711 PMCid:PMC557069 |
||||
| 24. Yau TM, Fedak PW, Weisel RD, et al. Predictors of operative risk for coronary bypass operations in patients with left ventricular dysfunction. J Thorac Cardiovasc Surg 1999; 118: 1006-13. https://doi.org/10.1016/S0022-5223(99)70094-2 |
||||
| 25. K/DOQI clinical practice guidelines for chronic kidney disease: evaluation, classification, and stratification. Am J Kidney Dis 2002; 39 (2 Suppl 1): S1-266. | ||||
| 26. Chowdhury R, Peel NM, Krosch M, et al. Frailty and chronic kidney disease: A systematic review. Arch Gerontol Geriatr 2017; 68: 135-42. https://doi.org/10.1016/j.archger.2016.10.007 PMid:27810661 |
||||
Impact of renal dysfunction on early outcomes of coronary artery bypass grafting surgery
Nanna Sveinsdóttir1
Sunna Rún Heiðarsdóttir1
Árni Steinn Steinþórsson1
Hera Jóhannesdóttir2
Alexandra Aldís Heimisdóttir2
Tómas Þór Kristjánsson2
Þórir Einarsson Long3
Ingibjörg Guðmundsdóttir1,4
Martin Ingi Sigurðsson1,5
Tómas Guðbjartsson1,2
1Faculty of Medicine, University of Iceland, 2Departments of Cardiothoracic Surgery, 3Nephrology, 4Cardiology and 5Anesthesia and Intensive Care, Landspitali University Hospital.
Correspondence: Tómas Guðbjartsson,
tomasgud@landspitali.is
Key words: Coronary artery bypass grafting (CABG), reduced kidney function, chronic kidney disease, short-term, complications, outcome
INTRODUCTION: Impaired renal function as seen in chronic kidney disease (CKD) is a known risk factor for coronary artery diseases and has been linked to inferior outcome after myocardial revascularization. Studies on the outcome of coronary bypass grafting (CABG) in CKD-patients are scarce. We aimed to study this subgroup of patients following CABG in a well defined whole-nation cohort, focusing on short term complications and 30 day mortality.
MATERIALS AND METHODS: A retrospective study on 2300 consecutive patients that underwent CABG at Landspítali University Hospital 2001-2020. Patients were divided into four groups according to preoperative estimated glomerular filtration rate (GFR), and the groups compared. GFR 45–59 mL/mín/1.73m2, GFR 30-44 mL/mín/1.73m2, GFR <30 mL/mín/1.73m2 and controls with normal GFR (≥60 mL/mín/1.73m2). Clinical information was gathered from medical records and logistic regression used to estimate risk factors of 30-day mortality.
RESULTS: Altogether 429 (18.7%) patients had impaired kidney function; these patients being more than six years older, having more cardiac symptoms and a higher mean EuroSCORE II (5.0 vs. 1.9, p<0.001) compared to controls. Furthermore, their left ventricular ejection fraction was also lower, their median hospital stay extended by two days and major short-term complications more common, as was 30 day mortality (24.4% vs. 1.4%, p<0.001). In multivariate analysis advanced age, ejection fraction <30% and GFR <30 mL/min/1.73m2 were independent predictors of higher 30-day mortality (OR=10.4; 95% CI: 3.98-25.46).
CONCLUSIONS: Patients with impaired renal function are older and more often have severe coronary artery disease. Early complications and 30-day mortality were much higher in these patients compared to controls and advanced renal failure and the strongest predictor of 30-day mortality.

