03. tbl. 108. árg. 2022
Fræðigrein
Graves-sjúkdómur í börnum og unglingum á Íslandi á árunum 2001-2021
Ágrip
INNGANGUR
Graves-sjúkdómur er sjálfsónæmissjúkdómur þar sem sjálfsmótefni gegn viðtaka stýrihormóns skjaldkirtils (Thyroid-stimulating hormone, TSH) valda ofseytingu skjaldkirtilshormóna, og er hann algengasta orsök skjaldvakaofseytingar (Thyrotoxicosis) í börnum. Einkenni barna eru fjölbreytt og óljósari en hjá fullorðnum. Markmið rannsóknarinnar var að kanna nýgengi Graves í börnum og unglingum á Íslandi síðastliðin 20 ár og gera grein fyrir meðferðarúrræðum og tíðni endurkomu sjúkdómsins.
EFNIVIÐUR OG AÐFERÐIR
Framkvæmd var afturskyggn lýsandi rannsókn. Rannsóknin náði til allra barna og unglinga sem greindust með Graves á árunum 2001-2021. Upplýsingar fengust úr lyfjagagnagrunni Embættis landlæknis og lista ICD-10 greininga á Landspítala.
NIÐURSTÖÐUR
57 börn og ungmenni greindust með Graves, 3,5 á hverja 100,000 íbúa yngri en 18 ára. Nýgengi jókst ekki á tímabilinu. Kynjahlutfall var 1:2,6 (strákar:stelpur) og meðalaldur við greiningu var 13,6 ár hjá strákum en 13,9 hjá stelpum. Lyfjameðferð er í gangi hjá 8 einstaklingum (14,5%), hjá 13 náðist að koma á eðlilegri starfsemi með lyfjum (23,7%), fjórir fengu sjúkdómsendurkomu og eru á lyfjameðferð (7,3%), 25 fengu meðferð með geislavirku joði (45,5%) og 5 skurðaðgerð (9,1%). Strákar fengu frekar sjúkdómsendurkomu en stúlkur, heildar sjúkdómsendurkoma á tímabilinu var 31,8%.
UMRÆÐA
Sjúkdómurinn var algengari í stelpum en þó var kynjahlutfall lægra en búist var við. Skjaldkirtilsbælandi lyf var fyrsta val í meðferð. Sjúkdómsendurkoma var algeng og meðferð með geislavirku joði var algengasta varanlega meðferðarúrræðið. Í framhaldi rannsóknarinnar mætti kanna mögulegt samband tímalengdar lyfjameðferðar og sjúkdómsendurkomu hjá bæði börnum og fullorðnum.
Greinin barst til blaðsins 22. ágúst 2021, samþykkt til birtingar 5. janúar 2022.
Inngangur
Graves-sjúkdómur (skjaldkeppseitrun) er sjálfsónæmissjúkdómur þar sem sjálfsmótefni gegn viðtaka stýrihormóns skjaldkirtils (Thyroid-stimulating hormone, TSH) valda of mikilli myndun skjaldkirtilshormóna, og kallast það ástand skjaldvakaofseyting (thyrotoxicosis). Graves er algengasta orsök skjaldvakaofseytingar.1,2 Sjúkdómurinn er algengari meðal kvenna og er heldur sjaldgæfari í börnum en fullorðnum.1,2 Rannsóknir erlendis hafa þó bent til þess að nýgengi sé að aukast í börnum og unglingum.3-6
Graves-sjúkdómur hefur sterk tengsl við erfðir, til að mynda er talið að tæplega helmingur allra sjúklinga með Graves eigi ættingja með sjálfsónæmis skjaldkirtilssjúkdóm.7 Auk þess hafa umhverfisþættir eins og joðinntaka og reykingar verið tengdir við aukna hættu á Graves.7,8
Sjúkdómsbyrði getur verið mikil fyrir börn enda hafa skjaldkirtilshormón fjölþætt áhrif á líkamann. Getur sjúk-dómurinn sett svip á mikilvæga þætti í lífi barna, eins og andlega líðan, námsgetu og svefn svo eitthvað sé nefnt.1,2 Einkenni sem börn og þá sérstaklega ókynþroska börn upplifa eru fjölbreytt og jafnan óljósari þeim er sjást í fullorðnum.9 Getur það leitt til þess að sjúkdómsgreining næst seinna hjá börnum fyrir kynþroska.9,10
Upphafsmeðferð við Graves er alla jafna skjaldkirtilsbælandi lyf (ATD) og reynt er að koma á eðlilegri starfsemi í skjaldkirtlinum (euthyroid). Lyf í þessum lyfjaflokki eru Methimazole/Thiamazole (MMI) og Propylthiouracil (PTU). Hindra lyfin ensímið thyroid peroxidasa (TPO) og þar með myndun hormóna í skjaldkirtli. Ýmsar aukaverkanir eru þekktar við notkun þessara lyfja11 en MMI verður frekar fyrir valinu vegna hárrar tíðni alvarlegra aukaverkana við notkun PTU, þá sérlega bráðrar lifrarbilunar.12 Sjúkdómsendurkoma er algeng eftir lyfjameðferð1,13 og þarf því oft að grípa til varanlegs inngrips, meðferðar með geislavirku joði eða skurðaðgerðar.
Markmið rannsóknarinnar var að meta nýgengi Graves í börnum og unglingum á Íslandi síðastliðin 20 ár og rannsaka hvort nýgengi hafi aukist á tímabilinu, en einnig að gera grein fyrir helstu meðferðarúrræðum og tíðni endurkomu sjúkdómsins.
Efniviður og aðferðir
Upplýsingar voru fengnar úr sjúkraskrám einstaklinga á Landspítala, Sjúkrahúsinu á Akureyri (SAk) og Domus Medica. Upplýsingar um kennitölur voru fengnar úr lyfjagagnagrunni Em-bættis landlæknis um ávísun lyfja undir ACT-kóðanum H03B hjá einstaklingum yngri en 18 ára. Einnig voru upplýsingar fengnar um þá sem höfðu fengið ICD-10 greiningarnar E05.0 - E05.9, yngri en 18 ára að aldri, á Landspítala. Út frá þessum gögnum fékkst heildarþýði rann-sóknarinnar sem innihélt 83 einstaklinga. Sex voru útilokaðir sökum rangrar ICD-10 greiningar. Öðrum fjórum einstaklingum var ekki fylgt eftir af barnalæknum, Graves var útilokað en ekki var hægt að staðfesta orsök skjaldvakaofseytingar. Eftir stóðu 73 einstaklingar í rannsóknarþýði. Af þeim voru 13 greind með skjaldvakaofseytingu af völdum Hashimoto-skjaldkirtilsbólgu, tveir með nýbura-skjaldvakaofseytingu (neonatal thyrotoxicosis) og einn einstaklingur sem þróaði sjúkdóminn eftir skurðaðgerð á kirtilæxli í heiladingli. Það voru því 57 einstaklingar greindir með Graves-sjúkdóm á rannsóknartímabilinu, tveimur þeirra var ekki fylgt eftir af barnalækni og höfðum við því ekki frekari klínískar upplýsingar um þá. Því voru 55 einstaklingar í rannsóknarþýði Graves-sjúkdóms. Sjúkdómsgreiningu Graves þurfti að staðfesta með mælingum á sjálfsmótefnum gegn TSH-viðtaka (TRAb) þar sem sjúkdómsmynd er jafnan óhefðbundin samanborið við fullorðna og því erfitt að styðjast eingöngu við klíníska greiningu. Dreifing einstaklinga innan heildarþýðis má sjá á mynd 1.
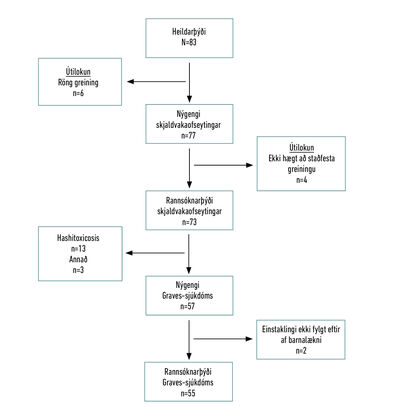 Mynd 1. Dreifing einstaklinga innan heildarþýðis út frá útilokunum og sjúkdómsgreiningu.
Mynd 1. Dreifing einstaklinga innan heildarþýðis út frá útilokunum og sjúkdómsgreiningu.
Einstaklingum var úthlutað rannsóknarnúmeri og gátu eingöngu rannsakendur tengt númer við einstaklinga. Öll úrvinnsla gagna fór fram undir rannsóknarnúmeri. Notuð voru forritin Microsoft Excel 2018 (Microsoft Corporation, Redmond, WA) og R studio, útgáfu 4.0.3 fyrir Windows til tölfræðiúrvinnslu. Rannsóknartímabili var skipt í tvö 10 ára tímabil og samanburður á milli þeirra notaður til að meta breytingar á nýgengi. Nýgengi miðað við 100.000 manns yngri en 18 ára var reiknað fyrir hvert ár, niðurstöður lagðar saman og meðaltal tekið til að finna nýgengitíðni áratuganna. Notað var t-tölfræðipróf til að meta hvort marktækur munur væri á nýgengi á tímabilunum tveimur. Miðað var við að niðurstöður væru marktækar ef p-gildi væri lægra en 0,05. Upplýsingar um fjölda barna á Íslandi á rannsóknartímabilinu voru sóttar á vef Hagstofu Íslands.
Tilskilin leyfi voru fengin frá vísindarannsóknarnefnd heilbrigðisrannsókna (VRN) á Landspítala (201119), vísindasiðanefnd (VSN-20-201) og lyfjagagnagrunni Embættis landlæknis (2011274/5.6.1/gkg).
Niðurstöður
Nýgengi, kyn og aldur
Alls greindust 57 einstaklingar yngri en 18 ára með Graves-sjúkdóm á rannsóknartímabilinu. Nýgengi á hverja 100.000 einstaklinga yngri en 18 ára var 3,5. Af þeim voru 16 strákar og 41 stelpur og það gaf kynjahlutfallið 2,6 stelpur á hvern strák. Það greindust 28 einstaklingar á fyrri áratug rannsóknar og 29 á þeim seinni. Nýgengi miðað við 100.000 einstaklinga í áhættuhópi sýndi að ekki var marktæk breyting á nýgengi á milli áratuganna tveggja í heildarþýði (p=0,833) né hjá kynjunum (p=0,459 hjá strákum og p=0,861 hjá stelpum). Nýgengi var nokkuð breytilegt eftir árum tímabilisins, dreifnisvið nýgengis var allt frá 0 upp í 6 tilfelli á ári, miðgildi nýgengis var 3.
Þar sem Graves er algengari í börnum í eða eftir kynþroska var ákveðið að skoða sérstaklega nýgengi í börnum fyrir kynþroska. Skráningu á Tanner-skala, varðandi kynþroska barnanna, var ábótavant og var þess vegna miðað við aldur yngri en 10 ára. Alls greindust 7 börn yngri en 10 ára á tímabilinu, tvö greindust á fyrri áratug og 5 á seinni. Ekki var marktæk aukning á nýgengi í þessum hópi (p=0,196).
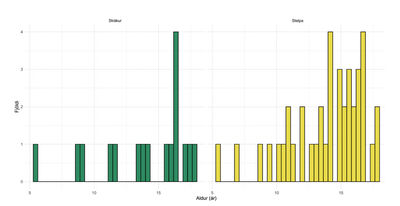 Mynd 2. Aldursdreifing þýðis við greiningu á Graves. Nýgengi eykst eftir 10 ára aldur hjá báðum kynjum.
Mynd 2. Aldursdreifing þýðis við greiningu á Graves. Nýgengi eykst eftir 10 ára aldur hjá báðum kynjum.
Á mynd 2 má sjá aldursdreifingu rannsóknarþýðis á greiningardag, skipt eftir kyni.
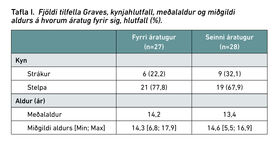
 Í töflu I má sjá hversu margir greindust á hvorum áratug fyrir sig hjá báðum kynjum. Einnig má sjá meðalaldur, miðgildi aldurs og hæsta og lægsta aldur á hvorum áratug fyrir sig. Meðalaldur stráka við greiningu var 13,6 ár og var miðgildi aldurs 14 ár. Meðal-aldur stelpna við greiningu var 13,9 ár og var miðgildi 14,6 ár.
Í töflu I má sjá hversu margir greindust á hvorum áratug fyrir sig hjá báðum kynjum. Einnig má sjá meðalaldur, miðgildi aldurs og hæsta og lægsta aldur á hvorum áratug fyrir sig. Meðalaldur stráka við greiningu var 13,6 ár og var miðgildi aldurs 14 ár. Meðal-aldur stelpna við greiningu var 13,9 ár og var miðgildi 14,6 ár.
Heilsufars- og fjölskyldusaga
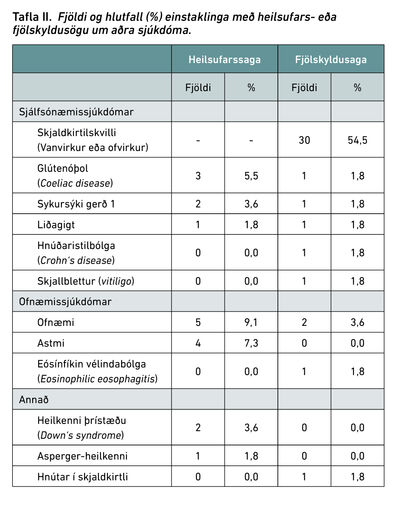
Í töflu II má sjá upplýsingar um heilsufarssögu einstaklinga í rannsóknarþýði, auk þess var saga um sjálfsónæmis-, ofnæmis- og skjaldkirtilssjúkdóma meðal ættingja í fyrsta ættlið skráð. Rúmlega helmingur einstaklinga með Graves átti ættingja í fyrsta ættlið með sögu um skjaldkirtilskvilla, annaðhvort van- eða ofvirkan.
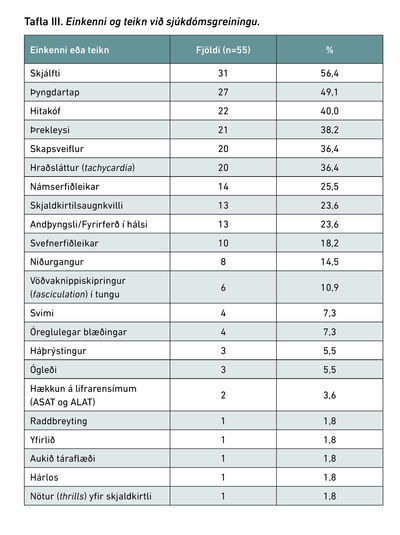
Einkenni og teikn
Í töflu III má sjá helstu einkenni hjá einstaklingum við greiningu. Enginn greindist með skjaldkirtilsfár (Thyroid storm) á tímabilinu. Einkenni meðal barna yngri en 10 ára voru heldur óljósari samanborið við þau sem sáust í börnum í eða eftir kynþroska. Algengasta einkenni sem sást í þeim hópi var þyngdartap, en það sást í 57,1% tilfella, en þar á eftir sáust vöðvaknippiskipringur (fasciculation) í tungu og skapsveiflur (42,8%). Er þetta frábrugðið þeim einkennum sem eru algengust í heildarþýði.
Meðferð
Allir greindir með Graves hófu meðferð með skjaldkirtilsbælandi lyfjum, annaðhvort Methimazole/Thiamazole (MMI) eða Propyl-thiouracil (PTU). Upplýsingar um meðferðarúrræði ein-stakl-inga í rannsóknarþýði Graves sjúkdóms má sjá á mynd 3.
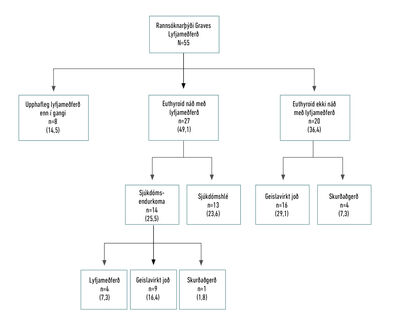 Mynd 3. Meðferðarúrræði fyrir Graves-sjúklinga á
rannsóknartímabilinu. Allir hófu lyfjameðferð og upphafleg lyfjameðferð
er í gangi hjá 8 manns. Af þeim sem náðu euthyroid-ástandi í upphaflegri
lyfjameðferð fengu 14 sjúkdómsendurkomu. Það voru 20 einstaklingar sem
náðu ekki
Mynd 3. Meðferðarúrræði fyrir Graves-sjúklinga á
rannsóknartímabilinu. Allir hófu lyfjameðferð og upphafleg lyfjameðferð
er í gangi hjá 8 manns. Af þeim sem náðu euthyroid-ástandi í upphaflegri
lyfjameðferð fengu 14 sjúkdómsendurkomu. Það voru 20 einstaklingar sem
náðu ekki
euthyroid-ástandi í upphaflegri lyfjameðferð. Tölur í sviga tákna hlutfall af rannsóknarþýði Graves-sjúkdóms.
β-blokkerar voru gefnir við sjúkdómsgreiningu hjá 27 einstaklingum en það eru 49% rannsóknarþýðis. Tveir fengu joðdropa stuttu fyrir varanlegt inngrip, annar þeirra undirgekkst skurð-aðgerð en hinn fékk meðferð með geislajoði.
Sjúkdómsendurkoma að lokinni lyfjameðferð átti sér stað hjá 14 einstaklingum í rannsóknarþýði, það samsvarar 25,5%. Á Íslandi er miðað við að lyfjameðferð vari í tvö ár og var því ákveðið að taka út einstaklinga sem greindust og hófu lyfjameðferð á árunum 2019-2021 þar sem þeir höfðu ekki lokið upphaflegri lyfjameðferð. Hlutfall þeirra sem fengu sjúkdómsendurkomu var því 31,8%. Tímalengd frá því sjúkdómshlé náðist með lyfjameðferð þar til sjúkdómsendurkoma átti sér stað var skráð hjá 13 af einstaklingunum. Eftir 12 mánuði höfðu 6 manns fengið sjúkdómsendurkomu og eftir 24 mánuði höfðu 11 fengið endurkomu. Einn fékk endurkomu eftir 36 mánuði og sá síðasti eftir 60 mánuði.
Sjúkdómshlé náðist hjá 13 einstaklingum í rannsóknarþýði eftir lyfjameðferð, það samsvarar 23,6%. Tíminn sem einstaklingar hafa verið í sjúkdómshléi er allt frá nokkrum mánuðum upp í 14 ár, miðgildi tímalengdar fyrir hópinn eru 72 mánuðir.
Þegar tímalengd lyfjameðferðar var borin saman milli þeirra sem fengu sjúkdómsendurkomu að lokinni lyfjameðferð og þeirra sem fengu sjúkdómshlé sást að tímalengdin var að meðaltali lengri hjá þeim sem fengu sjúkdómshlé (32,4 mánuðir miðað við 25,2 mánuði). Mikill breytileiki var á meðferðartímalengd í báðum hópum, þó að munur hafi verið á meðaltali var hann ekki marktækur (p=0,250).
Aukaverkanir voru tilkynntar hjá 8 manns vegna skjald-kirtilslyfja á tímabilinu, eða 14,5% rannsóknarþýðis. Í öllum tilfellum voru sjúklingar teknir af lyfjunum, annaðhvort tímabundið eða varanlega, og þá var skipt yfir í annan lyfjaflokk eða varanlegu inngripi beitt. Fjórar gerðir aukaverkana voru tilkynntar á tímabilinu vegna MMI-meðferðar. Tveir sjúklingar fengu liðverki, tveir útbrot, einn meltingarónot og í einu tilfelli bráða brisbólgu. Tvær gerðir aukaverkana sáust eða voru tilkynntar á tímabilinu vegna PTU-meðferðar. Í einu tilfelli hækkuðu lifrarensím og tveir upplifðu liðverki, annar þeirra hafði áður upplifað liðverki á MMI-meðferð og hafði skipt yfir á PTU.
Alls voru 5 manns meðhöndlaðir á tímabilinu með PTU í stað MMI. Þrír voru meðhöndlaðir með PTU vegna aukaverkana MMI-meðferðar og einn vegna skorts á MMI í landinu. Ekki fannst ástæða fyrir PTU-meðferð hjá einum einstaklingi en hann skipti síðar yfir í MMI-meðferð vegna aukaverkana PTU. Fjórir þeirra voru meðhöndlaðir með PTU á fyrri áratug, árin 2004, 2005, 2006 og 2008. Aðeins einn var meðhöndlaður á seinni áratug, árið 2012.
Meðferð með geislavirku joði var algengasta varanlega meðferðarúrræðið, eða 25 einstaklingar (45,5%). Meðalaldur við meðferð með geislajoði var 17,8 ár (staðalfrávik 2,8 ár; miðgildi 17,6 ár og spönn 14-25 ár). Fimm (9,1%) undirgengust skurðaðgerð. Þrír af þessum 5 höfðu stóran kirtil og því var meðferð með geislajoði ekki talin fýsileg. Einn þróaði bráða aukaverkun vegna lyfjameðferðar og var talinn of ungur fyrir geislajoð. Sá síðasti ákvað sjálfur frekar skurðaðgerð en geislajoð. Í fjórum var kirtillinn fjarlægður allur en í einum var hann fjarlægður að hluta til vegna áhættu á taugaskaða á afturhverfri barkakýlistaug (recurrent laryngeal nerve). Meðalaldur þeirra sem undirgengust skurðaðgerð var 16,8 ár, (staðalfrávik 2,4 ár, miðgildi 17 ár og spönn 13,2-19,7 ár). Ekki var marktækur munur á meðalaldri á milli inngripa (p=0,439).
Umræður
Nýgengi og kyn
Nýgengi var 3,5 á hverja 100.000 yngri en 18 ára. Er það almennt nokkuð hærri tala en sást í sambærilegum rannsóknum frá öðrum löndum, þar sem nýgengi var á bilinu 0,9-2,4.3-5 Aðeins ein rannsókn í Hong Kong hafði hærri nýgengitíðni en hér á landi, eða 4,9 á hverja 100.000 á 8 ára tímabil.6 Ekki eru skýrar ástæður fyrir háu nýgengi Graves meðal barna á Íslandi. Upplýsingar um heila þjóð gefur mögulega betri heildarmynd af nýgengi en erlendar rannsóknir eru jafnan takmarkaðar við ákveðin landsvæði eða meðferðarkjarna. Á móti má velta því fyrir sér hvort tölfræðin okkar sé marktæk, að okkur vanti tölfræðilegt afl fyrir þær sakir hversu lítið þýði við höfum, Graves er sjaldgæfur sjúkdómur í börnum og Ísland er fámenn þjóð. Ekki var marktækur munur á nýgengi sjúkdómsins þegar áratugirnir voru bornir saman. Niðurstöðurnar eru því ekki í samræmi við erlendar rannsóknir sem benda til þess að að nýgengi hjá börnum sé að aukast.3-6
Rannsóknin sýndi að kynjahlutfall stráka á móti stelpum meðal barna og unglinga með Graves var 1:2,6 sem er mun lægra en hefur sést í sambærilegum rannsóknum á skjaldvakaofseytingu í börnum, þar sáust kynjahlutföllin 1:4 í Svíþjóð, 1:4,3 í Danmörku, 1:3,8 í Bretlandi og Írlandi og 1:9,7 í Hong Kong.3-6 Einnig er vert að nefna að kynjahlutfall karla á móti konum fyrir Graves í almennu þýði er 1:10.1 Niðurstöðurnar eru áhugaverðar en erfitt er að segja til um hvers vegna kynjahlutfall hjá börnum og unglingum á Íslandi er frábrugðið. Samanburðarrannsókn á sykursýki gerð 1 í börnum á milli Norðurlandanna sýndi að kynjahlutfall á Íslandi var sambærilegt og sást í Noregi og Danmörku.14 Frekari rannsókna er þörf til þess að kanna kynjahlutfall í öðrum sjálfsónæmissjúkdómum í börnum á Íslandi og leggja mat á hvort það sé einnig ólíkt því sem sést annars staðar.
Heilsufars- og fjölskyldusaga
Við könnun á heilsufars- og fjölskyldusögu í rannsóknarþýði reyndist rúmlega helmingur barnanna hafa fjölskyldusögu um annaðhvort van- eða ofvirkan skjaldkirtil. Er þetta í samræmi við aðrar rannsóknir á áhrifum erfða á Graves1,7,15 en líklegra er að einstaklingar með heilsufars- eða fjölskyldusögu um sjálfsónæmis- og skjaldkirtilssjúkdóma þrói skjaldvakaofseytingu.16 Í þýði fundust nokkrir aðrir sjálfsónæmissjúkdómar á borð við coeliac-sjúkdóm, sykursýki gerð 1 og Crohns-sjúkdóm.
Meðferð
Meðaltímalengd lyfjameðferðar í heildarþýðinu var 691 dagur. Nokkur munur var á tímalengd meðferðar fyrir þá sem fengu sjúkdómshlé að lokinni lyfjameðferð og þeirra sem fengu sjúkdómsendurkomu. Meðaltímalengd fyrir hópinn þar sem sjúkdómsendurkoma átti sér stað voru 768 dagar (2,1 ár) en fyrir hópinn þar sem sjúkdómshlé náðist voru 976 dagar (2,7 ár). Engin alþjóðleg tilmæli eru til um tímalengd ATD-meðferðar. Samkvæmt rannsókn frá 2011 um hina ýmsu þætti í meðferð skjaldvakaofseytingar á mismunandi stöðum í heiminum var algengast að lyfjameðferð varaði í 12-18 mánuði.17 Hér á landi og á hinum Norðurlöndunum hefur tíðkast að miða við 24 mánuði (tvö ár).3,5 Þó að ekki hafi verið marktækur munur á meðaltali tímalengdar fyrir hópana (p=0,25) vekja þessar niðurstöður þá spurningu hvort tímalengd ATD-meðferðar sé veigamikill þáttur þegar kemur að því hvort sjúkdómshlé náist og hvort meðferðartímalengd sem tíðkast hefur sé að jafnaði ekki nógu löng. Þessum hugmyndum svipar til hugmynda sem Léger og félagar hafa áður sett fram varðandi tímalengd ATD-meðferðar.18 Þessa hugmynd væri vert að kanna nánar. Einnig veltu þau fyrir sér hvort hægt væri að bæla skjaldkirtil og gefa ungum börnum lága ATD-skammta til lengri tíma.18 Varanlegum inngripum í ungum börnum fylgir ávallt ákveðin áhætta, en með þessari aðferð er hægt að bíða með inngripin þar til að börnin hafa vaxið úr grasi og minnka þannig áhættu, þolist lyfjameðferð vel.
Líkurnar á því að barn nái viðvarandi sjúkdómshléi eru minni en hjá fullorðnum. Tíðni barna sem ná sjúkdómshléi eftir að hafa lokið lyfjameðferð með ATD hefur verið lýst í kringum 25-30%.1,13,19 Þessum tölum svipar til okkar rannsóknar, þar var hlutfallið 23,6%. Vert er að nefna að ekki er útilokað að einhver þeirra sem fengu sjúkdómshlé fái sjúkdómsendurkomu í framtíðinni. Hlutfall stráka var hærra í hópi sjúkdómsendurkomu samanborið við heildarhóp Graves-sjúklinga. Kynjahlutfall stráka á móti stelpum fyrir sjúkdómsendurkomu var 1:1,3. Niðurstöðurnar vekja því þá spurningu hvort kyn skipti máli hvað varðar sjúkdómsendurkomu eftir lyfjameðferð. Klínískar rannsóknir frá Bretlandi og Ítalíu sýndu að karlar fengu síður sjúkdómshlé20,21 og grísk rannsókn benti til þess að konur fengju sjúkdómshlé í lengri tíma.22 Á hinn bóginn sýndi klínísk rannsókn frá Ítalíu23 og rannsóknir frá Svíþjóð, Litháen og Taívan að kyn var ekki áhrifaþáttur hvað varðar sjúkdómshlé einstaklinga í rannsóknarþýði.24-26 Út frá þessum rannsóknum má sjá að margt er enn óljóst um áhrif kyns á virkni ATD-meðferðar og á það hvort sjúkdómshlé næst.
Alls voru 5 einstaklingar meðhöndlaðir með PTU en lyfin voru aðeins notuð við sérstök tilfelli, vegna aukaverkana MMI eða ef skortur var á MMI á Íslandi. Auk þess var PTU notað í stuttan tíma, oftast vegna aukaverkana. Notkun PTU átti sér nánast alfarið stað á fyrri áratug rannsóknartímabilsins en PTU var síðast notað í lyfja-meðferð hjá barni árið 2012. Þegar litið er á kannanir innkirtlalækna frá árunum 199027 annars vegar og 201117 hins vegar má sjá að val á milli MMI og PTU hefur breyst. Í dag verður MMI frekar fyrir valinu vegna tíðari tilkynninga um alvarlegar aukaverkanir við meðferð með PTU.17,28 Lifrarskaði er þekkt aukaverkun í báðum flokkum ATD en hún er frekar tengd við PTU. Undanfarna áratugi hefur vitund aukist til muna um þessa svæsnu aukaverkun og þá sérstaklega í börnum.12,29 Árið 2010 ákvað bandaríska lyfjaeftirlitið að koma svokölluðum svörtum kassa (black-box warning) á PTU varðandi notkun hjá börnum.30 Mælt er gegn notkun PTU í börnum nema nauðsyn krefji, í aðstæðum eins og við MMI-ofnæmi.
Í rannsóknarþýðinu fengu 27 einstaklingar β-blokkera við greiningu, eða tæplega helmingur. Það voru þó mun færri (20) skráðir með hraðslátt við greiningu. Það telst ólíklegt að β-blokkerar hafi verið gefnir börnum án hraðsláttar og teljum við því líklegt að eitthvað vanti upp á skráningu β-adrenergra-einkenna við greiningu. Notkun β-blokkera við einkennastillingu einstaklinga með skjaldvakaofseytingu er staðalmeðferð við hraðslætti og miklum skjálfta.17 Slembuð klínísk tilraun frá árinu 2012 sýndi að samsett meðferð MMI og β-blokkera var frekar tengd við reglulegan hjartslátt og almennt betri líðan, borið saman við staklyfjameðferð með MMI í einstaklingum með skjaldvakaofseytingu vegna Graves-sjúkdóms.31
Algengasta varanlega inngripið á tímabilinu var geislavirkt joð en 25 einstaklingar undirgengust meðferð með því. Notkun á geislajoði er algeng í Norður-Ameríku og þá sérstaklega í Bandaríkjunum. Samanburður á milli áranna 1991 og 2011 sýnir þó að notkun þess hefur minnkað.17,32 Notkun geislajoðs er heldur minni í Evrópu, Asíu og Eyjaálfu. Samanburður sýnir að notkun þess í Evrópu hefur minnkað á árunum milli 1991 og 2011 en aftur á móti aukist í Asíu og Eyjaálfu.17,32 Svo virðist sem áherslur í meðferð við skjaldvakaofseytingu í börnum í Evrópulöndum séu fyrst og fremst á lyfjameðferð og skurðaðgerð ef þarf, umfram geislavirkt joð3,5,33 en í Norður-Ameríku er áherslan frekar á geislavirkt joð.17,33 Miðað við þessar upplýsingar má ætla að notkun á geislajoði á Íslandi í börnum svipi frekar til Norður-Ameríku en annarra Evrópulanda.
Samkvæmt ráðleggingum samtaka bandarískra lækna um skjaldkirtilslækningar frá 2016 er mælt með því að kirtillinn sé fjarlægður í heild sinni, þurfi að grípa til skurðaðgerðar sem varanlegs inngrips11 því aðgerðir þar sem kirtillinn er tekinn að hluta til eru frekar tengdar við sjúkdómsendurkomu.34,35 Þá er einnig bent á að aukin reynsla skurðlækna í aðgerðum á skjaldkirtli minnki líkur á fylgikvillum.11 Í þessari rannsókn voru einungis framkvæmdar aðgerðir á seinni áratug rannsóknartímabilsins.
Samantekt og möguleg framtíð
Efni þessarar rannsóknar hefur ekki verið kannað hérlendis áður. Niðurstöður rannsóknarinnar gefa góða mynd af nýgengi Graves-sjúkdóms í börnum og unglingum og breytingum á því síðastliðin 20 ár. Einnig gera þær grein fyrir þeim meðferðarúrræðum sem hafa verið við lýði á Íslandi og sjúkdómsendurkomum í rannsóknarþýði að meðferð lokinni. Þó nýgengi rannsóknar endurspegli ekki þá aukningu sem hefur sést í öðrum löndum3-6 er gott að hafa vakandi auga með þessum hópi í framtíðinni og hugsanlegum breytingum á nýgengi, og þá sérstaklega hjá yngri börnum. Áhugavert væri í framhaldi rannsóknarinnar að kanna betur hátt hlutfall drengja sem sást í rannsóknarþýði og bera saman við aðra sjálfsónæmissjúkdóma í börnum á Íslandi. Einnig væri vert að kanna mögulegt samband tímalengdar lyfjameðferðar við sjúkdómshlé, eins og aðrir hafa stungið upp á18 og hvort skurðaðgerðir verði oftar fyrir valinu sem varanlegt meðferðarúrræði á komandi árum á Íslandi. Að lokum mætti kanna nýgengi Graves í fullorðnum á Íslandi.
Þakkir
Við viljum þakka þeim Árna V. Þórssyni og Kolbeini Guðmundssyni fyrir aðgang að gögnum og upplýsingum fyrir rannsóknina.
Heimildir
| 1. Léger J, Kaguelidou F, Alberti C, et al. Graves' disease in children. Best Pract Res Clin Endocrinol Metab 2014; 28: 233-43. https://doi.org/10.1016/j.beem.2013.08.008 PMid:24629864 |
||||
| 2. Franklyn JA, Boelaert K. Thyrotoxicosis. Lancet 2012; 379: 1155-66. https://doi.org/10.1016/S0140-6736(11)60782-4 |
||||
| 3. Rodanaki M, Lodefalk M, Forssell K, et al. The Incidence of Childhood Thyrotoxicosis Is Increasing in Both Girls and Boys in Sweden. Horm Res Paediatr 2019; 91: 195-202. https://doi.org/10.1159/000500265 PMid:31096231 PMCid:PMC6690413 |
||||
| 4. Williamson S, Greene SA. Incidence of thyrotoxicosis in childhood: a national population based study in the UK and Ireland. Clin Endocrinol (Oxf) 2010; 72: 358-63. https://doi.org/10.1111/j.1365-2265.2009.03717.x PMid:19769613 |
||||
| 5. Havgaard Kjær R, Smedegård Andersen M, Hansen D. Increasing Incidence of Juvenile Thyrotoxicosis in Denmark: A Nationwide Study, 1998-2012. Horm Res Paediatr 2015; 84: 102-7. https://doi.org/10.1159/000430985 PMid:26111962 |
||||
| 6. Wong GW, Cheng PS. Increasing incidence of childhood Graves' disease in Hong Kong: a follow-up study. Clin Endocrinol (Oxf) 2001; 54: 547-50. https://doi.org/10.1046/j.1365-2265.2001.01252.x PMid:11318792 |
||||
| 7. Manji N, Carr-Smith JD, Boelaert K, et al. Influences of age, gender, smoking, and family history on autoimmune thyroid disease phenotype. J Clin Endocrinol Metab 2006; 91: 4873-80. https://doi.org/10.1210/jc.2006-1402 PMid:16968788 |
||||
| 8. Asvold BO, Bjøro T, Nilsen TI, et al. Tobacco smoking and thyroid function: a population-based study. Arch Intern Med 2007; 167: 1428-32. https://doi.org/10.1001/archinte.167.13.1428 PMid:17620538 |
||||
| 9. Lazar L, Kalter-Leibovici O, Pertzelan A, et al. Thyrotoxicosis in prepubertal children compared with pubertal and postpubertal patients. J Clin Endocrinol Metab 2000; 85: 3678-82. https://doi.org/10.1210/jcem.85.10.6922 PMid:11061522 |
||||
| 10. Shulman DI, Muhar I, Jorgensen EV, et al. Autoimmune hyperthyroidism in prepubertal children and adolescents: comparison of clinical and biochemical features at diagnosis and responses to medical therapy. Thyroid 1997; 7: 755-60. https://doi.org/10.1089/thy.1997.7.755 PMid:9349579 |
||||
| 11. Ross DS, Burch HB, Cooper DS, et al. 2016 American Thyroid Association Guidelines for Diagnosis and Management of Hyperthyroidism and Other Causes of Thyrotoxicosis. Thyroid 2016; 26: 1343-421. https://doi.org/10.1089/thy.2016.0229 PMid:27521067 |
||||
| 12. Rivkees SA, Mattison DR. Propylthiouracil (PTU) Hepatoxicity in Children and Recommendations for Discontinuation of Use. Int J Pediatr Endocrinol 2009; 2009: 132041. https://doi.org/10.1186/1687-9856-2009-132041 |
||||
| 13. Kaguelidou F, Alberti C, Castanet M, et al. Predictors of autoimmune hyperthyroidism relapse in children after discontinuation of antithyroid drug treatment. J Clin Endocrinol Metab 2008; 93: 3817-26. https://doi.org/10.1210/jc.2008-0842 PMid:18628515 |
||||
| 14. Samuelsson U, Westerberg L, Aakesson K, et al. Geographical variation in the incidence of type 1 diabetes in the Nordic countries: A study within NordicDiabKids. Pediatr Diabetes 2020; 21: 259-65. https://doi.org/10.1111/pedi.12943 PMid:31702838 |
||||
| 15. Brix TH, Christensen K, Holm NV, et al. A population-based study of Graves' disease in Danish twins. Clin Endocrinol (Oxf) 1998; 48: 397-400. https://doi.org/10.1046/j.1365-2265.1998.00450.x PMid:9640404 |
||||
| 16. Boelaert K, Newby PR, Simmonds MJ, et al. Prevalence and relative risk of other autoimmune diseases in subjects with autoimmune thyroid disease. Am J Med 2010; 123: 183.e1-9. https://doi.org/10.1016/j.amjmed.2009.06.030 PMid:20103030 |
||||
| 17. Burch HB, Burman KD, Cooper DS. A 2011 survey of clinical practice patterns in the management of Graves' disease. J Clin Endocrinol Metab 2012; 97: 4549-58. https://doi.org/10.1210/jc.2012-2802 PMid:23043191 |
||||
| 18. Léger J, Gelwane G, Kaguelidou F, et al. Positive impact of long-term antithyroid drug treatment on the outcome of children with Graves' disease: national long-term cohort study. J Clin Endocrinol Metab 2012; 97: 110-9. https://doi.org/10.1210/jc.2011-1944 PMid:22031519 |
||||
| 19. Glaser NS, Styne DM. Predictors of early remission of hyperthyroidism in children. J Clin Endocrinol Metab 1997; 82: 1719-26. https://doi.org/10.1210/jcem.82.6.3986 https://doi.org/10.1210/jc.82.6.1719 |
||||
| 20. Allahabadia A, Daykin J, Holder RL, et al. Age and gender predict the outcome of treatment for Graves' hyperthyroidism. J Clin Endocrinol Metab 2000; 85: 1038-42. https://doi.org/10.1210/jcem.85.3.6430 https://doi.org/10.1210/jc.85.3.1038 PMid:10720036 |
||||
| 21. Vitti P, Rago T, Chiovato L, et al. Clinical features of patients with Graves' disease undergoing remission after antithyroid drug treatment. Thyroid 1997; 7: 369-75. https://doi.org/10.1089/thy.1997.7.369 PMid:9226205 |
||||
| 22. Anagnostis P, Adamidou F, Polyzos SA, et al. Predictors of long-term remission in patients with Graves' disease: a single center experience. Endocrine 2013; 44: 448-53. https://doi.org/10.1007/s12020-013-9895-0 PMid:23397523 |
||||
| 23. Cappelli C, Gandossi E, Castellano M, et al. Prognostic value of thyrotropin receptor antibodies (TRAb) in Graves' disease: a 120 months prospective study. Endocr J 2007; 54: 713-20. https://doi.org/10.1507/endocrj.K06-069 PMid:17675761 |
||||
| 24. Mohlin E, Filipsson Nyström H, Eliasson M. Long-term prognosis after medical treatment of Graves' disease in a northern Swedish population 2000-2010. Eur J Endocrinol 2014; 170: 419-27. https://doi.org/10.1530/EJE-13-0811 PMid:24366943 |
||||
| 25. Daukšienė D, Daukša A, Mickuvienė N. Independent pretreatment predictors of Graves' disease outcome. Medicina (Kaunas) 2013; 49: 427-34. https://doi.org/10.3390/medicina49100067 |
||||
| 26. Wang PW, Chen IY, Juo SH, et al. Genotype and phenotype predictors of relapse of graves' disease after antithyroid drug withdrawal. Eur Thyroid J 2013; 1: 251-8. https://doi.org/10.1159/000342621 PMid:24783027 PMCid:PMC3821483 |
||||
| 27. Solomon B, Glinoer D, Lagasse R, et al. Current trends in the management of Graves' disease. J Clin Endocrinol Metab 1990; 70: 1518-24. https://doi.org/10.1210/jcem-70-6-1518 PMid:1693371 |
||||
| 28. Bahn Chair RS, Burch HB, Cooper DS, et al. Hyperthyroidism and other causes of thyrotoxicosis: management guidelines of the American Thyroid Association and American Association of Clinical Endocrinologists. Thyroid 2011; 21: 593-646. https://doi.org/10.1089/thy.2010.0417 PMid:21510801 |
||||
| 29. Hardee JT, Barnett AL, Thannoun A, et al. Propylthiouracil-induced hepatotoxicity. West J Med 1996; 165: 144-7. | ||||
| 30. Rivkees SA. 63 years and 715 days to the "boxed warning": unmasking of the propylthiouracil problem. Int J Pediatr Endocrinol 2010; 658267. https://doi.org/10.1186/1687-9856-2010-658267 PMid:20706665 PMCid:PMC2913555 |
||||
| 31. Tagami T, Yambe Y, Tanaka T, et al. Short-term effects of β-adrenergic antagonists and methimazole in new-onset thyrotoxicosis caused by Graves' disease. Intern Med 2012; 51: 2285-90. https://doi.org/10.2169/internalmedicine.51.7302 PMid:22975536 |
||||
| 32. Wartofsky L, Glinoer D, Solomon B, et al. Differences and similarities in the diagnosis and treatment of Graves' disease in Europe, Japan, and the United States. Thyroid 1991; 1: 129-35. https://doi.org/10.1089/thy.1991.1.129 PMid:1688014 |
||||
| 33. Bartalena L, Burch HB, Burman KD, et al. A 2013 European survey of clinical practice patterns in the management of Graves' disease. Clin Endocrinol (Oxf) 2016; 84: 115-20. https://doi.org/10.1111/cen.12688 PMid:25581877 |
||||
| 34. Miccoli P, Vitti P, Rago T, et al. Surgical treatment of Graves' disease: subtotal or total thyroidectomy? Surgery 1996; 120: 1020-4; discussion 4-5. https://doi.org/10.1016/S0039-6060(96)80049-3 |
||||
| 35. Sung TY, Lee YM, Yoon JH, et al. Long-Term Effect of Surgery in Graves' Disease: 20 Years Experience in a Single Institution. Int J Endocrinol 2015; 2015: 542641. https://doi.org/10.1155/2015/542641 PMid:26064111 PMCid:PMC4443923 |
||||