11. tbl. 105. árg. 2019
Umræða og fréttir
Flixabi – aukaverkanir af nýju líftæknihliðstæðulyfi, undir sérstöku eftirliti
Lyfjastofnun og Miðstöð lyfjaupplýsinga á Landspítala hafa sett á fót samstarfsvettvang með það að leiðarljósi að skrá og fylgjast betur með aukaverkunum vegna lyfja á Íslandi. Í mars síðastliðnum kom lyfið Flixabi® (infliximab) á markað á Íslandi. Það er hliðstæða við líftæknilyfið Remicade®. Eins og önnur líftæknilyf og líftæknihliðstæður er það merkt svörtum þríhyrningi, en slík lyf eru undir sérstöku eftirliti til að nýjar upplýsingar um öryggi þess komist fljótt og örugglega til skila.1
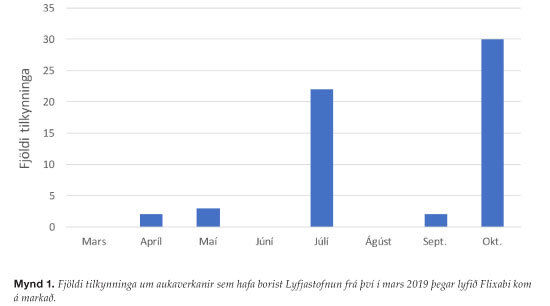
Á tímabilinu frá mars til október 2019 bárust 59 tilkynningar um aukaverkanir vegna Flixabi® til Lyfjastofnunar (mynd 1). Flestar tilkynningarnar komu frá Landspítala og var engin þeirra flokkuð sem alvarleg. Í heildina voru 35 tilkynningar vegna aukaverkana hjá konum en 24 hjá körlum. Flestar tilkynningar, eða um 74% tilkynninga, voru vegna aukaverkana hjá einstaklingum á aldrinum 30-59 ára. Allar aukaverkanir sem voru tilkynntar eru í samræmi við það sem er þekkt um infliximab-lyf. Þannig var engum óþekktum aukaverkunum lýst.
Eftirfylgni með Flixabi® virðist vera góð miðað við fjölda aukaverkanatilkynninga sem hafa borist Lyfjastofnun. Sambærilegar upplýsingar um aukaverkanir eftir markaðssetningu liggja ekki fyrir vegna annarra infliximab-lyfja hér á landi, þar sem samstarf um skráningu vegna aukaverkana var ekki í sama farvegi. Tilkynningarnar sem hafa borist fyrir Flixabi® eru hins vegar svipaðar og fyrir önnur infliximab-lyf. Til þess að meta líkindi þess að aukaverkanir komi fram þarf að skoða hversu margir tóku lyfið og hversu lengi það hafði verið á markaði. Flixabi hefur verið stuttan tíma á markaði og hugsanlega eru meiri líkur á því að þeir sem taka Flixabi fái frekar aukaverkun en við notkun annarra infliximab-lyfja. Það er sömuleiðis mögulegt að heilbrigðisstarfsfólk og notendur lyfsins séu meira vakandi fyrir aukaverkunum lyfja og/eða að bætt samstarf um að fylgjast með og skrá aukaverkanir sé ástæða fjölgunar á tilkynningum vegna infliximab.
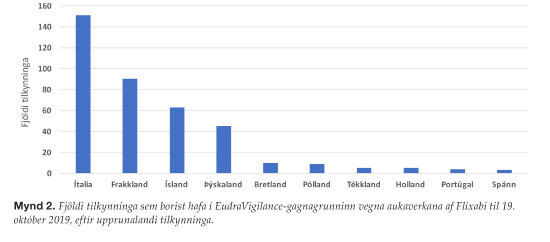
Lyfjastofnanir Evrópu senda tilkynningar um aukaverkanir áfram í evrópskan gagnagrunn, EudraVigilance (mynd 2).3 Þessi gagnagrunnur er öllum opinn og er einnig hluti af þeim upplýsingunum sem Lyfjastofnanir í Evrópu nota til eftirlits með ávinningi og áhættu af lyfjum eftir að þau hafa fengið markaðsleyfi. Í gagnagrunninum má sjá að tilkynntar aukaverkanir vegna Flixabi frá Íslandi hafa umtalsvert vægi í þessu evrópska samstarfi.
Samstarf Lyfjastofnunar og Landspítala hefur skilað góðum árangri í eftirfylgni með Flixabi® eftir að það kom á markað. Engar alvarlegar aukaverkanir hafa komið fram enn sem komið er. Mikilvægt er að halda áfram að fylgjast með Flixabi® þar sem stutt er síðan það kom á markað til að skilja betur orsakasamband lyfsins við aukaverkun, úrræði og langtímaáhrif lyfsins.
Til að tilkynna aukaverkun má hafa samband við klíníska lyfjafræðinga í Miðstöð lyfjaupplýsinga (S: 825 3525) eða tilkynna beint í gegnum vefsíðu Lyfjastofnunar ( lyfjastofnun.is ). Klínískir lyfjafræðingar í Miðstöð lyfjaupplýsinga veita læknum og hjúkrunarfræðingum ráðgjöf við mat á tengslum lyfs og aukaverkunar. Lyfjastofnun heldur utan um upplýsingar vegna aukaverkana lyfja og skráir þær í EudraVigilance.
Heimildir
| 1. European Medicines Agency. Guideline on good pharmacovigilance practices (GVP) Module X - Additional Monitoring, 19-April-2013. | |
| 2. Guðmundsson K. Ný líftæknilyf og hliðstæður þeirra. Læknablaðið 2014; 100: 267. | |
| 3. adrreports.eu/en/index.html - október 2019. | |



