02. tbl. 110. árg. 2024
Fræðigrein
Rannsókn. Frávik í blóðgildum og skerðing á insúlínnæmi barna og unglinga í Heilsuskóla Barnaspítala Hringsins
Ágrip
INNGANGUR
Fjöldi barna með offitu á heimsvísu hefur margfaldast á síðustu áratugum og eru íslensk börn þar engin undantekning. Offita getur haft mjög alvarlegar heilsufarslegar afleiðingar strax í barnæsku og er sérstaklega algengt að börn með offitu séu með skert insúlínnæmi. Heilsuskóli Barnaspítala Hringsins var stofnaður árið 2011 til þess að aðstoða börn með alvarlega offitu og fjölskyldur þeirra við að bæta lífsvenjur sínar og heilsu. Markmið rannsóknarinnar var að meta algengi skerðingar á insúlínnæmi sem og frávik í efnaskiptum barna í Heilsuskóla Barnaspítalans út frá blóðgildum þeirra.
EFNIVIÐUR OG AÐFERÐIR
Rannsóknin náði til allra barna (n=180) sem voru meðhöndluð í Heilsuskólanum frá 2016 til 2020 og fóru í fastandi blóðrannsókn þar sem mæld voru að minnsta kosti átta af níu eftirtöldum gildum í sermi: HbA1c, glúkósi, insúlín, ALAT, heildarkólesteról, HDL kólesteról, þríglýseríðar, TSH og frítt T4. HOMA-IR var reiknað út frá insúlín- og glúkósagildum og var skert insúlínnæmi skilgreint sem HOMA-IR >3,42.
NIÐURSTÖÐUR
84% barnanna mældust með að minnsta kosti eitt frávik í fyrrnefndum blóðgildum. 50% barnanna mældust með frávik í insúlíni og 44% með frávik í ALAT. Þá mældust 78% barnanna með skert insúlínnæmi. Meðal HOMA-IR þeirra reyndist 7,3 (± 5,0) eða rúmlega tvöfalt viðmiðunargildi.
UMRÆÐA
Ljóst er að meirihluti barna sem sækir meðferð hjá Heilsuskólanum er þegar með merki um fylgikvilla offitu og hefur sá hópur stækkað hlutfallslega frá sambærilegri rannsókn sem gerð var í Heilsuskólanum árið 2013. Sérstaklega alvarlegt er hversu algengt skert insúlínnæmi reyndist meðal barnanna. Mikilvægt er að sporna við þessari þróun með viðeigandi inngripum sem fyrst.
Greinin barst til blaðsins 5. september 2023, samþykkt til birtingar 4. janúar 2024.
Inngangur
Offita og ofþyngd barna og fullorðinna hefur verið ört vaxandi heilbrigðisvandamál síðan um miðja síðustu öld. Á heimsvísu hefur fjöldi 5-19 ára barna og unglinga með offitu tífaldast á síðustu 40 árum og hefur Ísland fylgt svipaðri þróun.1,2 Samkvæmt áður óbirtum tölum frá Þróunarmiðstöð íslenskrar heilsugæslu hefur algengi offitu meðal íslenskra barna á grunnskólaaldri hækkað úr 4,8% árið 2013-2014 í 7,3% árið 2021-2022. Þessar tölur eru fengnar úr mælingum skólahjúkrunarfræðinga á börnum í fyrsta, fjórða, sjöunda og níunda bekk á landsvísu.3
Offita á barnsaldri hefur verið tengd ótímabærum dauðsföllum og auknum líkum á sykursýki og hjarta- og æðasjúkdómum á fullorðinsárum.4,5 Auk þess eru börn með offitu líklegri til að vera með offitu á fullorðinsárum og aukast líkurnar með hækkuðum líkamsþyngdarstuðli (LÞS, body mass index, BMI).6,7 Offita getur einnig haft alvarlegar heilsufarslegar afleiðingar strax í barnæsku. Auknar líkur eru á fitulifur, kæfisvefni, beinbrotum, háþrýstingi, sykursýki af tegund tvö, öndunarfærasjúkdómum, sálfélagslegum erfiðleikum og ákveðnum tegundum krabbameina.8-10 Stór hluti barna með offitu reynist vera með frávik í að minnsta kosti einu blóðgildi sem eykur hættu á hjarta- og æðasjúkdómum og þar af er skerðing á insúlínnæmi algengasta frávikið.10 Skerðing á insúlín-næmi er forstig sykursýki af tegund tvö en rannsóknir hafa bent til þess að við greiningu á sykursýki af tegund tvö séu börn oft þegar komin með merki um smáæðaskaða og áhættumerki um yfirvofandi skemmdir á stórum æðum.9,11
Insúlínnæmi barna skerðist fyrst og fremst vegna dreif-ingar fitufrumna í insúlínnæma vefi, svo sem beinagrindarvöðva, lifur og fituvef. Sem svar við minnkuðu næmi eykur líkaminn framleiðslu insúlíns og hækkar því blóðstyrkur þess.12 Rannsóknir hafa sýnt að skerðing á insúlínnæmi hjá börnum með offitu auki líkur á þróun annarra þátta efnaskiptavillu (metabolic syndrome) og þar af leiðandi á þróun hjarta- og æðasjúkdóma og sykursýki af tegund tvö.13 Þá hafa rannsóknir einnig sýnt að umtalsverð eyðilegging verði á beta-frumum, sem framleiða insúlín, í brisi barna með offitu áður en sykurþolspróf eða fastandi blóðsykursmælingar sýna frávik.13 Því er gagnlegt að meta insúlínnæmi þrátt fyrir að blóðsykursmælingar reynist eðlilegar hjá börnum með offitu.13
Til þess að meta insúlínnæmi er talið best að nota rannsóknaraðferð sem felur í sér stöðuga gjöf insúlíns og breytilega gjöf glúkósa í æð sjúklings samhliða reglulegum mælingum á blóðstyrk hvors fyrir sig (Hyperinsulinemic euglycemic clamp). Þessi aðferð er flókin í framkvæmd og því ekki mikið notuð í rannsóknum á stórum hópum.14 Til eru aðrar leiðir til að mæla svörun líkamans við gjöf glúkósa en þær fela allar í sér endurteknar mælingar á blóðsykri og mikinn mannafla.10 Einfaldari kostur er að nota HOMA-IR (homeostatic model assessment – insulin resistance) reikniformúlu til mats á insúlínnæmi út frá stakri fastandi mælingu á styrk insúlíns og glúkósa í sermi. Hærra gildi HOMA-IR samsvarar meiri skerðingu á insúlínnæmi.13 Helsti kostur mælingarinnar er sá að aðeins þarf eina fastandi blóðprufu en ókosturinn er að hún nær ekki að fanga dýnamískt samband insúlíns og glúkósa. Alþjóðlega viðurkennt viðmið insúlínnæmis út frá HOMA-IR er ekki til þar sem HOMA-IR er ekki notað til þess að greina insúlínónæmi hjá einstökum sjúklingum heldur aðeins til þess að meta faraldsfræði insúlínónæmis.10 Rannsóknir hafa leitast við að greina slík viðmið út frá öðrum mælingum á insúlínnæmi og eru þá mismunandi viðmið fyrir börn í kjörþyngd og með offitu. Þá hefur kyn, kynþáttur og kynþroskastig einnig reynst hafa áhrif á viðmiðunargildin en insúlínnæmi skerðist tímabundið hjá öllum börnum á kynþroskaaldri.13,15
Til þess að áætla alvarleika offitu hafa ýmsir mælikvarðar verið notaðir. Helst hefur verið stuðst við LÞS sem reiknaður er út frá hæð og þyngd samkvæmt formúlunni þyngd⁄hæð2 (kg⁄m2).2 Hann er sérstaklega gagnlegur þegar meta á stærri þýði. Þegar meta á LÞS barna þarf að taka tillit til kyns og aldursstaðlaðra viðmiða. LÞS barnsins er reiknaður út og borinn saman við meðaltal jafnaldra af sama kyni. Þá eru reiknuð út staðalfráviksstig LÞS eða LÞS-SFS sem eru annaðhvort jákvæð eða neikvæð eftir því hvort barnið er yfir eða undir meðaltali. Samkvæmt Alþjóðaheilbrigðisstofnuninni miðast ofþyngd 5-18 ára barna við +1 LÞS-SFS og offita við +2,16 Í Heilsuskóla Barnaspítalans eru notuð alþjóðleg viðmið17 og tekið er við tilvísunum ef börn á aldrinum 5-18 ára eru að minnsta kosti +2,5 LÞS-SFS yfir meðaltali jafnaldra sinna.
Heilsuskóli Barnaspítala Hringsins var stofnaður árið 2011 til þess að aðstoða börn með offitu og fjölskyldur þeirra við að bæta lífsvenjur sínar og heilsu. Meðferðin miðar að því að hjálpa börnum sem hafa þyngst hratt á skömmum tíma og er markmiðið að stöðva eða hægja á þyngdaraukningu barnanna. Þetta er fjölskyldumiðuð atferlismeðferð sem byggir á rannsóknum Epsteins18 en hefur verið þróuð og aðlöguð að íslenskum aðstæðum með góðum árangri.19,20 Frá stofnun Heilsuskólans hafa rúmlega 800 börn og unglingar sótt meðferð hans og á hverjum tíma eru um það bil 250-300 börn í virkri meðferð. Við upphaf meðferðar í Heilsuskólanum eru blóðrannsóknir framkvæmdar til þess að meta efnaskipti barnanna.
Markmið rannsóknarinnar var að meta algengi frávika í efnaskiptum og skerðingar á insúlínnæmi barna í Heilsuskóla Barnaspítalans út frá blóðgildum þeirra.
Efni og aðferðir
Rannsóknin var afturskyggn og lýsandi. Hún náði til allra barna (n=180) sem komu í meðferð Heilsuskóla Barnaspítala Hringsins frá 2016 til 2020 og fóru í blóðrannsókn þar sem mæld voru að minnsta kosti átta af þeim níu blóðgildum sem skoðuð voru í þessari rannsókn (tafla I). Hæð var mæld með stafrænum, veggföstum hæðarmæli (Ulmer Stadiometer, BUSSE, Elrichen, Þýskalandi) og þyngd var mæld með BIA-mælingartæki (Tanita MC-780, Amsterdam, Hollandi). LÞS-SFS voru reiknuð út frá aldri, kyni, LÞS og stöðluðum viðmiðunarkúrfum.17

Upplýsingatæknisvið Landspítala tók saman dulkóðuð gögn sem innihéldu dagsetningar og niðurstöður blóðrannsókna hjá börnum sem voru í meðferð hjá Heilsuskólanum á rannsóknartímabilinu. Blóðrannsóknirnar voru framkvæmdar þegar þátttakendur voru fastandi og voru skoðuð níu gildi í sermi: HbA1c, glúkósi, insúlín, ALAT, heildarkólesteról, HDL--kólesteról, þríglýseríðar, TSH og frítt T4. Viðmiðunarmörk fyrir frávik blóðgildanna má sjá í töflu I. Notuð voru ALAT- viðmiðunarmörk til skimunar fyrir fitulifur hjá börnum með offitu, sem taka tillit til kyns, samkvæmt klínískum leiðbeiningum Samtaka meltingar- og lifrarlækna í Norður-Ameríku (NASPGHAN) frá árinu 2017.21 Ef barn átti fleiri en eina blóðrannsókn á tímabilinu þar sem mæld voru að minnsta kosti átta af þessum níu blóðgildum var fyrsta mæling notuð.
HOMA-IR var reiknað út frá mælingu á glúkósa og insúlíni í sermi samkvæmt jöfnunni:
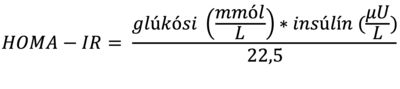
Skert insúlínnæmi barna með offitu, óháð kyni og kynþroskastigi, var skilgreint sem HOMA-IR >3,42. Þetta viðmið fyrir insúlínnæmi barna með offitu byggir á rannsókn Shashaj og félaga frá árinu 2016 sem tók til 2753 barna. Ályktun þeirra var sú að HOMA-IR hærra en 3,42 fyrir börn með offitu væri sjálfstæður áhættuþáttur hjarta- og æðasjúkdóma, óháð kyni, aldri og fitudreifingu.22 Þar sem kyn og kynþroski hafa áhrif á insúlínnæmi voru gögnin einnig skoðuð með tilliti til þessara þátta. Þegar litið var til kyns og kynþroska taldist eðlilegt HOMA-IR <2,22 fyrir stúlkur og <2,67 fyrir drengi sem ekki höfðu hafið kynþroskaskeið sitt og <3,82 fyrir stúlkur og <5,22 fyrir drengi á kynþroskaskeiði.15 Börn sem hefja meðferð í Heilsuskólanum eru ekki skoðuð með tilliti til kynþroskastigunar og því voru þátttakendur þessarar rannsóknar flokkaðir eftir aldri og gert ráð fyrir að 5-11 ára börn hefðu ekki hafið kynþroskaskeið sitt og 12-18 ára börn væru á kynþroskaaldri.
Unnið var úr gögnunum með R útgáfu 4.2.2.23 og var notuð lýsandi tölfræði. Leyfi fyrir rannsókninni fengust hjá siðanefnd heilbrigðisrannsókna á Landspítala (rannsóknarnúmer: 04/2020) og vísindarannsóknanefnd Landspítala.
Niðurstöður
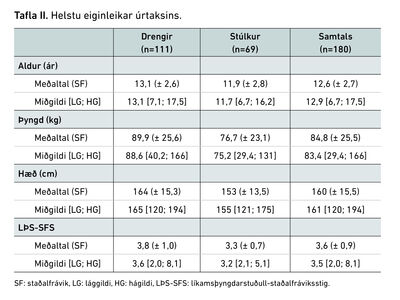
Eitt hundrað og áttatíu börn fóru í blóðrannsókn á vegum Heilsuskólans á rannsóknartímabilinu þar sem mæld voru að minnsta kosti átta af þeim níu blóðgildum sem skoðuð voru í þessari rannsókn. Þar af voru 69 (38%) stúlkur og 111 (62%) drengir. Meðalaldur þýðisins var 12,6 (± 2,7) ár og meðal-LÞS-SFS 3,6 (± 0,9) (tafla II).
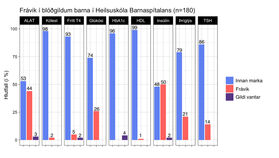
Blóðgildin níu sem rannsóknin náði til voru mæld hjá 170 af 180 börnum (94%) en eina mælingu vantaði hjá tíu börnum (6%). Aðeins 28 börn af 180 (16%) mældust ekki með nein frávik í blóðgildum en 84% barnanna mældust með að minnsta kosti eitt frávik. Algengi frávika í hverju blóðgildi fyrir sig má sjá á mynd 1.
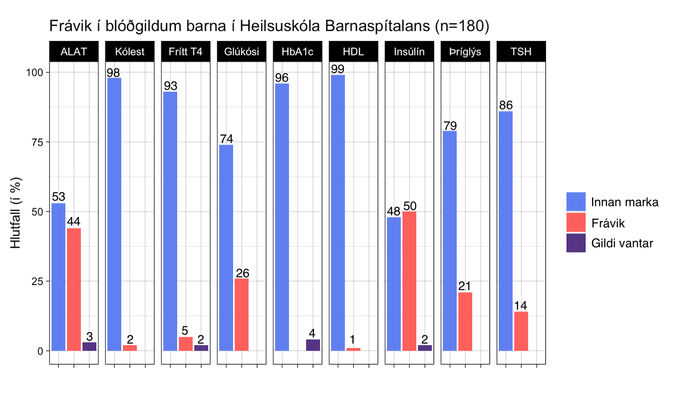 Mynd 1. Algengi frávika í hverju blóðgildi fyrir sig. ALAT: alanín amínótransferasi; Kólest: kólesteról; HbA1c: hemóglóbín A1c, glýkósýlerað hemóglóbín; HDL: high density lipoprotein; Þríglýs: þríglýseríðar; TSH: thyroid stimulating hormone.
Mynd 1. Algengi frávika í hverju blóðgildi fyrir sig. ALAT: alanín amínótransferasi; Kólest: kólesteról; HbA1c: hemóglóbín A1c, glýkósýlerað hemóglóbín; HDL: high density lipoprotein; Þríglýs: þríglýseríðar; TSH: thyroid stimulating hormone.
Insúlínmælingu vantaði hjá fjórum börnum af 180. Meðal-styrkur insúlíns í sermi reyndist yfir viðmiðunarmörkum þegar allur hópurinn var skoðaður (30,2 ± 19,2 µU/L) (sjá viðmiðunarmörk í töflu I). Þegar skipt var í þrjá aldurshópa, 5-9 ára (n=31), 10-14 ára (n=110) og 15-18 ára (n=39), var meðalstyrkur insúlíns hjá yngsta hópnum innan viðmiðunarmarka (16,9 ± 7,6 µU/L) en yfir viðmiðunarmörkum hjá báðum eldri hópunum (33,3 ± 21,0 µU/L hjá 10-14 ára börnum og 32,2 ± 16,3 µU/L hjá 15-18 ára börnum). Helmingur (50%) barnanna mældist með frávik í insúlíni og var það hæsta hlutfall frávika af öllum blóðgildum sem skoðuð voru. Því næst kom ALAT en 44% barnanna reyndust með frávik í mælingu þess. Meðalgildi ALAT hjá stúlkum mældist 27,3 (± 24,5) U/L og 30,7 (± 17,1) U/L hjá drengjum. Rúmlega fjórðungur (26%) barnanna mældist með frávik í blóðstyrk glúkósa og var það þriðja algengasta frávikið. Frávik í HbA1c mældist ekki hjá neinu barni en HbA1c mælingu vantaði hjá 7 börnum af 180 (4%).
HOMA-IR var reiknað út frá insúlín- og glúkósamælingum barnanna. Bæði gildin voru mæld hjá 176 börnum af 180. Niðurstöður sýndu að 78% barnanna voru með skert insúlínnæmi þegar það var skilgreint sem HOMA-IR >3,42. Þetta hlutfall hækkaði eftir aldri en 52% 5-9 ára barna (n=31), 83% 10-14 ára barna (n=110) og 87% 15-18 ára barna (n=39) voru með skert insúlínnæmi samkvæmt þeirri skilgreiningu (mynd 2). Meðal-HOMA-IR allra aldursflokka reyndist hærra en 3,42.
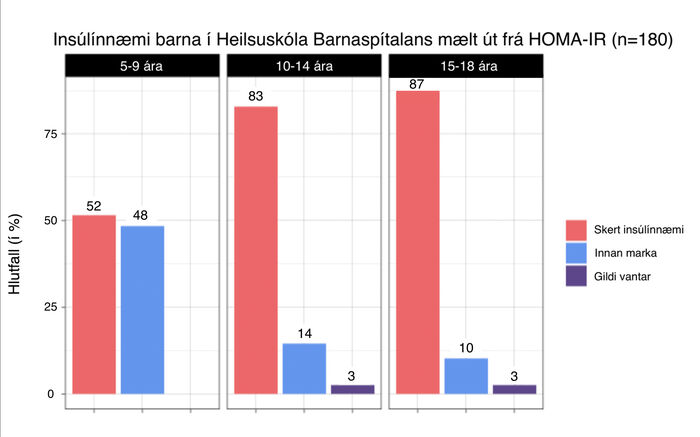 Mynd 2. Insúlínnæmi mælt út frá HOMA-IR, skipt eftir aldursflokkum þegar skert insúlínnæmi var skilgreint sem HOMA-IR >3,4222 (HOMA-IR: Homeostatic model assessment – insulin resistance).
Mynd 2. Insúlínnæmi mælt út frá HOMA-IR, skipt eftir aldursflokkum þegar skert insúlínnæmi var skilgreint sem HOMA-IR >3,4222 (HOMA-IR: Homeostatic model assessment – insulin resistance).
Þegar börnunum var skipt í tvo aldurshópa, 5-11 ára börn sem áætlað var að hefðu ekki hafið kynþroskaskeið sitt og 12-18 ára börn á kynþroskaaldri, voru meðaltöl og miðgildi HOMA-IR einnig yfir kyn- og kynþroskabundnum viðmiðunargildum fyrir stúlkur og drengi í báðum aldurshópum. Meðal-HOMA-IR hjá hverjum hóp fyrir sig var hærra en tvöfalt efra viðmiðunargildi að undanskildum 12-18 ára drengjum þar sem meðal-HOMA-IR var 8,9 (± 4,5) og viðmiðunargildi <5,22 (sjá töflu III).
Umræða
Aðeins 16% þeirra barna sem tóku þátt í þessari rannsókn reyndust vera án nokkurra frávika í mældum blóðgildum. Verður það að teljast töluvert áhyggjuefni í ljósi þess að verið er að mæla blóðgildi sem allajafna mælast ekki utan viðmiðunarmarka fyrr en á fullorðinsaldri. Skerðing á insúlínnæmi á stóran hlut í vaxandi algengi frávika í blóðgildum en algengasta frávikið var hækkaður blóðstyrkur insúlíns og mældust fleiri börn með frávik í insúlíni en ekki. Í rannsókn Ásdísar Evu Lárusdóttur og félaga sem framkvæmd var í Heilsuskólanum árið 201324 mældust engin frávik hjá 53% þátttakenda (n=116) þegar sömu blóðgildi voru skoðuð. Í þeirri rannsókn var notað eldra viðmiðunargildi fyrir ALAT og þegar það var notað hjá okkar þýði voru 24% barna án nokkurra frávika. Samkvæmt þessum niðurstöðum sýnir stór hluti barna sem sækja meðferð hjá Heilsuskólanum nú þegar merki um fylgikvilla offitu og hefur sá hópur stækkað hlutfallslega á þeim sjö árum sem liðu á milli rannsóknanna tveggja.
Annað algengasta frávikið reyndist vera hækkun á ALAT en niðurstöðurnar benda til þess að tæplega helmingur þessara barna sé mögulega kominn með íferð fitufrumna í lifur. Aðeins 9% barna í fyrrnefndri rannsókn frá árinu 201324 mældust með ALAT yfir viðmiðunarmörkum en í þeirri rannsókn var frávik skilgreint sem ALAT >45 U/L óháð kyni. Í núverandi rannsókn mældust 13% barna með ALAT >45 U/L. Samkvæmt fyrrnefndum klínískum leiðbeiningum NASPGHAN21 er næsta skref þegar barn með offitu mælist með ALAT yfir viðmiðunarmörkum án annarrar klárrar orsakar að ráðleggja lífsstílsbreytingar og að fylgja þeim eftir með blóðprufu eftir einn til sex mánuði.21 Fjögur börn mældust með ALAT yfir 80 U/L en slík hækkun krefst frekari rannsókna og tilvísunar til sérfræðings í lifrarsjúkdómum barna.21
Í úrvinnslu gagnanna var miðað við að insúlínnæmi barna með offitu teljist skert þegar HOMA-IR mælist hærra en 3,42 sem er talinn sjálfstæður áhættuþáttur hjarta- og æðasjúkdóma óháð kyni, kynþroska og fitudreifingu.22 Sjötíu og átta prósent barnanna í okkar rannsókn mældust með HOMA-IR hærra en 3,42. Þegar þau voru flokkuð með tilliti til kyns og hvort þau væru á kynþroskaaldri eða ekki reyndust meðal- og miðgildi allra hópa langt yfir tilskildum viðmiðunarmörkum (tafla III). Þessar niðurstöður benda til þess að mikill meirihluti þessara barna sé með skerðingu á insúlínnæmi og því í aukinni hættu á þróun frekari fylgisjúkdóma offitu. Í rannsókn Ásdísar Evu og félaga frá árinu 201324 var skert insúlínnæmi barna skilgreint sem HOMA-IR >3,16 óháð kyni og kynþroskastigi samkvæmt niðurstöðum rannsóknar frá 2005.25 Í fyrrnefndri rannsókn frá 201324 voru 57% barna með HOMA-IR >3,16 og þegar sömu viðmið voru notuð í núverandi rannsókn reyndist 81% barnanna með skert insúlínnæmi. Talsverð aukning hefur því orðið á algengi insúlínnæmisskerðingar meðal barna í Heilsuskólanum á árunum 2013 til 2020, sem er mikið áhyggjuefni.

Þrátt fyrir talsverða aukningu á algengi insúlínnæmisskerðingar er vert nefna að hlutfall drengja var hærra í okkar rannsókn (62%) en í rannsókninni frá 201324 (44%) sem getur haft áhrif á samanburð milli rannsóknanna þar sem kynbundin HOMA-IR viðmið eru hærri fyrir drengi. Þá var meðalaldur barna í okkar rannsókn hærri 12,6 (± 2,7) ár) en í rannsókninni frá 201324 11,5 (± 2,9) ár. Þessi munur á hópunum getur einnig valdið skekkju á samanburði milli rannsóknanna því að teknu tilliti til kynþroska eru HOMA-IR viðmiðin hærri fyrir eldri börn en yngri. Meðal-LÞS-SFS barna í þessari rannsókn var 3,6 (± 0,9) en meðal-LÞS-SFS þátttakenda í rannsókninni árið 201324 var 3,5 (± 0,8) og því ekki afgerandi munur á stigi offitu þátttakenda milli rannsókna samkvæmt þessum mælikvarða. Þau börn sem skoðuð voru nú höfðu þó beðið lengur eftir meðferð og þar af leiðandi verið lengur með alvarlega offitu en börnin í rannsókninni frá 2013.24 Þróun á insúlínónæmi þeirra gæti því verið komin lengra á veg.
Á síðastliðnum 10 árum hefur tilvísunum í Heilsuskólann fjölgað meira en unnt er að sinna með núverandi mönnun og er því aðeins hægt að taka við þeim börnum sem eru með alvarlegustu frávikin í offitu og hafa þau að jafnaði beðið lengi eftir meðferð. Þess má geta að þegar þetta er ritað er meðalbiðtími barna frá tilvísun til inntöku í Heilsuskólanum um eitt og hálft ár og hefur lengst töluvert frá fyrrnefndri rannsókn frá árinu 2013.24 Lengri biðtími gæti útskýrt að hluta þessa miklu aukningu í algengi og fjölda frávika, sem og aukningu í skerðingu á insúlínnæmi hjá börnum í meðferð Heilsuskólans milli rannsóknanna 2013 og 2020. Þá eru aðrir þættir sem geta aukið skerðingu á insúlínnæmi, til dæmis aukin kyrrseta og óheilbrigðar matarvenjur.12 Auk þess hefur börnum með taugaþroskaraskanir á borð við athyglisbrest með ofvirkni (ADHD), einhverfurófsröskun og ýmsar geðrænar raskanir fjölgað hlutfallslega í meðferð Heilsuskólans á síðastliðnum árum8 og hafa rannsóknir sýnt að börn með offitu og raskanir af þessum toga séu líklegri til þess að vera með skert insúlínnæmi en börn með offitu án þessara raskana.27 Líkt og fram hefur komið hér að framan getur skerðing á insúlínnæmi haft alvarlegar afleiðingar strax á barnsaldri og er mikilvægt að grípa inn í um leið og áhættuþættir og vísbendingar um fylgikvilla koma í ljós.28 Til þess þarf að aðstoða börn og foreldra þeirra við að finna leiðir til að tileinka sér heilbrigðar lífsvenjur, svo sem reglulega hreyfingu og heilsusamlegt mataræði en rannsóknir hafa sýnt að þessir þættir stuðla einnig að bættu insúlínnæmi. Þar skiptir snemmtæk íhlutun miklu máli.28,29
Styrkleikar rannsóknarinnar voru meðal annars þeir að hún náði til allra barna sem voru í meðferð á vegum Heilsuskólans yfir fjögurra ára tímabil og fóru í ítarlegar blóðprufur. Gallar hennar voru þeir að notaður var mælikvarði á insúlínónæmi sem er ekki notaður til greiningar í klínísku starfi, börnin voru ekki stiguð með tilliti til kynþroska, ekki voru skráðar upplýsingar um matarvenjur eða kyrrsetu barnanna né kynþáttur þeirra en allir þessir þættir geta haft áhrif á insúlínnæmi barna. Ekki eru til alþjóðleg viðmið fyrir insúlínónæmi barna sem taka tillit til kynþáttar12 en þess má geta að um 10% barna í Heilsuskólanum eru af erlendu bergi brotin og þar af eru 8% af evrópskum uppruna en 2% af afrískum eða asískum uppruna. Því er ólíklegt að kynþáttur hafi haft áhrif á niðurstöður þessarar rannsóknar.
Rannsóknin veitir yfirsýn yfir algengi skerðingar á insúlínnæmi og frávika í efnaskiptum barna í Heilsuskóla Barnaspítalans. Niðurstöður hennar má túlka sem merki um að ástand þeirra barna sem hófu meðferð í Heilsuskólanum árin 2016-2020 hafi verið alvarlegra en hjá börnum sem hófu meðferð fyrir árið 2013. Aðsókn að Heilsuskólanum hefur aukist frá árinu 2020 en á sama tíma hefur algengi offitu barna á Íslandi einnig haldið áfram að aukast. Því er vel hægt að draga þá ályktun að heilsufarsástand barna sem koma í meðferð á vegum Heilsuskólans í dag sé, ef eitthvað er, verra en hér er lýst. Þá hafa mælingar á árangri offitumeðferðar Heilsuskólans bent til þess að gagnlíkindi þess að börn nái góðum árangri í meðferðinni séu hærri, því yngri sem börnin eru við upphaf meðferðar.26 Því er þörf á að koma þessum börnum fyrr í meðferð til þess að minnka líkur á þróun alvarlegra fylgikvilla. Þessu til fyrirstöðu er að sá fjöldi barna sem bíður eftir offitumeðferð Heilsuskólans er meiri en tök eru á að sinna á hverjum tíma miðað við núverandi rekstraraðstæður. Það er mikilvægt að þróa og setja inn virk inngrip á öllum stigum heilbrigðisþjónustunnar og samfélagsins alls til þess að sporna við þeim vanda sem við stöndum nú frammi fyrir og tryggja börnum þá þjónustu sem þau þurfa.
Þakkir
Höfundar vilja þakka PC PAL fyrir aðgang að forriti til útreikninga á staðalfrávikastigum líkamsþyngdarstuðuls.Þakkir fá einnig Thorvaldsensjóður fyrir styrk til Barnaspítala Hringsins og þau börn og foreldrar sem tóku þátt í rannsókninni. Samstarfsfólk í Heilsuskólanum fær bestu þakkir fyrir
aðstoð við framkvæmd og úrvinnslu rannsóknarinnar. Ritrýnar Læknablaðsins fá þakkir fyrir góðan yfirlestur.
Heimildir
| 1. Tenfold increase in childhood and adolescent obesity in four decades: new study by Imperial College London and WHO. who.int/news/item/11-10-2017-tenfold-increase-in-childhood-and-adolescent-obesity-in-four-decades-new-study-by-imperial-college-london-and-who. - september 2023. | ||||
| 2. NCD Risk Factor Collaboration (NCD-RisC). Worldwide trends in body-mass index, underweight, overweight, and obesity from 1975 to 2016: a pooled analysis of 2416 population-based measurement studies in 128·9 million children, adolescents, and adults. Lancet 2017; 390: 2627-42. | ||||
| 3. Þróunarmiðstöð Heilsugæslu. Heilsuvernd skólabarna. Ársskýrsla 2021-2022: ofþyngd og offita 6-14 ára barna [óbirt skýrsla]. | ||||
| 4. Weihrauch-Blüher S, Schwarz P, Klusmann JH. Childhood obesity: increased risk for cardiometabolic disease and cancer in adulthood. Metabolism 2019; 92: 147-52. https://doi.org/10.1016/j.metabol.2018.12.001 PMid:30529454 |
||||
| 5. Park MH, Falconer C, Vine RM, et al. The impact of childhood obesity on morbidity and mortality in adulthood: a systematic review. Obes Rev 2012; 13: 985-1000. https://doi.org/10.1111/j.1467-789X.2012.01015.x PMid:22731928 |
||||
| 6. Guo SS, Wu W, Chumlea WC, et al. Predicting overweight and obesity in adulthood from body mass index values in childhood and adolescence. Am J Clin Nutr 2002; 76: 653-8. https://doi.org/10.1093/ajcn/76.3.653 PMid:12198014 |
||||
| 7. Simmonds M, Llewellyn A, Owen CG, et al. Predicting adult obesity from childhood obesity: a systematic review and meta-analysis. Obesity Rev 2016; 17: 95-107. https://doi.org/10.1111/obr.12462 https://doi.org/10.1111/obr.12334 PMid:26696565 |
||||
| 8. Þorsteinsdóttir S, Brynjólfsdóttir B, Bjarnason R, et al. Paediatric obesity treatment in Iceland: Prevalence and changes in the prevalence of ADHD, Autism Spectrum Disorders, anxiety and depression. Sálfræðiritið - Tímarit Sálfræðingafélags Íslands 2017; 22: 85-102. | ||||
| 9. Pulgaron ER, Delamater AM. Obesity and type 2 diabetes in children: epidemiology and treatment. Curr Diab Rep 2014; 14: 508. https://doi.org/10.1007/s11892-014-0508-y PMid:24919749 PMCid:PMC4099943 |
||||
| 10. Chiarelli F, Marcovecchio,ML. Insulin resistance and obesity in childhood. Eur J Endocrinol 2008; 159: Suppl 1, S67-74. https://doi.org/10.1530/EJE-08-0245 PMid:18805916 |
||||
| 11. Nadeau KJ, Anderson BJ, Berg EG, et al. Youth-Onset Type 2 Diabetes Consensus Report: Current Status, Challenges, and Priorities. Diabetes Care 2016; 39: 1635-42. https://doi.org/10.2337/dc16-1066 PMid:27486237 PMCid:PMC5314694 |
||||
| 12. Al-Beltagi M, Bediwy AS, Saeed N K. Insulin-resistance in paediatric age: Its magnitude and implications. World J Diabetes 2022; 13: 282-307. https://doi.org/10.4239/wjd.v13.i4.282 PMid:35582667 PMCid:PMC9052009 |
||||
| 13. Tagi VM, Giannini C, Chiarelli F. Insulin Resistance in Children. Front Endocrinol 2019; 10: 342. https://doi.org/10.3389/fendo.2019.00342 PMid:31214120 PMCid:PMC6558106 |
||||
| 14. Tahapary DL, Pratisthita LB, Fitri NA, et al. Challenges in the diagnosis of insulin resistance: Focusing on the role of HOMA-IR and Tryglyceride/glucose index. Diabetes Metab Syndr 2022; 16: 102581. https://doi.org/10.1016/j.dsx.2022.102581 PMid:35939943 |
||||
| 15. Kurtoğlu S, Hatipoğlu N, Mazıcıoğlu M, et al. Insulin Resistance in Obese Children and Adolescents: HOMA−IR Cut−Off Levels in the Prepubertal and Pubertal Periods. J Clin Res Pediatr Endocrinol 2010; 2: 100-6. https://doi.org/10.4274/jcrpe.v2i3.100 PMid:21274322 PMCid:PMC3005684 |
||||
| 16. Obesity and overweight. who.int/news-room/fact-sheets/detail/obesity-and-overweight. - september 2023. | ||||
| 17. Cole TJ, Bellizzi MC, Flegal KM, et al. Establishing a standard definition for child overweight and obesity worldwide: international survey. BMJ 2000; 320: 1240. https://doi.org/10.1136/bmj.320.7244.1240 PMid:10797032 PMCid:PMC27365 |
||||
| 18. Epstein LH. Family-based behavioural intervention for obese children. Int J Obes Relat Metab Disord 1996; 20 Suppl 1: S14-21. | ||||
| 19. Gunnarsdottir T, Sigurdardottir ZG, Njardvik U, et al. A randomized-controlled pilot study of Epstein's family-based behavioural treatment for childhood obesity in a clinical setting in Iceland. Nordic Psychol 2011; 63: 6-19. https://doi.org/10.1027/1901-2276/a000024 |
||||
| 20. Gunnarsdóttir Þ, Einarsson SM, Njarðvík U, et al. Fjölskyldumiðuð atferlismeðferð fyrir of feit börn - samantekt á niðurstöðum meðferðar og langtímaniðurstöðum við tveggja ára eftirfylgd. Læknablaðið 2014; 100: 139-45. https://doi.org/10.17992/lbl.2014.03.535 PMid:24636901 |
||||
| 21. Vos MB, Abrams SH, Barlow SE, et al. NASPGHAN Clinical Practice Guideline for the Diagnosis and Treatment of Nonalcoholic Fatty Liver Disease in Children: Recommendations from the Expert Committee on NAFLD (ECON) and the North American Society of Pediatric Gastroenterology, Hepatology and Nutrition (NASPGHAN). J Pediatr Gastroenterol Nutr 2017; 64: 319-34. https://doi.org/10.1097/MPG.0000000000001482 PMid:28107283 PMCid:PMC5413933 |
||||
| 22. Shashaj B, Luciano R, Contoli B, et al. Reference ranges of HOMA-IR in normal-weight and obese young Caucasians. Acta Diabetol 2016; 53: 251-60. https://doi.org/10.1007/s00592-015-0782-4 PMid:26070771 |
||||
| 23. R Core Team. R A Language and Environment for Statistical Computing. R Foundation for Statistical Computing, Vienna, Austria. (2021) R-project.org/. - september 2023. | ||||
| 24. Lárusdóttir ÁE, et al. Mikilvægi mittismáls við eftirlit barna með offitu. Alvarleg frávik í blóðgildum hjá íslenskum börnum með offitu. Læknablaðið 2015; 101: 399-403. https://doi.org/10.17992/lbl.2015.09.40 PMid:26374819 |
||||
| 25. Keskin M, Kurtoglu S, Kendirci M, et al. Homeostasis Model Assessment Is More Reliable Than the Fasting Glucose/Insulin Ratio and Quantitative Insulin Sensitivity Check Index for Assessing Insulin Resistance Among Obese Children and Adolescents. Pediatrics 2005; 115: e500-e503. https://doi.org/10.1542/peds.2004-1921 PMid:15741351 |
||||
| 26. Arnfríðardóttir AR. Líkamssamsetningarmælingar barna í Heilsuskóla Barnaspítalans [B.S. verkefni]. Háskóli Íslands, 2020. | ||||
| 27. Özalp Kızılay D, Yalın Sapmaz Ş, Şen S, et al. Insulin Resistance as Related to Psychiatric Disorders in Obese Children. J Clin Res Pediatr Endocrinol 2018; 10: 364-72. https://doi.org/10.4274/jcrpe.0055 PMid:29789273 PMCid:PMC6280318 |
||||
| 28. Valaiyapathi B, Gower B, Ashraf AP. Pathophysiology of Type 2 Diabetes in Children and Adolescents. CDR 2020; 16: 220-9. https://doi.org/10.2174/18756417OTA50ODUuTcVY https://doi.org/10.2174/1573399814666180608074510 PMid:29879890 PMCid:PMC7516333 |
||||
| 29. Wen LM, Rissel C, He G. The Effect of Early Life Factors and Early Interventions on Childhood Overweight and Obesity 2016. J Obesity 2017: e3642818. https://doi.org/10.1155/2017/3642818 PMid:28261496 PMCid:PMC5316452 |
||||