01. tbl. 110. árg. 2024
Fræðigrein
Sjúkratilfelli. Smáæðabólga með rauðkyrningafjöld, EGPA, falinn fylgisjúkdómur astma? Sjúkratilfelli
Höfundar fengu leyfi sjúklingsins fyrir þessari umfjöllun og birtingu.
Ágrip
72 ára kona sem hafði áður verið hraust leitaði á bráðamóttökuna vegna versnunar á andþyngslum og mæði. Við komu var hún talmóð og súrefnismettun aðeins 84%. Við lungnahlustun heyrðust önghljóð yfir báðum lungum. Blóðrannsókn sýndi verulega hækkun á rauðkyrningum, 1,4 x10E9/L.
Við nánari uppvinnslu á lungnadeild sýndi blóðrannsókn jákvætt MPO-ANCA sem ásamt klínískum einkennum leiddi til greiningar á smáæðabólgu með rauðkyrningafjöld, eða það sem áður hét Churg-Strauss-heilkenni. Barksterameðferð var hafin í lækkandi þrepum auk meðferðar með líftæknilyfinu mepolizumab, sem er IL-5 hemill. Einkenni urðu fljótt mikið betri og tíðar versnanir á lungnaeinkennum heyrðu sögunni til.
Greinin barst til blaðsins 13. júlí 2023, samþykkt til birtingar 1. desember 2023.
Inngangur
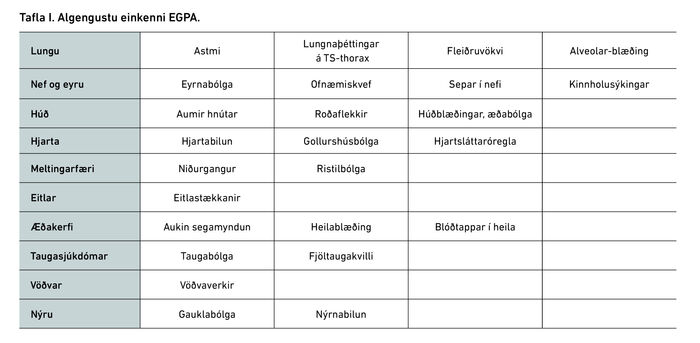
Smáæðabólga með rauðkyrningafjöld (eosinophilic granu-lomatosis with polyangiitis, EGPA) eða það sem áður hét Churg-Strauss-heilkenni, er alvarlegur fjölkerfa sjúkdómur sem einkennist af hækkun á rauðkyrningum í blóði, oft >1,5 x10E9/L. Einkenni geta verið almenn í byrjun, svo sem slappleiki, lystarleysi og blóðleysi. Algengast er að astmi og bólgueinkenni frá nefi og kinnholum hafi verið til staðar áður í nokkur ár. Einkenni frá hjarta og æðakerfi eru einnig algeng, svo sem aukin segahneigð, hjartavöðvabólga og hjartsláttaróregla. Einnig eru einkenni frá nýrum og meltingarvegi algeng en í raun getur rauðkyrningabólgan birst í flestum líffærum (tafla I).
 Ef bólgan er ómeðhöndluð getur hún jafnvel verið lífshættuleg eða leitt til óafturkræfs líffæraskaða með íferð rauðkyrninga og myndun bólguhnúða (granuloma) í æðum með tilheyrandi skerðingu á blóðflæði til líffæra.
Ef bólgan er ómeðhöndluð getur hún jafnvel verið lífshættuleg eða leitt til óafturkræfs líffæraskaða með íferð rauðkyrninga og myndun bólguhnúða (granuloma) í æðum með tilheyrandi skerðingu á blóðflæði til líffæra.
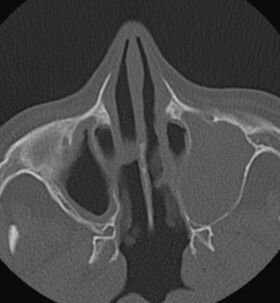
72 ára gömul kona leitaði á bráðamóttöku vegna versnunar á mæði og mikils slappleika. Hún var áður hraust en hafði fundið fyrir öndunarfæraeinkennum síðastliðin tvö ár af og til. Einkenni höfðu byrjað eftir öndunarfærasýkingu. Hún fékk mæðisköst, hósta og surg í brjóstholi. Í framhaldinu leitaði hún til heimilislæknis sem greindi hana með astma og ávísaði formóteról/búdesóníð innöndunarlyfi sem gerðu einkennin skárri. Hann vísaði henni svo í framhaldinu til lungnalæknis. Nokkrum mánuðum síðar leitaði hún aftur til heimilislæknisins, þá vegna einkenna frá ennis- og kinnholum. Slík einkenni höfðu plagað hana af og til síðustu ár. Hún var nú með verki í andliti samhliða nefstíflu og -rennsli. Var henni þá vísað til háls-, nef- og eyrnalæknis sem greindi hana með sepa í nefi. Hún fékk meðferð með barksterakúr (prednisólóni) og var bókuð í endurmat síðar. Fljótlega eftir að hún hóf meðferð urðu einkenni hennar mikið betri en að loknum sterakúr komu einkennin til baka. Nefstífla og verkir í andliti héldu áfram að plaga hana næstu mánuði. Við endurmat hjá HNE-lækni nokkrum mánuðum síðar var hún send í sneiðmyndarannsókn af andliti. Sú rannsókn sýndi þéttingar í nær öllum ennis- og kinnholum, sjá mynd 1.
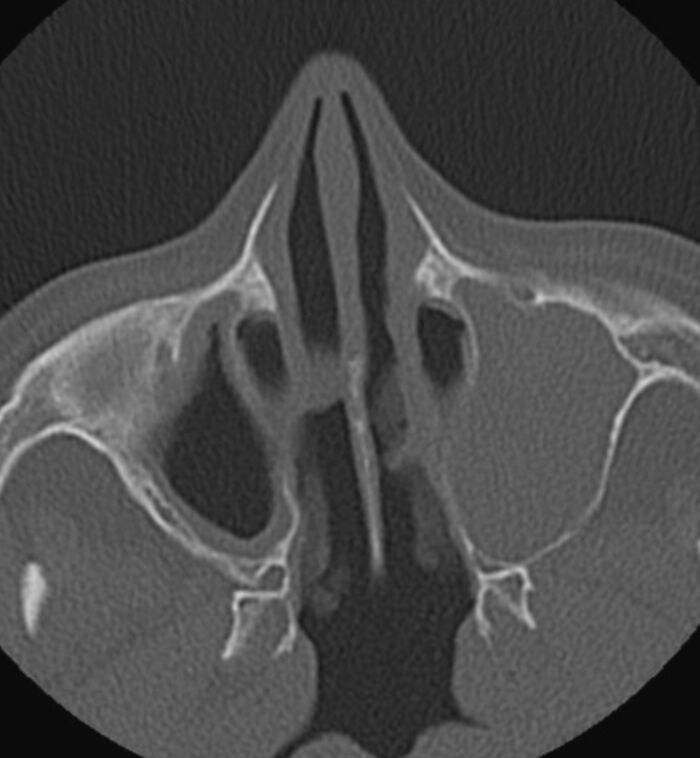
Mynd 1. Tölvusneiðmynd af kinnholum sjúklings. Á myndinni sést alskyggður sinus maxillaris vinstra megin og slímhúðarþykknun í þeim hægri.
Henni var þá ráðlagt að nota saltvatnsskolanir í nefhol samhliða barksterum bæði í töfluformi og nefúða. Þá var ákveðið að hún þyrfti FESS-aðgerð (functional endoscopic sinus surgery) til að létta á byrði nefsepanna og henni vísað til HNE-lækna á Landspítala til undirbúnings fyrir FESS-aðgerð.
Á meðan uppvinnslan hjá HNE-lækni fór fram hitti hún lungnalækni vegna hins nýgreinda astma. Lungnaeinkenni hennar höfðu þá nýverið elnað. Hún hafði samt sem áður verið að taka formóteról/búdesóníð innöndunarlyfið. Nú var farið ítarlega yfir heilsufarssögu hennar og áhættuþætti fyrir astma. Hún reyndist hvorki vera með bakflæðieinkenni né þekkt ofnæmi. Þá átti hún engin gæludýr og hafði aldrei reykt. Við lungnahlustun heyrðist talsvert af önghljóðum beggja vegna og var útöndun verulega lengd.
Gerð var öndunarmæling á stofu lungnalæknisins sem sýndi FVC 1,21 l eða 50% af forspáðu gildi og FEV1 0,72 l, eða 36% af forspáðu gildi. Öndunarmælingin sýndi því mikla teppu í lungum. Niðurstaðan var að hún hefði alvarlegan astma og fór hún í kjölfarið á nýjan barksterakúr. Hún hélt áfram með formóteról/búdesóníð innöndunarlyfið en skammtar voru tvöfaldaðir í tvö sog tvisvar sinnum á dag og fékk hún að auki þriggja daga sýklalyfjakúr með azitrómýcín vegna þáverandi elnunar á einkennum. Þá var hún einnig send í blóð- og ofnæmisrannsóknir.
Hún kom svo í endurtekna öndunarmælingu hjá lungnalækninum viku seinna. Einkenni hennar voru þá mun betri. Niðurstöður prófsins sýndu FVC 2,05 l, FEV1 1,73 l, þetta eru 85% og 87% af forspáðu gildi, mun betra en við síðustu mælingu. Niðurstöður ofnæmisrannsóknana lágu þá fyrir og voru þær eðlilegar.
Blóðrannsóknir höfðu þó sýnt verulega hækkun rauðkyrninga í blóði, 1,4 x10E9/L, en þeir voru 16% af heildarfjölda hvítkorna í blóði (HBK 8,9 x10E9/L).
Önnur heilsufarsvandamál voru beingisnun og var hún því sett á alendronat til beinstyrkingar. Hún fann einnig fyrir dofa og verkjum í vinstri handlegg og hendi sem höfðu einnig verið að trufla hana um svipað leyti. Hún leitaði ráða hjá heimilislækni sem taldi einkenni stafa frá úttaugum handleggsins og vísaði henni til taugalæknis. Skoðun tauga-læknisins benti helst til að einkenni hennar stöfuðu af truflun á ölnartaug (n. ulnaris) við vinstri úlnlið. Gert var taugaleiðnipróf síðar sem kom þá eðlilega út. Einkenni sjúklings voru breytileg, dofi og verkir komu og fóru yfir nokkura daga tímabil. Í framhaldinu var gerð segulómskoðun af vinstri úlnlið og framhandlegg sem sýndi væga þykknun á vinstri ölnartaug sem gæti verið vegna bólgu. Vegna vægs skorts á B-12 vítamíni var ákveðið að hefja uppbótarmeðferð og sjá hvort einhver bati yrði. Einkenni sjúklings urðu þó ekki betri.
Næstu mánuði fékk hún reglulegar versnanir á öndunar-færa- og nefholseinkennum. Hún þurfti ítrekað að taka bark-stera- og sýklalyfjakúra til að ná einkennum niður. Hún leitaði ýmist til lungnalæknis á stofu eða til heilsu-gæslunnar þegar hún fékk slæmar versnanir. Blóðrannsóknir sýndu áfram viðvarandi hækkun á rauðkyrningum. Lungnalæknirinn reyndi þá að bæta astmameðferð hennar með montelukast leukotrienhemli, en án árangurs.
Fyrir tilviljun var hún með mikla versnun þegar hún átti tíma hjá HNE-lækni á Landspítala til undirbúnings fyrir FESS-aðgerð. Hún hafði þá talmæði og aukinn hósta með grænum slímuppgangi og surg í lungum. HNE-læknirinn lét framkvæma öndunarmælingu vegna alvarleika einkenna sjúklingsins. Sú mæling sýndi mikla teppu og FEV1 aðeins 32% af áætluðu gildi og súrefnismettun aðeins 84%. Var henni vísað á bráðamóttöku Landspítala og þaðan til innlagnar á lungnadeild.
Nú voru um tvö ár liðin frá því hún fór fyrst að finna fyrir lungnaeinkennum. Blóðrannsóknir sýndu áfram viðvarandi hækkun rauðkyrninga í blóði 1,3 x10E9/L. Tölvusneiðmynd af brjóstholi sýndi vökvafylltar veggþykkar berkjur samhliða litlum íferðafláka neðanvert í hægra lunga og aðlægri fleiðruþykknun, sjá mynd 2. Hún fékk meðferð með súrefni, loftúðum og barksterum.
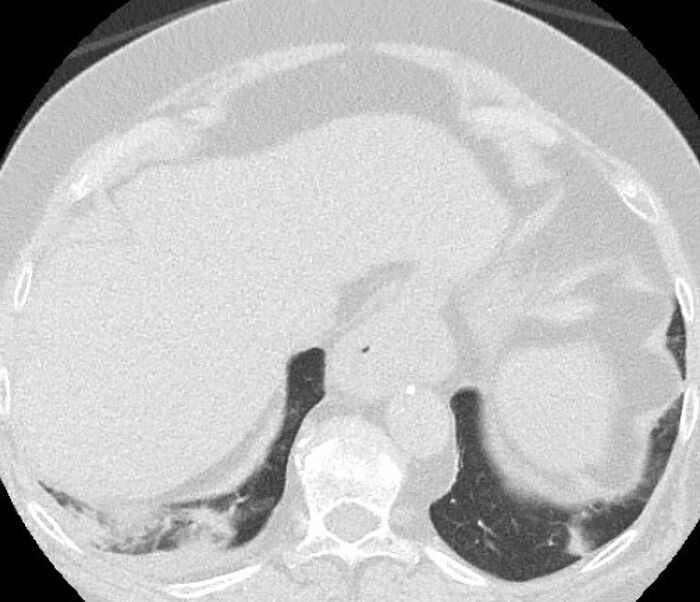
Mynd 2. Tölvusneiðmynd af brjóstholi sjúklings. Á myndinni sést íferð neðanvert í hægra lunganu og þykknun á fleiðru sömu megin.
Ítarlegar blóðrannsóknir voru í kjölfarið pantaðar, þar á meðal mótefni gegn innanfrumusameindum daufkyrninga (ANCA) með tilliti til smáæðabólgusjúkdóms. Niðurstöður ónæmisrannsókna má sjá í töflu II. Hún reyndist vera jákvæð fyrir MPO-ANCA. Þvagstix og kreatínín var innan marka.
Hennar einkenni voru því astmi, hækkun á rauðkyrningum umfram 10% af heildarfjölda hvítkorna, eintaugakvilli, bólgubreytingar í berkjum á tölvusneiðmynd, jákvætt MPO-ANCA og nefsepar samhliða langvarandi ennis- og kinnholubólgum.
Hún var í kjölfarið greind með smáæðabólgu með rauðkyrningafjöld eða það sem áður hét Churg-Strauss-heilkenni. Hún uppfyllti fimm skilmerki fyrir EGPA-greiningu auk jákvæðs MPO-ANCA. Barksterameðferð var haldið áfram og lækkuð niður í þrepum. Vegna alvarleika astmaeinkenna og smáæðabólgu var ákveðið að hefja einnig meðferð með líftæknilyfinu mepolizumab 100 mg á fjögurra vikna fresti, en það er IL-5 hemill. Einkenni hennar urðu fljótt mikið betri og tíðar versnanir á lungnaeinkennum heyrðu nú sögunni til. Ný öndunarmæling sýndi FEV1 76% mánuði eftir innlögn. Eftir að mepolizumab-meðferð var hafin var hægt að minnka barkstera enn meira og loks niður í viðhaldsmeðferð 5 mg, rauðkyrningar mældust þá ekki lengur í blóði hennar. Öndunarmælingar héldu áfram að batna næstu mánuði og FeNO (forced exhaled nitric oxide) mælingar sýndu fram á sífellt minnkandi bólgu í berkjum. Fimm ára mepolizumab-meðferð lauk síðastliðið vor en sjúklingur hefur áfram prednisólón 5 mg annan hvern dag í fyrirbyggjandi skyni auk innöndunar-astmalyfja. Engin merki eru um endurkomu sjúkdóms og er konan almennt við góða líðan.
Umræða
EGPA er einn af hinum svokölluðu ANCA-smáæðabólgusjúkdómum. Algengast er að EGPA-sjúklingar séu með MPO-ANCA mælanlegt í blóði. Þó er ANCA einungis jákvætt í 31-50% tilfella EGPA.1-3 Þetta er sjaldgæfur sjúkdómur með algengi á bilinu 11-157 tilfelli á hverja milljón einstaklinga.4,5 Sjúkdómurinn getur komið fram í nánast hvaða líffæri sem er. Meðalaldur sjúklinga við greiningu er um 50 ár. Oft er sjúkdómsmynd EGPA skipt í þrjú mismunandi tímabil en taka skal fram að ekki allir sjúklingar ganga í gegnum afmörkuð tímabil einkenna. Fyrsta tímabilið einkennist oft af ósértækum einkennum. Algengasta sjúkdómsmyndin í fyrstu er astmi, langvarandi nefrennsli, ofnæmiseinkenni og kinnholubólgur. Algengt er að þetta tímabil komi fram hjá fólki á þrítugs- eða fertugsaldri. Næsta stig sjúkdómsins einkennist af áberandi hækkun á rauðkyrningum í blóði og íferðum í líffæri, oftast í lungu en einnig stundum í hjarta. Slíkt getur valdið bæði hjartsláttaróreglu og hjartabilun og leiðir að lokum til fjölkerfabólgusjúkdóms.6 Þriðja stig sjúkdómsins einkennist svo af æðabólgu líkt og mynd 3 sýnir.7
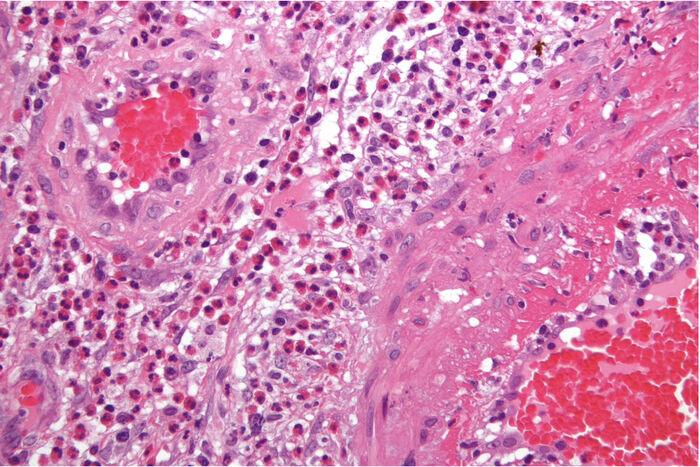
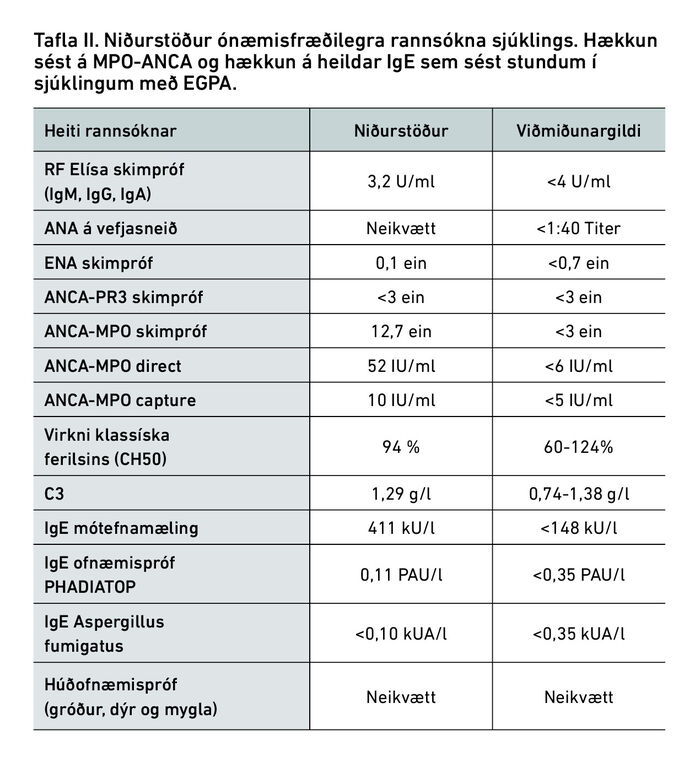
Mynd 3. Smásjármynd af EGPA-æðabólgu. H&E litað vefjasýni í smásjá. Á myndinni sjást ótal rauðkyrningar bæði umhverfis æðarnar og inni í æðaveggnum. Mynd sótt með leyfi frá Wikipedia, Churg-Strauss syndrome (13. apríl 2023), commons.wikimedia.org/wiki/File:Churg-Strauss_syndrome_-_high_mag.jpg
Þá getur komið fram gauklabólga vegna EGPA, en það er alvarleg sjúkdómsmynd sem þarf að skima fyrir reglulega hjá öllum sjúklingum. Segamyndun í lungum getur einnig sést sem fylgikvilli EGPA ásamt einkennum frá húð og taugakerfi. Útlæg taugabólga er algengasta taugaeinkenni EGPA.7
Rauðkyrningar eru mikilvægur þáttur meinmyndar. Þeir geta gefið frá sér frumudrepandi prótein sem ýta undir vefjaskaða sem getur hlotist af sjúkdómnum. En meinvirkni EGPA skýrist af flóknu samspili rauðkyrninga, daufkyrninga, T- og B-eitilfrumna. EGPA leiðir af sér T2-miðlaða bólgu er kemur af stað seytingu frumuboðefna rauðkyrninga IL-4, IL-5, IL-9, IL-13 og IL-25. Af þeim hefur IL-5 hvað mest áhrif á sérhæfingu og fjölgun rauðkyrninga og er því lyfjaskotmark. Þessu til viðbótar stuðla ANCA-mótefni að virkjun daufkyrninga sem leiðir til vefjaskaða. Því hefur verið lýst að sjúkdómsmynd geti verið mismunandi eftir því hvort sjúklingur er með ANCA-mótefni eða ekki. Þeir sem eru með ANCA-mótefni eru líklegri til að vera með einkenni frá nýrum og taugum. Aftur á móti eru þeir sem ekki eru með ANCA-mótefni líklegri til að fá hjartavöðvabólgu út frá EGPA.8
Greiningarskilmerki bandarísku gigtarlæknasamtakanna fyrir EGPA frá árinu 1990 gera ráð fyrir að sjúklingar uppfylli að minnsta kosti fjögur af eftirfarandi sex skilyrðum. Næmi þessara greiningarskilmerkja, þegar að minnsta kosti fjögur þeirra eru uppfyllt, er 85% en sértækið er 99,7%.9
1. Saga um astma
2. Fjöldi rauðkyrninga sé meiri en 10% af heildarfjölda
hvítkorna í blóði, eða yfir 1,5 x10E9/L
3. Ein- eða fjöltaugakvilli
4. Breytilegar bólgubreytingar og/eða þéttingar í lungum
á myndrannsóknum
5. Ennis- og kinnholubólgubreytingar
6. Rauðkyrningar sem sjást utan æða á vefjasýni
Í þessu tilfelli uppfyllti sjúklingur fimm af þessum skilyrðum, það er astmi, hækkun rauðkyrninga, eintaugakvilli, breytilegar bólgubreytingar á tölvusneiðmynd af lungum og langvarandi ennis- og kinnholubólgur. Ásamt því hafði sjúklingur jákvætt MPO-ANCA, sem styður greininguna.
Orsakir EGPA eru ekki þekktar en erfða- og umhverfisþættir, svo sem Aspergillus í umhverfi og jafnvel lyf geta átt þátt í sjúkdómnum. T2-bólga er áberandi í meingerðinni, einkum í fjölgun rauðkyrninga, en B-frumur taka einnig þátt í bólgusvöruninni. Einnig getur hækkun á IgE verið þáttur í sjúkdómsmyndinni.7 Útlit EGPA á tölvusneiðmynd af lungum getur verið afar breytilegt en stundum sjást íferðarflákar og berkjuveggsþykknanir líkt og mynd 4 sýnir.
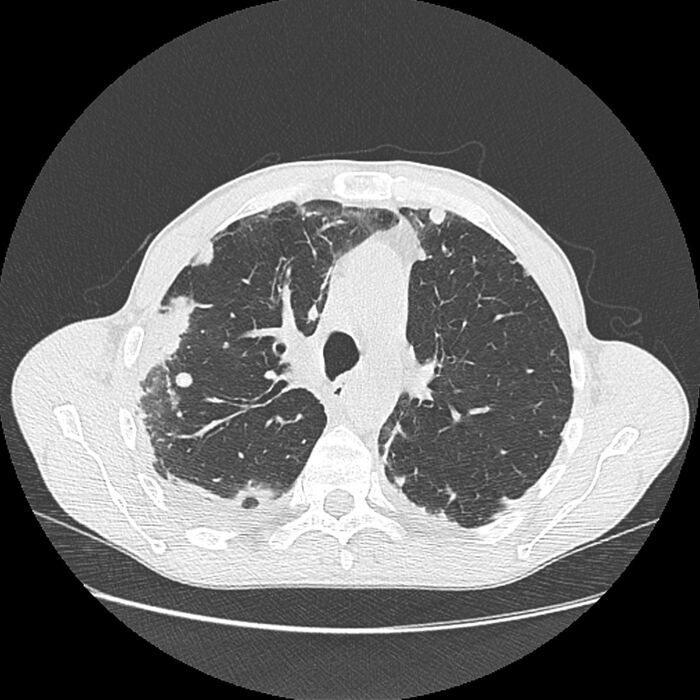
Mynd 4. Tölvusneiðmynd af brjóstholi sjúklings með EGPA. Á myndinni sjást íferðir í lungum og fleiðruvökvi og veggþykknun á berkjum. Case courtesy of Fabien Ho, Radiopaedia.org, rID: 63621
Mismunagreiningar við hækkun rauðkyrninga í blóði eru fjölmargar enda er hækkun rauðkyrninga í blóði ekki sértækt fyrir EGPA. Mikilvægt er að aðrir sjúkdómar sem valda rauðkyrningahækkun og geta að hluta til líkst EGPA séu útilokaðir við nýgreiningu á EGPA. Þar má nefna ýmsa sjúkdóma, svo sem ofnæmissvörun könnusvepps í berkjum og lungum (allergic bronchopulmonary aspergillosis), aspirín-miðlaður öndunar-færasjúkdómur (aspirin-exacerbated respiratory disease), rauðkyrningalungnabólgur, heilkenni hækkaðra rauðkyrninga (hypereosinophilic syndrome) og hnúðabólguger með fjölæðabólgu (granulomatosis with polyangiitis, GPA).
Meðferð ANCA-jákvæðra æðabólgna fer mikið eftir alvarleika einkenna og hvaða líffærakerfi hafa birtingarmynd sjúkdómsins. Í alvarlegu formi af EGPA er rítúxímab eða cýklófosfamíð gefið, en í minna alvarlegu formi má nota önnur ónæmisbælandi lyf. Mótefni gegn hvítfrumuboða 5 (interleukin 5) eru nýlega komin í meðferðarleiðbeiningar bandarísku og evrópsku gigtlæknasamtakanna og árangurinn gegn birtingarmyndum í efri og neðri loftvegum lofar góðu. Metótrexat, azatíóprín og mýkófenólat mófetíl hafa lengi verið notuð en vísindalegur grunnur fyrir þeirri lyfjameðferð er veikur og því eru lyf eins og mepolizumab ásamt barksterum nú orðin fyrstu línu meðferð. Mepolizumab hefur einnig reynst vel til að viðhalda sjúkdómshléi sjúklinga með EGPA og hefur einnig minnkað þörf þeirra fyrir barkstera. Mælt er með mepolizumab sem viðhaldsmeðferð með barksterameðferð ef viðhaldsþörf fyrir barkstera er lág (<7,5 mg).10
Einnig er mepolizumab gagnlegt til að halda niðri astmaeinkennum ásamt innöndunarastmalyfjum.
Þetta er fyrsti sjúklingurinn sem hefur fengið meðferð með líftæknilyfinu mepolizumab vegna EGPA á Íslandi svo vitað sé. Meðferðin hefur staðið í tæp sex ár og ekki hefur borið á alvarlegum versnunum á þessum tíma eða aukaverkunum. Auk þess hefur hún fengið prednisólon ásamt innöndunarlyfj-um vegna astma. Helsti kosturinn við notkun mepolizumab í stað hefðbundinnar eldri meðferðar er að meðferðin hefur minni aukaverkanir.11 Einnig getur sjúklingurinn gefið sér lyfið undir húð heima með lyfjapenna. Ekki liggja fyrir nákvæmar ráðleggingar um hve lengi þarf að meðhöndla sjúklinga með EGPA. Reynt er að miða við alvarleika sjúkdómsins en oftast er meðhöndlað í að minnsta kosti sex til átta ár. Þegar meðferð er hætt getur sjúkdómurinn þó komið fram að nýju. Enginn einn bólguþáttur í blóði getur mælt sjúkdómsvirkni EGPA eða spáð með vissu fyrir um versnanir. Mælt er með að fylgja eftir fjölda rauðkyrninga í blóði, CRP og MPO-ANCA hjá jákvæðum einstaklingum. Endurkoma MPO-ANCA jákvæðni í blóði getur bent til sjúkdómsversnunar en versnun getur einnig komið án þess að hækkunar á rauðkyrningum eða MPO-ANCA verði vart. Mikilvægt er einnig að fylgjast vel með klínískum einkennum einstaklinga með EGPA með reglubundnum skoðunum, blóð- og þvagrannsóknum ásamt öndunarmælingum með mælingu á fráblæstri (spirometry) og nituroxíði (FeNO) í útöndunarlofti sem gefur gagnlegar vísbendingar um loftvegabólgu.
Mikilvægt er að hafa EGPA í huga ef rauðkyrningar eru háir í blóði og sjúkdómsmyndin er í fleiri en einu líffærakerfi eins og í þessu tilfelli og einnig ef almenn einkenni eru til staðar eins og slappleiki, lystarleysi, þyngdartap eða vöðvaverkir án þekktra orsaka.
Heimildir
| 1. Prevalence and clinical significance of antineutrophil cytoplasmic antibodies in Churg-Strauss syndrome. /onlinelibrary.wiley.com/ - október 2023. | ||||
| 2. Comarmond C, Pagnoux C, Khellaf M, et al. Eosinophilic granulomatosis with polyangiitis (Churg-Strauss): Clinical characteristics and long-term followup of the 383 patients enrolled in the French Vasculitis Study Group cohort. Arthritis Rheum 2013; 65: 270-81. https://doi.org/10.1002/art.37721 PMid:23044708 |
||||
| 3. Sada KE, Amano K, Uehara R, et al. A nationwide survey on the epidemiology and clinical features of eosinophilic granulomatosis with polyangiitis (Churg-Strauss) in Japan. Mod Rheumatol 2014; 24: 640-4. https://doi.org/10.3109/14397595.2013.857582 PMid:24289197 |
||||
| 4. Mohammad AJ. An update on the epidemiology of ANCA-associated vasculitis. Rheumatology 2020; 59 (Supplement_3): iii42-50. https://doi.org/10.1093/rheumatology/keaa089 PMid:32348522 |
||||
| 5. Chung SA, Langford CA, Maz M, et al. 2021 American College of Rheumatology/Vasculitis Foundation Guideline for the Management of Antineutrophil Cytoplasmic Antibody-Associated Vasculitis. Arthritis Rheumatol 2021; 73: 1366-83. https://doi.org/10.1002/art.41773 https://doi.org/10.1002/art.41776 |
||||
| 6. Fijolek J, Radzikowska E. Eosinophilic granulomatosis with polyangiitis - Advances in pathogenesis, diagnosis, and treatment. Front Med 2023; 10. https://doi.org/10.3389/fmed.2023.1145257 PMid:37215720 PMCid:PMC10193253 |
||||
| 7. White J, Dubey S. Eosinophilic granulomatosis with polyangiitis: A review. Autoimmun Rev 2023; 22: 103219. https://doi.org/10.1016/j.autrev.2022.103219 PMid:36283646 |
||||
| 8. Sablé-Fourtassou R, Cohen P, Mahr A, et al. Antineutrophil Cytoplasmic Antibodies and the Churg-Strauss Syndrome. Ann Intern Med 2005; 143: 632-8. https://doi.org/10.7326/0003-4819-143-9-200511010-00006 PMid:16263885 |
||||
| 9. Gioffredi A, Maritati F, Oliva E, et al. Eosinophilic granulomatosis with polyangiitis: an overview. Front Immunol 2014; 5: 549. https://doi.org/10.3389/fimmu.2014.00549 PMid:25404930 PMCid:PMC4217511 |
||||
| 10. Emmi G, Bettiol A, Gelain E, et al. Evidence-Based Guideline for the diagnosis and management of eosinophilic granulomatosis with polyangiitis. Nat Rev Rheumatol 2023; 19: 378-93. https://doi.org/10.1038/s41584-023-00958-w PMid:37161084 |
||||
| 11. Bettiol A, Urban ML, Dagna L, et al. Mepolizumab for Eosinophilic Granulomatosis With Polyangiitis: A European Multicenter Observational Study. Arthritis Rheumatol Hoboken NJ 2022; 74: 295-306. https://doi.org/10.1002/art.41943 PMid:34347947 PMCid:PMC9305132 |
||||