07/08. tbl. 106. árg. 2020
Fræðigrein
Afdrif þeirra sem gengist hafa undir æxlisminnkandi skurðaðgerð og hitaða lyfjameðferð innan lífhimnu
doi 10.17992/lbl.2020.0708.590
ÁGRIP
INNGANGUR
Krabbameinager í kviðarholi er oft afleiðing krabbameins í ristli eða endaþarmi og er illlæknanlegt ástand. Lifun sjúklinga með krabbameinager hefur að meðaltali verið undir tveimur árum eftir kerfislæga krabbameinslyfjameðferð með eða án skurðaðgerðar. Einn meðferðarmöguleikinn felst í æxlisminnkandi skurðmeðferð og lyfjameðferð innan kviðarhols og hefur verið sýnt fram á að þessi meðferð getur bætt horfur valinna sjúklinga. Tilgangur þessarar rannsóknar var að kanna afdrif sjúklinga sem farið hafa frá Íslandi í þessa meðferð erlendis.
EFNIVIÐUR OG AÐFERÐIR
Afturskyggn rannsókn á öllum íslenskum sjúklingum sem gengust undir CRS-HIPEC-aðgerð erlendis á árunum 2008-2017. Upplýsingum var safnað frá Siglinganefnd Sjúkratrygginga Íslands og úr sjúkraskýrslum Landspítala.
NIÐURSTÖÐUR
Alls hafa 11 einstaklingar gengist undir CRS-HIPEC-meðferð eftir upphaflega meðferð á Landspítala. Allar aðgerðirnar voru framkvæmdar í Bandaríkjunum af sama skurðlækni. Hópurinn telur 10 konur og einn karl og var meðalaldur 53 ár. Orsök krabbameinagers var illkynja mein í botnlanga hjá 7 sjúklingum (67%) og illkynja mein í ristli hjá þremur sjúklingum (27%). Einn sjúklingur var með illkynja frummein í lífhimnu, iðraþekjuæxli. Þrír sjúklingar (27%) fengu fylgikvilla innan 30 daga frá aðgerð, tveir fengu sýkingu og einn garnatengingarleka. Einn sjúklingur fékk síðkominn fylgikvilla í formi þrenginga í görn og síðar fistilmyndunar. Fimm sjúklingar hafa lokið 5 ára eftirfylgd án endurkomu sjúkdóms en meðaltími eftirfylgdar eru 44 mánuðir. Af 11 sjúklingum eru 10 enn á lífi. Fimm manns hafa greinst með endurkomu krabbameins.
ÁLYKTANIR
Íslenskum sjúklingum sem gengist hafa undir CRS-HIPEC-aðgerð hefur í flestum tilvikum vegnað vel og lifun er sambærileg við erlendar rannsóknarniðurstöður. Helmingur sjúklinganna sem enn eru á lífi hafa lokið 5 ára eftirfylgd án endurkomu sjúkdóms. Horfur eru talsvert betri en þær voru áður en til þessarar meðferðar kom og því er full ástæða til að halda áfram að senda valda íslenska sjúklinga erlendis í þessa meðferð.
Greinin barst til blaðsins 30. september 2019, samþykkt til birtingar 4. júní 2020.
Inngangur
Ristil- og endaþarmskrabbamein er þriðja algengasta krabbamein heimsins og er krabbager í lífhimnu (peritoneal carcinomatosis) ein alvarlegasta birtingarmynd þess. Nýgengi er óljóst vegna þess hve illa myndgreining nemur krabbager í lífhimnu.1,2 Í 5-10% aðgerða í læknandi tilgangi við ristil- og endaþarmskrabbameinum reynist sjúklingurinn með meinvörp í lífhimnu og um 4-19% sjúklinga greinast með slík meinvörp við eftirfylgd eftir aðgerð.3,4 Hefðbundin meðferð samanstendur af krabbameinslyfjameðferð með eða án skurðaðgerðar. Lifun hefur að meðaltali verið um 5-7 mánuðir frá greiningu án meðferðar en með nýrri krabbameinslyfjum hefur verið sýnt fram á lifun allt að 23,9 mánuðum, eða 13% 5 ára heildarlifun.4-9
Æxlisminnkandi skurðaðgerð með hitaðri lyfjameðferð innan lífhimnu (cytoreductive surgery with hyperthermic intraperitoneal chemotherapy, CRS-HIPEC) var lýst af skurðlækninum Paul H. Sugarbaker sem meðferðarmöguleika fyrir sjúklinga með krabbager í lífhimnu sem áður höfðu litla von um langtímalifun.10,11 Meðferðin hefur verið í þróun síðastliðna tvo áratugi en krefst mikillar sérfræðiþekkingar og er því aðeins framkvæmd á sérhæfðum stofnunum.12 Talið er að skurðlæknir þurfi að framkvæma 70 slíkar aðgerðir til að ná ásættanlegri færni og að á hverri stofnun þurfi 140-220 aðgerðir að fara fram áður en sérhæfingu er náð.13 Í samantekt sem gerð hefur verið á þeim stofnunum þar sem yfir 500 slíkar meðferðir hafa farið fram, eru að meðaltali framkvæmdar um 50-55 aðgerðir á ári á hverri stofnun. Þar sem ekki er til aðgerðarkóði fyrir þessa meðferð hefur reynst erfitt að birta tölur um nýgengi en áætlað er að um 1500 sjúklingar gangist undir hana í Bandaríkjunum, af þeim 30-40.000 sem greinast með krabbager í lífhimnu á ári.13 Þar sem sjúklingarnir eru fáir er ekki mikið til af framskyggnum, slembiröðuðum rannsóknum. Þeim hefur fjölgað síðastliðin ár en niðurstöður er oft misvísandi.14
Á undanförnum árum hefur CRS-HIPEC-meðferð verið beitt í löndunum í kringum okkur. Rannsóknir hafa sýnt betri sjúkdómsfría lifun meðal valinna sjúklinga þó enn sé umdeilt hvort heildarlifun sé betri.7,15 Meðferðin samanstendur af skurðaðgerð þar sem allur sjáanlegur æxlisvefur er fjarlægður (cytoreductive surgery), lífhimnan fjarlægð að mestu og þau líffæri sem þörf er á. Kviðarholið svo skolað með hitaðri krabbameinslyfjablöndu. Rökin fyrir því eru að hægt er að nota háa skammta af krabbameinslyfjum í kviðarholinu og þegar þau frásogast fara þau fyrst í gegnum lifrina, sem á sama tíma dregur úr eitrunaráhrifum í líkamanum og eykur þéttni lyfjanna í lifrinni. Rannsóknir hafa sýnt að hitun á lyfja-vökva í sírennsli upp í 41-43 gráður á Celcius flýtir fyrir frumudauða. Ein svona aðgerð getur tekið 10-12 klukkustundir. Það fer eftir undirliggjandi sjúkdómi hvaða krabbameinslyf eru notuð en algengust eru oxaliplatín, cisplatín og carboplatín. Meðferðin er því í senn krabbameinsskurðaðgerð og staðbundin krabbameinslyfjameðferð og notuð fyrir sjúklinga með krabbager í lífhimnu af völdum ristil- og endaþarmskrabbameina,7,15 krabbameina í botnlanga og maga,16 krabbameina í eggjastokkum,17 slímhlaupshnúta í lífhimnu (pseudomyxoma peritonei)18,19 og iðraþekjuæxla (peritoneal mesothelioma).20-22
Slík meðferð hefur ekki verið veitt á Íslandi en íslenskir sjúklingar hafa undirgengist hana erlendis frá 2008. Fram til 2017 voru allir nema einn meðhöndlaðir í Bandaríkjunum en undanfarið hafa sjúklingar verið sendir til meðferðar í Svíþjóð.
Í þessari samantekt er farið yfir tilfelli allra Íslendinga sem fengu CRS-HIPEC-meðferð í Bandaríkjunum 2008-2017, ábendingu, hvað fólst í aðgerðinni og afdrif einstaklinganna eftir meðferðina. Tilgangur rannsóknarinnar er að meta hvort ávinningur meðferðarinnar sé réttlætanlegur til að halda áfram að vísa sjúklingum til útlanda í meðferð. Þessar upplýsingar hafa ekki verið teknar saman áður.
Efniviður og aðferðir
Rannsóknin var afturskyggn. Siglinganefnd Sjúkratrygginga Íslands veitti lista yfir sjúklingana. Úr sjúkraskrám fengust upplýsingar um aldur, kyn, fyrra heilsufar, aðgerð fyrir CRS-HIPEC, einkenni við greiningu, ábendingu fyrir HIPEC, undirbúning, lyfjameðferð, myndrannsóknir, að-gerðar-dag og aðgerðarlýsingu, eftirfylgd og afdrif eftir aðgerð. Við upphaf rannsóknarinnar lá fyrir leyfi frá vísindasiðanefnd, nr. 18012. Samantektin var sett upp á tilfellamiðaðan hátt vegna lítils sjúklingahóps. Lifun var reiknuð með aðferð Kaplan-Meier. Lok rannsóknar miðaðist við 31. janúar 2019.
Niðurstöður
Alls fundust 11 sjúklingar. Allar aðgerðirnar voru framkvæmdar í Bandaríkjunum af sama skurðlækni. Á sama tímabili fór einn sjúklingur í aðgerð til Svíþjóðar, sá sjúklingur er ekki með í þessum niðurstöðum. Einn sjúklingur var karl og 10 voru konur, meðalaldur 53 ár (29-67 ára). Orsök krabbagers var kirtilfrumukrabbamein í botnlanga hjá 7 sjúklingum (64%), þar af voru þrír með slímmyndandi kirtilfrumukrabbamein. Þrír (27%) voru með kirtilfrumu-ristilkrabbamein og einn (9%) var með frummein í lífhimnu, iðraþekjuæxli (tafla I) .
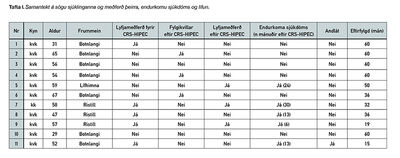 Átta sjúklingar (73%) fóru í aðgerð úti strax að undangenginni meðferð á Íslandi. Sú meðferð var í öllum tilfellum skurðaðgerð, ýmist kviðsjárspeglun til greiningar eða brottnám á ristli/botnlanga. Tveir af þessum 8 fóru í lyfjameðferð fyrir aðgerð úti, þeir voru báðir með óhreinar skurðbrúnir eftir aðgerð á Íslandi. Meðaltíminn frá greiningu að aðgerð úti voru rúmir 4 mánuðir (bil 2-7 mánuðir). Þrír sjúklingar (27%) fóru í aðgerð úti vegna endurkomu sjúkdóms, einn eftir 13 mánuði, annar eftir 36 mánuði og sá þriðji eftir 30 mánuði. Tveir sjúklingar fóru í enduraðgerð eftir fyrri aðgerð úti, einn sem hafði farið strax út og annar sem fór í aðgerð úti vegna endurkomu.
Átta sjúklingar (73%) fóru í aðgerð úti strax að undangenginni meðferð á Íslandi. Sú meðferð var í öllum tilfellum skurðaðgerð, ýmist kviðsjárspeglun til greiningar eða brottnám á ristli/botnlanga. Tveir af þessum 8 fóru í lyfjameðferð fyrir aðgerð úti, þeir voru báðir með óhreinar skurðbrúnir eftir aðgerð á Íslandi. Meðaltíminn frá greiningu að aðgerð úti voru rúmir 4 mánuðir (bil 2-7 mánuðir). Þrír sjúklingar (27%) fóru í aðgerð úti vegna endurkomu sjúkdóms, einn eftir 13 mánuði, annar eftir 36 mánuði og sá þriðji eftir 30 mánuði. Tveir sjúklingar fóru í enduraðgerð eftir fyrri aðgerð úti, einn sem hafði farið strax út og annar sem fór í aðgerð úti vegna endurkomu.
Þrír sjúklingar (27%) fengu fylgikvilla innan 30 daga frá aðgerð úti, tveir sýkingu og einn garnatengingarleka. Einn sjúklingur fékk síðkominn fylgikvilla í formi þrengingar í görn og þurfti nokkrar aðgerðir á Landspítala til að laga það. Af 11 sjúklingum voru 10 á lífi (90%) við lok rannsóknar og er því 5 ára lifun þessa hóps 90%. Fimm hafa greinst með endurkomu meins (45%), að meðaltali 16 mánuðum eftir aðgerð úti (bil 6-30). Þar af eru allir fjórir sjúklingarnir sem voru með frummein annars staðar en í botnlanga. Fimm sjúklingar hafa lokið 5 ára eftirfylgd án endurkomu sjúkdóms. Meðaltími eftirfylgdar eru 44 mánuðir. 5 ára sjúkdómsfrí lifun er um 50%, miðgildi 36 mánuðir.
Umræða
Í ljósi þess hve tæknilega flókin og tímafrek CRS-HIPEC er hefur verið ákveðið að reyna ekki að bjóða upp á þessa meðferð á Íslandi. Ekki aðeins þurfa skurðlæknar mikla þjálfun til að veita meðferðina heldur skortir einnig sérhæfingu á ýmsum öðrum sviðum lækninga og hjúkrunar. Þessa sérhæfingu er illmögulegt að byggja upp með svona fáa sjúklinga.
Á 10 árum fóru einungis 11 sjúklingar í CRS-HIPEC. Sjúklingahópurinn er ólíkur innbyrðis, með mismunandi undirliggjandi sjúkdóma sem orsök fyrir sínu krabbageri, og gerir þetta allan samanburð við aðrar rannsóknir erfiðar. Við treystum okkur ekki til þess að fullyrða af hverju svo margar konur eru í þessum hópi en líkleg skýring er sú að botnlangakrabbamein er algengara í konum og meirihlutinn af sjúklingahópnum (64%) er með upphafsmein í botnlanga og allir þeir sjúklingar eru konur.16 Í upphafi virðist aðalábendingin hafa verið botnlangakrabbamein en sjúklingar með upphafsmein í ristli bæst við síðar, þetta sést þegar horft er á lengd eftirfylgdar.
Sjúklingaval skiptir miklu máli og mikilvægt að taka tillit til fyrra heilsufars og stigs krabbameinsins26,27 Hægt er að notast við lífhimnukrabbameinsstuðul (peritoneal cancer index (PCI)) til að meta sjúkdómsbyrði og horfur. Stuðullinn er reiknaður með því að skipta kviðarholinu í 13 svæði og hvert svæði fær einkunn frá núll og upp í þrjá eftir því hversu mikill æxlisvöxtur er á lífhimnu á því svæði.23 Sýnt hefur verið fram á tengsl á milli PCI-stuðuls og lifunar; en 5 ára lifun er 53% fyrir þá sem hafa PCI <10, en aðeins 12% ef PCI >20 hjá sjúklingum með krabbamein í ristli sem grunnsjúkdóm og er það því talin frábending fyrir CRS-HIPEC-meðferð ef PCI er >20.24-26,28
Í framskyggnri slembirannsókn (prospective randomized controlled trial) frá 2003 voru bornir saman sjúklingahópar með ristilkrabbamein sem grunnmein sem fengu annars vegar hefðbundna krabbameinslyfjameðferð en hins vegar æxlisminnkandi skurðaðgerð og CRS-HIPEC.30 Miðgildi heildarlifunar hjá fyrri hópnum var 12,6 mánuðir en 22,3 mánuðir hjá þeim sem hlutu CRS-HIPEC. Síðustu misseri hefur verið framkvæmd stór fjölsetra slembuð samanburðarrannsókn (PRODIGE-7) þar sem tveir sjúklingahópar með ristilkrabbamein sem grunnmein hafa verið bornir saman; þeir sem aðeins gangast undir æxlisminnkandi skurðaðgerð og þeir sem gangast undir skurðaðgerð auk CRS-HIPEP-meðferðar með oxaliplatin. Niðurstöðurnar benda til að lifun sé fullnægjandi með skurðaðgerðinni einni en CRS-HIPEC breyti lífslíkum ekki umfram það.31 Þessi rannsókn hefur verið gagnrýnd fyrir val á sjúklingum en leyfilegt var að vera með lífhimnukrabbameinsstuðul upp að 25 og sjúklingarnir margir með langt genginn sjúkdóm. Eins og áður segir hefur ekki verið talið skynsamlegt að gera CRS-HIPEC-aðgerð á þeim sem hafa stuðul yfir 20.23,32 Í rannsókninni var miðgildi lifunar 41-42 mánuðir hjá þeim sem undirgengust æxlisminnkandi skurðaðgerð, án CRS-HIPEC-meðferðar eða með henni. Ekki var heldur munur á sjúkdómsfrírri lifun; 13 mánuðir hjá CRSHIPEC-hópnum og 11 mánuðir hjá viðmiðunarhópnum. En lifunartölurnar voru betri í CRS-HIPEC-hópnum ef aðeins voru teknir fyrir sjúklingar sem voru með PCI á milli 11 og 15.23,31
Aðrar minni rannsóknir hafa sýnt heildarlifun sjúklinga 40-51% með miðgildi lifunar allt að 62,7 mánuðum og lifun er marktækt betri ef í skurðaðgerðinni tekst að fjarlægja allan æxlisvef að fullu.7,23,33-35
Þrír af okkar 11 sjúklingum voru með frummein í ristli. Þeir voru allir á lífi í lok rannsóknartímabils en eftirfylgdin stutt, 19-36 mánuðir, en allir komnir með endurkomu sjúkdóms á þeim tíma. Því er erfitt að meta árangur aðgerðarinnar hjá þeim.
Afturskyggn rannsókn frá 2017 tók saman 66 sjúklinga sem gengist höfðu undir CRS-HIPEC-meðferð vegna botnlanga- eða ristilkrabbameins í Kóreu. 12,1% fengu fylgikvilla af gráðu III-IV samkvæmt Clavien-Dindo-flokkuninni innan 30 daga (til dæmis garnatengingarleka, garnastíflu, blæðingu og fleira) og 10,6% fengu fylgikvilla eftir fyrstu 30 dagana frá aðgerð.36 Önnur rannsókn frá 2008 tók til 124 sjúklinga sem höfðu gengist undir meðferðina, flestir vegna ristil- eða botnlangakrabbameins. Af þeim fengu 9 garnatengingarleka, 10 þurftu enduraðgerð og tveir (1,6%) létust innan 30 daga frá aðgerð.37
Í sjúklingahópnum okkar er áberandi hátt hlutfall með frummein í botnlanga, eða 7 af 11 (64%). Í samanburðarrannsóknum eru sjúklingar með ristil- og endaþarmskrabbamein oftast í meirihluta en 5-10% með botnlangakrabbamein.30,36,38,39 Við kunnum ekki góða skýringu á þessu hlutfalli. Kirtilfrumukrabbamein í botnlanga, sérstaklega ef það er slímmyndandi, hagar sér um margt öðruvísi en kirtilfrumukrabbamein í ristli eða endaþarmi. Það er sjaldgæft, er algengara í konum, en kirtilfrumukrabbamein í ristli og endaþarmi er aðeins algengara í körlum. Það dreifir sér frekar innan lífhimnu og árangur af CRS-HIPEC er einna bestur fyrir þessa tegund krabbagers, 5 ára lifun hefur verið lýst frá 50-75%.16,18 Eini sjúklingurinn sem lést á rannsóknartímabilinu var með upphafsmein í botnlanga en hinir 6 voru allir á lífi í lok rannsóknartímabils og höfðu fimm lokið 5 ára eftirliti án endurkomu meins. Við teljum okkur því geta sagt að árangur meðferðar hjá þessum sjúklingum hafi verið góður miðað við aðrar rannsóknir.
Iðraþekjuæxli eru sjaldgæfust af þeim æxlum sem okkar sjúklingar greindust með sem grunnsjúkdóm. Iðraþekjuæxli eru fjölbreyttur flokkur en heilt yfir hefur 5 ára lifun eftir CRS-HIPEC verið lýst í kringum 50%.20 Okkar eini sjúklingur var enn á lífi eftir 50 mánuði en hafði fengið endurkomu sjúkdóms og farið í enduraðgerð.
Æxlisminnkandi skurðaðgerð með HIPEC er stórvægileg aðgerð og ákvörðun um slíka meðferð ætti ekki að taka án þess að taka tillit til áhættunnar sem í henni felst. Árangur íslensku sjúklinganna er með besta móti miðað við sambærilega hópa í öðrum löndum. Þó er ekki ástæða til að taka upp framkvæmd þessarar meðferðar á Landspítala þar sem þörf væri á mun fleiri aðgerðum á hverju ári til að halda uppi þjálfun starfsfólks. Því er betri kostur að halda áfram að senda sjúklinga til annara landa þar sem viðeigandi þjálfun og aðstaða er nú þegar til staðar.
Heimildir
| 1. Klaver Y, Lemmens V, Nienhuijs S, et al. Peritoneal carcinomatosis of colorectal origin: Incidence, prognosis and treatment options. World J Gastroenterol 2012; 18: 5489-94. https://doi.org/10.3748/wjg.v18.i39.5489 PMid:23112540 PMCid:PMC3482634 |
||||
| 2. Koh J, Yan T, Glenn D, et al. Evaluation of preoperative computed tomography in estimating peritoneal cancer index in colorectal peritoneal carcinomatosis. Ann Surg Oncol 2009; 16: 327-33. https://doi.org/10.1245/s10434-008-0234-2 PMid:19050972 |
||||
| 3. Koppe M, Boerman O, Oyen W, et al. Peritoneal carcinomatosis of colorectal origin: incidence and current treatment strategies. Ann Surg 2006; 243: 212-22. https://doi.org/10.1097/01.sla.0000197702.46394.16 PMid:16432354 PMCid:PMC1448921 |
||||
| 4. Jayne D, Fook S, Loi C, et al. Peritoneal carcinomatosis from colorectal cancer. Br J Surg 2002; 89: 1545-50. https://doi.org/10.1046/j.1365-2168.2002.02274.x PMid:12445064 |
||||
| 5. Chu D, Lang N, Thompson C, et al. Peritoneal carcinomatosis in nongynecologic malignancy. A prospective study of prognostic factors. Cancer 1989; 63: 364-7. https://doi.org/10.1002/1097-0142(19890115)63:2<364::AID-CNCR2820630228>3.0.CO;2-V |
||||
| 6. Sadeghi B, Arvieux C, Glehen O, et al. Peritoneal carcinomatosis from non-gynecologic malignancies: results of the EVOCAPE 1 multicentric prospective study. Cancer 2000; 88: 358-63. https://doi.org/10.1002/(SICI)1097-0142(20000115)88:2<358::AID-CNCR16>3.0.CO;2-O |
||||
| 7. Elias D, Lefevre J, Chevalier J, et al. Complete cytoreductive surgery plus intraperitoneal chemohyperthermia with oxaliplatin for peritoneal carcinomatosis of colorectal origin. J Clin Oncol 2009; 27: 681-5. https://doi.org/10.1200/JCO.2008.19.7160 PMid:19103728 |
||||
| 8. Franko J, Shi Q, Goldman C, et al. Treatment of colorectal peritoneal carcinomatosis with systemic chemotherapy: a pooled analysis of north central cancer treatment group phase III trials N9741 and N9841. J Clin Oncol 2012; 30: 263-7. https://doi.org/10.1200/JCO.2011.37.1039 PMid:22162570 PMCid:PMC3269953 |
||||
| 9. Ripley R, Davis J, Kemp C, et al. Prospective Randomized Trial Evaluating Mandatory Second Look Surgery With HIPEC and CRS vs. Standard of Care in Patients at High Risk of Developing Colorectal Peritoneal Metastases. Trials 2010; 11: 62. https://doi.org/10.1186/1745-6215-11-62 PMid:20500867 PMCid:PMC2889988 |
||||
| 10. Sugarbaker P. Patient selection and treatment of peritoneal carcinomatosis from colorectal and appendiceal cancer. World J Surg 1995; 19: 235-40. https://doi.org/10.1007/BF00308632 PMid:7754629 |
||||
| 11. Sugarbaker P. Peritonectomy procedures. Ann Surg 1995; 221: 29-42. https://doi.org/10.1097/00000658-199501000-00004 PMid:7826158 PMCid:PMC1234492 |
||||
| 12. Turaga K, Levine E, Barone R, et al. Consensus Guidelines from the American Society of Peritoneal Surface Malignancies on Standardizing the Delivery of Hyperthermic Intraperitoneal Chemotherapy (HIPEC) in Colorectal Cancer Patients in the United States. Ann Surg Oncol 2014; 21: 1501-5. https://doi.org/10.1245/s10434-013-3061-z PMid:23793364 |
||||
| 13. Rajeev R, Klooster B, Turaga K. Impact of surgical volume of centers on post-operative outcomes from cytoreductive surgery and hyperthermic intra-peritoneal chemoperfusion. J Gastrointest Oncol 2016; 7: 122-8. | ||||
| 14. Eveno C, Pocard M. Randomized Controlled Trials Evaluating Cytoreductive Surgery (CRS) and Hyperthermic Intraperitoneal Chemotherapy (HIPEC) in Prevention and Therapy of Peritoneal Metastasis: A Systematic Review. Pleura Peritoneaum 2016; 1: 169-82 https://doi.org/10.1515/pp-2016-0027 PMid:30911621 PMCid:PMC6386515 |
||||
| 15. Mirnezami R, Mehta A, Chandrakumaran K, et al. Cytoreductive surgery in combination with hyperthermic intraperitoneal chemotherapy improves survival in patients with colorectal peritoneal metastases compared with systemic chemotherapy alone. Br J Cancer 2014; 11: 1500-8. https://doi.org/10.1038/bjc.2014.419 PMid:25225906 PMCid:PMC4200082 |
||||
| 16. Aziz O, Jaradat I, Chakrabart B, et al. Predicting Survival after Cytoreductive Surgery and Hypterthermic Intraperitoneal Chemotherapy for Appendix Adenocarcinoma. Dis Colon Rectum 2018; 61: 795-802. https://doi.org/10.1097/DCR.0000000000001076 PMid:29771808 |
||||
| 17. Auer RC, Sivajohanathan D , Biagi J, et al. Indications for Hyperthermic Intraperitoneal Chemotherpy with Cytoreductive Surgery: A Systematic Review. Eur J Cancer 2020; 127: 76-95 https://doi.org/10.1016/j.ejca.2019.10.034 PMid:31986452 |
||||
| 18. Chua T, Moran B, Sugarbaker P, et al. Early and long-term outcome data on 2298 patients with pseudomyxoma peritonei of appendiceal origin treated by a strategy of cytoreductive surgery and hyperthermic intraperitoneal chemotherapy. J Clin Oncol 2012; 30: 2449-56. https://doi.org/10.1200/jco.2012.30.4_suppl.532 https://doi.org/10.1200/JCO.2011.39.7166 PMid:22614976 |
||||
| 19. Elias D, Gilly F, Quenet F, et al. Pseudomyxoma peritonei: A French multicentric study of 301 patients treated with cytoreductive surgery and intraperitoneal chemotherapy. Eur J Surg Oncol 2010; 36: 456-62. https://doi.org/10.1016/j.ejso.2010.01.006 PMid:20227231 |
||||
| 20. Yan T, Deraco M, Baratti D, et al. Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy for malignant peritoneal mesothelioma: multi-institutional experience. J Clin Oncol 2009; 27: 6237-42. https://doi.org/10.1200/JCO.2009.23.9640 PMid:19917862 |
||||
| 21. Sugarbaker P. Surgical treatment of peritoneal carcinomatosis: 1988 Du Pont lecture. Can J Surg 1989; 32: 164-70. | ||||
| 22. Deraco M, Glehen O, Helm C, et al. Cytoreductive surgery & perioperative chemotherapy for peritoneal surface malignancy. 1. útg. Sugarbaker P, ritstjóri. Cine-Med Publishing, Inc 2012. | ||||
| 23. Eveno C, Pocard M. Randomized controlled trials evaluating cytoreductive surgery (CRS) and hyperthermic intraperitoneal chemotherapy (HIPEC) in prevention and therapy of peritoneal metastasis: a systematic review. Pleura Peritoneum 2016; 1: 169-82. https://doi.org/10.1515/pp-2016-0027 PMid:30911621 PMCid:PMC6386515 |
||||
| 24. Van der Speeten K, Lemoine L, Sugarbaker P. Overview of the optimal perioperative intraperitoneal chemotherapy regimens used in current clinical practice. Pleura Peritoneum 2017; 2: 63-72. https://doi.org/10.1515/pp-2017-0003 PMid:30911634 PMCid:PMC6405035 |
||||
| 25. Pinto A, Pocard M. Hyperthermic intraperitoneal chemotherapy with cisplatin and mitomycin C for colorectal cancer peritoneal metastases: A systematic review of the literature. Pleura Peritoneum 2019; 4: 20190006. https://doi.org/10.1515/pp-2019-0006 PMid:31388562 PMCid:PMC6668656 |
||||
| 26. Sánchez-Hidalgo J, Rodríguez-Ortiz L, Arjona-Sánchez Á, et al. Colorectal peritoneal metastases: Optimal management review. World J Gastroenterol 2019; 25: 3484-502. https://doi.org/10.3748/wjg.v25.i27.3484 PMid:31367152 PMCid:PMC6658395 |
||||
| 27. Klaver C, Groenen H, Morton D, et al. Research committee of the European Society of Coloproctology. Recommendations and consensus on the treatment of peritoneal metastases of colorectal origin: A systematic review of national and international guidelines. Color Dis 2017; 19: 224-36. https://doi.org/10.1111/codi.13593 PMid:28008728 |
||||
| 28. Faron M, Macovei R, Goéré D, et al. Linear relationship of peritoneal cancer index and survival in patients with peritoneal metastases from colorectal cancer. Ann Surg Oncol 2016; 23: 114-9. https://doi.org/10.1245/s10434-015-4627-8 PMid:26014158 |
||||
| 29. Elias D, Gilly F, Boutitie F, et al. Peritoneal colorectal carcinomatosis treated with surgery and perioperative intraperitoneal chemotherapy: Retrospective analysis of 523 patients from a multicentric French study. J Clin Oncol 2010; 28: 63-8. https://doi.org/10.1200/JCO.2009.23.9285 PMid:19917863 |
||||
| 30. Verwaal V. Randomized trial of cytoreduction and hyperthermic intraperitoneal chemotherapy versus systemic chemotherapy and palliative surgery in patients with peritoneal carcinomatosis of colorectal cancer. J Clin Oncol 2003; 21: 3737-43. PMid:14551293 |
||||
| 31. Quenet F, Élias D, Roca L, et al. A UNICANCER phase III trial of hyperthermic intraperitoneal chemotherapy (HIPEC) for colorectal peritoneal carcinomatosis (PC): PRODIGE 7. J Clin Oncol 2018; 36(18): suppl. |
||||
| 32. Sugarbaker P. Intraperitoneal chemotherapy and cytoreductive surgery for the prevention and treatment of peritoneal carcinomatosis and sarcomatosis. Semin Surg Oncol 1998; 14: 254-61. https://doi.org/10.1002/(SICI)1098-2388(199804/05)14:3<254::AID-SSU10>3.0.CO;2-U |
||||
| 33. Waite K, Youssef H. The role of neoadjuvant and adjuvant systemic chemotherapy with cytoreductive surgery and heated intraperitoneal chemotherapy for colorectal peritoneal metastases: A systematic review. Ann Surg Oncol 2017; 24: 705-20. https://doi.org/10.1245/s10434-016-5712-3 PMid:28058545 |
||||
| 34. Elias D, Raynard B, Farkhondeh F, et al. Peritoneal carcinomatosis of colorectal origin. Gastroenterol Clin Biol 2006; 30: 1200-4. |
||||
| 35. Verwaal V, van Ruth S, Witkamp A, et al. F. Long-term survival of peritoneal carcinomatosis of colorectal origin. Ann Surg Oncol 2005; 12: 65-71. https://doi.org/10.1007/s10434-004-1167-z PMid:15827780 |
||||
| 36. Park E, Baik S, Hur H, et al. Cytoreductive surgery with hyperthermic intraperitoneal chemotherapy for appendiceal and colorectal cancer with peritoneal carcinomatosis: Clinical outcomes at 2 tertiary referral centers in Korea. Med 2017; 96: e6632. https://doi.org/10.1097/MD.0000000000006632 PMid:28538365 PMCid:PMC5457845 |
||||
| 37. Gusani N, Cho S, Colovos C, et al. Aggressive surgical management of peritoneal carcinomatosis with low mortality in a high-volume tertiary cancer center. Ann Surg Oncol 2008; 15: 754-63. https://doi.org/10.1245/s10434-007-9701-4 PMid:18080166 |
||||
| 38. Verwaal V. 8-year follow-up of randomized trial: cytoreduction and hyperthermic intraperitoneal chemotherapy versus systemic chemotherapy in patients with peritoneal carcinomatosis of colorectal cancer. Ann Surg Oncol 2008; 15: 2426-32. https://doi.org/10.1245/s10434-008-9966-2 PMid:18521686 |
||||
| 39. Elias D, Delperro J, Sideris L, et al. Treatment of peritoneal carcinomatosis from colorectal cancer: impact of complete cytoreductive surgery and difficulties in conducting randomized trials. Ann Surg Oncol 2004; 11: 518-21. https://doi.org/10.1245/ASO.2004.09.008 PMid:15123461 |
||||