02. tbl. 110. árg. 2024
Fræðigrein
Rannsókn. Aðgerðartengt hjartadrep við kransæðahjá-veituaðgerðir á Íslandi: Tíðni og áhrif á horfur sjúklinga
Ágrip
INNGANGUR
Hjartadrep í tengslum við kransæðahjáveituaðgerð getur verið alvarlegur fylgikvilli og hefur ekki verið rannsakaður ítarlega á Íslandi. Markmið rannsóknarinnar var að kanna tíðni hjartadreps og áhrif þess á 30 daga dánartíðni og langtímalifun sjúklinga eftir kransæðahjáveitu hérlendis.
EFNIVIÐUR OG AÐFERÐIR
Afturskyggn rannsókn á 1446 kransæðahjáveitusjúklingum á Landspítala árin 2002-2018 sem ekki höfðu fengið hjartadrep fyrir aðgerð. Hjartadrep var skilgreint sem tíföld hækkun á efri viðmiðunarmörkum CK-MB, ásamt nýtilkomnum Q-bylgjum og/eða vinstra greinrofi á hjartariti, eða þar sem myndrannsóknir af hjarta sýndu nýtilkomið hjartadrep. Sjúklingar með hjartadrep voru bornir saman við viðmiðunarhóp með ein- og fjölþáttagreiningu og langtíma- og MACCE-frí lifun áætluð með Kaplan-Meier-gröfum. Forspárþættir lifunar voru metnir með Cox-lifunargreiningu og tvíkosta aðhvarfsgreining notuð til að meta forspárgildi 30 daga dánartíðni. Meðal eftirfylgdartími var 8,3 ár.
NIÐURSTÖÐUR
Alls fengu 78 (5,4%) sjúklingar hjartadrep (bil: 0-15,5%) og lækkaði tíðnin marktækt, eða um 12,7% á ári (p<0,001). Á sama tíma jókst notkun asetýlsalisýlsýru fram að aðgerð, þó ekki línulega en að meðaltali um 22,3% á ári, (p<0,018). Tíðni snemmkominna fylgikvilla var mun hærri í hjartadrepshópi og sömuleiðis 30 daga dánartíðni, sem var 11,5% en 0,4% fyrir viðmið, (p<0,001). Hjartadrep reyndist sjálfstæður forspárþáttur 30 daga dánartíðni (GH 15,44, 95% ÖB: 6,89-34,57) og þeir sjúklingar með lakari 5 ára MACCE-fría lifun (69,2% á móti 84,7%, p=0,01), en langtímalifun þeirra reyndist hins vegar áþekk og hjá sjúklingum án hjartadreps.
ÁLYKTANIR
Sjúklingar sem fá hjartadrep við kransæðahjáveituaðgerð hafa hærri tíðni snemmkominna fylgikvilla og umtalsvert hærri 30 daga dánartíðni. Langtímalifun þeirra sem lifa fyrstu 30 dagana eftir aðgerð virðist þó svipuð og hjá sjúklingum sem ekki fá hjartadrep og áhrif hjartadreps á lifun því mest á fyrstu vikum eftir aðgerðina.
Greinin barst til blaðsins 28. maí 2023, samþykkt til birtingar 9. janúar 2024.
Inngangur
Kransæðahjáveita er önnur af tveimur algengustu opnu hjartaskurðaðgerðunum sem framkvæmdar eru á Íslandi.1 Hefur árangur hennar töluvert verið rannsakaður hér á landi og virðist sem tíðni flestra alvarlegra fylgikvilla, eins og bráðs nýrnaskaða, miðmætisbólgu og heilaáfalls, sé sambærileg og í erlendum rannsóknum.1-4 Hjartadrep í eða eftir kransæðahjáveituaðgerð (perioperative myocardial infarction, PMI) hefur hins vegar verið minna rannsakað, bæði hér á landi og erlendis. Hjartadrep í tengslum við hjáveituaðgerð greinist oftast á fyrstu þremur sólarhringum eftir aðgerð en getur einnig greinst í aðgerðinni sjálfri, til dæmis ef loft eða kalkskella berst út í kransæð.5 Stórt hjartadrep getur valdið hjartabilun og losti en vægari blóðþurrð er algengari þar sem klínísk greining getur verið snúin, ekki síst þar sem sjúklingar eiga erfitt með að aðgreina hjartaöng frá verkjum sem stafa frá aðgerðarsvæði. Greiningin verður enn flóknari þar sem alltaf verður einhver blóðþurrð í hjartanu við opna hjartaaðgerð, með tilheyrandi hækkunum á hjartavísum.6
Hefð er fyrir því að flokka hjartadrep sem alvarlegan fylgikvilla kransæðahjáveitu,6 enda hafa fjölmargar rannsóknir sýnt fram á umtalsvert hærri 30-daga dánartíðni ef hjartadrep kemur fyrir.6-8 Áhrif þess á langtímalifun eru hins vegar mun minna rannsökuð og niðurstöður rannsókna misvísandi,2 sem meðal annars má rekja til mismunandi skilgreininga hjartadreps eftir rannsóknum.9,10 Þannig hefur allt frá 2-30% tíðni verið lýst7,9,11 en flestar nýrri rannsóknir styðjast gjarnan við tífalda hækkun á hjartavísinum CK-MB og/eða TnT. Í sumum eldri rannsóknum er miðað við hækkun á hlutfalli ensímanna ASAT/ALAT, en þau losna aðallega við lifrarsjúkdóma en ASAT einnig við blóðþurrð í hjarta.7 Ljóst er að hátt næmi næst með því að miða við tífalda hækkun á hjartavísum CK-MB og sérstaklega TnT (100%), en sértæki greiningarinnar er hins vegar mun lægra, sér í lagi fyrir TnT (4,2%).12 Hins vegar má hækka sértækið umtalsvert með því að bæta við skilgreininguna hjartalínuritsbreytingum og/eða myndrannsóknum af hjarta, aðallega hjartaómskoðun.10,13 Í dag styðjast því flestar hjartaskurðdeildir við slíka þrengri skilgreiningu hjartadreps,14 þótt þær hafi ekki enn náð inn í alþjóðlegar leiðbeiningar.
Mest verður hækkunin á hjartavísum ef kransæðagræðlingur lokast skyndilega15 en tæknileg atriði eins og langur tangartími, þar sem blóðrás til hjartans er stöðvuð og/eða hjartað ekki stöðvað nægilega með kalíumlausn (cardioplegia) geta einnig valdið óeðlilega mikilli blóðþurrð í hjartanu og hækkun hjartavísa.16 Aðrir þættir geta einnig komið við sögu, eins og blóðkornaskil (hematocrit) >34%, fyrri saga um hjartadrep og reykingar, sem taldir eru auka líkur á hjartadrepi eftir kransæðahjáveitu.17
Á Landspítala hefur sama skilgreining á hjartadrepi tengdu aðgerð verið notuð við allar hjartaaðgerðir síðustu tvo áratugi,4,18 þar á meðal hjáveituaðgerðir. Engu að síður hefur þessi mikilvægi fylgikvilli ekki verið rannsakaður í sama mæli og aðrir algengir fylgikvillar og áhættuþættir hans hérlendis því ekki þekktir. Einnig skortir rannsóknir á áhrifum þessa fylgikvilla á langtímalifun. Markmið þessarar rannsóknar var því að kortleggja í vel skilgreindu þýði sjúklinga, tíðni og afleiðingar hjartadreps tengt kransæðahjáveitu með áherslu á bæði 30 daga dánartíðni og langtímalifun.
Efniviður og aðferðir
Leyfi
Öll tilskilin leyfi frá vísindasiðanefnd (VSN-10-009-V14), Persónuvernd og framkvæmdastjóra lækninga á Landspítala lágu fyrir áður en rannsókn hófst.
Rannsóknin var afturskyggn ferilrannsókn og byggði á gagnagrunni hjarta- og lungnaskurðdeildar Landspítala, en í honum eru upplýsingar um alla sjúklinga sem gengist hafa undir kransæðahjáveituaðgerð á Íslandi á tímabilinu 1. janúar 2002 til 31. desember 2018. Til að tryggja að öll tilfellli væru tekin með, var einnig leitað í sjúklingabókhaldi Landspítala að aðgerðanúmerum fyrir kransæðahjáveituaðgerð (FNSA00, FNSC10, FNSC20, FNSC30) og aðgerðir þar sem notuð var hjarta- og lungnavél (FZSA00, FZSA10).
Sjúklingar
Á mynd 1 sést hvernig sjúklingar voru valdir inn í rannsóknina. Alls gengust 2059 sjúklingar eldri en 18 ára undir kransæðahjáveitu á árunum 2002 til 2018. Til þess að minnka áhrif tæknilegra þátta og annarra breytileika við framkvæmd aðgerðar voru aðeins skoðaðir sjúklingar sem gengust einungis undir kransæðahjáveituaðgerð (isolated CABG), en ekki aðra hjartaaðgerð samtímis hjáveitunni, svo sem lokuskipti eða viðgerðir.
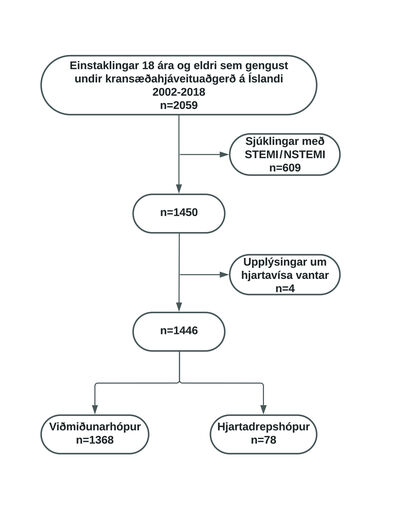 Mynd 1. Flæðirit sem sýnir val sjúklinga í rannsóknina.
Mynd 1. Flæðirit sem sýnir val sjúklinga í rannsóknina.
Sömuleiðis voru útilokaðir 609 sjúklingar sem fyrir aðgerð voru lagðir inn með hjartadrep með eða án ST-hækkana (ST-elevation myocardial infarction/Non-ST-elevation myocardial infarction, STEMI/NSTEMI), þar sem notaður var ICD-kóði í tölvukerfi spítalans (I21.0, I21.1, I21.9 og I21.4). Einnig voru útilokaðir þeir sjúklingar sem höfðu ófullnægjandi upplýsingar um hjartavísa fyrir eða eftir aðgerð (n=4). Eftir eru 1446 sjúklingar sem mynduðu rannsóknarhópinn og var þeim skipt í tvennt og hóparnir bornir saman: annars vegar þeir sem fengu hjartadrep í eða eftir aðgerð (hjartadrepshópur, n=78) og hins vegar viðmiðunarhópur (viðmið, n=1369).
Klínískar breytur
Fyrir hvern og einn sjúkling voru skráðar hátt í 200 breytur í rafræna Excel-skrá og fengust upplýsingar úr sjúkraskrám og aðgerðalýsingum. Þessum breytum hefur áður verið lýst ítarlega í nokkrum vísindagreinum í Læknablaðinu.19,20 Þar koma meðal annars fram lýðfræðilegar upplýsingar um kyn og aldur, líkamsþyngdarstuðull (body mass index, BMI), en áhættuþættir kransæðasjúkdóms einnig skráðir, notkun hjarta- og blóðþynningarlyfja auk fyrri sögu um hjarta- og æðasjúkdóma. Úr aðgerðalýsingum voru skráðar upplýsingar um lengd aðgerðar (skin-to-skin) í mínútum en líka tangar- og vélartími, fjöldi fjaræðatenginga og tegund æðagræðlinga.
Útkomur
Helstu endapunktar voru 30 daga dánartíðni og langtíma heildarlifun (overall survival). Snemmkomnir fylgikvillar voru þeir sem greindust innan 30 daga eftir aðgerð og voru þeir flokkaðir í minniháttar fylgikvilla og alvarlega. Til minniháttar fylgikvilla töldust nýtilkomið gáttatif, fleiðruvökvi sem krafðist aftöppunar, húðsýking í skurðsári yfir bringubeini eða á ganglim, þvagfærasýking og lungnabólga. Til alvarlegra fylgikvilla töldust, auk hjartadreps tengt aðgerð, djúp sýking í bringubeini, bringubeinslos (sternal dehiscence), heilablóðfall, bráður nýrnaskaði, fjöllíffærabilun (multiorgan failure) og enduraðgerð vegna blæðingar. Langtíma fylgikvillar sem tengdust aðgerðinni eða hjarta- og æðakerfinu miðuðust við greiningu eftir 30 daga eftir aðgerð og voru eftirfarandi: heilablóðfall, kransæðastífla, kransæðavíkkun, endur-hjáveituaðgerð og dauði. Þessir þættir voru síðan sameinaðir í einn endapunkt, MACCE (major adverse cardiac and cerebrovascular event).
Skilgreining á hjartadrepi í tengslum við aðgerð
Notuð var skilgreining á hjartadrepi í aðgerð sem notuð hefur verið á Landspítala síðastliðna tvo áratugi, og hefur verið stuðst við í fjölda vísindagreina í Læknablaðinu,4,18 sem og erlendum rannsóknum.10 Skilgreiningin byggir á i) tífaldri hækkun á efri mörkum CK-MB, það er yfir 70 mg/L, ásamt ii) nýtilkomnum sjúklegum Q-bylgjum á hjartariti og/eða vinstra greinrofi, eða iii) ómskoðun eða annarri myndrannsókn af hjarta sem sýndi merki um nýtilkomið hjartadrep. Skráð var síðasta mæling hjartavísa fyrir aðgerð sem og hæsta mæling í legu eftir aðgerð. Mælingar á TnT fyrir og eftir aðgerð lágu ekki alltaf fyrir og árið 2012 var tekin upp ný aðferð til að mæla TnT21 á Landspítala og hún mæld í ng/L en ekki eins og áður í mg/L.22 TnT-mælingar voru því ekki notaðar nema í vafatilfellum þegar hjartalínuritsbreytingar eða myndgreiningu vantaði til stuðnings, en þó litið sérstaklega á alla sjúklinga með tífalda hækkun á TnT (n=1039), það er yfir 140 ng/L, sem miðað er við í Fjórðu alþjóðlegu skilgreiningunni (4UD) á hjartadrepi eftir kransæðahjáveitu.
Tölfræðiúrvinnsla
Tölfræði var unnin í forritinu Rstudio, útgáfu 3.5.2 (R foundation for Statistical Computing, Vín, Austurríki). Flokkabreytum var lýst með fjölda og hlutföllum og hópar bornir saman með kí-kvaðratprófi. Talnabreytum var lýst með meðaltölum og staðalfráviki og hópar bornir saman með t-prófi. Samfelldar breytur sem ekki fylgdu normaldreifingu voru metnar með Mann-Whitney U prófi og lýst með miðgildi og fjórðungsbilum. Árleg breyting á nýgengi hjartadreps og notkun asetýlsalisýlsýru fram að aðgerð var metin með Poisson-aðhvarfsgreiningu og birt sem hlutfall af árlegum aðgerðafjölda. Langtímalifun og MACCE-frí lifun voru áætlaðar með aðferð Kaplan-Meier og bornar saman milli hópa með log-rank prófi. Tvíkosta aðhvarfsgreining (logistic regression) var notuð til að reikna gagnlíkindahlutfall (GH) og 95% öryggisbil (ÖB) fyrir 30 daga dánartíðni. Fylgni breyta við MACCE og langtímalifun var metin með Cox-áhættulíkani og skilyrði líkansins metin með cox.ph og cox.zph skipunum úr Survminer og Survival pökkunum í R. Val á breytum í fjölbreytugreiningu byggðist á marktækum bakgrunnsþáttum úr einbreytugreiningu og innihélt lokamódelið eftirfarandi breytur: aldur, kyn, sykursýki, langvinnur nýrnasjúkdómur, útstreymisbrot undir 35% og aðgerð á sláandi hjarta. Brottfallsgildi í fjölbreytugreiningum voru meðhöndluð með marghliða tilreiknun (multiple imputation) með aðstoð mice pakkans og var gert ráð fyrir slembidreifingu á gagnaeyðum.
Niðurstöður
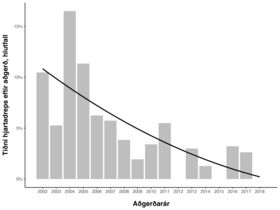
Af 1446 sjúklingum fengu 78 hjartadrep í tengslum við aðgerðina, eða 5,4%. Á mynd 2 sést árleg tíðni hjartadreps, en hún var hæst árið 2004 og lægst árin 2012, 2015 og 2018. Þótt ekki væri línuleg lækkun milli ára var hún marktæk og að meðaltali 12,7% á ári (95% ÖB 10,2-19,5%, p<0,001).
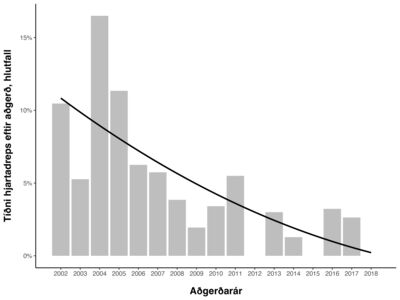 Mynd 2. Tíðni hjartadreps í tengslum við aðgerð frá 2002 til 2018. Árleg lækkun er 12,7% að meðaltali (p<0,001).
Mynd 2. Tíðni hjartadreps í tengslum við aðgerð frá 2002 til 2018. Árleg lækkun er 12,7% að meðaltali (p<0,001).
Tafla I sýnir samanburð á sjúklingum sem greindust með hjartadrep og þá sem ekki fengu slíka greiningu (viðmiðunarhópur). Kynjahlutfall reyndist svipað milli hópanna og sama átti við um aldur og líkamsþyngdarstuðul. Sjúklingar í hjartadrepshópi höfðu hins vegar oftar þriggja æða sjúkdóm og/eða vinstri höfuðstofnsþrengsli (98,7% á móti 67,9%, p=0,006). Einnig var hlutfall sjúklinga í CCS-flokki III/IV hærra í hjartadrepshópnum og þeir því með meiri einkenni (hjartaöng) fyrir aðgerð, (80,8% á móti 64,9%, p=0,006). Hins vegar voru hjartabilunareinkenni samkvæmt NYHA-flokkun svipuð í hópunum.
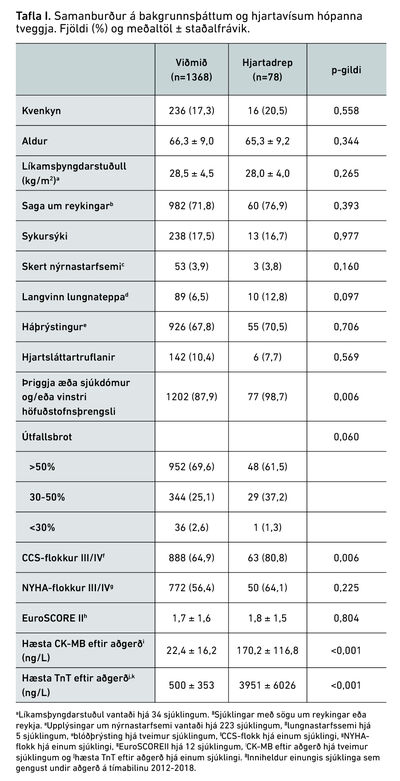
Meðal CK-MB mældist 170,2 mg/L í hjartadrepshópi og 22,4 mg/L hjá viðmiðum, en 34 sjúklingar (2,3%) reyndust með vægt hækkað CK-MB án hjartalínuritsbreytinga og/eða teikna um hjartadrep á myndrannsóknum af hjarta og flokkuðust því með viðmiðum. Hjá öllum sjúklingum í hjartadrepshópi þar sem TnT-mælingar lágu fyrir reyndist það að minnsta kosti tífalt hækkað. Að auki voru 103 sjúklingar (7,1%) með rúmlega tífalda hækkun á TnT (oftast innan við tólffalda hækkun) en CK-MB undir 70 mg/L og engar hjartalínuritsbreytingar eða merki um hjartadrep á myndrannsóknum af hjarta. Þeir voru heldur ekki flokkaðir með hjartadrepshópi og taldir með viðmiðum. Til viðbótar er sýndur sá undirhópur sjúklinga sem uppfyllti skilyrði fyrir tífaldri hækkun á TnT samkvæmt 4UD (n=1093), en lítil fylgni var milli þeirrar skilgreiningar og hækkunar á CK-MB.
Heildartíðni notkunar asetýlsalisýlsýru fram að aðgerð yfir tímabilið var 48,7% en upplýsingar vantaði hjá 78 sjúklingum. Lægst var tíðnin árið 2003, eða 1%, og jókst í 91,1% árið 2018, en þótt hækkunin hafi ekki verið línuleg var aukningin marktæk og að meðaltali 22,3% (95% ÖB 11,8-13,2%, p<0,018).
Samanburður á aðgerðar- og legutengdum þáttum er sýndur í töflu II. Marktækt lægra hlutfall sjúklinga í hjartadrepshópi fékk brjóstholsslagæðargræðling (LIMA), eða 88,5% borið saman við 96,4% fyrir viðmiðunarhóp (p=0,001). Sömuleiðis þurfti marktækt hærra hlutfall sjúklinga í hjartadrepshópi ósæðardælu (intra aortic balloon pump, IABP) í tengslum við aðgerðina, eða 9% borið saman við 1,7% í viðmiðunarhópi (p<0,001). Hins vegar reyndist ekki marktækur munur á tangar- og vélartíma hópanna, og sama átti við um notkun æðahvetjandi lyfja í og eftir aðgerðina. Blæðing í brjóstholskera eftir aðgerð reyndist sambærileg milli hópanna, en hjartadrepshópurinn þurfti þó oftar blóðhlutagjöf í legu. Sömuleiðis tengdist hjartadrep eftir aðgerð marktækt lengri gjörgæslu- og spítalalegu.
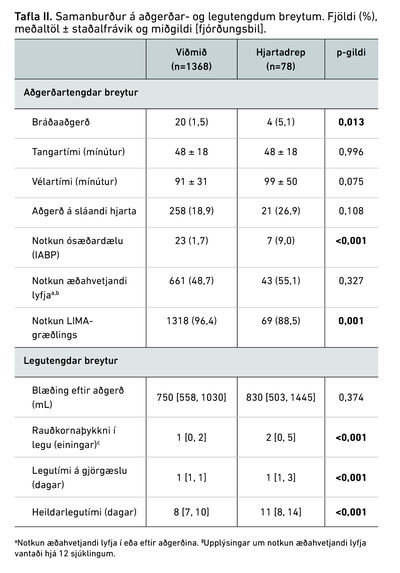
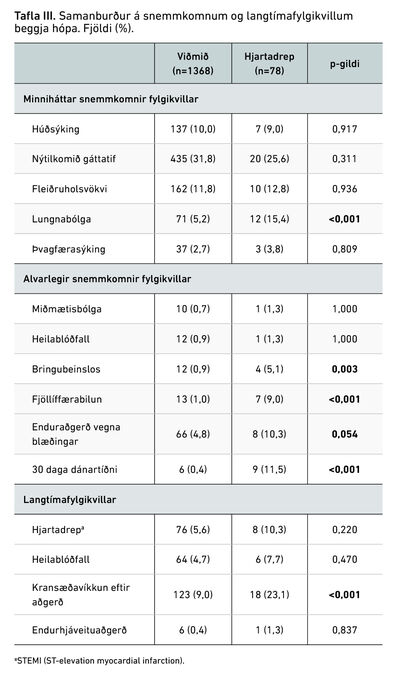
Tafla III sýnir samanburð á snemmkomnum og langtímafylgikvillum í hópunum tveimur. Hvað minniháttar fylgikvilla varðar, sást marktækt hærri tíðni lungnabólgu í hjartadrepshópi og af alvarlegum fylgikvillum (hjartadrep fráskilið) var marktækt hærri tíðni á bringubeinslosi og fjöllíffærabilunum. Hlutfall þeirra sem létust innan 30 daga frá aðgerð var mun hærra í hjartadrepshópi, eða 11,5% (n=9/78) borið saman við 0,4% (n=6/1369) í viðmiðunarhópi (p<0,001). Við samanburð langtímafylgikvilla þurfti 23,1% af sjúklingum í hjartadrepshópi að gangast undir kransæðavíkkun eftir aðgerð borið saman við 9% í viðmiðunarhópi (p<0,001). Sömuleiðis reyndist tíðni MACCE í hjartadrepshópi hærri (14,5% á móti 21,8%) 5 árum eftir aðgerð, (p=0,07), aðallega vegna hærri tíðni kransæðavíkkunar. Tíðni hjartaáfalls, heilablóðfalls og endur-hjáveituaðgerðar reyndist hins vegar sambærileg í hópunum.
Hjartadrep í eða eftir aðgerð reyndist sjálfstæður áhættuþáttur 30 daga dánartíðni, GH 15,44 (95% ÖB: 6,89-34,57, p<0,001), en það sama átti einnig við um útfallsbrot vinstri slegils undir 35%, GH 7,10 (95% ÖB: 3,21-15,70, p<0,001) og aðgerð sem framkvæmd var án hjarta- og lungnavélar, og var GH 2,18 (95% ÖB: 1,07-4,41, p=0,031).
Myndir 3a og 3b sýna samanburð á MACCE-frírri lifun og heildarlifun hópanna. MACCE-frí lifun var marktækt síðri í hjartadrepshópi, en einu ári frá aðgerð var hún 78,2% (95% ÖB: 67,0-88,0%) í hjartadrepshópi en 95,6% (95% ÖB: 95,1-97,9%) í viðmiðunarhópi, og fimm árum eftir aðgerð 69,2% (95% ÖB: 60,1-80,4%) og 84,7% (95% ÖB: 83,0-87,2%) í sömu hópum. Heildarlifun hópanna var sambærileg (log-rank próf, p=0,55), eða 84,6% (95% ÖB: 77,2-93,8%) fimm árum eftir aðgerð í viðmiðunarhópi og 72,6% (95% ÖB: 63,6-84,5%) hjá hjartadrepshópi. Í fjölbreytu-greiningu tengdist hjartadrep í tengslum við aðgerð marktækt hærri líkum á MACCE (HH: 1,36; ÖB: 1,02-1,80) en ekki dauða (HH: 1,35; ÖB: 0,96-1,91) eftir leiðréttingu fyrir öðrum blöndunarþáttum. Í undirhópagreiningu, þar sem útilokaðir voru þeir sjúklingar sem lifðu skemur en sex mánuði frá aðgerð, reyndust langtímaútkomur hópanna tveggja þó sambærilegar eftir leiðréttingu fyrir blöndunarþáttum (MACCE, HH: 1,05; ÖB: 0,73-1,51; heildarlifun, HH: 0,98; ÖB: 0,62-1,52).
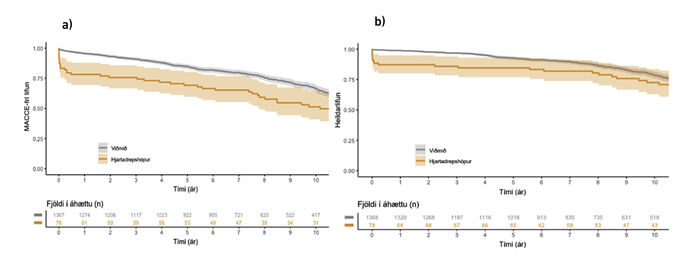 Mynd 3. Langtímaútkomur frá aðgerðardegi eftir tilkomu hjartadreps í aðgerð: a) MACCE-frí lifun beggja hópa. MACCE-frí lifun var marktækt síðri í hjartadrepshópnum. b) Langtímalifun beggja hópa. Lifun var marktækt síðri í hjartadrepshópnum á fyrstu árunum eftir aðgerð.
Mynd 3. Langtímaútkomur frá aðgerðardegi eftir tilkomu hjartadreps í aðgerð: a) MACCE-frí lifun beggja hópa. MACCE-frí lifun var marktækt síðri í hjartadrepshópnum. b) Langtímalifun beggja hópa. Lifun var marktækt síðri í hjartadrepshópnum á fyrstu árunum eftir aðgerð.
Umræða
Þessi afturskyggna rannsókn yfir 16 ára tímabil sýndi að árleg tíðni hjartadreps í tengslum við kransæðahjáveituaðgerð reyndist 5,4% og lækkaði eftir því sem leið á rannsóknartímabilið, eða úr 15,5% þegar það var sem hæst, í 0% þegar það var sem lægst. Enn fremur sást umtalsvert hærri tíðni snemmkominna fylgikvilla meðal hjartadrepssjúklinga, 30 daga dánartíðni þeirra reyndist fimmtánföld og tíðni langtímafylgikvilla sömuleiðis marktækt hærri. Engu að síður reyndist heildarlifun ekki marktækt frábrugðin milli hópanna, sem gefur til kynna að áhrif hjartadreps á lifun séu mest á fyrstu vikum eftir aðgerðina.
Tíðni hjartadreps
Tíðni hjartadreps í þessari rannsókn fellur innan þess ramma sem lýst hefur verið í fjölda sambærilegra rannsókna.7,23 Engu að síður er ljóst, líkt og rakið var í inngangi, að tíðnin er mjög breytileg eftir rannsóknum og skýrir að hluta víða tíðnispönn í eldri rannsóknum, eða frá 2-30%. Ákveðið var að styðjast við þá skilgreiningu sem tíðkast hefur hérlendis í um tveggja áratuga skeið og byggir á tífaldri hækkun CK-MB auk hjartalínurits eða breytinga á ómskoðun eða hjartaþræðingu sem benda til hjartadreps. Sú skilgreining er langt frá því að vera fullkomin og í dag mæla rannsóknir með Fjórðu alþjóðlegu skilgreiningu á hjartadrepi í tengslum við hjáveituaðgerð (4UD), sem svipar sterklega til okkar skilgreiningar að öðru leyti en að hún styðst við hs-TnT sem hjartavísi. Hér á landi var skipt um mæliaðferð á TnT árið 2012 og í sumum tilvikum vantaði TnT-mælingar alveg, sem hefði þýtt mun minna sjúklingaþýði. Ljóst er að enn eru mjög skiptar skoðanir á því hvaða skilgreining hjartadreps er best, enda næmi og sértæki þessara aðferða mismunandi. Þannig eru skilgreiningar mjög mismunandi á milli hjartaskurðdeilda á Norðurlöndunum (munnleg heimild, TG). Ljóst er að CK-MB, sem nær hæsta toppi 24-36 klukkustundum eftir aðgerð, er enn mikið notuð og þykir auðveldara að túlka en TnT sem toppar mun fyrr, eða strax nokkrum klukkustundum eftir aðgerð en helst hátt mun lengur, eða í allt að sex daga.24
Eins og búast mátti við var verulegur munur á meðalgildum bæði CK-MB og TnT hópanna eftir aðgerð, eða að meðaltali um það bil áttfaldur munur. Mun fleiri reyndust hafa tífalda hækkun á TnT, alls 71,8% samanborið við 7,2% með tífalda hækkun á CK-MB, og höfðu þeir jafnframt sjaldnast hækkun á CK-MB. Þetta sýnir hátt næmi TnT til þess að greina hjartadrep í tengslum við aðgerð, mun hærra en fyrir CK-MB, en um leið er sértækið síðra, sérstaklega þegar ekki eru teknar með hjartalínuritsbreytingar. Meðalgildi TnT var aðeins byggt á mælingum frá sjúklingum sem gengust undir aðgerð frá árinu 2012 en þá var ný mælingaraðferð tekin upp á Landspítala. Í heildina voru það 438 sjúklingar og af þeim voru 1,6% með hjartadrep. Í okkar rannsókn var ávallt miðað við tífalda hækkun á CK-MB en aðeins stuðst við hækkanir á TnT í vafatilfellum, þegar hjartalínuritsbreytingar eða myndgreiningu vantaði til stuðnings.
Ekki kom á óvart að tíðni hjartadreps sveiflaðist milli ára en lækkaði þó marktækt eftir því sem leið á rannsóknartímabilið, eða um 13% að meðaltali sem verður að teljast hröð lækkun. Á þessari jákvæðu þróun er ekki einhlít skýring en aukið hlutfall sjúklinga sem tóku asetýlsalisýlsýru fram að aðgerð gæti komið við sögu þótt ekki sé hægt að staðfesta það í afturskyggnri rannsókn sem þessari. Þannig var hlutfall þeirra sem tóku asetýlsalisýlsýru fram að aðgerð aðeins 1% árið 2003 og hækkaði í 91,1% í lok rannsóknartímabilsins árið 2018. Frá árinu 201714 mæla alþjóðlegar leiðbeiningar með því að asetýlsalisýlsýra sé tekin fram að kransæðahjáveituaðgerð, enda talið að það lækki tíðni hjartadreps um rúmlega 20%.25 Ástæðan er talin sú að lyfið dregur úr segamyndun í kransæðagræðlingunum. Magn blæðingar eykst þó eitthvað, eða í kringum 400 ml að meðaltali, en án þess að það leiði til hærri tíðni enduraðgerða vegna blæðinga eða aukinna gjafa rauðkornaþykknis og blóðflagna.26
Áhættuþættir hjartadreps
Bráðaaðgerðir voru tiltölulega sjaldgæfar í báðum hópum enda voru sjúklingar sem lögðust inn með einkenni hjartadreps útilokaðir. Erlendar rannsóknir hafa sýnt að tíðni aðgerðartengds hjartadreps sé mun hærri eftir bráðaaðgerðir,27 líkt og sást í okkar rannsókn, eða 5,1% borið saman við 1,5% (p=0,013).
Sjúklingar sem fengu hjartadrep reyndust oftar vera með þriggja æða sjúkdóm og/eða vinstri höfuðstofnsþrengsli, sem ber saman við niðurstöður erlendra rannsókna.8 Þar hefur tíðnin einnig reynst hærri hjá eldri sjúklingum og þeim með sykursýki og reykingasögu,11 sem ekki tengdist aukinni áhættu í okkar rannsókn. Viðbúið er að sjúklingar með útbreiddan kransæðasjúkdóm séu með hærri tíðni hjartadreps, enda taka aðgerðir þeirra lengri tíma og fleiri kransæðar þrengdar en hjá sjúklingum í viðmiðunarhópi. Erfiðara er að skýra af hverju hærri aldur, sykursýki og reykingar hafi ekki haft meiri áhrif, en hluti skýringarinnar gæti legið í of litlu sjúklingaþýði sem getur þýtt ónógan tölfræðilegan styrk.
Sjúklingar sem fengu hjartadrep í tengslum við aðgerð höfðu verri skammtímalifun en sjúklingar í viðmiðunarhópi. Niðurstöður okkar eru í samræmi við PREVENT IV rannsóknina þar sem áhrif hjartadreps eftir kransæðahjáveituaðgerð voru metin, bæði með tilliti til lifunar og fylgikvilla.23 Ljóst er að hjartadrep getur valdið hjartabilun og þannig haft áhrif á lifun en í öðrum tilfellum eru tengslin við hærri tíðni langtímafylgikvilla og síðri skammtímahorfur óljósari. Þeir gætu haft með lengra genginn hjarta- og æðasjúkdóm að gera, líkt og sást í okkar rannsókn, en einnig gætu tæknileg atriði við æðatengingar skipt máli og aukið hættu á síðkominni kransæðastíflu og dauða, löngu eftir aðgerðina.28
Fylgikvillar og lifun
Sjúklingar sem fengu hjartadrep í tengslum við aðgerð höfðu í stórum dráttum sambærilega tíðni minniháttar fylgikvilla. Hins vegar var þrjátíu daga dánartíðni sjúklinga með hjartadrep umtalsvert aukin, sem endurspeglast einnig í hærri tíðni fjöllíffærabilunar og lengri gjörgæslulegu. Líkur á andláti innan þrjátíu daga voru rúmlega fimmtánfaldar, en svipuðum niðurstöðum hefur verið lýst í fjölda sambærilegra rannsókna erlendis.6,29
Hjartadrep í tengslum við aðgerð tengdist verri MACCE-frírri lifun sem aðallega skýrist af hárri tíðni kransæðavíkkunar eftir aðgerð. Þetta var viðbúið þar sem hjartaþræðingu er stundum beitt við alvarlegu hjartadrepi tengdu aðgerð. Heildarlifun var hins vegar sambærileg í hópunum, en eins og sést á mynd 3b er mikill munur á lifun fyrsta mánuðinn eftir aðgerðina en lifunarkúrfurnar svo samsíða eftir það. Hins vegar voru tengsl hjartadreps við langtímaútkomur ekki marktæk í undirhópagreiningu þeirra sjúklinga sem lifðu að minnsta kosti sex mánuði eftir aðgerð. Því benda niðurstöður okkar til að áhrif hjartadrepsins séu að mestu bundin við fyrstu mánuðina eftir aðgerð. Nýlegar rannsóknir hafa þó sýnt verulegan mun á langtímahorfum sjúklinga eftir aðgerð, en það er þó háð því hvaða skilgreining er notuð.2,9,30 Þannig sýndu Pölzl og félagar að sé notuð skilgreining Society for Cardiovascular Angiography and Interventions (SCAI) eru áhrifin á MACCE-fría og langtímalifun óveruleg, en séu notuð 4UD og Academic Research Consortium (ARC) sjást tengsl við hærri tíðni MACCE og verri langtímalifun.2 SCAI-skilgreiningin styðst að mestu leyti við ensímhækkanir en skilgreiningar 4UD og ARC taka einnig mið af hjartalínuritsbreytingum og myndgreiningu.2 Þessi rannsókn og aðrar áþekkar undirstrika hversu miklu máli skiptir hvernig hjartadrep tengt aðgerð er skilgreint fyrir tengsl þeirra við fylgikvilla og lifun. Sömuleiðis að ensímhækkanir einar og sér, sérstaklega ef aðeins er miðað við TnT, hafa ófullnægjandi sértæki.24,31
Styrkleikar og takmarkanir rannsóknar
Styrkleiki telst að rannsóknin er byggð á ítarlegum gagnagrunni hjarta- og lungnaskurðdeildar Landspítala sem safnað hefur verið upplýsingum í síðastliðin 18 ár og nær til tilfella frá 2001 til dagsins í dag. Þarna eru skráðar næstum 200 breytur um hvern sjúkling þar sem hverjum einasta sjúklingi er fylgt eftir hvað varðar lifun með upplýsingum úr Dánarmeinaskrá en einnig leitað markvisst að langtímafylgikvillum sem tengjast hjarta- og æðasjúkdómum á öllum sjúkrahúsum landsins.
Það að rannsóknin er afturskyggn er veikleiki borið saman við framskyggna rannsókn, ekki síst þegar kemur að skráningu upplýsinga um einkenni kransæðasjúkdóms eða hugsanlega áhættu hjartadreps. Ekki lágu heldur alltaf fyrir upplýsingar um hugsanleg orsök hjartadrepsins, eins og hvort græðlingur hefði stíflast. Fyrir sjaldgæfari fylgikvilla er hætt við að stærð sjúklingaþýðisins sé ekki nægileg til að sýna fram á tölfræðilega marktækan mun og því hætta á villu af gerð II við tölfræðilegan samanburð hópa (núlltilgátu hafnað þótt hún sé sönn). Upplýsingar um TnT-mælingar vantaði hjá sumum sjúklingum og árið 2012 var breytt um mæliaðferð sem gerði það að verkum að erfiðara var að meta hjartadrep út frá TnT-mælingum og bera þau til dæmis saman við hjartadrep sem byggðust á tífaldri hækkun CK-MB.
Sömuleiðis miðaðist lifunargreining við aðgerðardag en ekki greiningardag hjartadreps, en því fylgir hætta á ódauðleikabjaga (immortal time bias) þar sem sumir sjúklingar gætu flokkast með hjartadrepshópi áður en drep er komið fram. Hins vegar greinist hjartadrep í tengslum við kransæðahjáveitu yfirleitt innan þriggja sólarhringa frá aðgerð5 og því sennilegt að áhrif bjagans á niðurstöður séu takmörkuð.
Samantekið sýnir þessi rannsókn að sjúklingar sem fá hjartadrep í tengslum við kransæðahjáveituaðgerð hafa hærri tíðni ýmissa snemmkominna fylgikvilla og umtalsvert hærri 30 daga dánartíðni. Tíðni kransæðavíkkunar eftir aðgerð reyndist einnig mun hærri í hjartadrepshópi og lifun fyrstu árin eftir aðgerð síðri, en ekki þegar liðin eru meira en fjögur ár frá aðgerð.
Þakkir
Rannsóknin var styrkt af Rannsóknarsjóði Háskóla Íslands og Minningarsjóði Helgu Jónsdóttur og Sigurliða Kristjánssonar.
Heimildir
| 1. Guðbjartsson T, Þorgeirsson G. Kransæðabókin. Ísafoldarprentsmiðja, Reykjavík 2016. | ||||
| 2. Pölzl L, Thielmann M, Cymorek S, et al. Impact of myocardial injury after coronary artery bypass grafting on long-term prognosis. Eur Heart J 2022; 43: 2407-17. https://doi.org/10.1093/eurheartj/ehac054 PMid:35139192 |
||||
| 3. Garðarsdóttir HR, Árnadóttir LÓ, Aðalsteinsson JA, et al. Árangur kransæðahjáveituaðgerða hjá konum á Íslandi. Læknablaðið 2018; 104: 335-40. https://doi.org/10.17992/lbl.2018.0708.192 PMid:29972134 |
||||
| 4. Sigurjónsson H, Helgadóttir S, Oddsson SJ, et al. Árangur kransæðahjáveituaðgerða á Íslandi 2002-2006. Læknablaðið 2012; 98: 451-6. https://doi.org/10.17992/lbl.2012.09.449 PMid:22947627 |
||||
| 5. Davierwala Piroze M, Verevkin A, Leontyev S, et al. Impact of Expeditious Management of Perioperative Myocardial Ischemia in Patients Undergoing Isolated Coronary Artery Bypass Surgery. Circulation 2013; 128: (11_suppl_1) S226-S34. https://doi.org/10.1161/CIRCULATIONAHA.112.000347 PMid:24030411 |
||||
| 6. Sef D, Szavits-Nossan J, Predrijevac M, et al. Management of perioperative myocardial ischaemia after isolated coronary artery bypass graft surgery. Open Heart 2019; 6: e001027. https://doi.org/10.1136/openhrt-2019-001027 PMid:31168389 PMCid:PMC6519404 |
||||
| 7. Pölzl L, Thielmann M, Cymorek S, et al. Impact of myocardial injury after coronary artery bypass grafting on long-term prognosis. Eur Heart J 2022; 43: 2407-17. https://doi.org/10.1093/eurheartj/ehac054 PMid:35139192 |
||||
| 8. Ranucci M, Frigiola A, Menicanti L, et al. Risk factors for fatal myocardial infarction after coronary bypass graft surgery. Eur J Anaesthesiol 2001; 18: 322-9. https://doi.org/10.1097/00003643-200105000-00007 PMid:11350475 |
||||
| 9. Weidenmann V, Robinson NB, Rong LQ, et al. Diagnostic dilemma of perioperative myocardial infarction after coronary artery bypass grafting: A review. Int J Surg 2020; 79: 76-83. https://doi.org/10.1016/j.ijsu.2020.05.036 PMid:32442689 PMCid:PMC7853700 |
||||
| 10. Ramsay J, Shernan S, Fitch J, et al. Increased creatine kinase MB level predicts postoperative mortality after cardiac surgery independent of new Q waves. J Thorac Cardiovasc Surg 2005; 129: 300-6. https://doi.org/10.1016/j.jtcvs.2004.06.005 PMid:15678039 |
||||
| 11. Pretto P, Martins GF, Biscaro A, et al. Perioperative myocardial infarction in patients undergoing myocardial revascularization surgery. Rev Bras Cir Cardiovasc 2015; 30: 49-54. https://doi.org/10.5935/1678-9741.20140059 PMid:25859867 PMCid:PMC4389522 |
||||
| 12. Nellipudi JA, Baker RA, Dykes L, et al. Prognostic Value of High-Sensitivity Troponin T After On-Pump Coronary Artery Bypass Graft Surgery. Heart Lung Circulation 2021; 30: 1562-9. https://doi.org/10.1016/j.hlc.2021.03.272 PMid:33931302 |
||||
| 13. Schnell F, Donal E, Bernard A, et al. Improved diagnosis of post-operative myocardial infarction by contrast echocardiography after coronary artery bypass graft surgery. Eur J Echocardiogr 2011; 12: 612-8. https://doi.org/10.1093/ejechocard/jer087 PMid:21785121 |
||||
| 14. Sousa-Uva M, Head SJ, Milojevic M, et al. 2017 EACTS Guidelines on perioperative medication in adult cardiac surgery. Eur J Cardio-Thorac Surg 2018; 53: 5-33. https://doi.org/10.1093/ejcts/ezx448 https://doi.org/10.1093/ejcts/ezx314 PMid:29029110 |
||||
| 15. Hausenloy DJ, Boston-Griffiths E, Yellon DM. Cardioprotection during cardiac surgery. Cardiovasc Res 2012; 94: 253-65. https://doi.org/10.1093/cvr/cvs131 PMid:22440888 PMCid:PMC3331616 |
||||
| 16. Thielmann M, Kottenberg E, Kleinbongard P, et al. Cardioprotective and prognostic effects of remote ischaemic preconditioning in patients undergoing coronary artery bypass surgery: a single-centre randomised, double-blind, controlled trial. Lancet 2013; 382: 597-604. https://doi.org/10.1016/S0140-6736(13)61450-6 PMid:23953384 |
||||
| 17. Spiess BD, Ley C, Body SC, et al. Hematocrit value on intensive care unit entry influences the frequency of Q-wave myocardial infarction after coronary artery bypass grafting. The Institutions of the Multicenter Study of Perioperative Ischemia (McSPI) Research Group. J Thorac Cardiovasc Surg 1998; 116: 460-7. https://doi.org/10.1016/S0022-5223(98)70012-1 PMid:9731788 |
||||
| 18. Johannesdottir H, Arnadottir LO, Adalsteinsson JA, et al. Favourable long-term outcome after coronary artery bypass grafting in a nationwide cohort. Scand Cardiovasc J 2017; 51: 327-33. https://doi.org/10.1080/14017431.2017.1364418 PMid:28805102 |
||||
| 19. Gunnarsdóttir ELT, Gunnarsdóttir SLX, Heimisdóttir AA, et al. Algengi og áhættuþættir lengdrar dvalar á gjörgæsludeild eftir kransæðahjáveituaðgerð. Læknablaðið 2020; 106: 123-9. https://doi.org/10.17992/lbl.2020.03.471 PMid:32124735 |
||||
| 20. Gunnarsdóttir SLX, Gunnarsdóttir ELT, Heimisdóttir AA, et al. Notkun ósæðardælu við kransæðahjáveituaðgerðir. Læknablaðið 2020; 106: 63-70. https://doi.org/10.17992/lbl.2020.02.372 PMid:32009623 |
||||
| 21. Thygesen K, Alpert JS, Jaffe AS, et al. Fourth Universal Definition of Myocardial Infarction. Circulation 2018; 138: e618-e51. https://doi.org/10.1161/CIR.0000000000000617 PMid:30571511 |
||||
| 22. Arnar DO. Hánæmt trópónín T - viðbót eða vandræði? Læknablaðið 2012; 98: 9. https://doi.org/10.17992/lbl.2012.01.406 PMid:22253085 |
||||
| 23. Yau JM, Alexander JH, Hafley G, et al. Impact of Perioperative Myocardial Infarction on Angiographic and Clinical Outcomes Following Coronary Artery Bypass Grafting (from PRoject of Ex-vivo Vein graft ENgineering via Transfection [PREVENT] IV). Am J Cardiol 2008; 102: 546-51. https://doi.org/10.1016/j.amjcard.2008.04.069 PMid:18721510 |
||||
| 24. Gahl B, Göber V, Odutayo A, et al. Prognostic Value of Early Postoperative Troponin T in Patients Undergoing Coronary Artery Bypass Grafting. J Am Heart Assoc 2018; 7: e007743. https://doi.org/10.1161/JAHA.117.007743 PMid:29487111 PMCid:PMC5866325 |
||||
| 25. Aboul-Hassan SS, Stankowski T, Marczak J, et al. The use of preoperative aspirin in cardiac surgery: A systematic review and meta-analysis. J Card Surg 2017; 32: 758-74. https://doi.org/10.1111/jocs.13250 PMid:29205497 |
||||
| 26. Ahn JM. Feel Free to Use Aspirin before Coronary Artery Bypass Surgery. Korean Circ J 2019; 49: 511-3. https://doi.org/10.4070/kcj.2019.0155 PMid:31172711 PMCid:PMC6554589 |
||||
| 27. Maganti M, Brister SJ, Yau TM, et al. Changing trends in emergency coronary bypass surgery. J Thorac Cardiovasc Surg 2011; 142: 816-22. https://doi.org/10.1016/j.jtcvs.2011.01.021 PMid:21334012 |
||||
| 28. Benedetto U, Gaudino M, Di Franco A, et al. Incomplete revascularization and long-term survival after coronary artery bypass surgery. Int J Cardiol 2018; 254: 59-63. https://doi.org/10.1016/j.ijcard.2017.08.005 PMid:29407133 |
||||
| 29. Pischke SE, Tronstad C, Holhjem L, et al. Perioperative detection of myocardial ischaemia/reperfusion with a novel tissue CO2 monitoring technology. Eur J Cardiothorac Surg 2012; 42: 157-63. https://doi.org/10.1093/ejcts/ezr278 PMid:22290904 |
||||
| 30. Gregson J, Stone GW, Ben-Yehuda O, et al. Implications of Alternative Definitions of Peri-Procedural Myocardial Infarction After Coronary Revascularization. J Am Coll Cardiol 2020; 76: 1609-21. https://doi.org/10.1016/j.jacc.2020.08.016 PMid:33004126 |
||||
| 31. Jørgensen PH, Nybo M, Jensen MK, et al. Optimal cut-off value for cardiac troponin I in ruling out Type 5 myocardial infarction. Interact Cardiovasc Thorac Surg 2014; 18: 544-50. https://doi.org/10.1093/icvts/ivt558 PMid:24468543 |
||||