01. tbl. 110. árg. 2024
Fræðigrein
Rannsókn. Nýtilkomið gáttatif eftir kransæðahjáveituaðgerð: Nýgengi, klínískur gangur og áhrif á snemmkominn árangur
Ágrip
INNGANGUR
Markmið þessarar afturskyggnu rannsóknar var að kanna tíðni og afdrif sjúklinga með nýtilkomið gáttatif eftir kransæðahjáveituaðgerð, þá sérstaklega klínískan gang gáttatifsins, hvaða meðferð var beitt, árangur hennar, tíðni fylgikvilla og 30 daga dánartíðni.
EFNIVIÐUR OG AÐFERÐIR
Rannsóknin náði til 1622 kransæðahjáveitusjúklinga á Landspítala 2006-2020 og fengust klínískar upplýsingar úr sjúkraskrám. Nýtilkomið gáttatif var skilgreint sem áður ógreint gáttatif/-flökt sem varði í minnst 5 mínútur eða lengur eftir aðgerð. Gáttatifssjúklingar voru skoðaðir sérstaklega og þeir síðan bornir saman við sjúklinga án gáttatifs.
NIÐURSTÖÐUR
Alls greindust 483 (32,2%) sjúklingar með nýtilkomið gáttatif og lækkaði tíðnin marktækt yfir tímabilið (tau= -0,45, p=0,023). Flestir greindust á öðrum degi frá aðgerð (43,5%) og 92,1% innan 4 daga. Miðgildi fjölda gáttatifskasta var 3 [1-5]. Fyrsta gáttatifskast varði í 1-6 klukkustundir í helmingi tilfella og skemur en sólarhring hjá 95,0% sjúklinga. Miðgildi heildarlengdar gáttatifskasta var 12 klst. [5,30]. Oftast var gáttatif meðhöndlað með amíódaróni (95,0%) og beta-hemlum (98,8%) en einnig rafvendingu í 14,9% tilfella. Alls náðust 94,7% sjúklinga í reglulegan sínustakt fyrir útskrift en 25 (5,3%) útskrifuðust í gáttatifi og 11 (2,3%) gáttatifssjúklingar létust í legu. Gáttatifssjúklingar voru eldri og höfðu marktækt hærra EuroSCORE II, hærri tíðni alvarlegra fylgikvilla (16,4% sbr. 10,0%) og lengri legutíma. Dánartíðni innan 30 daga og tíðni snemmkominna heilaáfalla reyndist hins vegar sambærileg milli hópa.
ÁLYKTANIR
Nýgengi gáttatifs eftir kransæðahjáveituaðgerð er enn hátt og tengist lengri legutíma en ekki hærri 30 daga dánartíðni eða snemmkomnum heilaáföllum eftir aðgerð. Oftast er um fá gáttatifsköst að ræða og um 95% sjúklinga útskrifast í reglulegum sínustakti.
Greinin barst til blaðsins 29. maí 2023, samþykkt til birtingar 20. nóvember 2023.
Inngangur
Kransæðahjáveituaðgerð er algengasta opna hjartaaðgerðin á Íslandi sem og á öðrum Vesturlöndum. Henni geta fylgt ýmsir fylgikvillar og er nýtilkomið gáttatif (postoperative atrial fibrillation, POAF) þeirra algengastur.1 Erlendis er tíðni þess oftast á bilinu 20-40%1-4 en hér á landi er nýgengið af óþekktum ástæðum ívið hærra.3 Enn er margt á huldu um orsakir gáttatifs eftir hjartaaðgerðir en tengsl hafa fundist við öldrunartengdar hrörnunarbreytingar í gáttum auk bólgusvars og bandvefsmyndunar í kjölfar aðgerðarinnar. Einnig er talið að gollurshússbólga og fleiðruvökvi geti komið við sögu ásamt lágu útfallsbroti vinstri slegils, blóðþurrð í hjartavöðva í aðgerð og sýkingar ýmiss konar.2,4
Þótt gáttatif sé yfirleitt vægur fylgikvilli finna flestir -sjúklingar fyrir einkennum, aðallega mæði og hröðum hjartslætti sem oft fylgir kvíðatilfinning. Það greinist oftast á öðrum til fjórða degi eftir aðgerð, varir yfirleitt stutt en getur komið í fleiri köstum.4 Hjá öldruðum og sjúklingum með hjartabilun geta jafnvel stutt gáttatifsköst valdið bráðri hjartabilun, nýrnabilun eða heilaáfalli sem rekja má til blóðsegareks til heila.4 Þannig hafa sjúklingar með nýtilkomið gáttatif tvöfalt hærri dánartíðni innan 30 daga, hærri endurinnlagnartíðni eftir útskrift og sjúkrahúskostnaður þeirra er töluvert hærri, aðallega vegna lengri legutíma sem algengt er að lengist um tvo til þrjá daga.2-4 Af ofanskráðu er brýnt að þekkja þætti sem auka hættuna á þessum algenga fylgikvilla; ekki síst í því skyni að reyna að fyrirbyggja hann. Það má helst gera með fyrirbyggjandi lyfjameðferð, sérstaklega beta-hemlum, sem alþjóðlegar leiðbeiningar mæla með að séu teknir fram að aðgerð.5,6 Sömuleiðis hafa rannsóknir sýnt að amíódarón gefið fyrir aðgerð geti lækkað tíðni gáttatifs en meðferðin er mun kostnaðarsamari og óhentugri en beta-hemlar.7
Nýgengi nýtilkomins gáttatifs eftir kransæðahjáveitu og afleiðingar þess, sérstaklega á 30 daga dánartíðni, hafa verið rannsakaðar í fjölda rannsókna erlendis1,3,4,8 en einnig hér á landi.3,9 Þessar rannsóknir eiga þó sameiginlegt að upplýsingar um klínískan gang gáttatifs vantar, ásamt því hvaða meðferð var beitt og hver tengslin eru við aðra snemmkomna fylgikvilla og lifun. Þannig er hugsanlegt að gáttatifsköst sem koma sjaldan og standa í nokkrar mínútur geti haft óveruleg áhrif á horfur, á meðan þau sem koma títt og standa dögum saman hækki 30 daga dánartíðni.
Markmið þessarar rannsóknar var því að lýsa nýgengi gáttatifs eftir kransæðahjáveitu hér á landi og kanna hvort hún hafi breyst, en um leið að kanna klínískan gang þess fyrst eftir aðgerðina, fjölda og tímalengd gáttatifskasta, meðferð og hvernig sjúklingum vegnaði fram að útskrift.
Efniviður og aðferðir
Leyfi
Öll tilskilin leyfi frá Persónuvernd, vísindasiðanefnd (VSN 10-009-V9) og framkvæmdastjóra lækninga á Landspítala lágu fyrir áður en rannsóknin hófst.
Gagnaöflun
Rannsóknin var afturskyggn ferilrannsókn þar sem stuðst var við gagnagrunn hjarta- og lungnaskurðdeildar Landspítala sem unnin er úr sjúkraskrárkerfi spítalans. Í honum eru skráðar hátt í 200 breytur um sjúklinga sem gengist hafa undir kransæðahjáveituaðgerð (CABG) á Landspítala frá 1. janúar 2001 og fram til dagsins í dag. Til þess að tryggja að öll tilfelli væru tekin með, var einnig leitað í aðgerðaskrá hjarta- og lungnaskurðdeildar og í sjúkraskrám Landspítala að aðgerðanúmerum fyrir kransæðahjáveituaðgerð (FNSA00, FNSC10, FNSC20, FNSC30) auk aðgerðanúmera fyrir notkun hjarta- og lungnavélar (FZSA00, FZSA10).
Rannsóknin náði til 1622 sjúklinga sem gengust undir sína fyrstu kransæðahjáveituaðgerð á Landspítala á 15 ára tímabili, frá 1. janúar 2006 til 31. desember 2020. Útilokaðar voru allar kransæðahjáveituaðgerðir þar sem önnur aðgerð, eins og lokuskipti eða viðgerð, var framkvæmd samtímis og sömuleiðis 121 sjúklingur sem hafði fyrri sögu um gáttatif eða flökt.
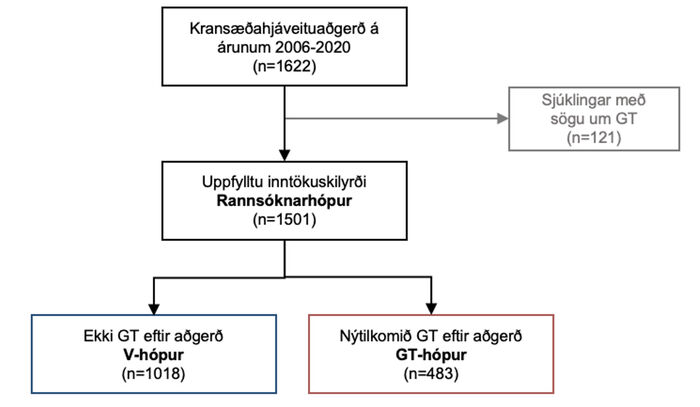 Mynd 1. Flæðirit yfir rannsóknarþýðið. GT-hópur: gáttatifshópur, V-hópur: viðmiðunarhópur.
Mynd 1. Flæðirit yfir rannsóknarþýðið. GT-hópur: gáttatifshópur, V-hópur: viðmiðunarhópur.
Eftir var þýði 1501 sjúklings sem skipt var í tvennt (mynd 1) eftir því hvort þeir fengu nýtilkomið gáttatif eftir aðgerð (GT-hópur, n=483) eða ekki (viðmiðunarhópur, V-hópur, n=1018). Nýtilkomið gáttatif eftir aðgerð var skilgreint sem áður ógreint gáttatif eða flökt, greint á hjartalínuriti og/eða hjartasírita og varði í að minnsta kosti fimm mínútur eða lengur, en skilgreiningin er fengin úr leiðbeiningum ESC (European Society of Cardiology) frá árinu 2020.6 Hóparnir -tveir voru bornir saman með tilliti til bakgrunns- og áhættuþátta kransæðasjúkdóms, aðgerðatengdra þátta, skammtíma fylgikvilla, legutíma og 30 daga dánartíðni frá aðgerð.
Klínískar breytur
Sérstaklega var litið á sjúklinga í GT-hópi og hjartalínurit þeirra skoðuð, sem og upplýsingar um hjartsláttaróreglu í læknabréfum og dagálum lækna eða hjúkrunarfræðinga. Skráð var í gagnagrunn hjarta- og lungnaskurðdeildar Landspítala á hvaða degi eftir aðgerð gáttatif greindist, hversu mörg gáttatifsköstin voru, tímalengd fyrsta gáttatifskasts og heildartímalengd gáttatifskasta í klukkustundum. Loks var kannað hvort beitt var lyfjagjöf og/eða rafvendingu, hvort sjúklingar útskrifuðust í reglulegum takti eða gáttatifi og þá hvort ávísað var langvarandi blóðþynningarmeðferð.
Stuðst var við breytur sem þegar höfðu verið skráðar í áðurnefndan gagnagrunn og lýst hefur verið nánar í fjölda greina um árangur kransæðahjáveituaðgerða á Íslandi í Læknablaðinu.9-13 Í grunninum eru skráðir áhættuþættir hjarta- og æðasjúkdóma eins og háþrýstingur, blóðfituröskun, reykingasaga og sykursýki, auk sögu um aðra sjúkdóma eins og kransæðastíflu/hjartadrep, hjartsláttaróreglu og langvinna lungnateppu. Einkenni kransæðasjúkdóms fyrir aðgerð voru skráð samkvæmt flokkun CCS (Canadian Cardiovascular Society) á hjartaöng14 og NYHA (New York Heart Association) flokkun til að meta einkenni hjartabilunar.15 EuroSCORE II (European System for Cardiac Operative Risk Evaluation II), sem er alþjóðlega viðurkennt áhættulíkan sem metur dánarlíkur innan 30 daga eftir hjartaskurðaðgerð,16 var reiknað út fyrir alla sjúklinga. Útbreiðsla kransæðasjúkdóms var metin út frá niðurstöðum kransæðaþræðingar, það er hvort sjúklingarnir voru með eins, tveggja eða þriggja æða sjúkdóm og/eða hvort um vinstri höfuðstofnsþrengsli var að ræða. Einnig var safnað upplýsingum um útfallsbrot vinstri slegils (left ventricular ejection fraction, LVEF) í hjartaómun fyrir aðgerð og lyf sem sjúklingar tóku fram að aðgerð, þar á meðal lyf gegn hjartsláttartruflunum eins og beta-hemlar, kólesteróllækkandi statín og blóðþynningar- eða blóðflöguhemjandi lyf.
Aðgerðatengdir þættir eins og lengd aðgerðar (skin-to-skin time), tangartími (aortic X-clamp time) og tími á hjarta- og lungnavél (ECC-time) í mínútum, ásamt fjölda og tegund græðlinga voru skráðir. Einnig var skráð hvort um var að ræða bráðaaðgerð (framkvæmd innan 24 klukkustunda frá innlögn), neyðaraðgerð (emergent) eða valaðgerð (elective). Notkun ósæðardælu (intra-aortic balloon pump, IABP) í aðgerð var skráð ásamt tegund aðgerðar, það er hvort aðgerð var framkvæmd með aðstoð hjarta- og lungnavélar eða á sláandi hjarta (off-pump, OPCAB).
Fylgikvillar eftir aðgerð voru skráðir sérstaklega eins og legutími á gjörgæslu, legudeild og heildarlegutími, allt í heilum dögum. Hlutfall sjúklinga sem létust innan 30 daga frá aðgerð var skráð og hver dánarorsök þeirra var. Fylgikvillar eftir aðgerð voru flokkaðir í minniháttar og alvarlega fylgikvilla. Til minniháttar fylgikvilla töldust, auk nýtilkomins gáttatifs, fleiðruholsvökvi sem þarfnaðist aftöppunar, yfirborðssýking í skurðsári á ganglim eða bringubeinsskurði, þvagfærasýking og lungnabólga. Alvarlegir fylgikvillar voru heilaáfall, bringubeinslos (sternal dehiscence), fjöllífærabilun, miðmætisbólga, bráður nýrnaskaði, hjartadrep í tengslum við aðgerð og enduraðgerð vegna blæðingar. Einnig var skráð í mL magn blæðingar í brjóstholskera á fyrsta sólarhringnum eftir aðgerð ásamt fjölda eininga af blóðhlutum sem gefnir voru eftir aðgerðina.
Eftirfylgd miðast við 1. júní 2021, en meðaleftirfylgd var 8,2 ár og miðgildi 8,5 ár (bil: 0,0–15,4). Upplýsingar um dánardag og dánarorsök fengust úr Dánarmeinaskrá Embættis landlæknis.
Tölfræðiúrvinnsla
Gögn voru skráð í Excel og tölfræðiúrvinnsla framkvæmd með forritinu R (R foundation for statistical computing, Vín, Austurríki, útgáfa 4.1.2) með hjálp Rstudio (útgáfa 2021.09.2+382). Flokkabreytur voru gefnar upp með fjölda og hlutföll (%) og talnabreytur eftir því sem við átti með meðaltali og staðalfrávikum eða miðgildum með fjórðungaspönnum (IQR). Kí-kvaðrat próf eða Fisher‘s Exact-próf voru notuð fyrir flokkabreytur og t-test eða ANOVA-próf notuð fyrir talnabreytur. Breyting í notkun beta-blokka fyrir aðgerð var, líkt og útreikningar á nýgengi gáttatifs eftir aðgerð, metin með Mann-Kendall-prófi og sýnd myndrænt með samlegðarlíkani (generalised additive model) og 95% öryggisbilum (ÖB). Upplýsingar um upphafsdag, tímalengd og fjölda gáttatifskasta eru sýndar með þéttniritum. Marktæki tölfræðiprófa miðaðist við p-gildi <0,05.
Niðurstöður
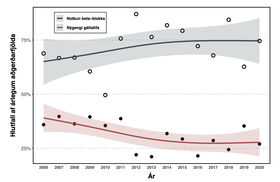
Árlegt nýgengi nýtilkomins gáttatifs eftir aðgerð og árleg tíðni notkunar beta-hemla fyrir aðgerð er sýnd á mynd 2. Nýgengi gáttatifs reyndist 32,2% yfir allt tímabilið; hæst 39,7% árið 2007 og lægst 21,1% árið 2013 og lækkaði marktækt yfir rannsóknartímabilið (tau= -0,45, p=0,023). Meðalnotkun beta-hemla fyrir aðgerð reyndist 71,1% yfir allt tímabilið; hæst 87,0% árið 2012 og lægst 52,2% árið 2010, en aukningin reyndist ekki marktæk á rannsóknartímabilinu (tau=0,181, p=0,37).
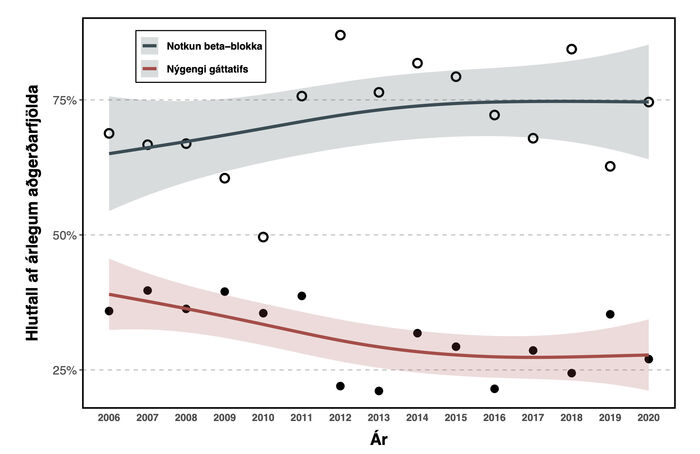
Mynd 2. Tíðni gáttatifs samanborið við notkun beta-hemla fyrir aðgerð.
Klínískur gangur gáttatifs eftir aðgerð
Mynd 3 sýnir þéttnirit af dreifingu á upphafsdegi gáttatifs frá aðgerð, fjölda kasta og heildartíma gáttatifskasta. Gáttatif greindist oftast á öðrum degi frá aðgerð (mynd 3a), eða hjá 43,5% sjúklinga, og 92,1% greindust á fyrstu fjórum dögunum frá aðgerð. Aðeins fjórir sjúklingar (0,83%) greindust meira en viku frá aðgerð. Mynd 3b sýnir þéttnirit yfir fjölda gáttatifskasta. Meðalfjöldi þeirra á hvern sjúkling var 3,9 ± 3,2 og miðgildið 3 [1, 5]. Flestir greindust með eitt gáttatifskast (25,9%) en 76,8% sjúklinganna fengu ≤5 köst í legunni. Mynd 3c sýnir samanlagða lengd allra gáttatifskasta á meðan á sjúkrahúsdvöl stóð, en miðgildið var 12 [5, 30] klst. og meðaltalið 23,1 ± 30,9 klst. Hjá 82,2% sjúklinga vöruðu gáttatifsköstin samtals skemur en 36 klst.
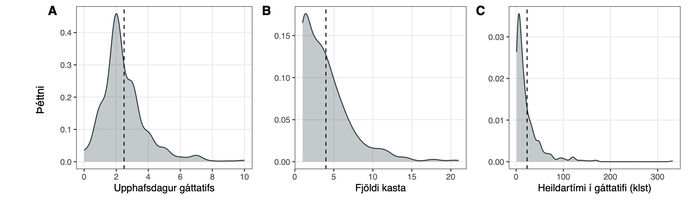 Mynd 3. Gáttatif. Þéttnirit af dreifingu mismunandi eiginleika gáttatifs eftir aðgerð. (A) Greiningardagur nýtilkomins gáttatifs hjá 483 sjúklingum með nýtilkomið gáttatif eftir kransæðahjáveituaðgerð, ásamt (B) heildarfjölda gáttatifskasta hvers sjúklings og (C) heildartíma í gáttatifi (klst). Miðgildi eru sýnd með strikalínu.
Mynd 3. Gáttatif. Þéttnirit af dreifingu mismunandi eiginleika gáttatifs eftir aðgerð. (A) Greiningardagur nýtilkomins gáttatifs hjá 483 sjúklingum með nýtilkomið gáttatif eftir kransæðahjáveituaðgerð, ásamt (B) heildarfjölda gáttatifskasta hvers sjúklings og (C) heildartíma í gáttatifi (klst). Miðgildi eru sýnd með strikalínu.
Mynd 4 sýnir tímalengd fyrsta gáttatifskasts, en hjá helmingi sjúklinga (49,7%) varði það 1-6 klst og hjá 95% sjúklinga skemur en 24 klst.
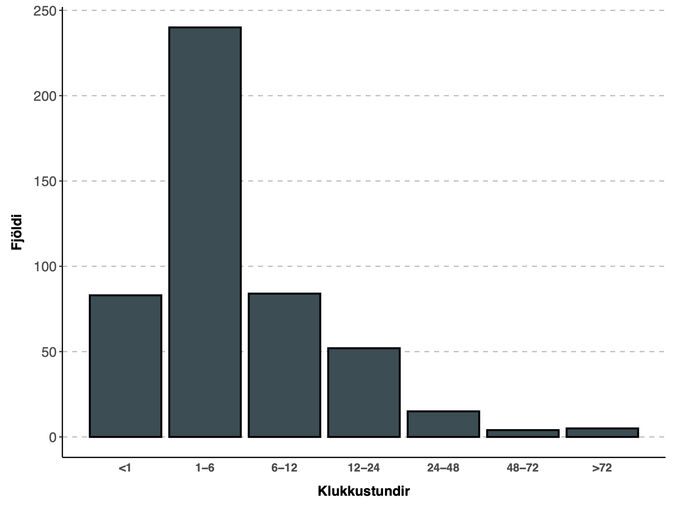
Mynd 4. Lengd fyrsta gáttatifskasts. Sýndur er fjöldi sjúklinga á y-ási og lengd fyrsta gáttatifskasts í klst. á x-ás.
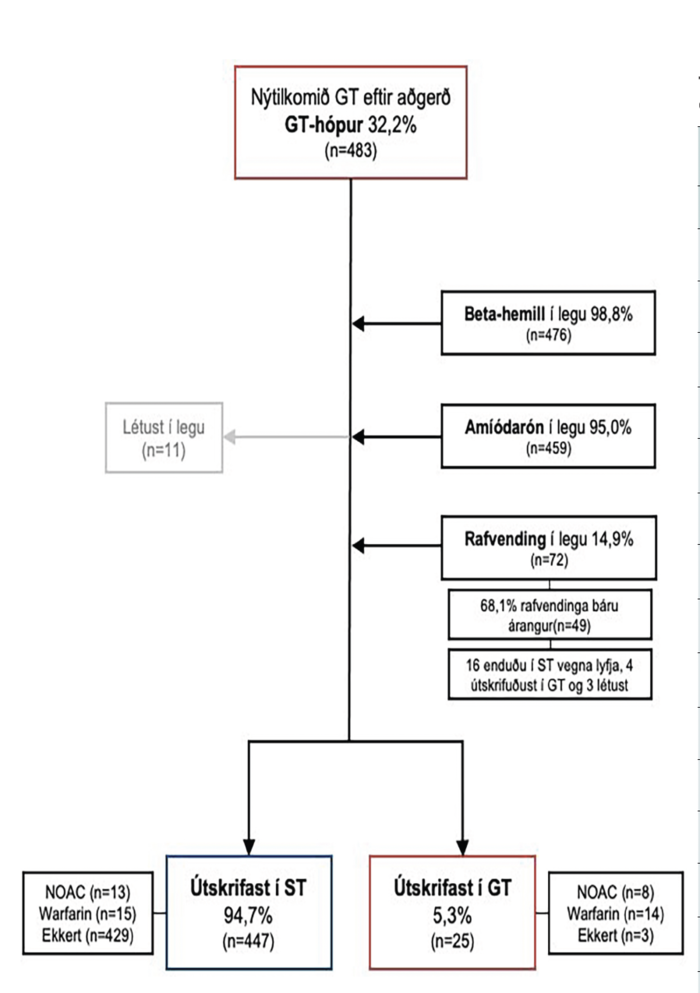
Mynd 5. Flæðirit sem sýnir meðferð sjúklinga með nýtilkomið gáttatif í legu og við útskrift. GT: gáttatif; ST: sínustaktur
Mynd 5 er flæðirit sem sýnir afdrif gáttatifssjúklinganna. Við útskrift höfðu 447 sjúklingar af 483 (94,7%) náðst aftur í sínustakt (ST) en 25 útskrifuðust í gáttatifi (5,3%) og 11 (2,3%) létust í legunni. Flestir gáttatifssjúklinganna, eða 459 (95,0%), fengu amíódarón sem fyrstu meðferð og 476 (98,8%) fengu beta-hemil. Alls voru 72 sjúklingar (14,9%) meðhöndlaðir með rafvendingu, 44 í eitt skipti og 28 tvisvar eða oftar. Í 49 tilfellum af 72 (68,1%) náðist að rafvenda sjúklingum í sínustakt en hjá þeim 23 sjúklingum þar sem það tókst ekki voru 16 (69,6%) sjúklingar sem síðar náðust í takt í legunni með lyfjum, fjórir (17,4%) útskrifuðust í gáttatifi og þrír (13,0%) létust í legu. Af þeim 25 (5,3%) sjúklingum sem útskrifuðust í gáttatifi fengu 88,0% blóðþynnandi meðferð, oftast með warfaríni (63,6%) en í 36,4% tilfella með svokölluðum NOAC-blóðþynningarlyfjum.
Samanburður á hópum
Samanburður sjúklinga með nýtilkomið gáttatif og viðmiðunarhóps er sýndur í töflu I.
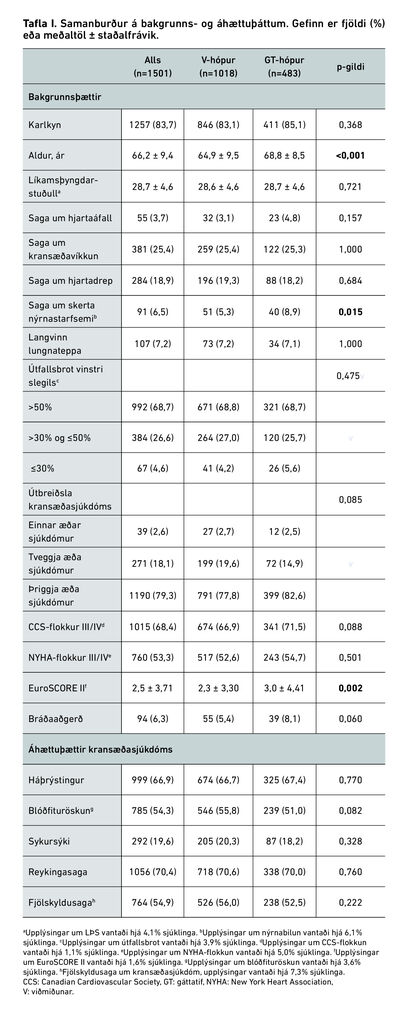
Af þeim sem hlutu nýtilkomið gáttatif voru 411 (85,1%) karlar. Lýðfræðilegir þættir reyndust svipaðir milli hópa en sjúklingar í gáttatifshópi voru þó 3,9 árum eldri (p<0,001), höfðu oftar sögu um skerta nýrnastarfsemi fyrir aðgerð (8,9% á móti 5,3%, p=0,015) og höfðu hærra EuroSCORE II (3,0 á móti 2,3, p=0,002). Ekki reyndist marktækur munur á öðrum áhættuþáttum kransæðasjúkdóms í hópunum tveimur.
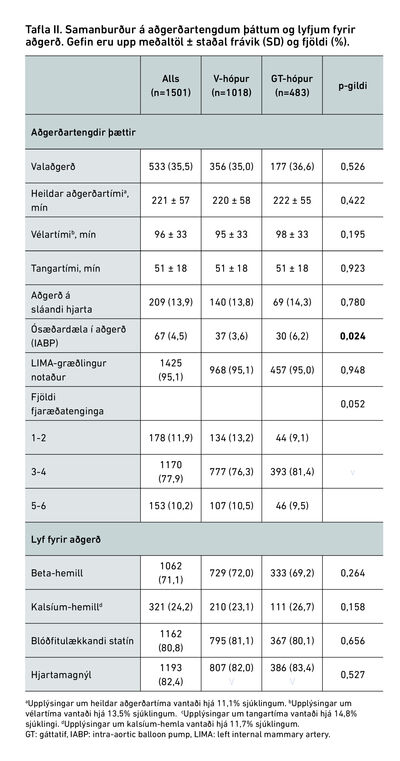
Í töflu II eru sýndir aðgerðatengdir þættir og lyf sem sjúklingar tóku fyrir aðgerð. Ekki var marktækur munur á aðgerðatengdum þáttum nema hvað notkun ósæðardælu í aðgerð var algengari hjá gáttatifshópi, eða 6,2% á móti 3,6% (p=0,024). Þá var vélar- og tangartími sambærilegur í hópunum, líkt og hlutfall val- og bráðaaðgerða. Loks reyndist ekki marktækur munur á notkun lyfja fyrir aðgerð í hópunum tveimur en notkun beta-hemla var 69,2% á móti 72,0% í viðmiðunarhópi (p=0,264).
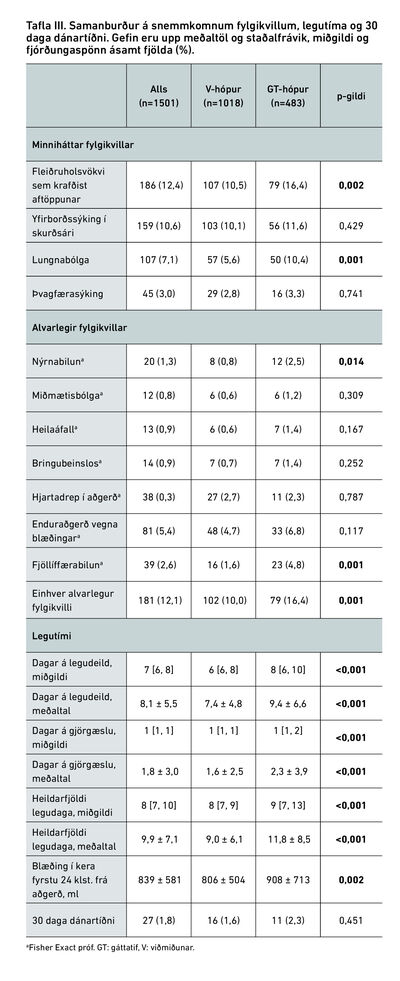
Í töflu III má sjá minniháttar og alvarlega fylgikvilla, legutíma og 30 daga dánartíðni í hópunum tveimur. Ekki reyndist marktækur munur á milli hópa á tíðni minniháttar fylgikvilla, ef frá er skilinn fleiðruholsvökvi sem þarfnaðist aftöppunar, en hann var algengari í gáttatifshópi (16,4% á móti 10,5%, p=0,002) líkt og lungnabólga (10,4% á móti 5,6%, p=0,001). Flestir alvarlegir fylgikvillar voru algengari í gáttatifshópi borið saman við viðmiðunarhóp (16,4% á móti 10,0%, p=0,001), meðal annars fjöllíffæra- (4,8% á móti 1,6%, p=0,001) og nýrnabilun (2,5% á móti 0,8%, p=0,014). Hins vegar reyndist ekki marktækur munur á snemmkomnu heilaáfalli eða miðmætisbólgu, en blæðing í brjóstholskera fyrstu 24 klst. frá aðgerð var hins vegar marktækt meiri í gáttatifshópi og munaði 102 ml (908 ± 713 ml á móti 806 ± 504 ml, p=0,002).
Miðgildi legutíma á legudeild reyndist marktækt hærra hjá gáttatifshópi (6 á móti 8 dögum hjá viðmiðunarhópi, p<0,001) og miðgildi heildarlegutíma var sömuleiðis lengri (8 á móti 9 dögum, p<0,001). Sömu sögu var að segja af meðallegutíma (sjá töflu III).
Alls létust 11 (2,3%) sjúklingar í gáttatifshópi borið saman við 16 (1,6%) í viðmiðunarhópi en munurinn reyndist þó ekki marktækur (p=0,451).
Umræða
Í þessari afturskyggnu rannsókn greindist þriðjungur krans-æða-hjáveitusjúklinga með nýtilkomið gáttatif í legunni og lækkaði nýgengið marktækt yfir rannsóknartímabilið. Þetta er fyrsta rannsóknin hér á landi sem lýsir fjölda og tímalengd gáttatifskasta eftir kransæðahjáveitu og einnig í hverju meðferðin fólst og árangur hennar. Aðeins fjórðungur sjúklinga fékk eitt gáttatifskast en algengara var að köstin væru fleiri og vöruðu þau oftast samtals um hálfan sólarhring. Nær allir gáttatifssjúklingarnir fengu meðferð með beta-hemlum, síðan var amíódaróni bætt við í 95,0% tilvika og rafvendingu þurfti aðeins hjá 14,9% sjúklinga. Árangur meðferðanna var góður og um 95% sjúklinga útskrifaðist í sínustakti. Loks reyndist tíðni snemmkominna alvarlegra fylgikvilla hærri hjá sjúklingum sem fengu nýtilkomið gáttatif, sem þó hafði ekki marktæk áhrif á 30 daga dánartíðni.
Nýgengi nýtilkomins gáttatifs og notkun beta-hemla fyrir aðgerð
Nýgengi nýtilkomins gáttatifs hérlendis (32,2%) reyndist svipað og í fjölda erlendra rannsókna þar sem það er oftast á bilinu 20-40%,2,4,17 meðal annars í sænska SwedeHEART gagnagrunninum, en þar reyndist nýgengið 30% í þýði 24.523 kransæðahjáveitusjúklinga.17 Marktæk lækkun nýgengis sást þegar leið á rannsóknartímabilið og fór það úr 37,6% á fyrsta fimm ára tímabilinu í 28,5% á því næsta og loks 26,9% á því síðasta. Þessi þróun þykir jákvæð en til samanburðar var nýgengið 44% í eldri rannsókn á árangri kransæðahjáveitu á Landspítala 2002-2006.3
Skýringin á lækkandi nýgengi gáttatifs er ekki augljós en má hugsanlega að hluta rekja til vaxandi notkunar beta-hemla fram að aðgerð. Þannig tóku 63,6% slík lyf fram að aðgerð 2006-2010 og 80,0% frá 2011-2015 en svo lækkaði hlutfallið af óþekktum ástæðum í 72% milli áranna 2016 og 2020. Skýringuna á þeirri lækkun virðist ekki að finna í auknu hlutfalli bráðaaðgerða, sem var 4,8% á fyrsta fimm ára tímabilinu, 8,1% á því næsta og 5,1% á því síðasta, en sjúklingar sem teknir eru brátt í aðgerð eru sjaldnar á hjartalyfjum en þeir sem teknir eru í valaðgerð.
Athyglisvert er að næstum þriðjungur sjúklinganna fékk ekki beta-hemla fyrir aðgerð, þótt þeir séu best rannsakaða forvarnarmeðferðin gegn gáttatifi og alþjóðlegar klínískar leiðbeiningar mæli eindregið með notkun þeirra fram að aðgerð.4-6,18,19 Þannig sýndi safngreining Khan og félaga að beta-hemlar lækka nýgengi gáttatifs að jafnaði um 50%,20 en reyndar tókst ekki að sýna fram á marktæka lækkun í annarri safngreiningu á 500.000 sjúklingum þar sem 86% alls þýðisins tóku beta-hemla fyrir aðgerð.21 Í bandarískri rannsókn fengu heldur færri, eða tæplega 80% þýðisins, beta-hemla fyrir aðgerð og reyndist ekki marktækur munur á notkun þeirra milli hópanna tveggja, líkt og í okkar rannsókn.22
Afdrif gáttatifshóps
Líkt og í erlendum rannsóknum greindust flestir (43,5%) sjúklingar á öðrum degi eftir aðgerð og rúmlega 90% á fyrstu fjórum dögunum eftir aðgerð.23-25 Þessi tímasetning gáttatifs gefur til kynna að þættir sem tengjast aðgerðinni beint, þar með talið bólguviðbragð í gollurshúsi, komi við sögu.4 Meðalfjöldi gáttatifskasta var 3,9 og rúmlega fjórðungur sjúklinga fékk einungis eitt kast. Langoftast, eða í 95,0% tilvika, varði fyrsta gáttatifskastið skemur en sólarhring og hjá 49,7% sjúklinga í 1-6 klst. Miðgildi samanlagðrar lengdar allra gáttatifskasta var 12 klst. og 70,8% sjúklinga voru samtals skemur en 24 klst í gáttatifi. Því miður vantar rannsóknir sem við getum borið okkur saman við. Í nýlegri rannsókn Rezk og félaga á nýtilkomnu gáttatifi eftir kransæðahjáveitu- og lokuaðgerðir sást þó að langflestir gáttatifssjúklingar útskrifast í reglulegum takti, eða 94,9% borið saman við 94,7% í okkar rannsókn.26 Ljóst er að stærra þýði en okkar þarf til að kanna hvort fjöldi gáttatifskasta og tímalengd hafi áhrif á langtímalifun. Þetta á ekki síst við um þá sjúklinga (5,3%) sem útskrifast í gáttatifi, en í bandarísku rannsókninni sem áður var vísað til virðist langtímalifun þeirra lakari en hinna,22 auk þess sem sænska rannsóknin sýndi aukna langtímaáhættu á hjartabilun.26
Meðferð gáttatifs
Gripið var til lyfjameðferðar við gáttatifi í öllum tilfellum og skilaði hún árangri í 81,5% tilfella. Oft var byrjað á að auka skammta af beta-hemlum, sem tæplega þrír af hverjum fjórum sjúklingum tóku fyrir aðgerð, en alls fengu 98,8% gáttatifssjúklinga beta-hemla, sem er sambærilegt og í framskyggnri rannsókn frá Boston,22 þar sem hlutfallið var 97%. Í þeirri rannsókn fengu þó mun færri amíódarón, eða tæplega 30% miðað við 95% hjá okkur, og var þeirri meðferð þá langoftast bætt ofan á beta-hemla.22 Tæplega sjöundi hver sjúklingur í okkar rannsókn þurfti rafvendingu til viðbótar við lyfjameðferð, sem er lægri tíðni en 26,4% í rannsókn Rezk og félaga.26 Rafvending bar árangur í 68,1% tilfella, en hjá þeim sem ekki náðust í reglulegan takt eftir rafvendingu fóru engu að síður 69,6% í takt með frekari lyfjameðferð. Af þeim 25 (5,3%) sjúklingum sem útskrifuðust í gáttatifi fengu 88,0% blóðþynnandi meðferð, oftast með warfaríni (63,6%) en í 36,4% tilfella með nýrri NOAC-lyfjum. Er það nokkuð lægra hlutfall en í sænsku rannsókninni sem áður var vísað til þar sem 94,4% sjúklinga í gáttatifi fengu blóðþynningarmeðferð við útskrift.26
Samanburður á sjúklingum með og án nýtilkomins gáttatifs
Karlar voru 83,1% sjúklinga og meðalaldur 66,2 ár en sjúklingar í gáttatifshópi voru 3,4 árum eldri og með hærra EuroSCORE II gildi en sjúklingar í sínustakti. Svipuðum niðurstöðum hefur verið lýst í fjölda erlendra rannsókna en hár aldur, útbreiddur kransæðasjúkdómur og nýrnabilun eru allt þekktir áhættuþættir gáttatifs eftir hjartaaðgerð. Sumir þessara þátta eru einnig teknir með í EuroSCORE II og hækka það.4,16,17,23,26,27 Ekki sást þó marktækur munur á helstu áhættuþáttum kransæðasjúkdóms milli hópanna tveggja en í erlendum rannsóknum er oft lýst hærri tíðni sykursýki og háþrýstings hjá gáttatifssjúklingum.17,28 Hvað aðgerðatengda þætti varðar reyndist heldur ekki marktækur munur á hópunum nema hvað notkun ósæðardælu (IABP) í aðgerð var algengari í gáttatifshópi. Í erlendum rannsóknum er gáttatif oft tengt lengri vélar- og tangartíma og getur hann jafnvel verið sjálfstæður áhættuþáttur þess, líkt og í rannsókn Mathew og félaga.29 Í bandarískri rannsókn á áhættuþáttum nýtilkomins gáttatifs reyndist lengri tangartími þó ekki sjálfstæður áhættuþáttur gáttatifs, líkt og í okkar rannsókn.30 Sama átti við um notkun hjartalyfja fyrir aðgerð, þar á meðal beta-hemla, sem kom nokkuð á óvart og var rætt að ofan.
Eins og búast mátti við voru snemmkomnir fylgikvillar tíðari hjá sjúklingum í gáttatifshópi. Af minniháttar fylgikvillum reyndist fleiðruholsvökvi sem krafðist aftöppunar algengari og lungnabólga reyndist tvöfalt algengari. Svipuðum niðurstöðum hefur verið lýst í erlendum rannsóknum, enda lungnabólga oft sjálfstæður áhættuþáttur nýtilkomins gáttatifs hjá kransæðahjáveitusjúklingum.30
Tíðni heilaáfalls í hópunum var mjög svipuð og reyndist heldur lægri en í safngrein Phan og félaga, þar sem hún var 2,7%.31 Hafa verður í huga að skilgreiningar á heilaáfalli eru mismunandi eftir rannsóknum og hefur þannig bein áhrif á tíðni þess. Auk þess voru tiltölulega fá heilaáfallstilfelli í okkar rannsókn sem býður heim hættu á villu af gerð II (núlltilgátu hafnað) við tölfræðilegan samanburð. Vel er þekkt að gáttatif getur valdið heilaáfalli og er með algengustu orsökum þess. Eftir hjartaaðgerð er áhætta á heilaáfalli vegna gáttatifs minni en í almennu þýði vegna blóðþynningar sem hjartaskurðsjúklingar eru á, auk þess sem hjarta- og lungnavélin letur storkukerfi þeirra.32
Ekki sást marktækur munur á 30 daga dánartíðni milli hópanna, sem er í samræmi við sænska rannsókn á rúmlega 7000 sjúklingum í SwedeHeart grunninum.33 Í safngrein Phan og félaga sem tók til 13 rannsókna sást þó munur á 30 daga dánartíðni, eða 2,5% fyrir gáttatifssjúklinga borið saman við 1,5% fyrir sjúklinga í sínustakti.31 Þrjátíu daga dánartíðni í okkar rannsókn var 1,8%, sem telst góður árangur, en í flestum rannsóknum er hún 1,5-3,5% og eru þá bráðaaðgerðir oft ekki teknar með eins og í okkar rannsókn.8,29,31,34-36
Miðgildi legutíma sjúklinga í gáttatifshópi var tæplega tveimur dögum lengri en hjá viðmiðunarhópi, sem svipar til erlendra rannsókna þar sem legutíminn er tveimur til þremur dögum lengri.31 Lengri legutími skýrist að hluta til af þeim tíma sem tekur að meðhöndla gáttatifið og koma sjúklingum í sínustakt, en tengist sennilega ekki síður þeim undirliggjandi sjúkdómum sem eru algengari hjá gáttatifssjúklingum, og má þar nefna bráðan nýrnaskaða og sýkingar. Á hjarta- og lungnaskurðdeild Landspítala hefur ávallt verið leitast við að ná sjúklingunum sem fyrst í sínustakt, enda bætir það líðan sjúklinga, styttir legutíma þeirra á bæði gjörgæslu og legudeild og stuðlar þannig að lækkun sjúkrahúskostnaðar.4,30
Styrkleikar og veikleikar
Þessi rannsókn byggir á ítarlegum gagnagrunni sem inniheldur hátt í 200 breytur um hvern og einn sjúkling sem gekkst undir kransæðahjáveituaðgerð á Landspítala á nýlegu 15 ára tímabili. Ótvíræður styrkur er að rannsóknin nær til heillar þjóðar og aðgerðirnar framkvæmdar af tiltölulega fáum skurðlæknum á sömu stofnun. Hins vegar er veikleiki að rannsóknin er afturskyggn en þá eru til að mynda upplýsingar um áhættuþætti ekki eins nákvæmar og í framskyggnri rannsókn. Skráning á notkun hjartalyfja fyrir aðgerð, sem og greining á gáttatifi eftir aðgerð, eru þó nákvæmar enda eru hjartaskurðsjúklingar á Landspítala tengdir við hjartasírita í að minnsta kosti fyrstu fimm dagana eftir aðgerð, sem er lengri tími en á mörgum hjartaskurðdeildum erlendis. Loks má nefna að þótt rannsóknin hafi tekið til 1622 sjúklinga var fjöldi í sumum undirhópum lítill og tölfræðilegur styrkur við samanburðarhópa því minni en ella.
Samantekt
Nýtilkomið gáttatif er langalgengasti fylgikvilli kransæðahjáveitu og greinist hjá þriðjungi sjúklinga hérlendis. Ánægjuleg staðreynd er að nýgengið hefur lækkað töluvert á síðastliðnum 15 árum, án þess að skýringin á því sé augljós. Tíðni snemmkominna fylgikvilla er hærri hjá gáttatifssjúklingum og legutími þeirra lengri en hjá sjúklingum sem haldast í sínustakti, án þess þó að það auki marktækt 30 daga dánartíðni. Ljóst er að flestir sjúklingar greinast með tiltölulega fá gáttatifsköst og næstum 95% sjúklinga nást í reglulegan takt fyrir útskrift. Hjá þeim sem útskrifast í gáttatifi er í dag oftast beitt blóðþynningarmeðferð til að minnka líkur á heilaáfalli, en frekari rannsóknir þarf til að meta hlut langtíma blóðþynningarmeðferðar á langtímahorfur þessa sjúklingahóps.
Þakkir
Þakkir fá allir sem koma að undirbúningi og framkvæmd opinna hjartaaðgerða á Landspítala sem og meðferð þeirra og umönnun eftir aðgerðina. Rannsóknin var styrkt af Rannsóknarsjóði Háskóla Íslands og Minningarsjóði Helgu Jónsdóttur og Sigurliða Kristjánssonar.
Heimildir
| 1. Rostagno C, La Meir M, Gelsomino S, et al. Atrial fibrillation after cardiac surgery: incidence, risk factors, and economic burden. J Cardiothorac Vasc Anesth 2010; 24: 952-8. https://doi.org/10.1053/j.jvca.2010.03.009 PMid:20570180 |
||||
| 2. Dobrev D, Aguilar M, Heijman J, et al. Postoperative atrial fibrillation: mechanisms, manifestations and management. Nature Rev Cardiol 2019; 16: 417-36. https://doi.org/10.1038/s41569-019-0166-5 PMid:30792496 |
||||
| 3. Helgadottir S, Sigurdsson MI, Ingvarsdottir IL, et al. Atrial fibrillation following cardiac surgery: risk analysis and long-term survival. J Cardiothorac Surg 2012; 7: 87. https://doi.org/10.1186/1749-8090-7-87 PMid:22992266 PMCid:PMC3515503 |
||||
| 4. Gudbjartsson T, Helgadottir S, Sigurdsson MI, et al. New-onset postoperative atrial fibrillation after heart surgery. Acta Anaesthesiol Scand 2020; 64: 145-55. https://doi.org/10.1111/aas.13507 PMid:31724159 |
||||
| 5. O'Brien B, Burrage PS, Ngai JY, et al. Society of Cardiovascular Anesthesiologists/European Association of Cardiothoracic Anaesthetists Practice Advisory for the Management of Perioperative Atrial Fibrillation in Patients Undergoing Cardiac Surgery. J Cardiothorac Vasc Anesth 2019; 33: 12-26. https://doi.org/10.1053/j.jvca.2018.09.039 PMid:30591178 |
||||
| 6. Hindricks G, Potpara T, Dagres N, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J 2021; 42: 373-498. https://doi.org/10.1093/eurheartj/ehab648 https://doi.org/10.1093/eurheartj/ehaa612 PMid:32860505 |
||||
| 7. Riber LP, Christensen TD, Jensen HK, et al. Amiodarone significantly decreases atrial fibrillation in patients undergoing surgery for lung cancer. Ann Thorac Surg 2012; 94: 339-44; discussion 45-6. https://doi.org/10.1016/j.athoracsur.2011.12.096 PMid:22516832 |
||||
| 8. Villareal RP, Hariharan R, Liu BC, et al. Postoperative atrial fibrillation and mortality after coronary artery bypass surgery. J Am Coll Cardiol 2004; 43: 742-8. https://doi.org/10.1016/j.jacc.2003.11.023 PMid:14998610 |
||||
| 9. Sigurjónsson H, Helgadóttir S, Oddsson SJ, et al. Árangur kransæðahjáveituaðgerða á Íslandi 2002-2006. Læknablaðið 2012; 98: 451-6. https://doi.org/10.17992/lbl.2012.09.449 PMid:22947627 |
||||
| 10. Garðarsdóttir HR, Árnadóttir LO, Aðalsteinsson JA, et al. Árangur kransæðahjáveituaðgerða hjá konum á Íslandi. Læknablaðið 2018; 104: 335-40. https://doi.org/10.17992/lbl.2018.0708.192 PMid:29972134 |
||||
| 11. Sveinsdóttir N, Heiðarsdóttir SR, Steinþórsson ÁS, et al. Áhrif skertrar nýrnastarfsemi á snemmkominn árangur kransæðahjáveituaðgerða. Læknablaðið 2022; 108: 231-7. https://doi.org/10.17992/lbl.2022.05.690 PMid:35499246 |
||||
| 12. Gunnarsdóttir SLX, Gunnarsdóttir ELT, Heimisdóttir AA, et al. Notkun ósæðardælu við kransæðahjáveituaðgerðir. Læknablaðið 2020; 106: 63-70. https://doi.org/10.17992/lbl.2020.02.372 PMid:32009623 |
||||
| 13. Gunnarsdóttir ELT, Gunnarsdóttir SLX, Heimisdóttir AA, et al. Algengi og áhættuþættir lengdrar dvalar á gjörgæsludeild eftir kransæðahjáveituaðgerð. Læknablaðið 2020; 106: 123-9. https://doi.org/10.17992/lbl.2020.03.471 PMid:32124735 |
||||
| 14. Campeau L. The Canadian Cardiovascular Society grading of angina pectoris revisited 30 years later. Can J Cardiol 2002; 18: 371-9. | ||||
| 15. Caraballo C, Desai NR, Mulder H, et al. Clinical Implications of the New York Heart Association Classification. J Am Heart Assoc 2019; 8: e014240. https://doi.org/10.1161/JAHA.119.014240 PMid:31771438 PMCid:PMC6912957 |
||||
| 16. Nashef SA, Roques F, Sharples LD, et al. EuroSCORE II. Eur J Cardiothorac Surg 2012; 41: 734-44; discussion 44-5. https://doi.org/10.1093/ejcts/ezs043 PMid:22378855 |
||||
| 17. Taha A, Nielsen SJ, Bergfeldt L, et al. New-Onset Atrial Fibrillation After Coronary Artery Bypass Grafting and Long-Term Outcome: A Population-Based Nationwide Study From the SWEDEHEART Registry. J Am Heart Assoc 2021; 10: e017966. https://doi.org/10.1161/JAHA.120.017966 PMid:33251914 PMCid:PMC7955471 |
||||
| 18. Norhayati MN, Shaiful Bahari I, Zaharah S, et al. Metoprolol for prophylaxis of postoperative atrial fibrillation in cardiac surgery patients: systematic review and meta-analysis. BMJ Open 2020; 10: e038364-e. https://doi.org/10.1136/bmjopen-2020-038364 PMid:33130564 PMCid:PMC7670955 |
||||
| 19. Hillis LD, Smith PK, Anderson JL, et al. 2011 ACCF/AHA Guideline for Coronary Artery Bypass Graft Surgery: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation 2011; 124: e652-735. | ||||
| 20. Khan MF, Wendel CS, Movahed MR. Prevention of post-coronary artery bypass grafting (CABG) atrial fibrillation: efficacy of prophylactic beta-blockers in the modern era: a meta-analysis of latest randomized controlled trials. Ann Noninvasive Electrocardiol 2013; 18: 58-68. https://doi.org/10.1111/anec.12004 PMid:23347027 PMCid:PMC6932325 |
||||
| 21. Brinkman W, Herbert MA, O'Brien S, et al. Preoperative β-blocker use in coronary artery bypass grafting surgery: national database analysis. JAMA Intern Med 2014; 174: 1320-7. https://doi.org/10.1001/jamainternmed.2014.2356 PMid:24934977 |
||||
| 22. Sigurdsson MI, Longford NT, Heydarpour M, et al. Duration of Postoperative Atrial Fibrillation After Cardiac Surgery Is Associated With Worsened Long-Term Survival. Ann Thorac Surg 2016; 102: 2018-26. https://doi.org/10.1016/j.athoracsur.2016.05.016 PMid:27424470 PMCid:PMC6506267 |
||||
| 23. Greenberg JW, Lancaster TS, Schuessler RB, et al. Postoperative atrial fibrillation following cardiac surgery: a persistent complication. Eur J Cardiothorac Surg 2017; 52: 665-72. https://doi.org/10.1093/ejcts/ezx039 PMid:28369234 |
||||
| 24. Zaman AG, Archbold RA, Helft G, et al. Atrial fibrillation after coronary artery bypass surgery: a model for preoperative risk stratification. Circulation 2000; 101: 1403-8. https://doi.org/10.1161/01.CIR.101.12.1403 PMid:10736284 |
||||
| 25. Melby SJ, George JF, Picone DJ, et al. A time-related parametric risk factor analysis for postoperative atrial fibrillation after heart surgery. J Thorac Cardiovasc Surg 2015; 149: 886-92. https://doi.org/10.1016/j.jtcvs.2014.11.032 PMid:25534301 |
||||
| 26. Rezk M, Taha A, Nielsen SJ, et al. Clinical Course of Postoperative Atrial Fibrillation After Cardiac Surgery and Long-Term Outcome. Ann Thorac Surg 2022. VANTAR https://doi.org/10.1016/j.athoracsur.2022.03.062 PMid:35430224 |
||||
| 27. Philip I, Berroëta C, Leblanc I. Perioperative challenges of atrial fibrillation. Curr Opin Anaesthesiol 2014; 27: 344-52. https://doi.org/10.1097/ACO.0000000000000070 PMid:24633361 |
||||
| 28. Bramer S, van Straten AHM, Soliman Hamad MA, et al. The Impact of New-Onset Postoperative Atrial Fibrillation on Mortality After Coronary Artery Bypass Grafting. Ann Thorac Surg 2010; 90: 443-9. https://doi.org/10.1016/j.athoracsur.2010.03.083 PMid:20667326 |
||||
| 29. Mathew JP, Parks R, Savino JS, et al. Atrial fibrillation following coronary artery bypass graft surgery: predictors, outcomes, and resource utilization. MultiCenter Study of Perioperative Ischemia Research Group. JAMA 1996; 276: 300-6. https://doi.org/10.1001/jama.1996.03540040044031 https://doi.org/10.1001/jama.276.4.300 PMid:8656542 |
||||
| 30. Aranki SF, Shaw DP, Adams DH, et al. Predictors of atrial fibrillation after coronary artery surgery. Current trends and impact on hospital resources. Circulation 1996; 94: 390-7. https://doi.org/10.1161/01.CIR.94.3.390 PMid:8759081 |
||||
| 31. Phan K, Ha HSK, Phan S, et al. New-onset atrial fibrillation following coronary bypass surgery predicts long-term mortality: a systematic review and meta-analysis. Eur J Cardio-Thorac Surg 2015; 48: 817-24. https://doi.org/10.1093/ejcts/ezu551 PMid:25602053 |
||||
| 32. Fang ZA, Navaei AH, Hensch L, et al. Hemostatic Management of Extracorporeal Circuits Including Cardiopulmonary Bypass and Extracorporeal Membrane Oxygenation. Semin Thromb Hemost 2020; 46: 62-72. https://doi.org/10.1055/s-0039-3400273 PMid:31858515 |
||||
| 33. Thorén E, Hellgren L, Jidéus L, et al. Prediction of postoperative atrial fibrillation in a large coronary artery bypass grafting cohort. Inter CardioVasc Thorac Surg 2012; 14: 588-93. https://doi.org/10.1093/icvts/ivr162 PMid:22314010 PMCid:PMC3329319 |
||||
| 34. Kaw R, Hernandez AV, Masood I, et al. Short- and long-term mortality associated with new-onset atrial fibrillation after coronary artery bypass grafting: a systematic review and meta-analysis. J Thorac Cardiovasc Surg 2011; 141: 1305-12. https://doi.org/10.1016/j.jtcvs.2010.10.040 PMid:21247589 |
||||
| 35. Patel A, Ngo L, Woodman RJ, et al. Institutional variation in early mortality following isolated coronary artery bypass graft surgery. Int J Cardiol 2022; 362: 35-41. https://doi.org/10.1016/j.ijcard.2022.04.080 PMid:35504451 |
||||
| 36. Filardo G, Hamilton C, Hebeler RF Jr, et al New-onset postoperative atrial fibrillation after isolated coronary artery bypass graft surgery and long-term survival. Circ Cardiovasc Qual Outcomes 2009; 2: 164-9. https://doi.org/10.1161/CIRCOUTCOMES.108.816843 PMid:20031833 |
||||