05. tbl. 111. árg. 2025
Fræðigrein
Rannsókn. Svipgerðir og faraldsfræði framheilabilunar á Íslandi
Greinin barst 10 janúar 2025, samþykkt til birtingar 19. mars 2025
Bréfaskriftum vegna greinarinnar svarar Helga Eyjólfsdóttir helgaeyj@landspitali.is
Inngangur
Framheilabilun er flokkur taugahrörnunarsjúkdóma með þrjár klínískar svipgerðir sem hver um sig hefur mismunandi einkenni. Meingerð framheilabilunar einkennist af hrörnun í ennis- og gagnaugablöðum heila. Markmið rannsóknarinnar var að kanna algengi og nýgengi framheilabilunar á Íslandi síðastliðna áratugi og að afla frekari upplýsinga um lýðfræði, klínísk einkenni og greiningaraðferðir ásamt því að bera saman svipgerðir sjúkdómsins með tilliti til klínískra einkenna. Gert er ráð fyrir að sjúklingar með þennan sjúkdóm fái greiningu og séu í eftirfylgd á minnismóttöku Landspítala.
Efni og aðferðir
Rannsóknarþýðið samanstóð af einstaklingum sem höfðu fengið greininguna framheilabilun frá upphafi rafrænnar sjúkraskrár á Landspítala til ársins 2022. Sjúkraskrárkerfi Landspítala voru notuð til gagnasöfnunar og lýsandi og greinandi tölfræðiaðferðir notaðar til gagnaúrvinnslu.
Niðurstöður
Hlutfall framheilabilunar í minnismóttökuþýði frá árunum 2008-2022 reyndist vera 1,7% en á öllu tímabilinu hlutu samtals 97 einstaklingar sjúkdómsgreiningu, 50 karlar og 47 konur. Algengi var 45,3/100.000 íbúa og meðal nýgengi 11,67/100.000/ár. Meðalaldur við upphaf klínískra einkenna var 67 ár. Hegðunarafbrigði (behavioural variant) framheilabilunar var algengasta svipgerðin og algengasta klíníska einkennið allra þriggja svipgerða var minnistruflun.
Umræður
Algengi framheilabilunar á íslandi er lægra en lýst hefur verið í nokkrum fyrri rannsóknum en samanburður á nýgengi er erfiður þar sem aldurshópar þýða eru breytilegir milli rannsókna. Tíðni í minnismóttökuþýði var lágt, sem endurspeglar sjaldgæfi framheilabilunar. Meðalaldur við greiningu var hærri á Íslandi en lýst er í erlendum rannsóknum og sömuleiðis var tíðni minnistruflunar sem upphafseinkennis hærri hérlendis en erlendis. Greiningaraðferðir hafa þróast á síðustu árum og greiningarferli er ítarlegra en áður.
Inngangur
Framheilabilun (frontotemporal dementia (FTD)) er sjaldgæfur taugahrörnunarsjúkdómur sem þó er talinn ein algengasta orsök snemmkominnar heilabilunar ásamt Alzheimer.1 Upphaf og einkenni snemkominnar heilabilunar eru fyrir 65 ára aldur samkvæmt alþjóðlegum skilgreiningum.2 Einkenni framheilabilunar byrja oft enn fyrr, eða í kringum sextugt, en þó eru dæmi um að sjúkdómurinn hafi byrjað að gera vart við sig við enn yngri aldur.3 Faraldsfræði framheilabilunar er lítið rannsökuð en algengi miðað við erlendar rannsóknir er talið vera á bilinu 15-22/100.000 íbúa í aldurshópnum 45-64 ára og nýgengið 2,7-4,1/100.000 persónuár, sjúkdómurinn er algengari á meðal karla og þá sérstaklega hegðunarafbrigði framheilabilunar. Framheilabilun er ágengur taugahrörnunarsjúkdómur og lifun er talin vera á bilinu sex til 11 ár eftir upphaf einkenna.1,4,5
Meingerð framheilabilunar felur í flestum tilfellum í sér rýrnun á ennisblaði og fremra gagnaugablaði. Nánast öll svæði heilans verða fyrir áhrifum en dæmigert er þó að aftari svæði heilans, þá helst hnakkablaðið, séu varðveitt þangað til seint í sjúkdómsferlinu.6,7
Flokka má meingerðir eftir því hvaða próteinútfellingar eru til staðar. Í FTLD-tau meingerð (frontotemporal lobar degeneration-tau), sem veldur allt að helmingi tilfella framheilabilunar, falla tau-prótein innlyksur (inclusions) út í taugafrumum8, áður kallaðar Picks útfellingar. FTLD-tau neikvæðar meingerðir skiptast svo í undirflokka og er þar FTLD-TDP (TAR DNA-binding protein 43) algengust, þar sem sjá má ubiquitin-útfellingar úr TDP-43 próteininu. Ekki ríkir fullt samræmi milli svipgerða og meingerða framheilabilunar, einkenni mismunandi meingerða geta skarast og sömuleiðis er lítið samræmi milli meingerða og rýrnunarmynsturs.8,9
Einkennamynd framheilabilunar getur því verið mismunandi og helgast af því hvort heilarýrnun herjar fyrst og fremst á ennis- eða gagnaugablöð heilans. Eftir því sem líður á sjúkdóm verður vaxandi skörun á einkennum svipgerðanna. Skilgreindar hafa verið þrjár meginsvipgerðir sjúkdómsins með tilliti til þess hvaða einkenni eru mest áberandi.
a) Hegðunarafbrigði framheilabilunar (frontotemporal dementia, behavioral variant, bvFTD) einkennist af breytingum á persónuleika og hegðun og má þar nefna einkenni eins og hömluleysi og framtaksleysi. Einstaklinginn skortir venjulega innsæi í einkenni sín. Athygli og vinnsluminni geta verið skert en atburðaminni er misjafnlega varðveitt. Í bvFTD má oft sjá samhverfa rýrnun í ennisblaði. Framtaksleysi tengist rýrnun í bak- og miðlægu (dorsomedial) ennisblaði á meðan hömluleysi tengist rýrnun í augntóttarhluta ennisblaðs (orbitofrontal area).10,11
b) Hrörnunarmálstol (primary progressive aphasia, PPA) sem skiptist í:
i) Framburðarmálstol (progressive nonfluent aphasia, PNFA) sem einkennist af áreynslumiklum framburði tals, málfræðilegum villum og mállegu verkstoli. Hegðunareinkenni koma sjaldnar fram í PNFA svipgerðinni miðað við hinar svipgerðirnar, vinnslu- minni og stýrifærni eru venjulega lítillega skert en atburðarminni varðveitt. Á segulómun hjá einstak- lingum með PNFA sést oft rýrnun í heilavef umhverfis hliðlæga heilaskor (fissura Sylvii) samsvarandi Wernicke- og Broca-svæðum.10,12
ii) Merkingarmálstol (semantic variant FTD eða semantic dementia, SD) einkennist af vaxandi tapi á málskiln- ingi og þekkingu á orðum og hugtökum á meðan máltján- ing er varðveitt en verður yfirleitt óskipuleg. Í fremra gagnaugablaði verður ósamhverf rýrnun og einkenni eru mismunandi eftir því hvoru megin rýrnunin er meiri. Einstaklingar með meiri rýrnun vinstra megin sýna stigvaxandi afturför á merk- ingarlegri þekkingu á hlutum, hugtökum og orðum. Ef rýrnun er meiri hægra megin í fremra gagnaugablaði eru einkenni líkari hegðunarafbrigði.10,12
Erfðir eru eini þekkti áhættuþáttur framheilabilunar og milli 30 og 50% einstaklinga sem greinast með sjúkdóminn eiga að minnsta kosti einn ættingja með framheilabilun.13
Í arfgengum tilfellum framheilabilunar er stökkbreyting í einu af þremur genum í 80% tilfella: MAPT, GRN eða C9orf72.14
Greining framheilabilunar er byggð á klínískum einkennum, greiningarskilmerkjum framheilabilunar, nákvæmri taugaskoðun og vitrænum prófunum, einkum taugasálfræðilegu mati, ásamt tæknilegum rannsóknum. Segulómun af heila er framkvæmd til að rannsaka staðbundna heilarýrnun í ennis- eða gagnaugablöðum og til að útiloka aðrar undirliggjandi orsakir einkenna. Mænuvökvarannsókn er einkum gerð til að útiloka merki um Alzheimer-sjúkdóm en sértæk lífmerki (bio- markers) í mænuvökva fyrir framheilabilun eru ekki til. Einnig er hægt að gera jáeindarannsókn með sykurbindiefni (fluorodeoxyglucose-positron emission tomography, FDG-PET) með tilliti til þess hvort staðbundin minnkuð sykurupptaka sést í framheila eða gagnaugablöðum, sem endurspeglar þá minnkuð efnaskipti í þeim hluta heilans.7,15 Greiningarskilmerki fyrir bvFTD voru gefin út af samtökum fyrir framheilabilun (The Association for frontotemporal degeneration) árið 2011.16,17 Einnig eru greining-arskilmerki fyrir framheilabilun í fimmtu útgáfu geðsjúkdómakerfis bandarísku geðlæknasamtakanna (The Diagnostic and Statistical Manual of Mental Disorders (DSM-5)) og eru þar flokkuð í mögulega framheilabilun (possible) eða líklega (probable).18
Sértæk lyfjameðferð við framheilabilun er ekki til og beinist meðferð að meðhöndlun geðrænna einkenna, til dæmis þunglyndis eða geðrofseinkenna, eftir því sem við á. Fáar rannsóknir hafa verið gerðar á einkennameðferð við sértækum einkennum framheilabilunar og byggist því meðferðin að langmestu leyti á klínískri reynslu sérfræðilækna með reynslu af sjúkdómnum.19
Faraldsfræði framheilabilunar hefur ekki verið könnuð áður á Íslandi og í alþjóðlegu samhengi eru til fáar rannsóknir á faraldsfræði og svipgerðum framheilabilunar.
Markmið rannsóknarinnar var að kanna algengi og nýgengi framheilabilunar á Íslandi síðastliðna áratugi og að afla frekari upplýsinga um lýðfræði, klínísk einkenni og greiningaraðferðir ásamt því að bera saman svipgerðir sjúkdómsins. Vegna eðlis framheilabilunar verður að teljast líklegt að nánast allir sjúklingar sem greinst hafa með framheilabilun hafi komið í greiningarferli á minnismóttöku Landspítalans eða séu þar í eftirliti á einhverjum tíma. Undirmarkmið var að kanna lyfjanotkun einstaklinga með framheilabilun við sjúkdómsgreiningu.
Efnviður og aðferðir
Leyfi
Tilskilin leyfi frá framkvæmdastjóra lækninga á Landspítala og Siðanefnd vísindarannsókna (VRN) á Landspítala (20/2023) lágu fyrir áður en rannsóknin hófst.
Gagnaöflun
Rannsóknin var afturskyggn ferilrannsókn. Rannsóknin náði til allra einstaklinga sem fengið höfðu sjúkdómsgreininguna framheilabilun með ICD-10 greiningarnar F02.0 og G31.0 frá 1997-2022. Kennitölur sjúklinga sem hlotið höfðu sjúkdóms- greininguna voru afhentar rannsakendum frá vöruhúsi gagna á Hagdeild Landspítala í kjölfar samþykkis (VRN). Upplýsinga um svipgerð framheilabilunar, niðurstöður rannsókna og lyfjanotkun var aflað úr sjúkraskrá Landspítala. Ekki reyndist unnt að afla nægilegra upplýsinga um einstaklinga sem hlotið höfðu sjúkdómsgreiningu fyrir 2008 og voru því notuð gögn frá 2008-2022 í faraldsfræðilegri úrvinnslu. Þó voru notuð þau klínísku gögn sem fundust fyrir þá sem greindir voru fyrir 2008 fyrir lýsandi tölfræði.
Klínískar breytur
Notaðar voru við eftirfarandi klínískar breytur: Ár við sjúkdómsgreiningu, aldur við upphaf einkenna, aldur við sjúkdómsgreiningu, aldur við andlát , klínísk einkenni við greiningu, fyrri saga um geðsjúkdóma, lyfjameðferð við greiningu, MMSE skor, niðurstöður taugasálfræðilegs mats, upplýsingar um tegund myndgreiningarrannsóknar (segulómun, tölvusneiðmynd, SPECT eða jáeindarannsókn), niðurstöður mænuvökvarannsókna, svipgerð framheilabilunar og sjúkdómskóði skv. 10.útgáfu International Classification of Diseases (ICD-10). Einnig var upplýsingum aflað um rýrnunarbreytingar í heila, almenn rýrnun í heilaberki (global cortical atrophy, GCA), gráða fyrir smáæðasjúkdóm í heila (Fazekas), gráða fyrir rýrnun í hvirfilblöðum (Koedam) og gráða fyrir rýrnun í gagnaugablöðum (medial temporal atrophy MTA) .
Tölfræðiúrvinnsla
Tölfræðileg úrvinnsla gagna fór fram í Microsoft Excel®, R studio og SPSS. Flokkabreytum er lýst með fjölda og prósentuhlutfalli. Kí-kvaðrat tilgátupróf var notað fyrir samanburð á flokkabreytum en ef gildi voru færri en 10 fyrir hverja breytu var Fisher tilgátupróf notað. Tölfræðileg marktækni var ákvörðuð við p-gildi <0,05. Kannað var hvort samfelldar breytur fylgdu normaldreifingu með Kolmogorov-Smirnov prófi. Miðgildi með tíundu hundraðshlutamörkum (percentile) var gefið upp fyrir breytur sem fylgdu ekki normaldreifingu. Meðaltal og staðalfrávik var gefið fyrir þær breytur sem fylgdu normaldreifingu. Algengi og nýgengi var reiknað með því að nota fólksfjöldatölur frá Hagstofu Íslands (aðgengilegar á vefsíðu Hagstofunnar) og hlutfall í minnismóttökuþýði var reiknuð með því að nota fjölda koma á minnismóttöku Landspítala, með tölum sem fengust frá Hagdeild Landspítala.
Niðurstöður
Fjöldi einstaklinga sem fengu greininguna framheilabilun frá upphafi rafrænnar sjúkraskrár á Landspítala reyndist 97. Af þeim voru 56,7% greindir með bvFTD, 1,0% með SD og 11,3% með PNFA. Í 27,8% tilfella var ekki að finna upplýsingar um svipgerð og í 2,1% tilfella var greiningin progressive supranuclear palsy (PSP) eða corticobasal syndrome (CBS) en einkennamynd þessara heilkenna getur svipað til framheilabilunar og þessir einstaklingar því hafðir með í tölfræðilegum greiningum.
Algengi, nýgengi og hlutfall í minnismóttökuþýði
Algengi framheilabilunar á Íslandi var 13,4/100.000 íbúa í aldurshópnum 45 ára og eldri, 11,0/100.000 íbúa í aldurshópnum 45-64 ára og 34,3/100.000 í aldurshópnum 65 ára og eldri þann 1. janúar 2023. Meðal árlegt nýgengi framheilabilunar frá 2008-2022 meðal 45 ára og eldri var 4,6/100.000 íbúa, 1,6/100.000 í 45-64 ára og 10,1/100.000 í 65 ára og eldri. Meðalhlutfall framheilabilunar í minnismóttökuþýði var 1,7% á árunum 2008-2022 en heildarfjöldi einstaklinga sem leituðu á minnismóttöku Landspítala á tímabilinu var 5.678. Við lok gagnasöfnunar voru 20,6% einstaklinganna enn á lífi. Miðgildi lifunar frá sjúkdómsgreiningu var þrjú ár.
Lýðfræði og klínískar bakgrunnsupplýsingar
Tafla I sýnir lýðfræðilegar upplýsingar um rannsóknarþýðið. Lyfjameðferð sjúklinga í fyrstu komu og aftur þremur mánuðum eftir sjúkdómsgreiningu var skoðuð.
Lægsti aldur við upphaf einkenna var 50 ár og hæsti 93 ár. Kynjahlutfall var nánast jafnt. Fyrri saga um geðsjúkdóm var til staðar í um 35% tilfella (þar með talið þunglyndi og kvíði). Algengasti lyfjaflokkurinn við sjúkdómsgreiningu var þunglyndislyf, þar á eftir hjartalyf, þar með talin blóðfitulækkandi lyf og blóðþrýstingslyf.
Aldursdreifing
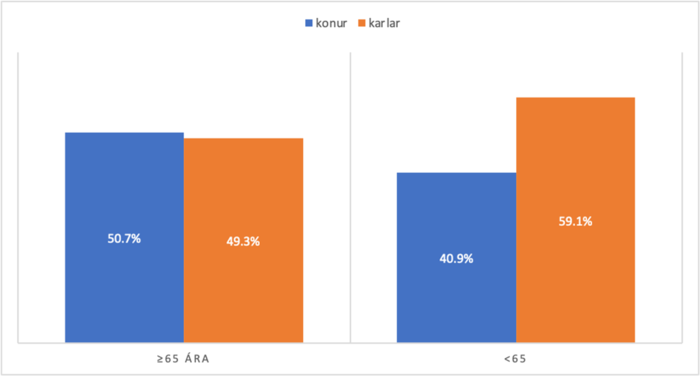
Upplýsingar um aldur við upphaf einkenna voru ekki aðgengilegar fyrir 23 (23,7%) einstaklinga. Alls 74 einstaklingar höfðu viðeigandi upplýsingar aðgengilegar, þar af voru 41,9% undir 65 ára aldri við upphaf einkenna og 58,1% voru 65 ára eða eldri við upphaf einkenna. Jafnframt voru 77,3% sjúklinga 65 ára eða eldri við greiningu á móti aðeins 22,7% undir 65 ára aldri og var sá munur tölfræðilega marktækur (p-gildi: <0,05).
Klínísk einkenni
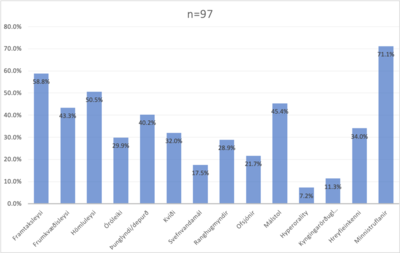
Algengasta einkenni sjúklinga við fyrstu komu á minnismóttöku var minnistruflun og reyndist ekki marktækur munur á tíðni minnistruflunar milli karla og kvenna (p-gildi: 0,75). Samanburður á tíðni minnistruflunar við fyrstu komu í mismunandi aldurshópum leiddi í ljós að 76% af þeim sem voru ≥65 ára og 55% <65 ára höfðu minnistruflanir við upphaf greiningarferlis en ekki reyndist marktækur munur á aldurshópunum (p-gildi: 0,092). Næst algengasta einkennið var framtaksleysi, þriðja algengasta hömluleysi, fjórða málstol og svo frumkvæðisleysi.
Niðurstöður klínískra athugana og rannsókna
Algengasta myndgreiningaraðferð var tölvusneiðmynd, þar á eftir segulómun. SPECT (single-photon emission computed tomography) og jáeindarannsóknir voru sjaldnar notaðar en sú síðarnefnda var aðeins aðgengileg allra síðustu ár tímabilsins. Algengasta klíníska matið til grundvallar sjúkdómsgreiningu var MMSE (mini-mental state examination) en um 80% greindra fóru í MMSE, 32% þeirra fengu skor ≤23 stig af 30 mögulegum. Meðal MMSE-skor við greiningu var 24. Taugasálfræðilegt mat var gert í um 53% tilvika, af þeim voru um 65% með skerta stýrifærni. Mælingar á lífmerkjum í mænuvökva voru gerðar í 34% tilvika, en af þeim tókst ekki að finna rannsóknarsvar úr mænuvökva hjá 6 einstaklingum. Lífmerki sem voru mæld voru amyloid-b, fosfó-tau (fosfórýlerað tau-prótein), heildar tau-prótein og neurofilament light protein (NfL). Tafla II sýnir hlutfall klínískra mata og rannsókna til grundvallar sjúkdómsgreiningu og niðurstöður valinna rannsókna.

Samanburður á svipgerðum
Einstaklingar greindir með bvFTD reyndust 55, einn einstaklingur greindist með SD og 11 með PNFA. Málstolssvipgerðirnar SD og PNFA voru sameinaðar í málsstolshópinn PPA (n=12) vegna þess hve fámennt var í undirhópunum.
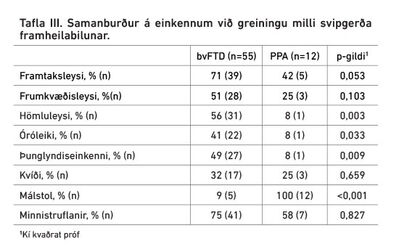
Framtaksleysi, hömluleysi, óróleiki og þunglyndiseinkenni voru marktækt tíðari hjá bvFTD hópnum en málstolseinkenni marktækt tíðari í PPA hópnum eins og má sjá í töflu III.
Myndgreiningarrannsóknir
Upplýsingar um rýrnun í miðlægu gagnaugablaði á segulómun (MTA) var að finna hjá aðeins 25 einstaklingum en hjá níu voru upplýsingar um MTA gráðu til staðar en ekki svipgerð. MTA gráða er aldursstaðlað mat á rýrnun á myndgreiningu, til dæmis segulómun, í miðlægu gagnaugablaði frá 0-4. Hjá einstaklingum yfir 75 ára aldri telst óeðlileg MTA gráða vera þrír eða hærri en fyrir einstaklinga yngri en 75 ára telst MTA gráða tveir eða hærra óeðlileg. Þrír í bvFTD-hópnum höfðu óeðlilega MTA gráðu og einn í PPA-hópnum, en munurinn var ómarktækur. Við notuðumst við þá nálgun að reikna meðaltal á MTA gráðu vinstri og hægri hliðar og meðaltal MTA gráðu alls hópsins reyndist vera 1,35. Upplýsingar um gráðu almennrar rýrnunar í heilaberki (global cortical atrophy, GCA), Koedam gráðu (gráða rýrnunar á í hvirfilblöðum heila) og Fazekas gráðu (gráða smáæðasjúkdóms í heila á SÓ) var ekki að finna hjá nógu mörgum einstaklingum til þess að hægt væri að gera samanburð.
Niðurstöður lífmerkjamælinga í mænuvökva
Mænuvökvi var tekinn hjá 34% einstaklinga. Hækkað heildar-tau prótein var að finna í mænuvökva níu einstaklinga, af þeim var einn þar sem ekki voru til staðar upplýsingar um svipgerð og samanburður því gerður fyrir 8 einstaklinga. Hækkað fosfó-tau próteini var að finna í mænuvökva tíu einstaklinga, af þeim vantaði upplýsingar um svipgerð hjá einum einstaklingi og samanburður því gerður á níu einstak- lingum. NfL var hækkað hjá níu einstaklingum, þar af voru ekki upplýsingar um svipgerð hjá tveimur, svo samanburður var gerður á sjö einstaklingum.
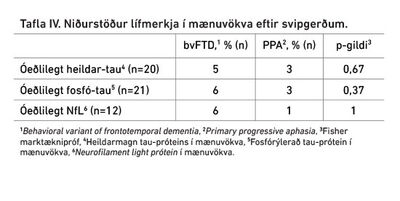
Ekki var marktækur munur á magni neins lífmerkis í mænuvökva á milli svipgerða. Tafla IV sýnir samanburð á mænuvökvarannsóknum (heildar-tau, fosfó-tau og NfL) í hópunum tveimur.
Umræður
Algengi framheilabilunar á Íslandi er lægra en lýst hefur verið áður í nokkrum erlendum rannsóknum. Einstaka erlendar rannsóknir hafa þó lýst lægra algengi og þannig er misræmi á milli rannsókna hvað varðar birt algengi. Því er ekki hægt að fullyrða að framheilabilun sé sjaldgæfari eða algengari á Íslandi miðað við önnur lönd og önnur þýði. Nýgengi fram- heilabilunar virðist einnig vera mismunandi, auk þess sem mismunandi aldurshópar eru teknir inn í útreikninga á ný- gengi í mismunandi rannsóknum, sem gerir samanburð á milli rannsókna erfiðan. Tíðni framheilabilunar í minnismóttöku-þýði er lág sem endurspeglar sjaldgæfi sjúkdómsins og samræmist þokkalega niðurstöðum úr sænsku heilabilunarskránni SveDem.20 Meðalaldur við bæði greiningu og upphaf einkenna var hærri á Íslandi en lýst er í erlendum rannsóknum. Rannsóknin sýndi að einungis 22% fengu einkenni fyrir 65 ára aldur. Sömuleiðis var tíðni minnistruflunar sem upphafseinkennis talsvert hærri í okkar rannsókn en í fyrri rannsóknum, sem gæti að hluta til verið vegna þess að aldur við upphaf einkenna virðist hærri á Íslandi. Greiningaraðferðir hafa þróast á síðustu árum og greiningarferli er ítarlegra en áður og er því tíðni sjúkdómsins hærri á fyrri hluta rannsóknartímabilsins, sem gæti endurspeglað nákvæmara greiningarferli á seinni hluta tímabilsins.
Faraldsfræði
Minnismóttaka Landspítala er tilvísunarmóttaka stærsta hluta landsins fyrir einstaklinga 65 ára og yngri og þegar grunur er um sjaldgæfa heilabilunarsjúkdóma en einhver tilfelli gætu hafa verið greind á minnismóttökunni á Akureyri. Því má ætla að flest tilfelli framheilabilunar á Íslandi komi til greiningar á Landspítalanum og teljum við því að rannsóknin nái yfir nánast alla sem fengu sjúkdómsgreiningu á tímabilinu. Í því ljósi teljum við að hægt sé að reikna algengi og nýgengi framheila- bilunar á Íslandi út frá gögnum rannsóknarinnar.
Greining framheilabilunar er áskorun vegna þess hve sjaldgæfur sjúkdómurinn er. Sjúkdómsgreiningin byggir á klínískum einkennum, studd af fremur ósértækum rannsóknum og lífmerkjum. Sjúkdómsgreiningin getur því verið flókin, ekki síst þar sem einkennamyndin getur verið margbreytileg. Því eru fáar rannsóknir til um faraldsfræði framheilabilunar, sem gerir samanburð við erlendar rannsóknir snúinn. Algengið í íslenska þýðinu í aldurshópnum 45-64 ára var 11,0/100.000 íbúa en til samanburðar sýndi samantektarrannsókn (meta-analysis) frá 2014 algengi á bilinu 15-22/100.000 í aldurshópnum 45-64 ára.21 Í Cambridge var algengið 15,1/100.000 í aldurshópnum 45-64 ára,4 í London 15,422 en í Zuid í Hollandi 4,0.23 Í Reggio Calabria í Ítalíu var algengið í aldurshópnum 50+, 18/100.00024 samanborið við 13,40/100.000 hér í aldurshópnum 45 og eldri. Það gefur því auga leið að birt algengi virðist mismunandi en hafa þarf í huga að samanburður við erlendar rannsóknir getur reynst erfiður þar sem erlendar rannsóknir miða ekki allar við sambærilegan aldurshóp og okkar rannsókn. Ljóst er þó að framheilabilun er sjaldgæf í öllum þessum rannsóknum.
Í okkar rannsókn reyndist meðal árlegt nýgengi framheila- bilunar meðal >45 ára vera 4,6/100.000 íbúa, 1,6/100.000 í 45-64 ára og 10,1/100.000 í >65 ára.
Í samantektarrannsókn reyndist nýgengið vera 2,7-4,1/100.000 í aldurshópnum 45-64 ára, 3,5/100.000 í Cambridgeshire á Englandi og á Girona á Spáni 2,7/100.000 í sama aldurshóp.25-27 Nýgengið í Stokkhólmi var 1,7, 2,07 í Lundi og 3,21 í Uppsölum á hverja 100.000 íbúa en aldurshópar voru ekki tilgreindir. Gögn frá sænska heilabilunargagnagrunn-inum SveDem sýndu að tíðni framheilabilunar meðal 20.305 einstaklinga með heilabilun á árunum 2008-2011 var 1,7%. Þess ber þó að geta að greiningar í þeim grunni koma bæði frá heilsugæslu og minnismóttökum. Ef það er sundurgreint eins og gert er í ársskýrslum stofnunarinnar20 sést að tíðinin er 3-4% í minnismóttökuþýði en engin (0%) í heilsugæslu og í heild 2% á allra síðustu árum. Í þessari rannsókn og sam-kvæmt gögnum frá minnismóttöku var tíðni framheilabilunar 1,7% en væri sennilegast enn lægri ef einnig væru upplýsingar úr heilsugæslu en þær liggja ekki fyrir. Samkvæmt sænska heilabilunargagnagrunninum greindust 30,6% af tilfellum FTD fyrir 65 ára aldur,28 en hlutfallið í okkar rannsókn var lægra, eða 22%. Í bandarískri rannsókn frá 2018 greindust 73% einstaklinga fyrir 65 ára aldur.29 Aðrar rannsóknir hafa því sýnt mun lægri meðalaldur við upphaf einkenna en okkar rannsókn. Mismunandi aldursdreifing á milli landa gæti endurspeglað breytileika á greiningarferli og skráningu og mögulega er einnig breytileiki á samsetningu þýðanna, til dæmis með tilliti til kynþátta, en þörf er á stærri faraldsfræðilegum rannsóknum á framheilabilun, sem gæti þó reynst krefjandi vegna þess hve sjaldgæfur sjúkdómurinn er.
Rannsóknir á lifun einstaklinga sem greinst hafa með framheilabilun eru fáar og slíkar rannsóknir eru erfiðar í framkvæmd, sjúkdómurinn er sjaldgæfur, sjúklingarnir lifa yfirleitt í þó nokkur ár eftir greiningu og skráning á lifun krefst því mjög langrar eftirfylgdar. Rannsóknir hafa sýnt fram á miðgildi lifunar frá 7 til 13 ára frá greiningu í klínískum þýðum og 6-8 ár í krufningarrannsóknum.30 Í þessari rannsókn var miðgildi lifunar frá greiningu aðeins þrjú ár. Taka þarf tillit til þess að miðgildi greiningartíma (tíminn frá upphafi einkenna að sjúkdómsgreiningu) var þrjú ár og hefur hinn langi greiningartími áhrif til styttingar lifunar eftir sjúkdómsgreiningu. Hugsanlegar útskýringar á löngum greiningartíma er að einstaklingar (eða aðstandendur þeirra) með framheilabilun þekki ekki einkenni sjúkdómsins og séu því lengi að leita til læknis, innsæisleysi ríki sjá sjúklingnum sjálfum varðandi einkennin eða einkennin séu misgreind sem geðsjúkdómur og sjúklingum vísað annað í heilbrigðiskerfinu, til dæmis á geðdeildir, áður en greiningarferli hefst á minnis-móttöku.
Klínísk einkenni og safngreining
Algengasta upphafseinkennið var minnistruflun, en 71% greindu frá minnistruflun sem upphafseinkenni. Ekki var marktækur munur á tíðni minnistruflunar milli svipgerða. Þetta kemur nokkuð á óvart og er hærra hlutfall en áður hefur verið greint frá.31 Svissnesk rannsókn frá 2016 fann að 56% höfðu minnistruflanir snemma í sjúkdómsferlinu en í yfirlits-grein frá 2009 er sagt frá að aðeins 10% einstaklinga hafi minnistruflun sem upphafseinkenni.32 Hafa þarf þó í huga að íslenska þýðið er heldur eldra en rannsóknarþýði flestra annarra rannsókna á framheilabilun og getur það haft áhrif á einkennamynd rannsóknarþýðisins. Einkenni sem lýst er í viðtali eru huglæg upplifun sjúklings, og oft einnig aðstandanda, og geta þættir eins og skert innsæi einstaklinga með framheilabilun haft áhrif þar á ásamt því að þekkingarleysi á vitrænum einkennum meðal almennings gerir það að verkum að fólk setur gjarnan einkenni hugrænnar skerðingar undir sama hatt „minnistruflunar“. Þannig gætu erfiðleikar við að finna orð og hægara tal, skert einbeiting og hægari hugsun verið talin minniskerðing í augum aðstandenda. Þó verður að teljast ólíklegt að mikill munur sé á milli landa hvað varðar áreiðanleika sjúkrasögu um minnistruflun og málstol.
Þunglyndiseinkenni, framtaksleysi, óróleiki og hömluleysi voru marktækt tíðari hjá bvFTD-hópnum en PPA-hópnum. Málstol var jafnframt marktækt tíðara einkenni hjá PPA-hópnum eins og við var að búast þar sem málstolseinkenni eru nauðsynleg til greiningar á PPA. Ekki var marktækur munur á öðrum einkennum eins og frumkvæðisleysi eða kvíða. Í bvFTD-hópnum voru 55 einstaklingar og í PPA aðeins 12, sem gerir tölfræðilegan samanburð óáreiðanlegan.
Við gagnasöfnun komu í ljós aukin gæði greiningarferlis, skilgreind sem nákvæmara greiningarferli, bæði hvað varðar klínískt mat og tæknilegar rannsóknir ásamt því að flokkun svipgerða framheilabilunar á síðustu tíu árum varð nákvæm- ari. Er það í takt við aukna þekkingu á framheilabilun og svipgerðum sjúkdómsins auk betra aðgengis að sértækum rannsóknum miðað við fyrri hluta tímabilsins. Eftir yfirferð sjúkraskráa voru tilfelli sem virtust ekki nægilega rökstudd miðað við nýjustu þekkingu á sjúkdómnum útilokuð. Tíðni sjúkdómsins á seinni hluta rannsóknartímabilsins (2013 og síðar) virðist því heldur lægri en fyrri hluta (2012 og fyrr).
Kostir og gallar rannsóknarinnar
Styrkur rannsóknarinnar er meðal annars gott aðgengi að gögnum fyrir íslenska sjúklinga, ætla má að flestir sem hafa greinst með sjúkdóminn séu með í rannsókninni þar sem minnismóttaka Landsspítala er tilvísunarmóttaka fyrir mestallt landið fyrir yngri einstaklinga og einstaklinga með sjald- gæfari sjúkdóma sem valda heilabilun. Möguleiki er þó á því að einstaklingar með sjúkdóminn hafi ekki fengið rétta ICD-10 greiningu og hafi því ekki verið fangaðir í tölfræðilegri úrvinnslu þessarar rannsóknar sem, gæti hafa leitt til vanmats á tíðni sjúkdómsins.
Veikleikar rannsóknarinnar felast meðal annars í afturskyggnri gagnasöfnun með lestri sjúkraskráa sem eru klínísk gögn sem ekki eru skráð með það að sjónarmiði að faraldsfræðilegum gögnum sé safnað og því ekki stöðluð. Þess vegna komu ekki alltaf fram þær upplýsingar sem leitað var að en þetta er þó veikleiki allra afturskyggnra faraldsfræðilegra gagnarannsókna. Rannsóknir á klínískum einkennum framheilabilunar hafa leitt til aukinnar flokkunar í svipgerðir og framþróun í mælingum á lífmerkjum á myndgreiningu og í mænuvökva hafa leitt til þess að greiningarferlið hefur breyst á tímabilinu sem rannsóknin náði yfir. Mögulega hefðu ákveðnar niðurstöður rannsóknarinnar verið aðrar ef allir einstaklingarnir hefðu fengið svipgerðargreiningu og það hefði sömuleiðis gert samanburð á milli hópa mögulegan.
Rannsóknin sýnir að framheilabilun er sjaldgæfur sjúkdómur á Íslandi. Nýgengið reyndist hærra meðal fólks sem er eldra en 65 ára en hjá yngri aldurshópum, sem er öndvert við erlendar niðurstöður. Minnistruflun var algengara upphafseinkenni í íslenska þýðinu en lýst hefur verið annars staðar. Einnig varpar rannsóknin ljósi á þær miklu framfarir sem hafa orðið á þekkingu og í greiningu á framheilabilun, sem endurspeglast í nákvæmara greiningarferli og flokkun í svipgerðir. Niðurstöðurnar og samanburður við erlendar rannsóknir endurspegla jafnframt þörf á frekari rannsóknum á faraldsfræði framheilabilunar á heimsvísu.
Þakkir
Þakkir fá skjólstæðingar minnismóttöku Landspítala og aðstandendur þeirra. Einnig fær starfsfólk minnismóttöku þakkir fyrir aðstoð og útskýringar við gerð rannsóknarverkefnis. Þakkir fá sömuleiðis starfsfólk Hagdeildar Landspítala fyrir veitta aðstoð við gagnaöflun.
Heimildir
| 1.
Hogan DB, et al. The Prevalence and Incidence of Frontotemporal
Dementia: a Systematic Review. Can J Neurol Sci 2016; 43 Suppl 1:
S96-S109. https://doi.org/10.1017/cjn.2016.25 PMid:27307130 | ||||
| | ||||
| 2. Clinical descriptions and diagnostic requirements for ICD-11 mental, behavioural and neurodevelopmental disorders. World Health Organization, Geneva 2024. | ||||
| | ||||
| 3.
Johnson JK, et al. Frontotemporal lobar degeneration: demographic
characteristics of 353 patients. Arch Neurol 2005; 62(6): 925-30. https://doi.org/10.1001/archneur.62.6.925 PMid:15956163 | ||||
| | ||||
| 4. Ratnavalli E, et al. The prevalence of frontotemporal dementia. Neurology 2002; 58(11): 1615-21. https://doi.org/10.1212/WNL.58.11.1615 PMid:12058088 | ||||
| | ||||
| 5. Koedam EL, et al. Early-onset dementia is associated with higher mortality. Dement Geriatr Cogn Disord 2008; 26(2): 147-52. https://doi.org/10.1159/000149585 PMid:18679029 | ||||
| | ||||
| 6.
Perry DC, et al. Clinicopathological correlations in behavioural
variant frontotemporal dementia. Brain 2017; 140(12): 3329-3345. https://doi.org/10.1093/brain/awx254 PMid:29053860 PMCid:PMC5841140 | ||||
| | ||||
| 7. Josephs KA. Frontotemporal lobar degeneration. Neurol Clin 2007; 25(3): 683-96, vi. https://doi.org/10.1016/j.ncl.2007.03.005 PMid:17659185 PMCid:PMC2702867 | ||||
| | ||||
| 8.
Neumann M, Mackenzie IRA. Review: Neuropathology of non-tau
frontotemporal lobar degeneration. Neuropathol Appl Neurobiol 2019;
45(1): 19-40. https://doi.org/10.1111/nan.12526 PMid:30357887 | ||||
| | ||||
| 9. Roberson ED. Frontotemporal dementia. Curr Neurol Neurosci Rep 2006; 6(6): 481-9. https://doi.org/10.1007/s11910-006-0050-7 PMid:17074283 | ||||
| | ||||
| 10.
Rabinovici GD, Miller BL. Frontotemporal lobar degeneration:
epidemiology, pathophysiology, diagnosis and management. CNS Drugs 2010;
24(5): 375-98. https://doi.org/10.2165/11533100-000000000-00000 PMid:20369906 PMCid:PMC2916644 | ||||
| | ||||
| 11. Rosen HJ, et al. Neuroanatomical correlates of behavioural disorders in dementia. Brain 2005; 128(Pt 11): 2612-25. https://doi.org/10.1093/brain/awh628 PMid:16195246 PMCid:PMC1820861 | ||||
| | ||||
| 12.
Gorno-Tempini ML, et al. Cognition and anatomy in three variants of
primary progressive aphasia. Ann Neurol 2004; 55(3): 335-46. https://doi.org/10.1002/ana.10825 PMid:14991811 PMCid:PMC2362399 | ||||
| | ||||
| 13.
Binetti G, et al. Prevalence of TAU mutations in an Italian clinical
series of familial frontotemporal patients. Neurosci Lett 2003; 338(1):
85-7. https://doi.org/10.1016/S0304-3940(02)01330-7 PMid:12565146 | ||||
| | ||||
| 14.
Rademakers R, Neumann M, Mackenzie IR. Advances in understanding the
molecular basis of frontotemporal dementia. Nat Rev Neurol 2012; 8(8):
423-34. https://doi.org/10.1038/nrneurol.2012.117 PMid:22732773 PMCid:PMC3629543 | ||||
| | ||||
| 15. Chan DK, et al. Frontotemporal dementia - features, diagnosis and management. Aust Fam Physician 2011; 40(12): 968-72. | ||||
| | ||||
| 16. Rascovsky K, et al. Sensitivity of revised diagnostic criteria for the behavioural variant of frontotemporal dementia. Brain 2011; 134(Pt 9): 2456-77. | ||||
| | ||||
| 17. Gorno-Tempini ML, et al. Classification of primary progressive aphasia and its variants. Neurology 2011; 76(11): 1006-14. https://doi.org/10.1212/WNL.0b013e31821103e6 PMid:21325651 PMCid:PMC3059138 | ||||
| | ||||
| 18. Diagnostic and statistical manual of mental disorders. American Psychiatric Association, 2013(5th edition): 614-618. https://doi.org/10.1176/appi.books.9780890425596 | ||||
| | ||||
| 19. Tsai RM, Boxer AL. Treatment of frontotemporal dementia. Curr Treat Options Neurol 2014; 16(11): 319. https://doi.org/10.1007/s11940-014-0319-0 PMid:25238733 PMCid:PMC4920050 | ||||
| | ||||
| 20. SVEDEM Annual Report 2023. 2023, Svenska registret för kognitiva sjukdomar/demenssjukdomar. | ||||
| | ||||
| 21. Onyike CU, Diehl-Schmid J. The epidemiology of frontotemporal dementia. Int Rev Psychiatry 2013; 25(2): 130-7. https://doi.org/10.3109/09540261.2013.776523 https://doi.org/10.3109/09540261.2013.785169 | ||||
| | ||||
| 22.
Harvey RJ, Skelton-Robinson M, Rossor MN. The prevalence and causes of
dementia in people under the age of 65 years. J Neurol Neurosurg
Psychiatry 2003; 74(9): 1206-9. https://doi.org/10.1136/jnnp.74.9.1206 PMid:12933919 PMCid:PMC1738690 | ||||
| | ||||
| 23.
Rosso SM, et al. Frontotemporal dementia in The Netherlands: patient
characteristics and prevalence estimates from a population-based study.
Brain 2003; 126(Pt 9): 2016-22. https://doi.org/10.1093/brain/awg204 PMid:12876142 | ||||
| | ||||
| 24.
Bernardi L, et al. Epidemiology and genetics of frontotemporal
dementia: a door-to-door survey in southern Italy. Neurobiol Aging 2012;
33(12): 2948 e1-2948 e10. https://doi.org/10.1016/j.neurobiolaging.2012.06.017 PMid:22819134 PMCid:PMC5019339 | ||||
| | ||||
| 25.
Garre-Olmo J, et al. Incidence and subtypes of early-onset dementia in a
geographically defined general population. Neurology 2010; 75(14):
1249-55. https://doi.org/10.1212/WNL.0b013e3181f5d4c4 PMid:20810999 | ||||
| | ||||
| 26. Mercy L, et al. Incidence of early-onset dementias in Cambridgeshire, United Kingdom. Neurology 2008; 71(19): 1496-9. https://doi.org/10.1212/01.wnl.0000334277.16896.fa PMid:18981371 | ||||
| | ||||
| 27.
Knopman DS, et al. The incidence of frontotemporal lobar degeneration
in Rochester, Minnesota, 1990 through 1994. Neurology 2004; 62(3):
506-8. https://doi.org/10.1212/01.WNL.0000106827.39764.7E PMid:14872045 | ||||
| | ||||
| 28.
Nilsson C, et al. Age-related incidence and family history in
frontotemporal dementia: data from the Swedish Dementia Registry. PLoS
One 2014; 9(4): e94901. https://doi.org/10.1371/journal.pone.0094901 PMid:24722237 PMCid:PMC3983262 | ||||
| | ||||
| 29.
Seo SW, et al. Early vs late age at onset frontotemporal dementia and
frontotemporal lobar degeneration. Neurology 2018; 90(12): e1047-e1056. https://doi.org/10.1212/WNL.0000000000005163 PMCid:PMC5874448 | ||||
| | ||||
| 30. Onyike CU. What is the life expectancy in frontotemporal lobar degeneration? Neuroepidemiology 2011; 37(3-4): 166-7. https://doi.org/10.1159/000333347 PMid:22056969 PMCid:PMC3953732 | ||||
| | ||||
| 31.
Chandra SR, et al. Neuropsychiatric Symptoms in a Cohort of Patients
with Frontotemporal Dementia: Our Experience. Indian J Psychol Med 2016;
38(4): 326-30. https://doi.org/10.4103/0253-7176.185960 PMid:27570344 PMCid:PMC4980900 | ||||
| | ||||
| 32.
Papageorgiou SG, et al. Amnesia in frontotemporal dementia: shedding
light on the Geneva historical data. J Neurol 2016; 263(4): 657-64. https://doi.org/10.1007/s00415-015-8019-6 PMid:26810723 | ||||