02. tbl. 99. árg. 2013
Umræða og fréttir
Tveir læknar hlutu Nóbelsverðlaunin í efnafræði 2012


Magnús Karl Magnússon Guðmundur Þorgeirsson
prófessor í lyfja- og eiturefnafræði og yfirlæknir á Landspítala og prófessor
forstöðumaður rannsóknarstofu í lyfja- í lyflæknisfræði og deildarforseti læknadeildar HÍ
og eiturefnafræði við læknadeild HÍ
Nóbelsverðlaunin í efnafræði 2012 voru veitt fyrir rannsóknir á G-próteintengdum viðtökum og féllu í skaut tveimur bandarískum læknum, Robert J. Lefkowitz, prófessor í lyflæknisfræði og lífefnafræði við Duke-háskóla, og Brian K. Kobilka, prófessor í sameinda- og frumulífeðlisfræði og hjartasjúkdómafræði við Stanford-háskóla.
Í tilkynningu Konunglegu sænsku vísindaakademíunnar segir: „Líkaminn er fínstillt kerfi þar sem billjónir frumna eiga samskipti. Sérhver fruma býr yfir viðtökum sem skynja umhverfið og gera frumunni kleift að bregðast við nýjum aðstæðum. Robert Lefkowitz og Brian Kobilka fá Nóbelsverðlaunin í efnafræði fyrir uppgötvanir sem marka tímamót með því að varpa ljósi á það hvernig viðtakar úr ákveðinni fjölskyldu viðtaka, svokallaðra G-próteintengdra viðtaka, vinna sitt verk.“ Síðar í tilkynningunni segir: „Á síðasta ári (2011) urðu önnur tímamót þegar Kobilka og samstarfsmönnum hans tókst að ná mynd af b-adrenerga viðtakanum á því augnabliki sem hann binst hormóni og virkjast og sendir síðan boð inn í frumuna (mynd 1). Þessi mynd er efnafræðilegt meistaraverk – árangur áratuga rannsóknarvinnu.“
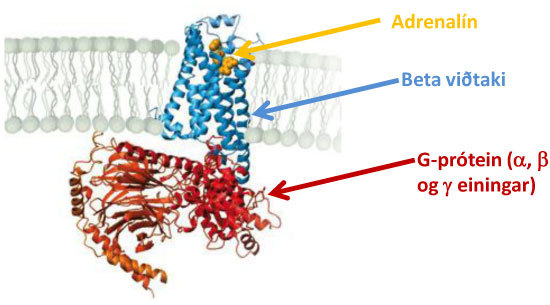
Mynd 1. Módel af kristallamynd þríþættrar samstæðu (ternary complex) sem er mynduð af adrenalíni (gult), beta-viðtaka (blár) og G-próteini (rautt). Byggir á kristallamyndatöku á því augnabliki þegar áverkunarefni binst viðtaka. Þessi binding leiðir til breyttrar afstöðu á innra borði viðtakans sem leiðir til bindingar og örvunar á G-próteininu.
Saga svokallaðra G-próteintengdra viðtaka er nátengd sögu lífeðlisfræði og frumulíffræði 20. aldar. Þessi fjölskylda telur um eitt þúsund viðtaka á yfirborði frumunnar.¹ Þeir skynja umhverfi frumunnar með bindingu við hormón og boðefni og þeir skynja einnig utanaðkomandi boð í formi ljóss eða lyktar. Um 40% allra lyfja skila verkun sinni í gegnum þessa mikilvægu fjölskyldu frumuviðtaka.
Robert Lefkowitz, læknir við lyflæknisdeild Duke-háskóla, hefur verið í fararbroddi vísindamanna við rannsóknir á G-próteintengdum viðtökum allt frá lokum sjöunda áratugs síðustu aldar. Árið 1970 birti hann greinar sem lýstu einangrun adrenvirkra viðtaka sem leyfðu nákvæmar mælingar á bindingu hormóns og viðtaka.² Árið 1980 setti hann ásamt samstarfsmönnum fram módel yfir það hvernig viðtakaörvun ætti sér stað. Módelið var kallað „ternary complex módel“ eða þríþætt samstæða³ og gerir ráð fyrir að miðlun örvunar verði í gegnum bindingu þriggja sameinda þegar viðtakinn örvast, það er áverkunarefnis, viðtaka og G-próteins. Þeir spáðu því að binding áverkunarefnis við viðtakann myndi valda breytingu í byggingu viðtakans á innra borði frumuhimnunnar sem síðan leiddi til bindingar við G-prótein. Slík binding örvaði G-próteinið og leiddi til boðflutnings inn í frumuna. Þetta módel hefur grundvallað skilning manna á samskiptum áverkunarefna og þessarar víðfeðmu viðtakafjölskyldu síðustu áratugi. G-próteinið er tímastillt boðefnissameind sem við örvun viðtaka bindur GTP í stað GDP en eftir GTP-bindinguna getur prót-einið örvað fjölda innri boðkerfa, meðal annars myndun á c-AMP. En G-próteinið hefur líka innbyggðan tímastilli, svokallaðan GTP-asa, sem klýfur GTP í GDP og við það slekkur sameindin á sér.
Brian Kobilka, læknir og vísindamaður við Stanford-háskóla, hóf vísindaferil sinn á rannsóknarstofu Lefkowitz um miðjan níunda áratuginn. Um það leyti hafði sameindaerfðafræðin hafið innreið sína í frumulíffræði og rannsóknarstofa Lefkowitz var í fararbroddi á sviði sameindaerfðafræði viðtaka. Það taldist til stórafreka er þeim tókst að einangra og raðgreina beta-1 viðtakann.⁴ Með samanburði við nýlega raðgreindan rhodopsin- viðtaka greindu þeir grundvallareiningu viðtakans, 7 mismunandi vatnsfælnar a-helix einingar sem gætu teygt sig gegnum frumuhimnuna. Þessi sameindarbygging einkennir alla G-próteintengda viðtaka og leggur grunn að skilningi á þessari stóru viðtakafjölskyldu, meðal annars því hvernig viðtakinn miðlar boðum sínum. Eftir að Kobilka hóf sinn sjálfstæða vísindaferil við Stanford-háskóla hefur hann lagt geysimikið af mörkum, sérstaklega hvað varðar skilning á þrívíddarbyggingu G-próteintengdra viðtaka. Sú vinna hefur dýpkað skilning á því hvernig binding áverkunarefnis við viðtaka leiðir til breytinga á þrívíddarbyggingu viðtakans og nær sá skilningur til hlutverks einstakra sameinda. Miklar framfarir í lyfjafræði hafa fylgt í kjölfarið, til dæmis aðferðir til að þróa áverkunarefni, viðtakahindra og jafnvel ný lyf sem geta örvað eða hindrað mismunandi boðferli í gegnum sama viðtaka. Eitt nýjasta vísindaafrek Kobilka var einmitt að ná mynd í nákvæmri upplausn af þrívíddarbyggingu hinnar þríþættu samstæðu,⁵ sem Lefkowitz hafði spáð fyrir um rúmum 30 árum fyrr. Þetta var mikið afrek enda lifir slík samstæða örstutt auknablik en skilningur á nákvæmri uppbyggingu hennar er lykill að skilningi á því flókna ferli sem boðskipti gegnum frumuhimnuna er.
Það er tímanna tákn að skilningur á nákvæmum efna- og frumusamskiptum mannslíkamans sé kominn á það stig að verðskulda Nóbelsverðlaun í efnafræði. Hraði framfaranna er slíkur að á ferli eins vísindamanns, Robert Lefkowitz, hefur þekkingin þróast úr óljósri mynd af boðskiptum sem vekja lífeðlisfræðilega svörun í mannslíkamanum yfir í þrívíddarskilning á afstöðu einstakra sameinda í boðskiptum frumunnar.
Heimildir
- Fredriksson R, Lagerström MC, Lundin LG, Schiöth HB. The G-protein-coupled receptors in the human genome form five main families. Phylogenetic analysis, paralogon groups, and fingerprints. Mol Pharmacol 2003; 63: 1256-72.
- Lefkowitz RJ, Roth J, Pastan I. Radioreceptor assay of adrenocorticotropic hormone: new approach to assay of polypeptide hormones in plasma. Science 1970; 170: 633-5.
- De Lean A, Stadel JM, Lefkowitz RJ. A ternary complex model explains the agonist-specific binding properties of the adenylate cyclase-coupled beta-adrenergic receptor. J Biol Chem 1980; 255: 7108-17.
- Dixon RA, Kobilka BK, Strader DJ, Benovic JL, Dohlman HG, Frielle T, et al. Cloning of the gene and cDNA for mammalian beta-adrenergic receptor and homology with rhodopsin. Nature 1986; 321: 75-9.
- Rasmussen SG, DeVree BT, Zou Y, Kruse AC, Chung KY, Kobilka TS, et al. Crystal structure of the beta2 adrenergic receptor-Gs protein complex. Nature 2011; 477: 549-55.
