0708. tbl. 111. árg. 2025
Fræðigrein
Sjúkratilfelli. Meðferð við ættlægum ALS-sjúkdómi með lyfinu tofersen
doi 10.17992/lbl.2025.0708.848
Greinin barst 16. febrúar 2025,Samþykkt til birtingar 20. maí 2025
Fyrirspurnum svarar Ólafur Árni Sveinsson, olafursv@landspitali.is
Ágrip
Hreyfitaugahrörnun (amyotrophic lateral sclerosis, ALS), er alvarlegur og ágengur taugahrörnunarsjúkdómur. Við lýsum hér fjórum tilfellum ættlægs ALS á grunni SOD1 meinvaldandi breytinga sem fengu meðferð með tjáningarhindranum (antisense oligonucleotide) tofersen á Landspítala. Eftir að meðferð hófst hefur ekki orðið markverð versnun á ástandi sjúklinganna og þrír hafa sýnt merki um bata. Styrkur neurofilament light chain (Nf-L) í mænuvökva sem er lífmerki sem finnst í auknum styrk við skaða á taugafrumuþráðum, hefur lækkað niður í viðmiðunargildi heilbrigðra. Engar alvarlegar aukaverkanir hafa komið fram.
Inngangur
Hreyfitaugahrörnun (amyotrophic lateral sclerosis, ALS), er alvarlegur og ágengur taugahrörnunarsjúkdómur, sem herjar á hreyfitaugunga þverrákóttra vöðva og veldur vaxandi máttleysi og á endanum útbreiddri lömun. ALS er algengasta undirtegund motor neuron disease (MND) og veldur hrörnun á bæði efri og neðri hreyfitaugungum. Einkenni byrja oftast í einum útlim og færast svo í aðra útlimi (limb-onset), en í hluta sjúklinga byrjar sjúkdómurinn í heilastofnstaugum með vaxandi kyngingar- og taltruflunum og öndunarfæraeinkennum (bulbar-onset). ALS er sjaldgæfur sjúkdómur. Árlengt nýgengi er á milli 0,6 og 3,8 á hverja 100 þúsund íbúa á ári og er breytilegt eftir heimshlutum.1 Sjúkdómsgangur er almennt hraður og eru meðallífslíkur sjúklinga tvö til fimm ár frá upphafi einkenna.2
Flest tilfelli eru stakstæð (sporadic) en um 10% flokkast sem ættgeng (familial) og orsakast af meinvaldandi breytingum í þekktum sjúkdómsgenum.3 Kortlagðar hafa verið meinvaldandi breytingar í yfir 40 genum sem erfast flestar með ríkjandi hætti.3,4 Meinvaldandi breytingar í superoxide dismutase 1 (SOD1) geninu eru önnur algengasta orsök ættgengs ALS (19%) og 1,22% allra stakstæðra ALS-tilfella.5 Meinvaldandi breytingar í SOD1 geni eru algengasta orsök ættgengs ALS á Íslandi (óbirtar niðurstöður).6 Yfir 200 meinvaldandi breytingar hafa verið kortlagðar í geninu og erfast yfirleitt með ríkjandi hætti. Sú algengasta á Íslandi er c.280G>A (p.Gly94Ser), þar sem glýsín-aminósýru er skipt út fyrir serín-amínósýru í stöðu 94 í SOD1-próteininu. Meinmyndun stökkbreytinga í SOD1-geni er talin vera vegna mislögunar á SOD1-próteini, sem veldur skaða í hreyfitaugungum (toxic gain of function). Líklega dreifist svo mislagað SOD1-prótein um hreyfitaugunga líkamans.7
ALS er ólæknandi sjúkdómur þar sem árangursríkar meðferðir skortir áþreifanlega. Skilningur á undirliggjandi meinafræðilegum þáttum, og þá sérstaklega þegar kemur að ættgengu ALS, hefur aukist á undanförnum áratug og nýlega var fyrsta lyfjameðferð við ættgengu ALS samþykkt. Lyfið kallast tofersen og er tjáningarhindri (antisense oligonucleotide, ASO). Lyfið binst við SOD1-mRNA og hindrar umritun þess í SOD1-próteinið. Lyfið er gefið í mænuvökvahólf á fjögurra vikna fresti.3 Tvær klínískar rannsóknir hafa metið áhrif tofersen á ALS orsakað af SOD1. Fasa I-II rannsókn sýndi fram á að tofersen þolist vel, auk þess að lækka styrk SOD1-próteins í mænuvökva og lækka styrk neurofilament light chain (Nf-L) í blóði og mænuvökva.8 Nf-L er mikilvægt lífmerki sem finnst í auknum styrk við skaða á taugafrumuþráðum (axons) og er yfirleitt mjög hækkað í ALS.9 Í framhaldinu var framkvæmd fasa III tvíblind klínísk slembirannsókn, VALOR, sem stóð yfir í 24 vikur. Rannsóknin sýndi ekki fram á marktæk áhrif lyfsins hvað klíníska meginútkomu varðaði. Eigi að síður varð greinileg lækkun á styrk SOD1 í mænuvökva og styrk Nf-L í blóði og mænuvökva hjá þeim sem fengu lyfið.10 Öllum sjúklingum var í framhaldinu boðið að taka þátt í opinni framhaldsrannsókn (open-label extension). Í þeirri rannsókn sýndu mælingar eftir 52 vikur viðvarandi lækkun á SOD1-próteini og styrk Nf-L í blóði. Lækkun varð einnig á þessum gildum í þeim hópi sjúklinga sem upphaflega voru meðhöndlaðir með lyfleysu en fengu lyfið síðar. Í framhaldsrannsókninni sást marktækur munur á mælingum á vöðvastyrk og lungnarýmd (vital capacity) eftir 52 vikur milli upphaflegu meðferðar- og lyfleysu hópanna.10 Taugalæknar á vegum TRICALS (Treatment Research Initiative to Cure ALS), sem eru samtök helstu ALS-rannsóknarsetra, sendu í kjölfarið frá sér yfirlýsingu eftir birtingu þessara niðurstaðna. Þau töldu niðurstöðurnar benda til árangurs lyfsins og hvöttu til samþykktar á notkun þess.11 Tofersen var svo samþykkt af Matvæla- og lyfjaeftirliti Bandaríkjanna (United States Food and Drug administration, FDA) í apríl undir nafninu Qualsody og síðar af Lyfjastofnun Evrópu (European Medicines Agency, EMA) í maí 2024.12-13 Á Landspítala hófst notkun lyfsins í mars 2023, studd af lyfjafyrirtækinu Biogen (early access program). Hér lýsum við öllum fjórum tilfellum ættgengs ALS á grunni SOD1 meinvaldandi breytinga sem hafa verið meðhöndluð með tofersen á Landspítala, öll á grunni c.280G>A (p.Gly94Ser).
Tilfelli 1
47 ára kona með tveggja ára sögu um vaxandi máttleysi í ganglimum. Tólf mánuðum fyrir meðferð hóf hún einnig að finna fyrir máttminnkun í höndum. Taugaskoðun leiddi í ljós brottfall í neðri taugungum, meira áberandi í fótleggjum. Gat hún aðeins gengið örfá skref, þurfti hjólastól og háa göngugrind. Eftir 21 mánaðar lyfjameðferð með tofersen hefur orðið framför í athöfnum daglegs lífs. Í dag kemst hún auðveldar úr rúmi, gengur lengra með göngugrind, þarf ekki lengur snúningslak um nætur og getur klætt sig sjálf. Til staðar er aukinn styrkur í hægri hendi sem gerir henni kleift að greiða hárið sjálf. Nær allar styrkmælingar hafa batnað til muna við samanburðarmælingar sjúkraþjálfara. Þróun á styrk Nf-L í mænuvökva sýnir kröftuga lækkun (mynd 1a).
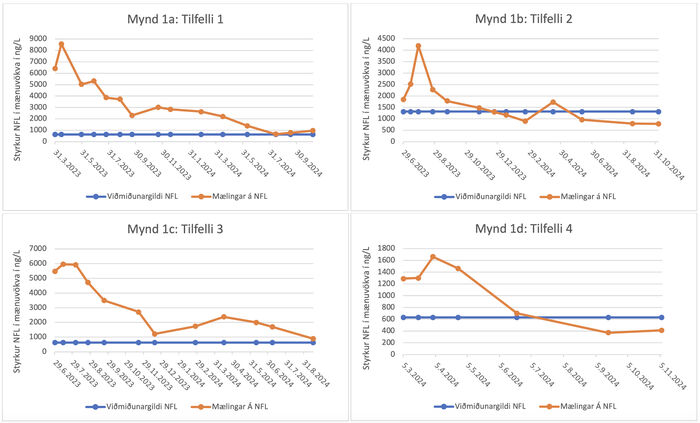
Mynd 1. Á myndum 1a-d. sést þróun styrks Nf-L í mænuvökva við meðferð með lyfinu tofersen hjá fjórum einstaklingum með ættlægan SOD1 ALS-sjúkdóm.
Tilfelli 2
71 árs karlmaður með sex ára sögu um vaxandi máttleysi, fyrst í ganglimum, síðar höndum og að lokum í heilataugum. Taugaskoðun leiddi í ljós brottfall í neðri taugungum, meira áberandi í ganglimum, auk heilatauga. Notar sjúklingur næringarsondu auk ytri öndunarstuðnings á nóttu. Eftir 17 mánaða lyfjameðferð með tofersen hefur rödd hans og öndunargeta styrkst og þörf fyrir ytri öndunarvélastuðning á næturnar hefur minnkað. Hann getur aftur raulað með lögum, sem hann gat ekki áður. Engar augljósar breytingar hafa orðið á styrk útlima við samanburð nema hann á erfiðara með að setja vinstri fót á fótafjöl hjólastólsins. Nf-L í mænuvökva sýnir mælanlega lækkun (mynd 1b).
Tilfelli 3
36 ára gamall karlmaður sem greindist árið 2020 með ættlægt form ALS. Einkennin byrjuðu tveimur árum áður með þverrandi mætti, fyrst í fótleggjum og síðar handleggjum. Versnunin var hæg en stöðug. Göngugeta breyttist frá án aðstoðar yfir í að ganga við tvær hækjur auk minnkaðs gripkrafts. Sjúklingur er ekki með kyngingarvanda og engin skerðing er á öndun. Eftir 18 mánaða meðferð með tofersen hefur hann ekki fundið fyrir frekari versnun á sjúkdómseinkennum. Mælingar hjá sjúkraþjálfara styðja það og sýna mjög svipuð gildi og áður en meðferð hófst, þar sem sum eru lítillega betri og önnur lítillega verri. Sjúklingur keyrir bíl og er áfram sjálfbjarga. Þróun á styrk Nf-L í mænuvökva sýnir kröftuga lækkun (mynd 1c).
Tilfelli 4
42 ára karlmaður með tveggja ára sögu um vaxandi kraftminnkun í fjærlægum (distal) hluta ganglima. Sjúklingur á erfitt með að standa á tám og hefur útbreiddan fjörfisk um líkamann. Hafði þremur mánuðum áður lokið 51 viku langri þátttöku í lyfjatilraun við ALS erlendis með tilraunalyfinu AP-101 (NCT05039099). Á meðan á henni stóð og á eftir fann hann fyrir áframhaldandi hægri versnun einkenna. Eftir níu mánaða lyfjameðferð með tofersen finnur hann fyrir bættu þoli á göngu, minni þreytu og auknum styrk í ganglimum. Getur hann gengið lengri vegalengdir án erfiðleika Mælingar hjá sjúkraþjálfara styðja það, því próf á göngugetu (30 mínútna göngupróf) er heldur betra en fyrir meðferð. Þróun á styrk Nf-L í mænuvökva sýnir kröftuga lækkun (mynd 1d).
Umræða
Fyrrgreind fjögur tilfelli ættlægs ALS á grunni SOD1 meinvaldandi breytinga fengu meðferð með lyfinu tofersen á Landspítala. Ekkert þeirra hefur sýnt markverða versnun frá því meðferðin hófst, þvert á móti hafa þrír fundið bata sem hægt var að staðfesta með eldri samanburðarmælingum hjá sjúkraþjálfara. Þessi hæging og jafnvel stöðvun á sjúkdómsframgangi endurspeglast í kröftugri lækkun á styrk Nf-L í mænuvökva (mynd 1). Hjá öllum sjúklingum hófst lækkunin strax á fyrstu mánuðum meðferðar og var að mestu komin fram eftir 6 mánuði. Þegar upphafsgildi Nf-L var reiknað út frá meðaltali mælinga á fyrsta mánuði meðferðar og meðaltali síðustu tveggja mælinga á meðferð var lækkunin frá 7485ng/L niður í 865ng/L (tilfelli eitt), úr 2850ng/L niður í 785ng/L (tilfelli tvö), úr 5960ng/L niður í 1290ng/L (tilfelli þrjú) og úr 1417ng/L niður í 390ng/L (tilfelli fjögur) (mynd 1). Hjá öllum sjúklingum er Nf-L gildið í dag komið undir eða er á pari við viðmiðunargildi heilbrigðra miðað við aldur. Engar alvarlegar aukaverkanir komu fram en allir sjúklingarnir hafa fundið fyrir vægum aukaverkunum eins og staðbundnum eymslum yfir stungustað, höfuðverk eða slappleika fyrstu daga eftir gjöf lyfsins af og til sem svarað hefur vægum verkjalyfjum.
Þrátt fyrir að tofersen hafi ekki sýnt marktæk áhrif á klínísku meginútkomuna í upphaflegu VALOR-rannsókninni þá er mögulegt að sú rannsókn hafi verið of stutt til að sýna fram á klínískan árangur. Í opna og lengri hluta rannsóknarinnar varð aftur á móti marktækur klínískur munur á ALS-kvarða, vöðastyrkleika og öndunargetu milli þeirra sem fengu lyfið í heilar 52 vikur og þeirra sem byrjuðu síðar.14 Þegar verið er að fást við hrörnunarsjúkdóm eins og ALS þarf að öllum líkindum lengri tíma til að sýna fram á árangur lyfs en í mörgum öðrum sjúkdómum. Helmingunartími SOD1-próteinsins er um 25 dagar og hefur tofersen um fjögurra vikna helmingunartíma í mænuvökva. Það tekur því tofersen nokkra mánuði að draga úr styrk stökkbreytts SOD1-próteins í mænuvökva. Enn lengri tíma tekur að hafa áhrif á hreyfitaugunga líkamans, ekki síst ef þeim hefur þegar fækkað til muna eða varanlegar vefjaskemmdir eru til staðar. Því er hafin rannsókn á einstaklingum sem enn hafa ekki þróað með sér einkenni sjúkdómsins (presymptomatic) en eru með hækkaðan styrk Nf-L í blóði, sem merki um byrjandi niðurbrot taugavefs.15 Ef til vill mun sú rannsókn varpa ljósi á hvort hægt sé að hindra eða seinka til muna sjúkdómsupphafi þessarar undirgerðar af ALS. Að öllum líkindum er mikilvægt að hefja meðferð snemma enda „náði“ lyfleysuhópurinn í framhaldsrannsókn VALOR ekki þeim sem hófu meðferð fyrr. Fleiri rannsóknir hafa stutt áhrif tofersen á sjúkdómsgang og lækkun á Nf-L.16
Hafa verður í huga að í þessari samantekt var eingöngu um fjóra einstaklinga að ræða og engan samanburðarhóp. Eigi að síður eru niðurstöður allar á sömu leið, með kröftugri lækkun Nf-L gildis, stöðvun sjúkdómsgangs og bættri virkni í vissum tilfellum. Er þetta í samræmi við aðrar sambærilegar rannsóknir með fleiri sjúklingum.16 Því telja höfundar afar mikilvægt að lyfið verði áfram í boði fyrir þennan hóp sjúklinga og sé vonandi forsmekkurinn að bættri meðferð við hinum illvíga ALS-sjúkdómi. Voru þetta fyrstu sjúklingarnir á Íslandi til að fá þetta lyf. Lyfið hefur hlotið markaðsleyfi í Bandaríkjunum og Evrópu en ekki enn á Norðurlöndum.
Heimildir
| 1.
Longinetti E, Fang F. Epidemiology of amyotrophic lateral sclerosis: an
update of recent literature. Curr Opin Neurol 2019;32(5):771-776. https://doi.org/10.1097/WCO.0000000000000730 PMid:31361627 PMCid:PMC6735526 | ||||
| | ||||
| 2. Feldman EL, Goutman SA, Petri S, et al. Amyotrophic lateral sclerosis. Lancet 2022;400:1363-1380. https://doi.org/10.1016/S0140-6736(22)01272-7 PMid:36116464 | ||||
| | ||||
| 3. Everett WH, Bucelli RC. Tofersen for SOD1 ALS. Neurodegener Dis Manag, 2024;14(5):149-160. https://doi.org/10.1080/17582024.2024.2402216 PMid:39330700 PMCid:PMC11524200 | ||||
| | ||||
| 4.
Chia R, Chiò A, Traynor BJ. Novel genes associated with amyotrophic
lateral sclerosis: diagnostic and clinical implications. Lancet Neurol
2018;17(1):94-102. https://doi.org/10.1016/S1474-4422(17)30401-5 PMid:29154141 | ||||
| | ||||
| 5.
Zou, ZY, Zhou ZR, Che CY, et al. Genetic epidemiology of amyotrophic
lateral sclerosis: a systematic review and meta-analysis. Journal of
Neurology, Neurosurgery & Psychiatry 2017;88(7):540-549. https://doi.org/10.1136/jnnp-2016-315018 PMid:28057713 | ||||
| | ||||
| 6.
Benatar M, Robertson J, Andersen PM. Amyotrophic lateral sclerosis
caused by SOD1 variants: from genetic discovery to disease prevention.
Lancet Neurol 2025;24(1):77-86. https://doi.org/10.1016/S1474-4422(24)00479-4 PMid:39706636 | ||||
| | ||||
| 7.
Bidhendi EE, Bergh J, Zettersröm P, et al. Mutant superoxide dismutase
aggregates from human spinal cord transmit amyotrophic lateral
sclerosis. Acta Neuropathol 2018;136(6): 939-953. https://doi.org/10.1007/s00401-018-1915-y PMid:30284034 PMCid:PMC6280858 | ||||
| | ||||
| 8.
Miller T, Cudkowicz M, Shaw PJ, et al. Phase 1-2 Trial of Antisense
Oligonucleotide Tofersen for SOD1 ALS. N Engl J Med 2020;383(2):109-119. https://doi.org/10.1056/NEJMoa2003715 PMid:32640130 | ||||
| | ||||
| 9.
Coppens S, Lehmann S, Hopley C, et al. Neurofilament-Light, a Promising
Biomarker: Analytical, Metrological and Clinical Challenges. Int J Mol
Sci 2023;24(14):1-12. https://doi.org/10.3390/ijms241411624 PMid:37511382 PMCid:PMC10380627 | ||||
| | ||||
| 10.
Miller TM, Cudkowicz ME, Genge A, et al. Trial of Antisense
Oligonucleotide Tofersen for SOD1 ALS. N Engl J Med
2022:387(12):1099-1110. https://doi.org/10.1056/NEJMoa2204705 PMid:36129998 | ||||
| | ||||
| 11. TRICALS. TRICALS Consensus Statement on Tofersen. [online]. ODI: Utrecht, janúar 2025. https://www.tricals.org/news/tricals-consensus-statement-on-tofersen?nav_context=0. | ||||
| | ||||
| 12. U.S. Food and Drug Administration. FDA approves treatment of amyotrophic lateral sclerosis associated with a mutation in the SOD1 gene. [online]. ODI: Maryland, janúar 2025 https://www.fda.gov/drugs/news-events-human-drugs/fda-approves-treatment-amyotrophic-lateral-sclerosis-associated-mutation-sod1-gene?utm_source=chatgpt.com - janúar 2025. | ||||
| | ||||
| 13. European Medicines Agency. Qalsody. [online]. ODI: Amsterdam, janúar 2025. https://www.ema.europa.eu/en/medicines/human/EPAR/qalsody?utm_source=chatgpt.com. | ||||
| | ||||
| 14. Miller TM, Cudkowicz ME, Genge A, et al. Evaluating efficacy and safety of tofersen in adults with SOD1- ALS: Results from the Phase III VALOR trial and open-label extension. Amyotrophic Lateral Sclerosis and Frontotemporal Degeneration 2022(23):S1-31 - janúar 2025. | ||||
| | ||||
| 15.
Benatar M, Wuu J, Andersen PM,et al. Design of a Randomized,
Placebo-Controlled, Phase 3 Trial of Tofersen Initiated in Clinically
Presymptomatic SOD1 Variant Carriers: the ATLAS Study. Neurotherapeutics
2022;19(4):1248-1258. https://doi.org/10.1007/s13311-022-01237-4 PMid:35585374 PMCid:PMC9587202 | ||||
| | ||||
| 16.
Sabatelli M, Cerri F, Zuccarino R, et al. Long-term treatment of SOD1
ALS with tofersen: a multicentre experience in 17 patients. Journal of
Neurology 2024;271(8): 5177-5186. https://doi.org/10.1007/s00415-024-12437-7 PMid:38829431 | ||||