06. tbl. 111. árg. 2025
Fræðigrein
Rannsókn. Væg vitræn skerðing – forstig heilabilunar eða eðlileg öldrun?
Inngangur
Væg vitræn breyting er algeng á efri árum og getur valdið áhyggjum um byrjandi heilabilun. Skilgreind eru tvö stig vægrar vitrænnar breytingar: upplifuð vitræn skerðing og væg vitræn skerðing. Munurinn felst í því hvort vitræn skerðing er staðfest með vitrænum prófunum eða ekki. Einstaklingar sem vísað var til minnismóttöku Landspítala og voru metnir á stigi vægrar vitrænnar skerðingar fengu boð um þátttöku í rannsókn á orsökum einkennanna. Markmið rannsóknarinnar var að skoða áhættu einstaklinga með væga vitræna skerðingu á að vera með sjúkdóm sem leiðir til heilabilunar.
Efniviður og aðferðir
214 einstaklingar með væga vitræna skerðingu uppfylltu inntökuskilmerki og samþykktu þátttöku í rannsókninni á árunum 2014-2017. Meðalaldur þátttakenda var 72,5 ár og meðalstigafjöldi á MMSE prófi var 27,5 stig af 30 mögulegum.
Niðurstöður
Af upphaflegum hóp 214 þátttakenda fengu 73 (34%) greiningu undirliggjandi orsakar í kjölfar rannsókna. Alls reyndust 26 (12%) þátttakendur ekki vera með væga vitræna skerðingu á taugasálfræðilegu mati og var greiningu því breytt í upplifaða vitræna skerðingu og var ekki fylgt frekar eftir. 115 (54%) þátttakendum var fylgt eftir í eitt ár og 79 í tvö ár. Við tveggja ára eftirfylgd voru 47 (41%) enn með væga vitræna skerðingu en tveir höfðu bætt vitræna getu og töldust ekki lengur uppfylla skilmerki vægrar vitrænnar skerðingar. Tíu féllu úr rannsókninni.
Ályktanir
Þriðjungur einstaklinga með væga vitræna skerðingu fengu greiningu á orsökum einkenna sinna og rannsóknin sýndi enn fremur að hátt hlutfall þátttakenda greindist með undirliggjandi sjúkdóm á rannsóknartímabilinu. Greining undirliggjandi orsakar vægrar vitrænnar skerðingar mun verða enn mikilvægari nú þegar líftæknilyf við algengum taugahrörnunarsjúkdómum verða aðgengileg.
Inngangur
Aukin umræða um heilabilun og ekki síst Alzheimersjúkdóm, sem er jafnframt algengasta orsök heilabilunar, hefur leitt til þess að einstaklingar sækja í vaxandi mæli til lækna þegar þeir upplifa breytingar á minni eða annarri vitrænni getu. Einföld vitræn skimunarpróf geta verið gagnleg en gefa oft ekki rétta mynd, ekki síst vegna þess að vitræn grunngeta er misjöfn meðal fólks og getur útkoma úr skimunarprófum því verið eðlileg þótt í raun hafi orðið afturför hjá einstaklinginum, einkum ef vitræn grunngeta viðkomandi var áður ofan við meðallag.1
Minnismóttakan á Landakoti var stofnuð árið 1995 og er hluti af göngudeild öldrunarlækninga. Þjónustan fékk fljótt góðar viðtökur og hefur verið stigvaxandi ásókn í tæp 30 ár þannig að nú er nokkurra mánaða bið eftir fyrsta viðtali, þrátt fyrir nýlega hert skilyrði um forvinnu gagnvart tilvísunaraðilum. Líkleg skýring er meðal annars stór kynslóð eftirstríðsáranna (baby boomers) en Íslendingum á aldrinum 65-85 ára hefur fjölgað úr 29.504 árið 2000 í 56.544 árið 2025 eða um tæp 92%.2 Önnur skýring er aukin meðvitund almennings um einkenni taugahrörnunarsjúkdóma og áhugi á inngripum ef og þegar möguleg verða.
Hér verður fjallað um tvö væg stig vitrænna breytinga sem mögulega eru undanfari heilabilunar, en eru það þó ekki alltaf. Við upplifað minnistap eða upplifaða vitræna skerðingu (subjective memory complaint eða subjective cognitive impairment) hefur einstaklingurinn áhyggjur af hugrænni getu, oftast minnistapi, en niðurstöður úr vitrænu mati, hvort sem er einföldum skimunarprófum eða ítarlegu taugasálfræðilegu mati, eru innan eðlilegra marka.3 Væg vitræn skerðing (mild cognitive impairment, MCI) lýsir hins vegar heilkenni vitrænnar skerðingar, sem er meiri en vænta má miðað við aldur og menntun einstaklingsins en hefur þó ekki markverð áhrif á færni til athafna daglegs lífs og uppfyllir þannig ekki greiningarskilmerki heilabilunar.4 Væg vitræn skerðing er þannig millistig milli eðlilegrar vitrænnar getu eða upplifaðrar vitrænnar skerðingar og byrjandi heilabilunar. Í vægri vitrænni skerðingu eru auknar líkur á framþróun einkenna yfir á stig heilabilunar5,6 en ástandið getur þó haldist óbreytt í mörg ár og jafnvel batnað.5 Greining undirliggjandi orsaka vægrar vitrænnar skerðingar og heilabilunar er byggð á klínískum einkennum og, í tilfelli Alzheimersjúkdóms, óeðlilegum lífmerkjum (biomarkers). Í samræmi við gildandi skilmerki var greining sjúkdómsins á stigi vægrar vitrænnar skerðingar eingöngu sett ef lífmerki úr mænuvökva sýndu afbrigðileg gildi. Amyloid--jáeindaskönnun (positron emission tomography, PET) af heila var ekki aðgengilegt á tíma þessarar rannsóknar.
Í kjölfar tillögu Petersen4 að bættum greiningarskilmerkjum vægrar vitrænnar skerðingar þótti ástæða til að skilgreina ástandið nánar, einkum með nánari prófunum á vitrænni getu, en greiningarskilmerki alþjóðlegs vinnuhóps eru víðast notuð í dag þegar ekki eru tök á að gera taugasálfræðilegt mat. Greiningarskilmerki alþjóðlega vinnuhópsins á vægri vitrænni skerðingu eru:7
1. Vitræn færni er ekki eðlileg en uppfyllir ekki greiningarskilmerki heilabilunar (DSM IV, ICD-10).
2. Einstaklingur sjálfur og/eða aðstandandi segir frá vitrænni skerðingu og hún er staðfest á hlutbundinn hátt í vitrænum prófum eða afturför á vitrænni getu hefur verið staðfest með endurteknum mælingum.
3. Færni til grunnathafna daglegs lífs er yfirleitt óskert en mjög væg skerðing í færni til flóknari athafna (instrumental functions) getur verið til staðar.
Þegar einstaklingur greinist með væga vitræna skerðingu er mikilvægt að vita hvort líklegt sé að einkenni muni þróast yfir í heilabilun á næstu árum eða ekki. Eðli máls samkvæmt getur frásögn og upplifun einstaklingsins sjálfs verið ófullkomin ef minni eða innsæi er farið að versna og því er mikilvægt að afla einnig upplýsinga frá aðstandanda.
Með tilkomu lífmerkjamælinga (biomarkers) Alzheimersjúkdóms er hægt að greina sjúkdóminn með mikilli nákvæmni á stigi vægrar vitrænnar skerðingar. Lífmerkin eru meðal annars amyloid- og tau-prótein8 sem mæld eru í mænuvökva, amyloid-binding á jáeindaskanna og dæmigert rýrnunarmynstur á miðlægum gagnaugablöðum heila á segulómun.
Í þessari rannsókn er lýst þýði einstaklinga, sem greindir voru með væga vitræna skerðingu í fyrsta viðtali á minnismóttöku, og samþykktu þátttöku í rannsókninni. Sjúkdómsgreiningin var í kjölfarið studd með taugasálfræðilegu mati. Lýst er hversu margir reyndust vera með undirliggjandi sjúkdóm, svo sem Alzheimersjúkdóm, sem veldur framþróun einkenna yfir í heilabilun. Þátttakendum með væga vitræna skerðingu sem ekki fengu greiningu undirliggjandi sjúkdóms var fylgt eftir í allt að tvö ár með tilliti til þróunar vitrænnar skerðingar. Rannsókn minnismóttökunnar á vægri vitrænni skerðingu (MCI-rannsóknin) mat einnig nýjar greiningaraðferðir, en þeim hluta verður aðeins lítillega lýst í þessari grein enda fjallað ítarlegar um hann í öðrum birtum greinum. Um var að ræða nýja aðferð til að vinna úr heilaritum,9 aðferð til mælinga á súrefnismettun í æðum í sjónhimnu augans10 og mæling á ýmsum próteinum úr mænuvökva og þýðingu þeirra fyrir greiningu.11
Markmið rannsóknarinnar var að greina hversu margir einstaklingar með væga vitræna skerðingu reyndust vera með ágengan taugahrörnunarsjúkdóm og hversu vel greiningaraðferðir reyndust til greiningar á undirliggjandi orsök.
Efniviður og aðferðir
Rannsóknin var framkvæmd á minnismóttöku Landspítala á árunum 2014-2018 og var skipulögð í samstarfi við augndeild Landspítala, rannsóknar- og þróunarfyrirtækið Mentis Cura, Röngen Domus og Lífvísindasetur Háskóla Íslands. Einstaklingar sem komu til skoðunar á minnismóttöku Landspítala í kjölfar tilvísunar og voru metnir með væga vitræna skerðingu í fyrsta viðtali voru spurðir um áhuga á þátttöku í rannsókninni. Sjúkdómsgreiningin væg vitræn skerðing var ákvörðuð samkvæmt greiningarskilmerkjum Petersen4 á grunni upplýsinga frá sjúklingi og aðstandanda um versnun á vitrænni getu, frá því sem áður var, án afgerandi breytinga á færni til athafna daglegs lífs, auk niðurstöðu úr vitrænu skimunarprófi sem var íslensk útgáfa á Mini-Mental State Examination (MMSE).12 Einnig var notaður spurningalisti til aðstandanda, Informant Questionnaire on Cognitive Decline in the Elderly (IQCODE)13 sem gefur meðalstigafjölda frá 0-5 og metur breytingar á minni eða annarri vitrænni getu að mati aðstandanda. Auk þess var CERAD-1014 lagt fyrir, sem er 10 orða minnispróf í þremur hlutum. Fyrsti hluti metur tafarlaust minni, annar hluti upprifjun og þriðji kennslaminni (bera kennsl á orð sem sýnd höfðu verið). Að endingu var klukkupróf lagt fyrir og metið með aðferð Shulmans.15 Allir þátttakendur fóru í segulómun af heila í Röntgen Domus til mats á rýrnunarbreytingum í heila. Að auki fóru allir þátttakendur í ítarlegt taugasálfræðilegt mat þar sem metin var vitræn geta á þeim sviðum sem mikilvægt er að skoða þegar grunur er um byrjandi heilabilun.16 Inntökuskilyrði í rannsóknina voru eftirfarandi: MMSE skor ≥24 stig og meðalstigafjöldi á IQCODE 3,2-4,0. Útilokunarskilmerki voru: 1) heilabilun greind, 2) sjúkdómur, annar en taugahrörnunar- eða æðasjúkdómur í heila, sem talinn var orsaka vitræna skerðingu, 3) aðrar heilsufarslegar ástæður er takmörkuðu þátttöku í rannsókninni, 4) félagslegar aðstæður er takmörkuðu þátttöku í rannsókninni og 5) búseta utan höfuðborgarsvæðisins, nema ríkur vilji væri til og aðstæður leyfðu.
Í lok upphafsviðtals var gerð áætlun um greiningarrannsóknir til skoðunar á orsök vitrænnar skerðingar og skriflegar og munnlegar upplýsingar veittar. Skipulagðar voru sömu rannsóknir fyrir hugsanlega þátttakendur verkefnisins og aðra með sambærileg einkenni að viðbættu heilariti og myndatökum af sjónhimnu. Allir fengu umþóttunartíma og eftirfylgd með símtali nokkru síðar þar sem athugað var með áhuga á þátttöku og gefinn tími í töku heilarits á minnismóttökunni, ef áhugi var fyrir hendi. Við komu í heilarit gafst viðkomandi aftur kostur á að spyrja spurninga varðandi rannsóknina og að því loknu var upplýst samþykki undirritað af þátttakanda og rannsakanda í samræmi við ákvæði Helsinkiyfirlýsingar Alþjóðasamtaka lækna.
Taugasálfræðilegt mat
Taugasálfræðilegt mat var lagt fyrir alla þátttakendur og metin vitræn geta á þeim sviðum sem mikilvægt er að skoða þegar grunur er um byrjandi heilabilun. Meðal annars var metið yrt og óyrt minni, vinnsluminni og augnabliksminni, mál, einbeiting og tvískipting athygli, sjónúrvinnsla, hugrænn hraði og stýring.16 Þetta mat var lagt fyrir af taugasálfræðingum minnismóttökunnar og tók á bilinu 90 til 120 mínútur. Við túlkun á niðurstöðum var tekið tillit til aldurs, kyns og menntunarstigs og til viðmiðunar voru niðurstöður úr sömu verkefnum hjá heilbrigðum einstaklingum. Að auki var, í túlkun gagna, ætíð tekið tillit til annarra þátta úr heilsufarssögu sem gætu haft þýðingu (til dæmis aðrar sjúkdómsgreiningar, saga um geðrænan vanda og höfuðhögg). Í skýrslu til læknis var upplýst hvort um frávik væri að ræða miðað við það sem ætla mætti og ef svo var, hversu langt það væri frá meðalgildi samanburðarhóps. Ef frávik var meira en 1,5 staðalfráviki lakara, var sagt að það svið vitrænnar getu væri skert en ef frávikið niður á við var minna, var sagt að það væri fyrir neðan meðalgildi.17 Þetta hafði mikla þýðingu varðandi endanlega greiningu. Að endingu gaf taugasálfræðingur álit sitt á því hvað niðurstaðan þýddi og gat þannig sagt til dæmis að niðurstaðan væri í samræmi við Alzheimersjúkdóm. Slík niðurstaða er styðjandi fyrir greiningu en ekki grundvöllur hennar.
Segulómun af heila
Við úrlestur segulómunarrannsókna var stuðst við T1, T2 og FLAIR (fluid-attenuated inversion recovery) myndaraðir og lesið úr myndunum á staðlaðan hátt. Auk almennrar lýsingar á heila var rýrnun á drekasvæðum (hippocampi), sem liggja miðlægt í gagnaugablöðum, athuguð sérstaklega með mati á rýrnun miðlægs gagnaugablaðs (medial temporal atrophy, MTA) frá 0 (engin rýrnun) og upp í 4 sem er hámarksrýrnun.18 Einnig var heildarrýrnun í heilaberki metin (global cortical atrophy, GCA) (gráða 0-3)19 og rýrnun á heilaberki hvirfilblaðs (Koedam--gráða) (0-3).20 Að endingu var magn hvítavefsbreytinga í heila metið með Fazekas gráða (0-3).21 Einn röntgenlæknir (MS) fór yfir niðurstöður allra segulómrannsókna að nýju, samræmdi og skráði í gagnagrunn rannsóknarinnar.
Mænuvökvarannsóknir
Við uppvinnslu á minnismóttöku, sérstaklega þegar grunur leikur á um Alzheimersjúkdóm, kemur til greina að taka mænuvökva til mælingar á lífmerkjum (biomarkers) sem eru próteinin amyloid-β (Aβ), heildar tau-prótein og fosfórylerað tau (fosfó-tau) prótein, en styrkur þeirra breytist í Alzheimersjúkdómi. Aβ er til í nokkrum afbrigðum og voru tvö þeirra mæld í rannsókninni, Aβ42 (42 amínósýru peptíð) og Aβ40 (40 amínósýru peptíð). Óeðlileg lífmerki í mænuvökva með lækkun á Aβ42 og hlutfalli Aβ42/40 ásamt hækkun á fosfó-tau, ásamt klínískri svipgerð dæmigerðri fyrir Alzheimersjúkdóm gefa mikið greiningaröryggi með háu næmi og sértæki.8 Niðurstöður lífmerkjamælinga þarf alltaf að setja í samhengi við einkennamynd einstaklings en þær geta þó gefið mikilvægar vísbendingar um byrjandi meingerð sjúkdóms, jafnvel hjá þeim sem hafa lítil sem engin einkenni, því breytingar á þessum próteinum koma venjulega fram mörgum árum áður en viðkomandi finnur fyrir einkennum. Lífmerkjamælingar hafa verið notaðar á minnismóttöku Landspítala í vaxandi mæli. Mænuvökvataka er gerð af læknum í samræmi við verkferla minnismóttökunnar. Niðurstöður eru settar inn í rannsóknargrunn Landspítala.
Sjúkdómsgreining
Sjúkdómsgreining var ákvörðuð á þverfaglegum samráðsfundi lækna, taugasálfræðinga og hjúkrunarfræðinga minnismóttöku á grundvelli klínískra upplýsinga og niðurstaðna úr rannsóknum. Í upphafi var sérstaklega skoðað hvort niðurstöður taugasálfræðilegs mats bentu ekki til vægrar vitrænnar skerðingar (það er upplifuð vitræn skerðing) eða hvort skilmerki heilabilunar væru uppfyllt og var þá þátttöku í rannsókninni lokið. Næst var skoðuð hugsanleg orsök vitrænnar skerðingar. Ef greining undirliggjandi sjúkdóms lá fyrir var endapunkti rannsóknarinnar náð. Í þessum tilvikum var viðkomandi vísað í venjubundið klínískt eftirlit. Ef niðurstaðan reyndist vera væg vitræn skerðing án augljósrar ástæðu var viðkomandi boðið eftirlit eftir eitt ár, þar sem lagt var mat á hugsanlegar breytingar á vitrænni getu á grundvelli upplýsinga frá sjúklingi og aðstandanda og lögð fyrir einföld vitræn próf. Ef matið var óbreytt og sjúkdómsgreining áfram væg vitræn skerðing án greindrar orsakar fór fram sambærileg skoðun ári síðar.
Upplýsingar með rannsóknarnúmerum og án persónuauðkenna voru færðar inn í REDCap-gagnagrunn sem hýstur er hjá Læknadeild Háskóla Íslands. Í REDCap-gagnagrunninum eru öll gögn rannsóknarinnar vistuð. Lýsandi tölfræði var unnin í Microsoft Excel (Microsoft) og í R (Posit Software). Heimildavinna fór fram í Mendeley Cite.
Tilskilin leyfi lágu fyrir frá Vísindasiðanefnd (VSN-14-028) og Vísindarannsóknanefnd heilbrigðisrannsókna á Landspítala áður en rannsókn hófst. Ábyrgðarmaður rannsóknarinnar var Jón Snædal.
Niðurstöður
Alls skrifuðu 214 einstaklingar undir upplýst samþykki. Konur voru 53% þátttakenda og meðalaldur þeirra var 72,5 ár og karla 72,3 ár (sjá töflu I).
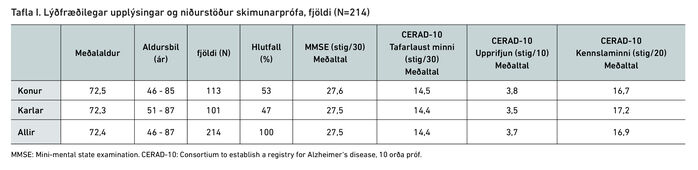
Meðalstigafjöldi á MMSE var 27,5 (spönn 24-30). Á CERAD-10 minnisprófinu reyndist tafarlaust minni vera að meðaltali 14,5 orð af 30 mögulegum og í upprifjun að meðaltali 3,7 orð af 10 mögulegum (sjá töflu II).
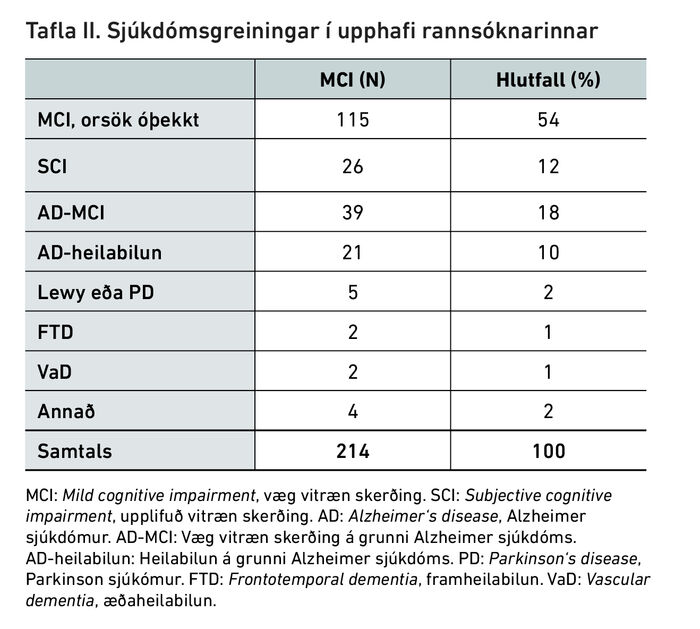
Eftir taugasálfræðilegt mat kom í ljós að 26 þátttakenda (12%) reyndust vera með eðlilega vitræna getu og því greindir með upplifaða vitræna skerðingu og var þátttöku þeirra lokið í rannsókninni. Tuttugu og einn þátttakandi (10%) reyndist vera kominn með heilabilun vegna Alzheimersjúkdóms, 13 voru greindir með Lewy-sjúkdóm, Parkinson sjúkdóm, framheilabilun eða heilaæðasjúkdóm, sjá töflu III.
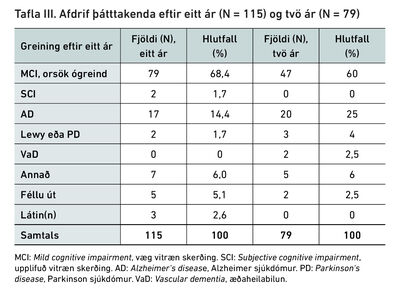 Væg vitræn skerðing var greind hjá 39 þátttakendum sem jafnframt reyndust vera með lífmerki Alzheimersjúkdóms í mænuvökva og fengu því þá sjúkdómsgreiningu og var endapunkti rannsóknarinnar þar með náð fyrir þessa einstaklinga. Eftir stóðu 115 þátttakendur með væga vitræna skerðingu án greindrar undirliggjandi orsakar og var þeim boðin eftirfylgd í rannsókninni að 12 mánuðum liðnum. Hundrað og sjö þátttakendur komu í eftirfylgd, fimm mættu ekki og þrír voru látnir. Tuttugu og sex (23%) fengu greiningu á orsök vitrænnar skerðingar eftir eitt ár, 17 (65%) þeirra reyndust vera með Alzheimersjúkdóm, níu (35%) með aðra sjúkdóma. Tveir reyndust vera komnir með betri vitræna getu en upphaflega og féllu úr rannsókninni. Eftirfylgd tveimur árum frá upphafi rannsóknar fengu því 79 þátttakendur.
Væg vitræn skerðing var greind hjá 39 þátttakendum sem jafnframt reyndust vera með lífmerki Alzheimersjúkdóms í mænuvökva og fengu því þá sjúkdómsgreiningu og var endapunkti rannsóknarinnar þar með náð fyrir þessa einstaklinga. Eftir stóðu 115 þátttakendur með væga vitræna skerðingu án greindrar undirliggjandi orsakar og var þeim boðin eftirfylgd í rannsókninni að 12 mánuðum liðnum. Hundrað og sjö þátttakendur komu í eftirfylgd, fimm mættu ekki og þrír voru látnir. Tuttugu og sex (23%) fengu greiningu á orsök vitrænnar skerðingar eftir eitt ár, 17 (65%) þeirra reyndust vera með Alzheimersjúkdóm, níu (35%) með aðra sjúkdóma. Tveir reyndust vera komnir með betri vitræna getu en upphaflega og féllu úr rannsókninni. Eftirfylgd tveimur árum frá upphafi rannsóknar fengu því 79 þátttakendur.
Við tveggja ára eftirfylgd voru 20 (25%) þátttakendur greindir með Alzheimersjúkdóm og tíu (13%) fengu aðra sjúkdómsgreiningu. Af upphaflegum þátttakendum voru því 47 eða 41% enn með væga vitræna skerðingu án greindrar undirliggjandi orsakar eftir tveggja ára eftirfylgd. Í heildina voru 58 þátttakendur greindir með Alzheimersjúkdóm innan tveggja ára og 32 að auki greindir með aðra sjúkdóma sem orsök vitrænnar skerðingar. Þegar tillit er tekið til þess að tíu af 214 þátttakendum féllu úr rannsókninni er hlutfall þeirra sem greindust með undirliggjandi sjúkdóm á rannsóknartímabilinu 44%.
Umræða
Aðalmarkmið rannsóknarinnar var að greina hversu hátt hlutfall einstaklinga með væga vitræna skerðingu reyndust vera með ágengan taugahrörnunarsjúkdóm og hversu vel greiningaraðferðir reyndust til greiningar á undirliggjandi orsök ásamt því að lýsa lýðfræði þessa hóps og greiningarferli. Annað markmið var að kanna hversu hátt hlutfall þátttakenda sem ekki greindust með undirliggjandi sjúkdóm í upphafi rannsóknar, fengju sjúkdómsgreiningu á tveggja ára eftirfylgdartímabili.
Nýgengi vægrar vitrænnar skerðingar er ekki þekkt á Íslandi og er þessi rannsókn fyrsta rannsókn á tíðni vægrar vitrænnar skerðingar í minnismóttökuþýði hérlendis. Hins vegar hefur nýleg faraldsfræðileg rannsókn frá Noregi sýnt 35% algengi vægrar vitrænnar skerðingar meðal þeirra sem voru 70 ára og eldri.22 Þetta er hærra algengi en áður hefur verið greint frá og ætti ekki síst að vekja athygli á Íslandi því rannsóknin var gerð í Þrændalögum í Noregi þaðan sem stór hluti landnámsmanna Íslands komu á sínum tíma. Faraldsfræðilegar rannsóknir hafa sýnt aukið nýgengi heilabilunar næstu ár á eftir að einstaklingar greinast með væga vitræna skerðingu.23 Þetta er þó misjafnt eftir því hvert upphafsþýðið var og virðast líkur á heilabilunargreiningu hærri í minnismóttökuþýði, líkt því sé hér er skoðað, en meðal þeirra sem taka þátt í faraldsfræðilegum rannsóknum. Nýleg norræn rannsókn skoðaði líkur þriggja skilgreindra hópa um sjötugt á að fá heilabilun á næstu fimm árum: 1) Heilbrigður viðmiðunarhópur, hafði ekki komið á minnismóttöku, 2) hópur einstaklinga með upplifaða vitræna skerðingu og 3) hópur einstaklinga með væga vitræna skerðingu sem höfðu komið á minnismóttöku. Aðeins 1,5% einstaklinga úr heilbrigða hópnum (meðalaldur 66 ár) höfðu greinst með heilabilun fimm árum síðar. Sambærilegt hlutfall meðal hópsins með upplifaða vitræna skerðingu (meðalaldur 68 ár) reyndist vera 16,0% en hlutfall einstaklinga með væga vitræna skerðingu (meðalaldur 71 árs) sem þróuðu með sér heilabilun innan fimm ára var 76%.24 Munur á meðalaldri í rannsóknunum getur mögulega skýrt hluta þessa munar, en þó er mjög ólíklegt að munurinn skýrist að öllu leyti af mismunandi aldri. Okkar rannsókn sýndi að 56 (49%) þátttakendur sem í upphafi voru með væga vitræna skerðingu án greindrar orsakar greindust með undirliggjandi sjúkdóm innan tveggja ára, þar af 37 (66%) með Alzheimersjúkdóm. Þetta er nokkuð lægra hlutfall en í norrænu rannsókninni og munurinn gæti skýrst að hluta til af styttri eftirfylgdartíma í okkar rannsókn. Önnur möguleg skýring er sú að í norrænu rannsókninni var þátttakendum með væga vitræna skerðingu á grunni Alzheimersjúkdóms fylgt eftir í rannsókninni en ekki í þessari rannsókn. Mælingar á lífmerkjum Alzheimersjúkdóms bæta greiningaröryggi umtalsvert en þær rannsóknaraðferðir eru ýmist ífarandi (mænuvökvataka) eða kostnaðarsamar (amyloid-jáeindaskönnun af heila). Þær eru einnig mjög sérhæfðar og því almennt ekki notaðar nema á minnismóttökum eða við háskólaspítala. Það sama á við um taugasálfræðilegt mat sem krefst mjög sérhæfðs starfskrafts (taugasálfræðings).
Alzheimersjúkdómur er algengasta ástæða heilabilunar en einnig vægrar vitrænnar skerðingar, eins og þessi rannsókn sýnir. Skilmerki sjúkdómsins frá 2018 taka til hans á mismunandi stigum vitrænnar skerðingar allt frá heilbrigðum einstaklingum með merki um sjúkdóminn til þeirra sem komnir eru með heilabilun.25
Þegar einstaklingur hefur upplifað afturför á vitrænni getu og sú afturför er studd af sögu aðstandanda eru auknar líkur á því að greinast með undirliggjandi sjúkdóm sem valdið getur heilabilun, og ber því að taka slík einkenni alvarlega, jafnvel þó niðurstaða einfaldra vitrænna skimunarprófa sé eðlileg. Algengasta greinda orsök vægrar vitrænnar skerðingar í þessari rannsókn var Alzheimersjúkdómur. Mikilvægi þess að greina Alzheimersjúkdóm á stigi vægrar vitrænnar skerðingar mun aukast verulega á næstu árum vegna innleiðingar sjúkdómshemjandi líftæknilyfja með ábendinguna Alzheimersjúkdómur á stigi vægrar vitrænnar skerðingar eða vægrar heilabilunar.
Ályktun
Margir upplifa skerðingu á minni eða annarri vitrænni færni þegar árin færast yfir. Skilgreind hafa verið tvö stig breytinga á vitrænni færni, annars vegar upplifuð vitræn skerðing og hins vegar væg vitræn skerðing, sem var meginviðfangsefni þessarar rannsóknar. Niðurstöður rannsóknarinnar sýna að tæpur helmingur einstaklinga með væga vitræna skerðingu greinist með heilabilun innan tveggja ára. Heimilislæknar sem fá til sín einstaklinga vegna breytinga á minni eða annarri vitrænni færni þurfa því að taka slíka umkvörtun mjög alvarlega, jafnvel þótt einfalt skimunarpróf gefi eðlilega niðurstöðu.
Leyfi
Leyfi Vísindasiðanefndar nr. VSN-14-028.
Þakkir
Höfundar þakka öllum þátttakendum rannsóknarinnar sem lögðu á sig rannsóknir, til viðbótar þeim sem fara fram í venjulegu greiningarferli á minnismóttöku. Þakkir fær einnig Kristín Hanna Hannesdóttir, hjúkrunarfræðingur, sem sá um samskipti við þátttakendur, tímabókanir og tók saman öll gögn. Að lokum fær allt starfsfólk minnismóttökunnar sem tóku þátt í greiningarfundum rannsóknarinnar en voru að öðru leyti ekki aðilar að henni. Vísindasjóður minnismóttökunnar styrkti rannsóknina.
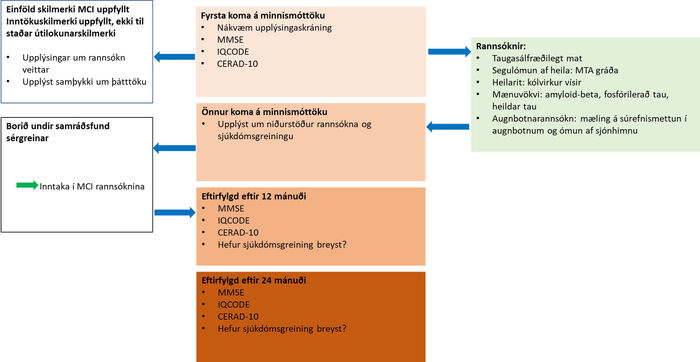
Mynd 1. Flæði við skimun og inntöku í rannsóknina.
MCI: Mild cognitive impairment, væg vitræn skerðing. MMSE: Mini-mental state examination. CERAD-10: Consortium to establish a registry for Alzheimer‘s disease, 10 orða próf.
Heimildir
| 1. Devenney E, Hodges JR. The Mini-Mental State Examination: Pitfalls and limitations. Pract Neurol. 2017;17(1):79-80. https://doi.org/10.1136/practneurol-2016-001520 PMid:27903765 |
||||
| 2. Hagstofan . Reykjavík. | ||||
| 3. Jessen F, Amariglio RE, Buckley RF, et al. The characterisation of subjective cognitive decline. Lancet Neurol. 2020;19(3):271-278. https://doi.org/10.1016/S1474-4422(19)30368-0 PMid:31958406 |
||||
| 4. Petersen RC. Clinical practice. Mild cognitive impairment. - supplementary data. N Engl J Med. 2011;364(23) :2227-34. https://doi.org/10.1056/NEJMcp0910237 PMid:21651394 |
||||
| 5. Jak AJ, Preis SR, Beiser AS, et al. Neuropsychological Criteria for Mild Cognitive Impairment and Dementia Risk in the Framingham Heart Study.J Int Neuropsychol Soc. 2016;22(9):937-943. https://doi.org/10.1017/S1355617716000199 PMid:27029348 PMCid:PMC5045758 |
||||
| 6. Bondi MW, Edmonds EC, Jak AJ, et al. Neuropsychological Criteria for Mild Cognitive Impairment Improves Diagnostic Precision, Biomarker Associations, and Progression Rates. J Alzheimers Dis. 2014;42(1):275-89. https://doi.org/10.3233/JAD-140276 PMid:24844687 PMCid:PMC4133291 |
||||
| 7. Winblad B, Palmer K, Kivipelto M, et al. Mild cognitive impairment - Beyond controversies, towards a consensus: Report of the International Working Group on Mild Cognitive Impairment. J Intern Med. 2004;256(3):240-6. https://doi.org/10.1111/j.1365-2796.2004.01380.x PMid:15324367 |
||||
| 8. Zetterberg H, Blennow K. Moving fluid biomarkers for Alzheimer's disease from research tools to routine clinical diagnostics. Mol Neurodegener. 2021;16(1):10. https://doi.org/10.1186/s13024-021-00430-x PMid:33608044 PMCid:PMC7893769 |
||||
| 9. Snaedal J, Johannesson GH, Gudmundsson TE, et al. Diagnostic accuracy of statistical pattern recognition of electroencephalogram registration in evaluation of cognitive impairment and dementia. Dement Geriatr Cogn Disord. 2012;34(1):51-60. https://doi.org/10.1159/000339996 PMid:22922592 |
||||
| 10. Olafsdottir OB, Saevarsdottir HS, Hardarson SH, et al. Retinal oxygen metabolism in patients with mild cognitive impairment. Alzheimer's and Dementia: Diagnosis, Assessment and Disease Monitoring. Alzheimers Dement (Amst). 2018;10:340-345. https://doi.org/10.1016/j.dadm.2018.03.002 PMid:30014033 PMCid:PMC6024244 |
||||
| 11. Teitsdottir UD, Jonsdottir MK, Lund SH, et al. Association of glial and neuronal degeneration markers with Alzheimer's disease cerebrospinal fluid profile and cognitive functions. Alzheimers Res Ther. 2020;12(1)92. https://doi.org/10.1186/s13195-020-00657-8 PMid:32753068 PMCid:PMC7404927 |
||||
| 12. Folstein MF, Folstein SE, McHugh PR. "Mini-mental state". A practical method for grading the cognitive state of patients for the clinician. J Psychiatr Res. 1975;12(3):189-98. https://doi.org/10.1016/0022-3956(75)90026-6 PMid:1202204 |
||||
| 13. Jorm AF, Korten AE. Assessment of cognitive decline in the elderly by informant interview. Br J Psychiatry. 1988;152:209-13. https://doi.org/10.1192/bjp.152.2.209 PMid:3167337 |
||||
| 14. Fillenbaum GG, Belle G Van, Morris JC, et al. Consortium to Establish a Registry for Alzheimer's Disease (CERAD): the first twenty years. Alzheimers Dementia. 2008;4(2):96-109. https://doi.org/10.1016/j.jalz.2007.08.005 PMid:18631955 PMCid:PMC2808763 |
||||
| 15. Shulman KI. Clock-drawing: Is it the ideal cognitive screening test? In: International Journal of Geriatric Psychiatry. 2000. https://doi.org/10.1002/1099-1166(200006)15:6<548::AID-GPS242>3.3.CO;2-L PMid:10861923 |
||||
| 16. Lezak MD, Howieson DB, Loring DW. Neuropsychological assessment: Oxford University Press. New York. 2004. | ||||
| 17. Pestana, PC, Cardoso, S, Guerreiro, M, et al. Frequency, sociodemographic, and neuropsychological features of patients with subjective cognitive decline diagnosed using different neuropsychological criteria. Alz Res Therapy.2024;16:261. https://doi.org/10.1186/s13195-024-01634-1 PMid:39639343 PMCid:PMC11619704 |
||||
| 18. Scheltens P, Kuiper M, Ch Wolters E, et al. Atrophy of medial temporal lobes on MRI in "probable" Alzheimer's disease and normal ageing: diagnostic value and neuropsychological correlates. J Neurol Neurosurg Psychiatry. 1992;55(10):967-72. https://doi.org/10.1136/jnnp.55.10.967 PMid:1431963 PMCid:PMC1015202 |
||||
| 19. Pasquier F, Leys D, Weerts JGE, et al. Inter-and intraobserver reproducibility of cerebral atrophy assessment on mri scans with hemispheric infarcts. Eur Neurol. 1996;36(5). https://doi.org/10.1159/000117270 PMid:8864706 |
||||
| 20. Koedam ELGE, Lehmann M, Van Der Flier WM, et al. Visual assessment of posterior atrophy development of a MRI rating scale. Eur Radiol. 2011;21(12):2618-25. https://doi.org/10.1007/s00330-011-2205-4 PMid:21805370 PMCid:PMC3217148 |
||||
| 21. Fazekas F, Chawluk JB, Alavi A, et al. MR signal abnormalities at 1.5 T in Alzheimer's dementia and normal aging. American Journal of Roentgenology. 1987;149(2):351-6. https://doi.org/10.2214/ajr.149.2.351 PMid:3496763 |
||||
| 22. Gjøra L, Strand BH, Bergh S, et al. Current and future prevalence estimates of mild cognitive impairment, dementia, and its subtypes in a population-based sample of people 70 years and older in Norway: The HUNT study. Journal of Alzheimer's Disease. 2021;79(3):1213-1226. https://doi.org/10.3233/JAD-201275 PMid:33427745 PMCid:PMC7990439 |
||||
| 23. Campbell NL, Unverzagt F, LaMantia MA, et al. Risk factors for the progression of mild cognitive impairment to dementia. Clin Geriatr Med. 2013;29(4):873-93. https://doi.org/10.1016/j.cger.2013.07.009 PMid:24094301 PMCid:PMC5915285 |
||||
| 24. Engedal K, Barca ML, Høgh P, et al. The Power of EEG to Predict Conversion from Mild Cognitive Impairment and Subjective Cognitive Decline to Dementia. Dement Geriatr Cogn Disord. 2020;49(1):38-47. https://doi.org/10.1159/000508392 PMid:32610316 |
||||
| 25. Jack CR, Bennett DA, Blennow K, et al. NIA-AA Research Framework: Toward a biological definition of Alzheimer's disease. Alzheimers Dement. 2018;14(4):535-562. https://doi.org/10.1016/j.jalz.2018.02.018 PMid:29653606 PMCid:PMC5958625 |
||||
