Fræðigreinar
Ómega-3 fjölómettaðar fitusýrur: Hlutverk í læknisfræði
Ágrip
Áhugi á notkun ómega-3 fjölómettaðra fitusýra í læknisfræðilegum tilgangi hefur glæðst mikið síðustu áratugi enda liggja nú fyrir fjölmargar rannsóknir á gagnsemi þeirra við meðferð ýmissa sjúkdóma. Yfirvöld lyfjamála í nokkrum löndum Evrópu hafa veitt lyfi sem inniheldur ómega-3 fjölómettaðar fitusýrur markaðsleyfi sem meðferð við hárri þéttni þríglýseríða í blóði og nýverið einnig sem hluta af meðferð eftir brátt hjartadrep. Þá hafa rannsóknir gefið vísbendingar um ávinning í mun fleiri sjúkdómum, sérstaklega hjarta- og æðasjúkdómum, og hafa meðal annars leitt í ljós að ómega-3 fjölómettaðar fitusýrur gætu nýst við meðferð háþrýstings, æðakölkunar og til að fyrirbyggja alvarlegar hjartsláttartruflanir og skyndidauða. Einnig hafa á undanförnum árum komið fram fjölmargar áhugaverðar rannsóknir á notkun þessara fitusýra í meðferð langvinnra bólgusjúkdóma, sérstaklega iktsýki og ónæmisglóbúlín A nýrnameins þar sem niðurstöður benda til marktæks ávinnings af slíkri meðferð en hafa ekki verið alveg samhljóða. Loks hafa rannsóknir á hlutverki ómega-3 fjölómettaðra fitusýra í miðtaugakerfi ýtt undir athuganir á gildi þeirra fyrir taugaþroska ungbarna og notkun við meðferð geðsjúkdóma en þær rannsóknir eru ekki eins langt á veg komnar. Í þessari grein er fjallað um gildi ómega-3 fjölómettaðra fitusýra í læknisfræði og helstu rannsóknir sem farið hafa fram á notkun þeirra við meðferð sjúkdóma.English Summary |
| Indriðason ÓS, Pálsson R, Eðvarðsson VÖ The role of omega-3 polyunsaturated fatty acids in clinical medicine Læknablaðið 2003; 89: 199-211 In recent years there has been a growing interest in the use of omega-3 polyunsaturated fatty acids as medical therapeutic agents, and a multitude of epidemiological and clinical studies have evaluated their role in health and disease. A drug containing high concentration of omega-3 polyunsaturated fatty acids has been approved for the treatment of hypertriglyceridemia and following myocardial infarction in some European countries. Furthermore, there is a growing body of evidence suggesting that these fatty acids may be of benefit in several other diseases. To date, the majority of research has focused on cardiovascular diseases including hypertension, atherosclerosis and the prevention of sudden cardiac death, where these fatty acids may be useful. In addition, several studies have suggested a beneficial effect in severe acute and chronic inflammatory diseases, particularly rheumatoid arthritis and immunoglobulin A nephropathy, although the results have not been consistent. Finally, the role of omega-3 polyunsaturated fatty acids in the structure and function of nervous tissue has prompted investigations on their effect on neurological development of premature and young infants and their use as therapeutic agents in psychiatric disorders. In this article we review the scientific evidence for the role of omega-3 polyunsaturated fatty acids in clinical medicine. Key words: omega-3 polyunsaturated fatty acids, fish oil, cardiovascular diseases, inflammatory diseases, IgA nephropathy, mental illness, neurological development. Correspondence: Viðar Örn Eðvarðsson, vidare@landspitali.is |
Inngangur
Allt frá því fyrst var tekið eftir lágri dánartíðni vegna hjarta- og æðasjúkdóma meðal inúíta á Grænlandi hafa farið fram miklar rannsóknir á áhrifum sjávarfangs, lýsis og þeirra fitusýra sem þessar afurðir hafa að geyma á heilbrigði og sjúkdóma (1-3). Þessar rannsóknir hafa einkum beinst að sjúkdómum í hjarta og æðakerfi og hækkaðri blóðfitu en svo virðist sem neysla þessara afurða hafi þar mikilvæg verndandi áhrif. Einnig hafa frumurannsóknir, dýratilraunir og rannsóknir á mönnum gefið til kynna að ómega-3 fjölómettaðar fitusýrur hafi umtalsverð bólgu- og ónæmishemjandi áhrif (4) og hlutverk þeirra í byggingu frumuhimna er talið mikilvægt fyrir þroska og starfsemi taugakerfis (5).Nýlega var sérlyfinu OmacorTM (Solway Pharmaceuticals, Brussel, Belgía), sem er blanda af eikósapentaensýru (eicosapentaenoic acid, EPA) og dókósahexaensýru (docosahexaenoic acid, DHA), veitt markaðsleyfi í nokkrum löndum Evrópu sem meðferð við hækkaðri þéttni þríglýseríða í blóði og eftir brátt hjartadrep. Sterkar vísbendingar eru þó um að lyfið geti gagnast við fleiri meinsemdum. Í þessari yfirlitsgrein er fjallað um helstu rannsóknir á þýðingu sjávarfangs og/eða ómega-3 fjölómettaðra fitusýra fyrir heilbrigði og mögulega gagnsemi þessara fitusýra við meðferð sjúkdóma, þar á meðal hjarta- og æðasjúkdóma, en flestar rannsóknir hafa beinst að þeim. Einnig verður fjallað um spennandi niðurstöður sem fengist hafa við rannsóknir á meðferð ýmissa bólgusjúkdóma en þar ber hæst nýlegar rannsóknir á iktsýki og ónæmisglóbúlín A (immunoglobulin A, IgA) nýrnameini. Þá verður skýrt frá mögulegri notkun þessara fitusýra til að flýta taugaþroska ungbarna sem nærð eru með þurrmjólk og að lokum rannsóknum á meðferð geðsjúkdóma sem óhætt er að segja að hafi gefið mjög athyglisverðar niðurstöður.
Í þeim rannsóknum sem hér verður fjallað um hafa ómega-3 fjölómettaðar fitusýrur verið gefnar á mismunandi formi, ýmist sem lýsi sem við Íslendingar þekkjum eða sem fiskolíur er hreinsaðar hafa verið af A- og D-vítamíni. Þessar hreinsuðu fiskolíur innihalda mishátt hlutfall ómega-3 fjölómettaðra fitusýra, allt frá um 30% og upp í 85%, og getur slíkt valdið nokkrum ruglingi. Í grein okkar er lýsi skilgreint sem hreinsuð fiskolía er inniheldur A- og D-vítamín en fiskolía er notað yfir A- og D-vítamínsnauðar afurðir. Leitast er við að lýsa meðferðarrannsóknum út frá magni ómega-3 fjölómettaðra fitusýra þar sem því verður við komið og skammtastærðir skilgreindar út frá þeim. Að öðru leyti vísum við til þeirra afurða sem rannsakaðar hafa verið og á það sérstaklega við um faraldsfræðilegar rannsóknir.
Lífefnafræði og líffræðileg áhrif ómega-3 fjölómettaðra fitusýra
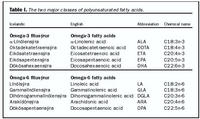
Helstu fitusýrur í fiskafurðum eru EPA sem er 20 kolefnisatóm að lengd og inniheldur fimm tvítengi í keðjunni [20:5(5,8,11,14,17), 20:5n3], og DHA sem er 22 kolefni að lengd og hefur sex tvítengi [22:6(4,7, 10,13,16,19), 22:6n3]. Þessar fitusýrur eru fjölómettaðar þar sem þær eru með fleiri en eitt tvítengi í kolefniskeðjunni og eru nefndar ómega-3 fitusýrur þar sem fyrsta tvítengið er staðsett milli þriðja og fjórða kolefnisatóms frá metýlenda fitusýrunnar (mynd 1, tafla I). Menn og önnur spendýr hafa hæfni til að lengja og afmetta a-línólensýru í EPA og DHA en þessi ferli eru hægvirk og takmarkast mögulega af aldri (6) og sjúkdómum, svo sem háþrýstingi og sykursýki (7). Því er mikilvægt og jafnvel nauðsynlegt fyrir suma að fá þessar fitusýrur úr fæðu til að ná æskilegri þéttni í blóði og vefjum en þá þéttni er unnt að meta með mælingum á hlutfalli fitusýranna í himnum rauðra blóðkorna. Frumur líkamans geta hins vegar lengt EPA og myndað þannig DHA og öfugt (mynd 1).Ómega-6 fjölómettaðar fitusýrur eru frábrugðnar ómega-3 fjölómettuðum fitusýrum að því leyti að fyrsta tvítengið er milli sjötta og sjöunda kolefnisatóms frá metýlendanum (mynd 1). Mikilvægust þeirra er arakídónsýra sem líkaminn myndar úr línólsýru. Ómega-6 og ómega-3 fjölómettaðar fitusýrur eru mikilvægar í uppbyggingu frumuhimna auk þess að vera hvarfefni til myndunar svonefndra eikósanóíða en þeir eru fjölskylda líffræðilega virkra fituefna eða fituboðefna sem mynduð eru með hýdroxýleringu fitusýranna um cýklóoxýgenasa og lípoxýgenasa ferli (mynd 2). Meðal eikósanóíða eru prostaglandín, þromboxön, leukotríen, lípoxín, hýdróperoxýeikósatetraensýrur og hýdroxýeikósatetraensýrur. Eikósanóíðar hafa áhrif á fjölmörg lífeðlisfræðileg og meinalífeðlisfræðileg viðbrögð, svo sem viðnám æða, segamyndun, gróningu sára og bólguviðbrögð en hafa yfirleitt skamman helmingunartíma og verka staðbundið (8).
Eikósanóíðar er myndast úr arakídónsýru nefnast díenóískir eikósanóíðar og í þeim flokki eru meðal annars prostaglandín E2, þromboxan A2 og leukótríen B4 (9). EPA getur líka virkað sem hvarfefni fyrir cýklóoxýgenasa og leiðir til myndunar tríenóískra eikósanóíða, svo sem prostacýklíns (prostaglandín I3) sem hefur æðavíkkandi áhrif og hamlar kekkjun (þyrpingu) blóðflagna (10), og þromboxans A3 sem hvorki hefur teljandi æðaherpandi áhrif né hvetjandi áhrif á kekkjun blóðflagna (11). Þromboxan A2 sem myndað er úr arakídónsýru, hvetur hins vegar herpingu æða og kekkjun blóðflagna. EPA er einnig ákjósanlegt hvarfefni fyrir lípoxýgenasa og leiðir til myndunar leukotríens B5, sem hefur litla líffræðilega virkni (9, 12, 13). Á hinn bóginn er leukotríen B4 sem kemur frá arakídónsýru lykilboðefni fyrir þátttöku hvítra blóðfrumna í bólgu.
Hlutfallsleg aukning styrks EPA og DHA miðað við arakídónsýru í frumuhimnum getur því breytt jafnvægi díenóískra og tríenóískra eikósanóíða (mynd 2) og þar með haft hagstæð áhrif á meinalífeðlisfræðileg ferli í ýmsum sjúkdómum, til dæmis háþrýstingi, æðakölkun og bólgusjúkdómum. Mýmargar frumurannsóknir og dýratilraunir styðja að svo sé. Auk hærra hlutfalls tríenóískra eikósanóíða í blóði og frumuhimnum hefur verið sýnt fram á minni framleiðslu á interleukín-1 og æxlisdrepsþætti (tumor necrosis factor) í örvuðum einkyrningum eftir meðferð með ómega-3 fjölómettuðum fitusýrum (14). Ómega-3 fjölómettaðar fitusýrur draga einnig úr gleypni átfrumna og tjáningu vefjaflokkasameinda og viðloðunarsameinda (15, 16). Ríkulegt magn ómega-3 fjölómettaðra fitusýra í fæði minnkar jafnframt marktækt tilfærslu einkyrninga í átt að efnaboðum (chemotactic signals) (14, 17). Ekki er ólíklegt að þessi áhrif á einkyrndar bólgufrumur séu vegna minna framboðs á leukótríen B4.
Ómega-3 fjölómettaðar fitusýrur og hjarta-
og æðasjúkdómar
Á síðustu áratugum hafa komið fram ýmsar vísbendingar um gagnsemi ómega-3 fjölómettaðra fitusýra og fiskneyslu við hjarta- og æðasjúkdómum. Margar faraldsfræðilegar rannsóknir hafa litið á samband fiskneyslu og dauðsfalla almennt og/eða dauðsfalla af völdum hjartasjúkdóma en niðurstöður hafa ekki verið samhljóða. Flestar rannsóknir hafa sýnt lægri dánartíðni í tengslum við fiskneyslu (18-22) en aðrar hafa engan ávinning sýnt (23-25) og fáeinar hafa sýnt aukna dánartíðni (26, 27). Þetta misræmi gæti meðal annars skýrst af mismunandi áhrifum feits og magurs fiskmetis (28) eða mismunandi áhrifum fiskneyslu meðal hinna ýmsu áhættuhópa (29). Hafa verður þó í huga að rannsóknir sem þessar geta einungis sýnt fram á tengsl mataræðis og sjúkdóma en ekki sannað orsakasamband þar á milli. Þannig gætu tengsl fiskneyslu og minni dánartíðni stafað af því að þeir sem neyta fiskafurða hreyfi sig meira eða hugi meira að heilsu sinni en aðrir og verði því langlífari. Fjölmargar vel unnar framskyggnar samanburðarrannsóknir hafa komið fram á síðustu árum og áratugum sem staðfest hafa gildi ómega-3 fjölómettaðra fitusýra í meðferð ýmissa sjúkdóma í hjarta og æðakerfi. Þannig virðast ómega-3 fjölómettaðar fitusýrur leiða til lækkunar þríglýseríða í blóði, lækka blóðþrýsting, hindra æðakölkun og bæta blóðflæði í smáæðum og hafa fyrirbyggjandi áhrif á takttruflanir í hjarta.
Hækkuð þéttni þríglýseríða í blóði
Hækkuð þéttni þríglýseríða í blóði er einn af áhættuþáttum hjarta- og æðasjúkdóma. Fjölmargar rannsóknir hafa sýnt að aukin fiskneysla og meðferð með ómega-3 fjölómettuðum fitusýrum leiðir til verulegrar lækkunar á þéttni þríglýseríða í blóði (30), til dæmis leiddi meðferð með 4 g af OmacorTM daglega til 45% lækkunar á blóðþéttni þríglýseríða samanborið við lyfleysu hjá einstaklingum með of háa þéttni þríglýseríða í blóði (31). Í þeirri rannsókn lækkaði einnig *LDL-kólesteról og marktæk hækkun mældist á *HDL-kólesteróli. Þau áhrif hafa þó ekki komið fram í öllum rannsóknum og hafa sumar sýnt hækkun á þéttni LDL-kólesteróls í blóði (30). Þessi áhrif ómega-3 fjölómettaðra fitusýra á blóðfitur má rekja til aukinnar virkni lípóprótein lípasa sem stuðlar að auknu niðurbroti þríglýseríða en einnig hefur verið sýnt fram á minnkaða framleiðslu og losun þríglýseríða og *VLDL í lifur (32-34) .
Þó einsýnt sé að ómega-3 fjölómettaðar fitusýrur lækka þéttni þríglýseríða í blóði hafa enn ekki komið fram langtímarannsóknir sem sýna fram á minnkaða hættu á hjarta- og æðasjúkdómum samfara þessari breytingu á blóðfitu en líklegt verður að teljast að það dragi úr þeirri áhættu. Svo afgerandi eru áhrifin til lækkunar þríglýseríða í blóði að OmacorTM hefur verið skráð í þessum tilgangi í ýmsum löndum Evrópu og sótt hefur verið um markaðsleyfi fyrir lyfið í Bandaríkjunum.
Háþrýstingur
Háþrýstingur er mjög algengt heilsufarsvandamál í vestrænum samfélögum og áhugi á meðferð hans með breytingum á mataræði eða fæðubótarefnum hefur verið mikill (35). Þó meinalífeðlisfræði háþrýstings sé að miklu leyti óþekkt eru ýmis atriði í líffræði ómega-3 fjölómettaðra fitusýra sem benda til að þær geti komið að gagni við meðferð hans. Má þar nefna aukna myndun eikósanóíða með æðavíkkandi eiginleika, svo sem prostacýklíns, og bein áhrif á samdrátt sléttvöðvafruma í æðaveggjum (36). Einnig hafa sumar rannsóknir sýnt fram á minnkuð viðbrögð æða við æðaherpandi efnum, svo sem angíótensíni II, og aukinn eftirgefanleika æðaveggja (37-39), en aðrar hafa ekki leitt í ljós slík áhrif (40, 41).
Margar vandaðar samanburðarrannsóknir á meðhöndlun háþrýstings með ómega-3 fjölómettuðum fitusýrum hafa litið dagsins ljós og sumar þeirra sýnt fram á umtalsverða lækkun slagbils- og/eða lagbilsþrýstings (42,43) en aðrar hafi ekki staðfest þann ávinning (35, 44). Þennan mun á niðurstöðum er erfitt að skýra. Þó kom í ljós í einni af stærri rannsóknunum að blóðþrýstingslækkandi áhrif voru í öfugu sambandi við hlutfall ómega-3 fjölómettaðra fitusýra í blóðfitu og að ekki urðu marktæk áhrif á blóðþrýsting meðal þeirra sem þegar neyttu fiskmetis að minnsta kosti þrisvar í viku (42). Því geta skammtar, meðferðarheldni og aðrir eiginleikar þýðisins haft afgerandi áhrif. Í fjölrannsóknagreiningu sem tók til 17 samanburðarrannsókna kom fram marktæk lækkun, eða 5,5 mmHg í slagbils- og 3,5 mmHg í lagbilsþrýstingi, við meðferð með ómega-3 fjölómettuðum fitusýrum hjá einstaklingum með háþrýsting, en höfundarnir bentu réttilega á að flestar rannsóknirnar náðu yfir stutt tímabil eða minna en þrjá mánuði þannig að langtímaáhrif eru ekki ljós (45). Skammtar voru nokkuð mismunandi en líklega koma lægri skammtar en 2,5 til 3 g á dag ekki að gagni (46). Áhrif ómega-3 fjölómettaðra fitusýra til lækkunar blóðþrýstings virðast því vera talsverð en þörf er á stórum samanburðarrannsóknum sem ná yfir langan tíma til að skera úr um hvort ávinningur er af þeirri meðferð. Líkt og með áhrif til lækkunar á þéttni þríglýseríða í blóði er ekki vitað hvort blóðþrýstingslækkandi áhrif leiða til lækkunar á dánartíðni eða tíðni fylgikvilla vegna hjarta- og æðasjúkdóma. Á hitt er þó að líta að lág aukaverkanatíðni og jákvæð áhrif á blóðfitur og æðasjúkdóma almennt hljóta að vega þungt við ákvörðun meðferðar.
Æðakölkun
Tilraunir í svínum og öpum (rhesus monkey) hafa leitt í ljós að langvarandi gjöf ómega-3 fjölómettaðra fitusýra dregur úr myndun æðakölkunar (47, 48), en ekki hefur tekist að sýna fram á þau áhrif í kanínum (49). Ekki liggja fyrir rannsóknir í mönnum þar sem meðferð með ómega-3 fjölómettuðum fitusýrum hefur verið borin saman við lyfleysu eða aðra meðferð til að koma í veg fyrir æðakölkun í kransæðum en hins vegar hefur slík meðferð verið könnuð hjá sjúklingum sem greinst hafa með kransæðasjúkdóm. Stærsta rannsóknin er svonefnd GISSI-rannsókn þar sem 11.324 einstaklingum sem höfðu greinst með hjartadrep var skipt í fjóra hópa með slembidreifingu (50). Af þeim fengu 2836 sjúklingar 880 mg af ómega-3 fjölómettuðum fitusýrum á dag, 2830 fengu 300 mg af E-vítamíni á dag, 2830 fengu hvort tveggja og 2828 fengu hvorugt. Sjúklingunum var fylgt eftir í 3,5 ár að meðaltali. Meðferð með ómega-3 fjölómettuðum fitusýrum leiddi til 10-15% fækkunar dauðsfalla samanborið við lyfleysu en E-vítamín hafði ekki marktæk áhrif. Smærri rannsóknir á sjúklingum sem lifað hafa af brátt hjartadrep benda til sömu niðurstöðu (51, 52). Einnig hefur verið sýnt fram á hægari framvindu kransæðakölkunar (53) og minni hættu á þrengslum í bláæðagræðlingum eftir hjáveituaðgerðir á kransæðum (54) meðal sjúklinga sem meðhöndlaðir hafa verið með ómega-3 fjölómettuðum fitusýrum samanborið við lyfleysu. Rannsóknir á notkun ómega-3 fjölómettaðra fitusýra til að fyrirbyggja endurmyndun þrengsla í kransæðum eftir víkkun þeirra hafa hins vegar ekki verið samhljóða, nokkrar hafa sýnt marktækan ávinning (55, 56) en aðrar engan (57, 58).
Með hliðsjón af þekkingu á áhrifum ómega-3 fjölómettaðra fitusýra á áhættuþætti æðakölkunar, svo sem háþrýsting og aukna þéttni þríglýseríða í blóði, er rökrétt að ætla að þær geti hamlað myndun æðakölkunar. Þá benda smærri rannsóknir til að ómega-3 fjölómettaðar fitusýrur lækki hómósýsteinþéttni í blóði (59) og minnki upptöku LDL-kólesteróls í bandvefsfrumum (60). Rannsóknir síðustu ára hafa einnig leitt í ljós mikilvægi bólgu í meinmyndunarferli æðakölkunar (61). Því má leiða að því líkum að ómega-3 fjölómettaðar fitusýrur dragi úr æðakölkun vegna myndunar bólguletjandi eikósanóíða og vegna hamlandi áhrifa á kekkjun blóðflagna og fjölgun sléttvöðvafrumna (3, 36). Þá hefur komið í ljós að innsetning ómega-3 fjölómettaðra fitusýra í frumuhimnur veldur breytingum á fljótanleika (fluidity) himnanna. Þetta leiðir til minnkaðrar seigju blóðs og aukins sveigjanleika eða aflögunarhæfni rauðra blóðkorna og gæti því bætt flutning súrefnis í kölkuðum æðum til vefja (62). Verkunarmáti þessara fitusýra getur því verið margslunginn og vísbendingar um gagnsemi þeirra í kransæðasjúkdómum verða að teljast mjög sterkar. Nýlega var meðferð eftir hjartadrep samþykkt sem ábending fyrir sérlyfið OmacorTM í Bretlandi.
Hjartsláttartruflanir
Frumu- og dýratilraunir benda eindregið til að ómega-3 fjölómettaðar fitusýrur geti komið að miklu gagni við meðferð alvarlegra hjartsláttartruflana. Þannig hafa rannsóknir á hjartavöðvafrumum úr rottum sýnt að ómega-3 fjölómettaðar fitusýrur minnka ertanleika þeirra og virðist verkunarmátinn vera gegnum hindrun á Na+-göngum í innanfrumuhimnum (sarcolemma). Þessi hömlun veldur minni kalsíumlosun innan frumunnar þannig að sterkara áreiti þarf til að koma af stað hrifspennu (63). Einnig hefur verið sýnt fram á að eikósanóíðar er myndast úr arakídónsýru geta aukið ertanleika hjartavöðva og valdið hraðatakttruflunum en EPA og afleiddir eikósanóíðar hamla slíkum misslætti (64). Þá hafa ýmsar dýratilraunir leitt í ljós að ómega-3 fjölómettaðar fitusýrur hindra lífshættulegar takttruflanir í sleglum (65-67), en ekki liggja fyrir rannsóknir á áhrifum þeirra á alvarlegar takttruflanir hjá mönnum. Hins vegar hefur verið litið á áhrif ómega-3 fjölómettaðra fitusýra á aukaslög frá sleglum hjá mönnum og eru niðurstöður þeirra rannsókna misvísandi, sumar hafa sýnt góðan árangur (68) en aðrar, meðal annars íslensk rannsókn, hafa ekki sýnt fram á fækkun slíkra aukaslaga hjá sjúklingum eftir brátt hjartadrep (69). Þá hefur komið í ljós minni hætta á skyndidauða meðal þeirra sem neyta fiskmetis reglulega, og er sú áhætta í öfugu hlutfalli við magn ómega-3 fjölómettaðra fitusýra í frumuhimnum rauðra blóðkorna (20). Benda þessar niðurstöður til þess að ómega-3 fjölómettaðar fitusýrur komi að gagni við að fyrirbyggja lífshættulegar takttruflanir í hjörtum mannanna (70). Í ljósi þess að ýmis lyf sem notuð hafa verið í meðferð alvarlegra hjartsláttartruflana frá sleglum geta haft í för með sér hættulegar hjartsláttartruflanir (pro-arrhythmic effect) og þannig aukið dánartíðni, gætu ómega-3 fjölómettaðar fitusýrur komið til álita sem meðferðarúrræði. Þetta þarf þó að rannsaka nánar.
Aðrir sjúkdómar í æðakerfi
Víðtæk áhrif ómega-3 fjölómettaðra fitusýra á blóðkorn og æðar hafa leitt til athugana á gagnsemi þeirra í ýmsum sjúkdómum í æðakerfi, til dæmis við endurtekin fósturlát í andfosfólípíðmótefnaheilkenni (antiphospholipid antibody syndrome) (71), við Raynaud fyrirbæri (72), í meðgönguháþrýstingi og meðgöngueitrun (73, 74) og í æðasjúkdómum sem tengjast lokastigsnýrnabilun (75). Benda margar þessara rannsókna til að ómega-3 fjölómettaðar fitusýrur komi að gagni en flestar þeirra eru smáar og þarf að staðfesta niðurstöður þeirra með stærri rannsóknum.
Ómega-3 fjölómettaðar fitusýrur
og bólgusjúkdómar
Meðferð með ómega-3 fjölómettuðum fitusýrum getur haft hagstæð áhrif á jafnvægi bólguhvetjandi og bólguletjandi þátta og því ekki að undra að slík meðferð hefur verið rannsökuð í ýmsum bólgusjúkdómum. Fjölmargar rannsóknir hafa verið gerðar á notkun ómega-3 fjölómettaðra fitusýra við meðferð bráðra og langvinnra bólgusjúkdóma í tilraunadýrum. Þær hafa skilað mismunandi árangri og ekki er rúm til að tíunda þær hér. Almennt virðist þó sem ómega-3 fjölómettaðar fitusýrur hafi bælandi áhrif á marga tilbúna bólgusjúkdóma í tilraunadýrum en hafa verður í huga að samsvarandi sjúkdómar í mönnum hafa ekki endilega sambærilega meingerð. Á hinn bóginn liggja nú fyrir nokkuð margar klínískar rannsóknir á notkun ómega-3 fjölómettaðra fitusýra við meðferð bráðra eða langvinnra bólgusjúkdóma í mönnum. Helstu rannsóknirnar hafa farið fram á iktsýki og IgA nýrnameini þar sem ávinningur virðist allnokkur en einnig hafa farið fram smærri rannsóknir á notkun ómega-3 fjölómettaðra fitusýra við sármyndandi ristilbólgu og asma og langvinnum teppusjúkdómi í lungum. Verður stuttlega greint frá þeim hér á eftir en um meðferð IgA nýrnameins með ómega-3 fjölómettuðum fitusýrum er fjallað í tengslum við aðra nýrnasjúkdóma.Iktsýki
Iktsýki er sá bólgusjúkdómur þar sem meðferð með ómega-3 fjölómettuðum fitusýrum hefur verið mest rannsökuð. Faraldsfræðilegar rannsóknir benda til að fiskneysla sé til bóta (76) en einnig hafa verið framkvæmdar margar vel hannaðar tvíblindar, lyfleysustýrðar samanburðarrannsóknir og sýna þær flestar að ómega-3 fjölómettaðar fitusýrur minnka fjölda bólginna og aumra liða og draga úr morgunstirðleika og alhliða virkniskori sjúkdómsins (77-82). Þessi áhrif voru samfara minnkaðri blóðþéttni interleukín-1 og leukótríen B4 (77, 78, 81). Þá hafa sumar þessara rannsókna leitt í ljós minni þörf fyrir bólgueyðandi gigtarlyf (nonsteroidal anti-inflammatory drugs, NSAID) ef ómega-3 fjölómettaðar fitusýrur hafa verið gefnar samhliða (80, 83, 84). Þessar rannsóknir hafa staðið frá þremur upp í 12 mánuði og hafa skammtastærðir ómega-3 fjölómettaðra fitusýra verið mismunandi en yfirleitt á bilinu 2,6 g á dag, upp í 130 mg/kg (9,1 g fyrir 70 kg einstakling) á dag. Í einni rannsókn var gefið 1,3 g af ómega-3 fjölómettuðum fitusýrum daglega í einum meðferðararmi en sá skammtur bar ekki árangur (79). Svo virðist því sem þurfi að gefa í það minnsta 2,6 g af ómega-3 fjölómettuðum fitusýrum á dag og ein rannsókn benti til þess að enn hærri skammtar, 54 mg/kg af EPA og 36 mg/kg af DHA á dag, væru árangursríkari en lægri skammtar (85). Ómega-3 fjölómettaðar fitusýrur virðast því geta komið að gagni í meðferð iktsýki, ekki síst til að minnka notkun bólgueyðandi gigtarlyfja. Langtímarannsókna með og án annarra lyfja er þó þörf til að finna þeim réttan sess í heildarmeðferð sjúkdómsins.
Sáraristilbólga
Nokkrar rannsóknir hafa verið framkvæmdar þar sem gerður hefur verið samanburður á ómega-3 fjölómettuðum fitusýrum og lyfleysu við meðferð á vægri eða meðalsvæsinni sárabólgu í ristli, aðallega í fjærenda ristils. Þær sýna að gjöf ómega-3 fjölómettaðra fitusýra dregur að einhverju leyti úr virkni sjúkdómsins og getur minnkað þörf fyrir barkstera (86-88). Ein rannsókn sýnir þó að þau áhrif eru ekki eins mikil og af súlfasalazíni (89).
Asmi og langvinnur teppusjúkdómur í lungum
Þær rannsóknir sem gerðar hafa verið á virkni ómega-3 fjölómettaðra fitusýra á asma hafa ekki sýnt óyggjandi ávinning (90). Þó eru vísbendingar um að þær geti komið að gagni við meðferð asma hjá börnum (90, 91). Enn fremur benda faraldsfræðilegar rannsóknir til almennt betri lungnaheilsu hjá þeim er neyta fæðu sem auðug er af ómega-3 fjölómettuðum fitusýrum (92) og minni hættu á langvinnum teppusjúkdómi í lungum hjá reykingamönnum með hátt hlutfall DHA í blóðfitu (93). Því er líklegt að samband ómega-3 fjölómettaðra fitusýra og langvinnra lungnasjúkdóma verði athugað nánar og að rannsóknir á meðferð þessara sjúkdóma með ómega-3 fjölómettuðum fitusýrum muni líta dagsins ljós.
Bráðir bólgusjúkdómar
Fjölmargar rannsóknir hafa kannað áhrif ómega-3 fjölómettaðra fitusýra á bráða bólgusjúkdóma og sýkingar í mönnum og dýrum. Dýratilraunir benda sterklega til minni bólgusvörunar og betri útkomu hjá sýktum dýrum sem meðhöndluð hafa verið með ómega-3 fjölómettuðum fitusýrum (94). Meðal annars hafa nýlegar íslenskar rannsóknir sýnt fram á lengri lifun músa sem sýktar voru með Klebsiella pneumoniae og fengu lýsi samanborið við ólífuolíu (95). Þær rannsóknir sýndu ekki fram á áhrif á bakteríuvöxt in vivo þannig að verkunarmátinn er að líkindum vegna áhrifa á bólgusvörun (96). Rannsóknir í rottum hafa hins vegar ekki gefið jafn óyggjandi niðurstöður (97).
Einnig hafa verið framkvæmdar nokkuð margar rannsóknir á notkun ómega-3 fjölómettaðra fitusýra við sýkingum og blóðsýkingarheilkenni hjá bráðveiku fólki á gjörgæslu. Þær hafa flestar sýnt færri nýjar sýkingar, styttri tíma í öndunarvél og/eða skemmri legu á gjörgæslu og sumar betri lifun (98-101). Í þessum rannsóknum hefur þó oftast einnig verið gefið arginín, glútamín og/eða núkleótíð í einhverri samsetningu með ómega-3 fjölómettuðum fitusýrum, stundum kallað ónæmisstyrkjandi fæða, þannig að ekki er unnt að meta eingöngu áhrif fitusýranna. Fjölrannsóknagreiningar á slíkum rannsóknum hafa sýnt marktæka minnkun á nýjum sýkingum en ekki aukna lifun meðal sjúklinga sem fengu þessa meðferð (102, 103).
Tíðaverkir
Talið er að prostaglandín gegni hlutverki í meinalífeðlisfræði tíðaverkja. Árið 1996 var birt bandarísk rannsókn á meðferð tíðaverkja hjá 42 stúlkum á unglingsaldri með ómega-3 fjölómettuðum fitusýrum (104). Þeim var skipt í tvo hópa og fékk annar hópurinn 1080 mg EPA og 720 mg DHA daglega í tvo mánuði og síðan lyfleysu í aðra tvo en hinn fékk fyrst lyfleysu og síðan ómega-3 fjölómettaðar fitusýrur. Einkenni voru metin með Cox tíðaeinkennaskala (Cox Menstrual Symptom Scale) og reyndust mun minni (P<0,0004) meðan á meðferð með ómega-3 fjölómettuðum fitusýrum stóð, sem bendir til að þessar fitusýrur dragi verulega úr tíðaverkjum hjá unglingsstúlkum.
Ómega-3 fjölómettaðar fitusýrur
og nýrnasjúkdómar
IgA nýrnamein er ásamt iktsýki sá bólgusjúkdómur þar sem meðferð með ómega-3 fjölómettuðum fitusýrum hefur verið einna best rannsökuð og byggir á þeim forsendum að þessar fitusýrur geti haft áhrif á myndun eikósanóíða og annarra frumuboðefna, myndun millifrumuefnis, blóðþrýsting, prótínmigu og/eða blóðfitu (105). Fjölþætt áhrif fitusýranna hafa einnig leitt til rannsókna á notkun þeirra við ýmsum öðrum nýrnavandamálum, meðal annars cýklósporíneiturvirkni á nýru, gauklabólgu af völdum rauðra úlfa, myndun kalsíumnýrnasteina samfara ofgnótt kalsíum í þvagi (hypercalciuria) og segamyndun í æðaaðgengi fyrir blóðskilun.IgA nýrnamein
IgA nýrnamein er algengasta tegund gauklabólgu í veröldinni. Sjúkdómsgangurinn er talsvert breytilegur, er oft góðkynja en í mörgum tilvikum á sér þó stað hægfara hnignun nýrnastarfsemi sem leiðir til lokastigsnýrnabilunar hjá 20-30% sjúklinga 10-20 árum eftir greiningu (106). Háþrýstingur er algengur fylgikvilli IgA nýrnameins og hefur ásamt mikilli prótínmigu og skertri nýrnastarfsemi, slæmt forspárgildi hjá sjúklingum með þennan sjúkdóm.
Fjórar slembiraðaðar rannsóknir hafa kannað áhrif ómega-3 fjölómettaðra fitusýra á IgA nýrnamein (107-110). Tvær af þessum rannsóknum hafa sýnt hagstæð áhrif á nýrnastarfsemi en tvær sýndu ekki fram á marktæk áhrif. Stærstu rannsóknina (106 sjúklingar) framkvæmdu vísindamenn á Mayo-sjúkrahúsinu í Bandaríkjunum en það var tvíblind, lyfleysustýrð rannsókn á áhrifum daglegrar inntöku 12 g af fiskolíu (1,88 g EPA og 1,47 g DHA) samanborið við ólífuolíu hjá sjúklingum með prótínmigu >1 g/d og kreatínín í sermi (S-kreatínín) < 265 mmól/L, þar af höfðu 68% hækkað S-kreatínín (110). Meðferðin stóð yfir í tvö ár og reyndist nýrnastarfsemin stöðug hjá hópnum sem fékk ómega-3 fjölómettaðar fitusýrur en versnaði hjá viðmiðunarhópnum. Aðeins þrír (6%) sjúklingar í fiskolíuhópnum náðu meginlokapunkti sem var 50% hækkun S-kreatíníns en 17 (33%) í lyfleysuhópnum. Hlutfall sjúklinga sem hafði fengið lokastigsnýrnabilun eða var látinn eftir fjögur ár var 10% í fiskolíuhópnum og 40% í lyfleysuhópnum. Enginn munur var á prótínútskilnaði eða blóðþrýstingsstjórnun hjá hópunum. Rannsókninni var fram haldið (open-label observational study) (111) og reyndist árangur langtímameðferðar með ómega-3 fjölómettuðum fitusýrum einnig marktækt betri en meðferð með lyfleysu. Þessi rannsókn gefur því til kynna umtalsverðan ávinning af meðferð með ómega-3 fjölómettuðum fitusýrum í framangreindum skömmtum fyrir sjúklinga með alvarlegt form IgA nýrnameins. Sami rannsóknarhópur sýndi nýlega fram á að hærri skammtar af ómega-3 fjölómettuðum fitusýrum leiddu ekki til betri útkomu (112). Aðrar rannsóknir hafa gefið mismunandi niðurstöður, rannsókn frá Japan með mun færri sjúklingum sýndi svipaðan ávinning (107) en hins vegar sýndu rannsóknir frá Ástralíu (108) og Svíþjóð (109) engan ávinning af ómega-3 fjölómettuðum fitusýrum. Báðar þessar rannsóknir voru þó smáar og eftirfylgdartími skammur (sex mánuðir) í þeirri síðarnefndu.
Fjölrannsóknagreining er sameinaði þessar fjórar samanburðarrannsóknir og eina sem bar saman sjúklinga fyrir og eftir meðferð með ómega-3 fjölómettuðum fitusýrum (113) sýndi að þegar tekið var tillit til mismunandi eftirfylgdar reyndist ávinningur af fiskolíumeðferð ekki tölfræðilega marktækur en minniháttar ávinningur virtist líklegur (114). Höfundarnir mæltu með stórri lyfleysustýrðri rannsókn með langtímaeftirfylgd og er slík rannsókn nú í gangi í Bandaríkjunum (115).
Þar til niðurstöður úr þeirri rannsókn liggja fyrir kemur mjög til álita að meðhöndla alla sjúklinga með IgA nýrnamein með ómega-3 fjölómettuðum fitusýrum, bæði þá sem hafa sjúkdóminn á alvarlegu stigi þar sem vísbendingar um ávinning verða að teljast mjög sterkar og jafnvel einnig þá sem eru með vægari form IgA nýrnameins. Þótt rannsóknir liggi ekki fyrir um gildi meðferðar með ómega-3 fjölómettuðum fitusýrum hjá þeim síðarnefndu eru nokkrar líkur á ávinningi og meðferðin án teljandi aukaverkana. Lágskammtameðferð Mayo-hópsins, EPA 1,88 g og DHA 1,47 g á dag, er sú meðferð sem líklega hentar best.
Eiturverkun cýklósporíns á nýru
Cýklósporín er ónæmisbælandi lyf sem hefur valdið straumhvörfum við meðferð líffæraþega. Sá böggull fylgir þó skammrifi að lyfið getur bæði valdið afturkræfri starfrænni skerðingu á nýrnastarfsemi og óafturkræfum æða- og pípluskemmdum sem leitt geta til nýrnabilunar. Ómega-3 fjölómettaðar fitusýrur hafa reynst gagnlegar til að fyrirbyggja nýrnaskemmdir í tilraunadýrum sem fengið hafa cýklósporín (116). Klínískar rannsóknir sem framkvæmdar hafa verið á síðasta áratug eru flestar litlar og ekki samhljóða varðandi áhrif fiskolíu á eiturverkun cýklósporíns (117-120) en flestar styðja þær þó að ómega-3 fjölómettaðar fitusýrur hafi gagnleg áhrif sem kunna að vera skammtaháð (119). Auk verndandi áhrifa þessara fitusýra gegn eiturverkunum cýklósporíns eru vísbendingar um að ómega-3 fjölómettaðar fitusýrur geti aukið ónæmisbælandi áhrif lyfsins (121, 122). Meðferð með ómega-3 fjölómettuðum fitusýrum getur því gagnast einstaklingum sem meðhöndlaðir eru með cýklósporíni á ýmsan hátt en þó hefur slík meðferð ekki náð fótfestu. Óvisst aðgengi að öruggu lyfjaformi sem og skortur á stórum rannsóknum þar sem græðlingslifun er meginendapunktur á vafalítið stóran þátt í að svo er ekki.
Gauklabólga af völdum rauðra úlfa
Rannsóknir á gauklabólgu af völdum rauðra úlfa í mönnum hafa ekki sýnt fram á marktækan ávinning af meðferð með ómega-3 fjölómettuðum fitusýrum og hafa því ekki uppfyllt þær væntingar sem dýratilraunir hafa gefið tilefni til.
Kalsíumnýrnasteinar
Hækkuð þéttni arakídónsýru í blóðvökva og aukið hlutfall þeirrar fitusýru í himnum rauðra blóðkorna hafa fundist hjá sjúklingum með kalsíumnýrnasteina. Enn fremur hefur greinst aukinn útskilnaður prostaglandíns E2 í þvagi þessara sjúklinga en það bendir til hlutverks díenóískra eikósanóíða í meinmyndun kalsíumofgnóttar í þvagi sem er vel þekktur áhættuþáttur fyrir myndun kalsíumnýrnasteina (123). Sýnt hefur verið fram á að ómega-3 fjölómettaðar fitusýrur geta dregið úr kalsíumofgnótt í þvagi hjá sjúklingum með nýrnasteina. Baggio og samstarfsmenn bættu daglegum skammti af 2,6 g EPA og DHA við fæði sjúklinga með kalsíumnýrnasteina í 30 daga. Það leiddi til lækkunar á hlutfalli arakídónsýru í blóðfitu, minnkunar á útskilnaði kalsíum og fosfats í þvagi auk þesss sem það dró úr uppsogi kalsíum frá görn (124). Þessar niðurstöður benda til að ómega-3 fjölómettaðar fitusýrur geti haft hagstæð áhrif á undirliggjandi efnaskiptaraskanir og gæti það minnkað klínískar afleiðingar nýrnasteina. Langtíma meðferðartilraunar er þörf.
Segamyndun í æðagræðlingi fyrir blóðskilun
Lokun æðaaðgengis vegna segamyndunar er algengasta orsök sjúkrahúsinnlagna sjúklinga sem eru í langvinnri blóðskilunarmeðferð. Oft er æðaaðgengið myndað með ísetningu gerviæðargræðlings sem tengir saman slagæð og bláæð. Meira en 75% slíkra græðlinga lokast vegna segamyndunar á fyrsta ári (125).
Nýleg, lyfleysustýrð rannsókn á sjúklingum í blóðskilunarmeðferð sem fengu gerviæðargræðling sýndi að tíðni opinna græðlinga eftir eitt ár var 76% hjá hópi sjúklinga sem var meðhöndlaður með 4 g af 80% etýlestraþykkni ómega-3 fjölómettaðra fitusýra á dag en 15% hjá samanburðarhópnum (126). Þennan ávinning má ef til vill rekja til myndunar tríenóískra prostanóíða sem draga úr kekkjunarhæfni blóðflagna, beinna áhrifa á æðaþelsfrumur eða minni myndunar bólgu- og vaxtarhvetjandi frumuboðefna. Ef þessi stórkostlegu áhrif af meðhöndlun með ómega-3 fjölómettuðum fitusýrum verða staðfest í öðrum rannsóknum gæti þetta valdið byltingu fyrir blóðskilunarsjúklinga með gerviæðaraðgengi.
Ómega-3 fjölómettaðar fitusýrur
og miðtaugakerfið
Í miðtaugakerfi heilbrigðra einstaklinga er ríkulegt magn fjölómettaðra fitusýra. Mest er af arakídónsýru og DHA en þessar tvær fitusýrur eru um það bil 20% af þurrþyngd heilans (5, 127, 128) og DHA er allt að 40% fitusýra í sjónhimnu (5, 127). Þessar löngu fjölómettuðu fitusýrur eru því mikilvægar byggingareiningar frumuhimna taugakerfisins og líklegt að þær hafi áhrif á boð milli taugafrumna og virkni himnubundinna viðtækja, jónaganga og ensíma (5, 127, 129). Áhrif á taugaþroska
Ýmislegt bendir til að fyrirburar og nýburar geti ekki myndað nægilega mikið af arakídónsýru og DHA þrátt fyrir fullnægjandi magn forstiganna línólsýru og a-línólensýru í fæðu (6, 130, 131). Hafa sumir dregið þá ályktun að arakídónsýra og DHA séu í raun lífsnauðsynlegar fyrir yngstu börnin og því eigi að bæta þeim í þurrmjólk sem þeim er ætluð (132). Þetta hefur einnig leitt til nokkuð víðtækra rannsókna á tengslum mataræðis og fitusýruinnihalds heila og taugaþroska ungbarna þar sem vitað er að brjóstamjólk inniheldur allar þær fitusýrur sem barnið þarfnast en óbætt þurrmjólk og kúamjólk innihalda hvorki arakídónsýru né DHA (5, 133).
Rannsóknir á heilavef barna sem dóu vöggudauða innan fjögurra mánaða aldurs sýndu að marktækt meira var af DHA í heila þeirra barna sem nærst höfðu á brjóstamjólk en í samanburðarhópi sem nærst hafði á óbættri þurrmjólk (134) og staðfesta þannig afgerandi áhrif næringar á fitusýruinnihald í heilavef ungbarna.
Fjölrannsóknagreiningar á áhrifum DHA-uppbótar í þurrmjólk á sjónskerpu hraustra fullbura annars vegar og hins vegar fyrirbura á aldrinum eins til 12 mánaða, benda einnig eindregið til þess að sjón þeirra barna sem nærðust á DHA-bættri þurrmjólk þroskist fyrr en hjá þeim sem ekki fengu hana en langtímaáhrif á sjón eru ekki þekkt (135, 136).
Niðurstöður einstakra rannsókna sem beinst hafa að nauðsyn DHA og arakídónsýru fyrir almennan taugaþroska hafa þó ekki verið einhlítar. Eldri rannsóknir sýndu að taugaþroski tveggja ára barna sem nærðust á brjóstamjólk var meiri en barna sem nærð voru með þurrmjólk (137) en nýlegar rannsóknir hafa gefið nokkuð misvísandi niðurstöður. Til dæmis birtust nýlega tvær ítarlegar rannsóknir og sýndi önnur fram á jákvæð áhrif á taugaþroska fyrirbura með fæðingarþyngd undir 1250 g þegar þeim var gefin DHA- og arakídónsýrubætt þurrmjólk allt fyrsta árið (138) en hin rannsóknin sem gerð var á fullburða börnum sýndi engin áhrif á taugaþroska við 14 mánaða aldur (139). Þá sýndi rannsókn á fullburða börnum ekki mun á taugaþroska við 18 mánaða aldur meðal barna sem fengu DHA- og arakídónsýrubætta þurrmjólk samanborið við börn sem fengu ýmist hefðbundna þurrmjólk eða brjóstamjólk fyrstu sex mánuði ævinnar (140). Í annarri rannsókn sem gerð var á fullburða börnum fékk einn hópur DHA-bætta þurrmjólk, annar fékk DHA- og arakídónsýrubætta þurrmjólk, þriðji hópurinn hefðbundna þurrmjólk og sá fjórði brjóstamjólk í 12 mánuði frá fæðingu (141). Ekki reyndist munur á taugaþroska barnanna í þessum hópum við 12 mánaða aldur. Við 24 mánaða aldur kom þó í ljós að börn sem nærst höfðu á brjóstamjólk höfðu þroskast marktækt betur en ekki var munur á hinum hópunum. Loks sýndi bandarísk rannsókn að Vitsmunaþroskavísir Baleys (Baley's Mental Developmental Index) við 18 mánaða aldur var marktækt hærri hjá börnum sem fengu DHA- eða DHA- og arakídónsýrubætta þurrmjólk í fjóra mánuði frá fæðingu en hjá samanburðarhópi sem fékk venjulega þurrmjólk (142). Langtímaáhrif slíkrar meðferðar á heildarþroska og vöxt ungbarna sem fengið hafa næringu bætta með ómega-3 fjölómettuðum fitusýrum hafa þó ekki verið könnuð með fullnægjandi hætti.
Þó niðurstöður séu ekki einhlítar hefur nefnd sérfræðinga á vegum Alþjóða heilbrigðisstofnunarinnar og Matvæla- og landbúnaðarstofnunar Sameinuðu þjóðanna mælt með því að þurrmjólk sem ætluð er fullburða börnum innihaldi 3,5% fitu þar sem 0,38% fitunnar er DHA (20 mg/kg/líkamsþyngdar á dag) og þurrmjólk sem ætluð er fyrirburum innihaldi 4% fitu, þar af 0,60% DHA (40 mg/kg/líkamsþyngdar á dag) (136). Á Íslandi fæst þurrmjólk sem er bæði DHA- og arakídónsýrubætt en ekki er völ á kúamjólk sem bætt er með þessum fitusýrum.
Geðsjúkdómar
Á undanförnum árum hafa verið gerðar margar rannsóknir á sambandi ómega-3 fjölómettaðra fitusýra og geðhvarfaveiki, þunglyndi og geðklofa (127, 128, 143-145) og hafa komið fram sterk tengsl milli lágrar þéttni ómega-3 fjölómettaðra fitusýra í blóðvökva eða himnum rauðra blóðkorna og þessara geðraskana (146-148).
Geðhvarfaveiki
Nýlega birtust niðurstöður lyfleysustýrðrar samanburðarrannsóknar þar sem geðhvarfaveiki var meðhöndluð með háum skömmtum af ómega-3 fjölómettuðum fitusýrum (6,2 g af EPA og 3,4 g af DHA á dag) en annarri meðferð (lyfjameðferð og viðtalsmeðferð) var ekki breytt á rannsóknartímanum (143). Þrjátíu sjúklingar sem allir uppfylltu greiningarskilyrði *DSM-IV fyrir geðhvarfaveiki tóku þátt í rannsókninni sem stóð í fjóra mánuði og var tvíblind. Niðurstöðurnar sýndu marktækt lengra tímabil þar sem oflætis varð ekki vart hjá þeim sjúklingum sem meðhöndlaðir voru með ómega-3 fjölómettuðum fitusýrum (P=0,002) en einnig stóðu þeir sjúklingar sig marktækt betur á stöðluðum oflætis- og þunglyndisprófum. Þó þessi rannsókn sé frekar lítil bendir hún eindregið til gagnsemi meðferðar með ómega-3 fjölómettuðum fitusýrum við geðhvarfaveiki en nauðsynlegt er að endurtaka rannsóknina á stærri hópi sjúklinga og með lengri eftirfylgd.
Þunglyndi
Faraldsfræðirannsóknir hafa sýnt fram á samband lítillar fiskneyslu og þunglyndis (149). Einnig hefur endurtekið verið sýnt fram á aukið hlutfall ómega-6 fjölómettaðra fitusýra samanborið við ómega-3 fjölómettaðar fitusýrur í himnum rauðra blóðkorna hjá sjúklingum með þennan sjúkdóm (148, 150). Þessar rannsóknir varpa þó ekki ljósi á hvort skortur á ómega-3 fjölómettuðum fitusýrum veldur þunglyndi og gagnsemi ómega-3 fjölómettaðra fitusýra við meðferð sjúkdómsins hefur enn ekki verið rannsökuð til hlítar (127, 128).
Geðklofi
Ýmsar rannsóknir hafa staðfest minnkaða þéttni bæði ómega-6 og ómega-3 fjölómettaðra fitusýra (einkum arakídónsýru og DHA) í himnum rauðra blóðkorna hjá sjúklingum með geðklofa, hvort sem þeir hafa verið meðhöndlaðir með geðlyfjum eða ekki (151, 152). Rannsóknir á látnum einstaklingum með geðklofa hafa staðfest sömu breytingar á fitusýrusamsetningu í heila þeirra en áberandi lítið er þar af arakídónsýru (129, 153). Niðurstöður rannsókna með 31P segulómunarlitrófsgreiningu (magnetic resonance spectroscopy) á miðtaugakerfi geðklofasjúklinga benda til þess að lága þéttni áðurnefndra fitusýra megi skýra að hluta til með aukinni losun þeirra úr himnum taugafrumna (154-156). Talið er að þessi aukna losun fitusýranna úr frumuhimnum stafi af aukinni virkni fosfólípasa A2 (145, 157, 158). Sú staðreynd að lyf sem notuð eru við geðklofa draga úr virkni fosfólípasa A2 og auka þéttni fjölómettaðra fitusýra í himnum rauðra blóðkorna og heila (159) styður þá kenningu að aukin virkni fosfólípasa A2 sé mikilvægur hlekkur í meinmyndun sjúkdómsins. Umhverfisþættir, svo sem næring (134, 160), reykingar (129) og breytingar á hormónabúskap (161), geta einnig haft afgerandi áhrif á fitusýrusamsetningu líkamans.
Fáar rannsóknir hafa verið gerðar þar sem geðklofasjúklingar hafa verið meðhöndlaðir með ómega-3 og/eða ómega-6 fjölómettuðum fitusýrum. Nýlega var þó greint frá tveimur mjög vel rannsökuðum sjúkratilfellum þar sem alvarleg einkenni geðklofa bötnuðu verulega af meðferð með ómega-3 fjölómettuðum fitusýrum eingöngu (147, 162). Í báðum tilvikum kom bati fram á fyrstu fjórum til átta vikunum og voru áberandi áhrif á jákvæð einkenni sjúkdómsins hjá öðrum sjúklinganna en hjá hinum bæði á jákvæð og neikvæð einkenni. Þessu samfara varð mikil breyting til batnaðar á fitusýrusamsetningu í himnum rauðra blóðkorna.
Auk þessara sjúkratilfella birtust nýlega niðurstöður tveggja mjög áhugaverðra tvíblindra frumrannsókna (pilot studies) á áhrifum meðferðar með ómega-3 fjölómettuðum fitusýrum við geðklofa (146). Fyrri rannsóknin stóð í þrjá mánuði en þar voru borin saman áhrif DHA, EPA og lyfleysu á sjúkdómseinkenni geðklofa hjá sjúklingum sem að auki voru meðhöndlaðir með geðlyfjum á hefðbundinn hátt. Sjúklingum var slembiraðað í þrjá hópa og fengu 15 sjúklingar 2 g af EPA á dag, 16 voru meðhöndlaðir með 2 g af DHA á dag og 14 sjúklingum var gefin lyfleysa. Að meðferð lokinni reyndist heildarskor á klínísku geðklofaprófi (positive and negative syndrome scale, PANSS) vera marktækt lægra hjá sjúklingum sem fengið höfðu EPA í samanburði við þá sem fengið höfðu lyfleysu. Enn fremur kom í ljós að EPA hafði marktækt meiri áhrif á jákvæð einkenni geðklofa en DHA en ekki kom fram mælanlegur bati á neikvæðum einkennum í neinum hópanna þriggja. Umtalsverð aukning varð á þéttni EPA og DHA í himnum rauðra blóðkorna þeirra sjúklinga sem fengu EPA og DHA en engra breytinga varð vart í lyfleysuhópnum. Í seinni rannsókninni sem einnig var tvíblind var 15 nýgreindum geðklofasjúklingum gefið 2 g af EPA daglega í þrjá mánuði en 15 sjúklingar í samanburðarhópi fengu lyfleysu (146). Allir 15 sjúklingarnir í lyfleysuhópnum fengu hefðbundna lyfjameðferð við geðklofa en einungis níu af 15 sjúklingum í meðferðarhópnum fengu slíka meðferð. Þrátt fyrir þennan mun á notkun hefðbundinna geðlyfja milli hópanna var meðal PANSS skor mun betra hjá þeim hópi sjúklinga sem fékk EPA og mestur var munurinn á jákvæðum einkennum sjúkdómsins.
Þannig benda þessar rannsóknir til þess að meðferð með ómega-3 fjölómettuðum fitusýrum geti leiðrétt óeðlilega samsetningu fitusýra í frumuhimnum sjúklinga með geðklofa og dregið verulega úr einkennum sjúkdómsins.
Aukaverkanir
Í flestum samanburðarrannsóknum sem framkvæmdar hafa verið hefur ekki komið fram mikill munur á ómega-3 fjölómettuðum fitusýrum og lyfleysu með tilliti til aukaverkana. Þó hafa væg meltingarfæraóþægindi, svo sem ropi og lýsisbragð í munni, ógleði, þemba og hægðabreytingar, verið algengari hjá þeim sem taka þessar fitusýrur og gæti það fylgt hærri skömmtum (110, 112). Einnig verður að hafa í huga að hætta á blæðingum getur aukist vegna áhrifa á blóðflögur (163). Það hefur þó ekki verið staðfest í þeim rannsóknum sem hér hafa verið tíundaðar og meðferð með ómega-3 fjölómettuðum fitusýrum verður því að teljast örugg meðferð.Lyfjaform_>
Þeir skammtar af ómega-3 fjölómettuðum fitusýrum sem notaðir hafa verið við meðferð hinna ýmsu sjúkdóma eru nokkuð háir (tafla II). Þar sem hlutfall þessara fitusýra í lýsi er tiltölulega lágt er óráðlegt að nota það við meðferð sjúkdóma vegna hárrar þéttni A- og D-vítamíns (tafla III). Því er nauðsynlegt að hafa völ á lyfjaformi sem inniheldur hærra hlutfall EPA og DHA. Í nokkrum nágrannalöndum okkar hefur fengist markaðsleyfi fyrir sérlyfið OmacorTM, sem inniheldur sterka blöndu af EPA og DHA (tafla III). Meginábendingar eru sem fyrr segir hækkuð blóðþéttni þríglýseríða og meðferð eftir brátt hjartadrep. Þetta lyf hefur ekki verið skráð hér á landi en eitt lyfjaform hefur verið verið samþykkt sem náttúrulyf (Eskimo-3, Cardinova AB, Uppsalir, Svíþjóð). Það hefur þó ekki verið markaðssett sem slíkt en í heilsu- og matvörubúðum er hægt að kaupa afurðir frá ýmsum framleiðendum sem innihalda mismunandi mikið af ómega-3 fjölómettuðum fitusýrum og flokkast sem náttúruvörur (tafla III). Unnt er að reikna út það magn sem ráðlegt er að taka, byggt á skömmtum sem beitt hefur verið við meðferð þess sjúkdóms sem um ræðir (tafla II). Eftir brátt hjartadrep til dæmis er ráðlegt að taka tvö hylki af Omega-forte (Lýsi hf, Reykjavík, Ísland) daglega. Með vaxandi notkun ómega-3 fjölómettaðra fitusýra við meðferð sjúkdóma verður mikilvægi þess að hafa aðgang að öruggu lyfjaformi enn meira því upp hafa komið vissar áhyggjur varðandi öryggi sumra þeirra afurða sem á markaði eru. Þær áhyggjur hafa einkum beinst að mengunarefnum, svo sem snefilmálmum (164) og eiturefnum á borð við fjölklórtvífenýlsambönd. Hreinsun er því mikilvæg og notkun andoxunarefna, aðallega tókóferóls, til að fyrirbyggja oxun fitusýranna er mjög þýðingarmikil (165). Í þeim tilvikum þar sem sýnt hefur verið fram á ávinning af meðferð með ómega-3 fjölómettuðum fitusýrum, til dæmis við háa blóðþéttni þríglýseríða, eftir hjartadrep, við iktstýki og IgA nýrnameini, er nauðsynlegt að læknar geti ávísað þessum fitusýrum sem öðrum lyfjum í réttri blöndu og styrkleika. Enn fremur þurfa sjúklingar að eiga kost á slíku lyfi á viðráðanlegu verði og gæti það kallað á þátttöku sjúkratrygginga.
Niðurlag
Ljóst má vera af því sem rakið hefur verið hér að framan að ómega-3 fjölómettaðar fitusýrur geta nýst við meðferð margra sjúkdóma. Ganga sumir svo langt að mæla með meðferð með ómega-3 fjölómettuðum fitusýrum eða aukinni neyslu sjávarfangs sem næsta skrefi í baráttunni við hjarta- og æðasjúkdóma (166, 167). Þótt öðrum þyki þetta nokkuð djúpt í árinni tekið (168) má reikna með að hlutverk ómega-3 fjölómettaðra fitusýra eigi eftir að skýrast betur á næstu árum. Óhætt er að segja að þessar fitusýrur séu góður kostur við meðferð hárrar blóðþéttni þríglýseríða, iktsýki, IgA nýrnameins og eftir hjartadrep. Notkun í öðrum sjúkdómum þarf frekari rannsókna við og sérstaklega þarf að kanna nánar misræmi í niðurstöðum rannsókna á sumum sjúkdómum, til dæmis háþrýstingi og endurmyndun þrengsla eftir kransæðavíkkanir. Mögulegar orsakir geta legið í mismunandi skammtastærðum og mismunandi líkamsbirgðum þátttakenda af ómega-3 fjölómettuðum fitusýrum, E-vítamíni og snefilefnunum zinki og selen sem eru nauðsynleg fyrir efnahvörf sem leiða til nýmyndunar langra fjölómettaðra fitusýra (42, 136). Þá geta náttúruleg uppspretta fitusýranna og hvaða kolefnisfrumeind í glýserólsameind þríglýseríða fitusýrurnar tengjast líka skipt máli varðandi frásog og þéttni þeirra í vefjum líkamans (169). Einnig er brýnt að svara spurningum um skammtastærðir en skammtar hafa verið á bilinu 1 til 10 g í þeim klínísku rannsóknum sem hér hefur verið fjallað um (tafla II). Loks er heldur ekki ljóst hvort EPA og DHA séu jafngildar eða hafi mismunandi klíníska þýðingu (170-172). Þó ýmsum spurningum sé þannig ósvarað hlýtur hin lága tíðni aukaverkana að gera ómega-3 fjölómettaðar fitusýrur að fýsilegum kosti við meðferð sjúkdóma þar sem sýnt þykir að þær komi að gagni. Heimildir
1. Dyerberg J, Bang HO. A hypothesis on the development of acute myocardial infarction in Greenlanders. Scand J Clin Lab Invest Suppl 1982; 161: 7-13.
2. O'Keefe JHJ, Harris WS. From Inuit to implementation: omega-3 fatty acids come of age. Mayo Clin Proc 2000; 75: 607-14.
3. Das UN. Beneficial effect(s) of n-3 fatty acids in cardiovascular diseases: but, why and how? Prostagl Leukotrien Ess Fatty Acids 2000; 63: 351-62.
4. Calder PC. n-3 polyunsaturated fatty acids and cytokine production in health and disease. Ann Nutr Metabol 1997; 41: 203-34.
5. Heird WC. The role of polyunsaturated fatty acids in term and preterm infants and breastfeeding mothers. Ped Clin N Amer 2001; 48: 173-88.
6. Uauy R, Peirano P, Hoffman D, Mena P, Birch D, Birch E. Role of essential fatty acids in the function of the developing nervous system. Lipids 1996; 31 Suppl: S167-S176.
7. De Caterina R, Endres S, Kristensen SD, Schmidt EB. n-3 fatty acids and renal diseases. Am J Kidney Dis 1994; 24: 397-415.
8. Donadio JV Jr, Grande JP. Immunoglobulin A Nephropathy: A Clinical Perspective. J Am Soc Nephrol 1997; 1324-32.
9. Crawford MA. Background to essential fatty acids and their prostanoid derivatives. Br Med Bull 1983; 39: 210-3.
10. Fischer S, Weber PC. Prostaglandin I3 is formed in vivo in man after dietary eicosapentaenoic acid. Nature 1984; 307: 165-8.
11. Fischer S, Weber PC. Thromboxane A3 (TXA3) is formed in human platelets after dietary eicosapentaenoic acid (C20: 5 omega 3). Biochem Biophys Res Commun 1983; 116: 1091-9.
12. Lee TH, Mencia-Huerta J-M, Corey EJ, Lewis RA, Austen KF. Effects of exogenous arachidonic, eicosapentaenoic, and docosahexaenoic acids on the generation of 5-lipoxygenase pathway products by ionophore-activated human neutrophils. J Clin Invest 1984; 74: 1922-33.
13. Weaver BJ, Holub BJ. Health effects and metabolism of dietary eicosapentaenoic acid. Prog Food Nutr Sci 1988; 12: 111-50.
14. Endres S, Ghorbani R, Kelley VE, Georgilis K, Lonnemann G, van der Meer JWM, et al. The effect of dietary supplementation of n-3 polyunsaturated fatty acids on the synthesis of interleukin-1 and tumor necrosis factor by mononuclear cells. N Engl J Med 1989; 320: 265-71.
15. Calder PC, Bond JA, Harvey DJ, Gordon S, Newsholme EA. Uptake of saturated and unsaturated fatty acids into macrophage lipids and their effect upon macrophage adhesion and phagocytosis. Biochem J 1990; 269: 807-14.
16. Hughes DA, Pinder AC, Piper Z, Johnson IT, Lund EK. Fish oil supplementation inhibits the expression of major histocompatibility complex class II molecules and adhesion molecules on human monocytes. Am J Clin Nutr 1996; 63: 267-72.
17. Lee TH, Hoover RL, Williams JD, Sperling RI, Ravalese J, Spur BW, et al. Effects of dietary enrichment with EPA and DHA on in vitro neutrophil and monocyte leukotriene generation and neutrophil function. N Engl J Med 1985; 312: 1217-24.
18. Kromhout D, Bosschieter EB, de Lezenne C. The inverse relation between fish consumption and 20-year mortality from coronary heart disease. N Engl J Med 1985; 312: 1205-9.
19. Daviglus ML, Stamler J, Orencia AJ, Dyer AR, Liu K, Greenland P, et al. Fish consumption and the 30-year risk of fatal myocardial infarction. N Engl J Med 1997; 336: 1046-53.
20. Albert CM, Hennekens CH, O'Donnell CJ, Ajani UA, Carey VJ, Willett WC, et al. Fish consumption and risk of sudden cardiac death. JAMA 1998; 279: 23-8.
21. Albert CM, Campos H, Stampfer MJ, Ridker PM, Manson JE, Willett WC, et al. Blood levels of long-chain n-3 fatty acids and the risk of sudden death. N Engl J Med 2002; 346: 1113-8.
22. Hu FB, Bronner L, Willett WC, Stampfer MJ, Rexrode KM, Albert CM, et al. Fish and omega-3 fatty acid intake and risk of coronary heart disease in women. JAMA 2002; 287: 1815-21.
23. Lapidus L, Andersson H, Bengtsson C, Bosaeus I. Dietary habits in relation to incidence of cardiovascular disease and death in women: a 12-year follow-up of participants in the population study of women in Gothenburg, Sweden. Am J Clin Nutr 1986; 44: 444-8.
24. Ascherio A, Rimm EB, Stampfer MJ, Giovannucci EL, Willett WC. Dietary intake of marine n-3 fatty acids, fish intake, and the risk of coronary disease among men. N Engl J Med 1995; 332: 977-82.
25. Morris MC, Manson JE, Rosner B, Buring JE, Willett WC, Hennekens CH. Fish consumption and cardiovascular disease in the physicians' health study: a prospective study. Am J Epidemiol 1995; 142: 166-75.
26. Orencia AJ, Daviglus ML, Dyer AR, Shekelle RB, Stamler J. Fish consumption and stroke in men. 30-year findings of the Chicago Western Electric Study. Stroke 1996; 27: 204-9.
27. Pietinen P, Ascherio A, Korhonen P, Hartman AM, Willett WC, Albanes D, et al. Intake of fatty acids and risk of coronary heart disease in a cohort of Finnish men. The Alpha-Tocopherol, Beta-Carotene Cancer Prevention Study. Am J Epidemiol 1997; 145: 876-87.
28. Oomen CM, Feskens EJ, Rasanen L, Fidanza F, Nissinen AM, Menotti A, et al. Fish consumption and coronary heart disease mortality in Finland, Italy, and The Netherlands. Am J Epidemiol 2000; 151: 999-1006.
29. Marckmann P, Gronbaek M. Fish consumption and coronary heart disease mortality. A systematic review of prospective cohort studies. Eur J Clin Nutr 1999; 53: 585-90.
30. Harris WS. n-3 fatty acids and lipoproteins: comparison of results from human and animal studies. Lipids 1996; 31: 243-52.
31. Harris WS, Ginsberg HN, Arunakul N, Shachter NS, Windsor SL, Adams M, et al. Safety and efficacy of Omacor in severe hypertriglyceridemia. J Cardiovasc Risk 1997; 4: 385-91.
32. Harris WS, Lu G, Rambjor GS, Walen AI, Ontko JA, Cheng Q, et al. Influence of n-3 fatty acid supplementation on the endogenous activities of plasma lipases. Am J Clin Nutr 1997; 66: 254-60.
33. Ikeda I, Kumamaru J, Nakatani N, Sakono M, Murota I, Imaizumi K. Reduced hepatic triglyceride secretion in rats fed docosahexaenoic acid-rich fish oil suppresses postprandial hypertriglyceridemia. J Nutr 2001; 131: 1159-64.
34. Harris WS, Connor WE, Illingworth DR, Rothrock DW, Foster DM. Effects of fish oil on VLDL triglyceride kinetics in humans. J Lipid Res 1990; 31: 1549-58.
35. Anonymous. The effects of nonpharmacologic interventions on blood pressure of persons with high normal levels. Results of the Trials of Hypertension Prevention, Phase I. [erratum appears in JAMA 1992 May 6; 267: 2330.] JAMA 1992; 267: 1213-20.
36. Abeywardena MY, Head RJ. Longchain n-3 polyunsaturated fatty acids and blood vessel function. Cardiovasc Res 2001; 52: 361-71.
37. Kenny D, Warltier DC, Pleuss JA, Hoffmann RG, Goodfriend TL, Egan BM. Effect of omega-3 fatty acids on the vascular response to angiotensin in normotensive men. Am J Cardiol 1992; 70: 1347-52.
38. Goode GK, Garcia S, Heagerty AM. Dietary supplementation with marine fish oil improves in vitro small artery endothelial function in hypercholesterolemic patients: a double-blind placebo-controlled study. Circulation 1997; 96: 2802-7.
39. McVeigh GE, Brennan GM, Cohn JN, Finkelstein SM, Hayes RJ, Johnston GD. Fish oil improves arterial compliance in non-insulin-dependent diabetes mellitus. Arterioscler Thrombosis 1994; 14: 1425-9.
40. Grossman E, Peleg E, Shiff E, Rosenthal T. Hemodynamic and neurohumoral effects of fish oil in hypertensive patients. Am J Hypert 1993; 6: 1040-5.
41. Kothny W, Angerer P, Stork S, von Schacky C. Short term effects of omega-3 fatty acids on the radial artery of patients with coronary artery disease. Atherosclerosis 1998; 140: 181-6.
42. Bonaa KH, Bjerve KS, Straume B, Gram IT, Thelle D. Effect of eicosapentaenoic and docosahexaenoic acids on blood pressure in hypertension. A population-based intervention trial from the Tromsö study. N Engl J Med 1990; 322: 795-801.
43. Knapp HR, Fitzgerald GA. The antihypertensive effects of fish oil. A controlled study of polyunsaturated fatty acid supplements in essential hypertension. N Engl J Med 1989; 320: 1037-43.
44. Lofgren RP, Wilt TJ, Nichol KL, Crespin L, Pluhar R, Eckfeldt J. The effect of fish oil supplements on blood pressure. Am J Publ Health 1993; 83: 267-9.
45. Appel LJ, Miller ER, Seidler AJ, Whelton PK. Does supplementation of diet with 'fish oil' reduce blood pressure? A meta-analysis of controlled clinical trials. Arch Int Med 1993; 153: 1429-38.
46. Bach R, Schmidt U, Jung F, Kiesewetter H, Hennen B, Wenzel E, et al. Effects of fish oil capsules in two dosages on blood pressure, platelet functions, haemorheological and clinical chemistry parameters in apparently healthy subjects. Ann Nutr Metabol 1989; 33: 359-67.
47. Weiner BH, Ockene IS, Levine PH, Cuenoud HF, Fisher M, Johnson BF, et al. Inhibition of atherosclerosis by cod-liver oil in a hyperlipidemic swine model. N Engl J Med 1986; 315: 841-6.
48. Davis HR, Bridenstine RT, Vesselinovitch D, Wissler RW. Fish oil inhibits development of atherosclerosis in rhesus monkeys. Arteriosclerosis 1987; 7: 441-9.
49. Rich S, Miller JF, Charous S, Davis HR, Shanks P, Glagov S, et al. Development of atherosclerosis in genetically hyperlipidemic rabbits during chronic fish-oil ingestion. Arteriosclerosis 1989; 9: 189-94.
50. Anonymous. Dietary supplementation with n-3 polyunsaturated fatty acids and vitamin E after myocardial infarction: results of the GISSI-Prevenzione trial. Gruppo Italiano per lo Studio della Sopravvivenza nell'Infarto miocardico. Lancet 1999; 354: 447-55.
51. Burr ML, Fehily AM, Gilbert JF, Rogers S, Holliday RM, Sweetnam PM, et al. Effects of changes in fat, fish, and fibre intakes on death and myocardial reinfarction: diet and reinfarction trial (DART). Lancet 1989; 2: 757-61.
52. Singh RB, Niaz MA, Sharma JP, Kumar R, Rastogi V, Moshiri M. Randomized, double-blind, placebo-controlled trial of fish oil and mustard oil in patients with suspected acute myocardial infarction: the Indian experiment of infarct survival--4. Cardiovasc Drugs Ther 1997; 11: 485-91.
53. von Schacky C, Angerer P, Kothny W, Theisen K, Mudra H. The effect of dietary omega-3 fatty acids on coronary atherosclerosis. A randomized, double-blind, placebo-controlled trial. Ann Int Med 1999; 130: 554-62.
54. Eritsland J, Arnesen H, Gronseth K, Fjeld NB, Abdelnoor M. Effect of dietary supplementation with n-3 fatty acids on coronary artery bypass graft patency. Am J Cardiol 1996; 77: 31-6.
55. Gapinski JP, VanRuiswyk JV, Heudebert GR, Schectman GS. Preventing restenosis with fish oils following coronary angioplasty. A meta-analysis. Arch Int Med 1993; 153: 1595-601.
56. Bairati I, Roy L, Meyer F. Double-blind, randomized, controlled trial of fish oil supplements in prevention of recurrence of stenosis after coronary angioplasty. Circulation 1992; 85: 950-6.
57. Leaf A, Jorgensen MB, Jacobs AK, Cote G, Schoenfeld DA, Scheer J, et al. Do fish oils prevent restenosis after coronary angioplasty? Circulation 1994; 90: 2248-57.
58. Johansen O, Brekke M, Seljeflot I, Abdelnoor M, Arnesen H. N-3 fatty acids do not prevent restenosis after coronary angioplasty: results from the CART study. Coronary Angioplasty Restenosis Trial. J Am Coll Cardiol 1999; 33: 1619-26.
59. Olszewski AJ, McCully KS. Fish oil decreases serum homocysteine in hyperlipemic men. Coron Artery Dis 1993; 4: 53-60.
60. Hsu HC, Lee YT, Chen MF. Effect of n-3 fatty acids on the composition and binding properties of lipoproteins in hypertriglyceridemic patients. Am J Clin Nutr 2000; 71: 28-35.
61. Ross R. Atherosclerosis - an inflammatory disease. N Engl J Med 1999; 340: 115-26.
62. Cartwright IJ, Pockley AG, Galloway JH, Greaves M, Preston FE. The effects of dietary omega-3 polyunsaturated fatty acids on erythrocyte membrane phospholipids, erythrocyte deformability and blood viscosity in healthy volunteers. Atherosclerosis 1985; 55: 267-81.
63. Leaf A, Kang JX, Xiao YF, Billman GE. Dietary n-3 fatty acids in the prevention of cardiac arrhythmias. Curr Op Clin Nutr Metabol Care 1998; 1: 225-8.
64. Li Y, Kang JX, Leaf A. Differential effects of various eicosanoids on the production or prevention of arrhythmias in cultured neonatal rat cardiac myocytes. Prostaglandins 1997; 54: 511-30.
65. Billman GE, Kang JX, Leaf A. Prevention of sudden cardiac death by dietary pure omega-3 polyunsaturated fatty acids in dogs. Circulation 1999; 99: 2452-7.
66. McLennan PL, Bridle TM, Abeywardena MY, Charnock JS. Comparative efficacy of n-3 and n-6 polyunsaturated fatty acids in modulating ventricular fibrillation threshold in marmoset monkeys. Am J Clin Nutr 1993; 58: 666-9.
67. McLennan PL, Abeywardena MY, Charnock JS. Dietary fish oil prevents ventricular fibrillation following coronary artery occlusion and reperfusion. Am Heart J 1988; 116: 709-17.
68. Sellmayer A, Witzgall H, Lorenz RL, Weber PC. Effects of dietary fish oil on ventricular premature complexes. Am J Cardiol 1995; 76: 974-7.
69. Hardarson T, Kristinsson A, Skuladottir G, Asvaldsdottir H, Snorrason SP. Cod liver oil does not reduce ventricular extrasystoles after myocardial infarction. J Int Med 1989; 226: 33-7.
70. Siscovick DS, Raghunathan TE, King I, Weinmann S, Wicklund KG, Albright J, et al. Dietary intake and cell membrane levels of long-chain n-3 polyunsaturated fatty acids and the risk of primary cardiac arrest. JAMA 1995; 274: 1363-7.
71. Rossi E, Costa M. Fish oil derivatives as a prophylaxis of recurrent miscarriage associated with antiphospholipid antibodies (APL): a pilot study. Lupus 1993; 2: 319-23.
72. DiGiacomo RA, Kremer JM, Shah DM. Fish-oil dietary supplementation in patients with Raynaud's phenomenon: a double-blind, controlled, prospective study. Am J Med 1989; 86: 158-64.
73. Moutquin JM, Garner PR, Burrows RF, Rey E, Helewa ME, Lange IR, et al. Report of the Canadian Hypertension Society Consensus Conference: 2. Nonpharmacologic management and prevention of hypertensive disorders in pregnancy. CMAJ 1997; 157: 907-19.
74. Olsen SF, Secher NJ. A possible preventive effect of low-dose fish oil on early delivery and pre-eclampsia: indications from a 50-year-old controlled trial. Brit J Nutr 1990; 64: 599-609.
75. Rylance PB, Gordge MP, Saynor R, Parsons V, Weston MJ. Fish oil modifies lipids and reduces platelet aggregability in haemodialysis patients. Nephron 1986; 43: 196-202.
76. Shapiro JA, Koepsell TD, Voigt LF, Dugowson CE, Kestin M, Nelson JL. Diet and rheumatoid arthritis in women: a possible protective effect of fish consumption. Epidemiol 1996; 7: 256-63.
77. Kremer JM, Jubiz W, Michalek A, Rynes RI, Bartholomew LE, Bigaouette J, et al. Fish-oil fatty acid supplementation in active rheumatoid arthritis. A double-blinded, controlled, crossover study. Ann Int Med 1987; 106: 497-503.
78. van der Tempel H, Tulleken JE, Limburg PC, Muskiet FA, van Rijswijk MH. Effects of fish oil supplementation in rheumatoid arthritis. Ann Rheum Dis 1990; 49: 76-80.
79. Geusens P, Wouters C, Nijs J, Jiang Y, Dequeker J. Long-term effect of omega-3 fatty acid supplementation in active rheumatoid arthritis. A 12-month, double-blind, controlled study. Arthritis Rheum 1994; 37: 824-9.
80. Skoldstam L, Borjesson O, Kjallman A, Seiving B, Akesson B. Effect of six months of fish oil supplementation in stable rheumatoid arthritis. A double-blind, controlled study. Scand J Rheumatol 1992; 21: 178-85.
81. Kremer JM, Lawrence DA, Petrillo GF, Litts LL, Mullaly PM, Rynes RI, et al. Effects of high-dose fish oil on rheumatoid arthritis after stopping nonsteroidal antiinflammatory drugs. Clinical and immune correlates. Arthritis Rheum 1995; 38: 1107-14.
82. Volker D, Fitzgerald P, Major G, Garg M. Efficacy of fish oil concentrate in the treatment of rheumatoid arthritis. J Rheumatol 2000; 27: 2343-6.
83. Lau CS, Morley KD, Belch JJ. Effects of fish oil supplementation on non-steroidal anti-inflammatory drug requirement in patients with mild rheumatoid arthritis--a double-blind placebo controlled study. Brit J Rheumatol 1993; 32: 982-9.
84. Belch JJ, Ansell D, Madhok R, O'Dowd A, Sturrock RD. Effects of altering dietary essential fatty acids on requirements for non-steroidal anti-inflammatory drugs in patients with rheumatoid arthritis: a double blind placebo controlled study. Ann Rheumat Dis 1988; 47: 96-104.
85. Kremer JM, Lawrence DA, Jubiz W, DiGiacomo R, Rynes R, Bartholomew LE, et al. Dietary fish oil and olive oil supplementation in patients with rheumatoid arthritis. Clinical and immunologic effects. Arthritis Rheum 1990; 33: 810-20.
86. Hawthorne AB, Daneshmend TK, Hawkey CJ, Belluzzi A, Everitt SJ, Holmes GK, et al. Treatment of ulcerative colitis with fish oil supplementation: a prospective 12 month randomised controlled trial. Gut 1992; 33: 922-8.
87. Stenson WF, Cort D, Rodgers J, Burakoff R, DeSchryver-Kecskemeti K, Gramlich TL, et al. Dietary supplementation with fish oil in ulcerative colitis. Ann Int Med 1992; 116: 609-14.
88. Aslan A, Triadafilopoulos G. Fish oil fatty acid supplementation in active ulcerative colitis: a double-blind, placebo-controlled, crossover study. Am J Gastroenterol 1992; 87: 432-7.
89. Dichi I, Frenhane P, Dichi JB, Correa CR, Angeleli AY, Bicudo MH, et al. Comparison of omega-3 fatty acids and sulfasalazine in ulcerative colitis. Nutrition 2000; 16: 87-90.
90. Woods RK, Thien FC, Abramson MJ. Dietary marine fatty acids (fish oil) for asthma. [update of Cochrane Database Syst Rev 2000; (2): CD001283.] Cochrane Database of Systematic Reviews [computer file.] 2000; CD001283.
91. Hodge L, Salome CM, Peat JK, Haby MM, Xuan W, Woolcock AJ. Consumption of oily fish and childhood asthma risk. Med J Austral 1996; 164: 137-40.
92. Smit HA, Grievink L, Tabak C. Dietary influences on chronic obstructive lung disease and asthma: a review of the epidemiological evidence. Proc Nutr Soc 1999; 58: 309-19.
93. Shahar E, Boland LL, Folsom AR, Tockman MS, McGovern PG, Eckfeldt JH. Docosahexaenoic acid and smoking-related chronic obstructive pulmonary disease. The Atherosclerosis Risk in Communities Study Investigators. Am J Resp Crit Care Med 1999; 159: 1780-5.
94. Blok WL, Vogels MT, Curfs JH, Eling WM, Buurman WA, van der Meer JW. Dietary fish-oil supplementation in experimental gram-negative infection and in cerebral malaria in mice. J Infect Dis 1992; 165: 898-903.
95. Björnsson S, Harðardóttir I, Gunnarsson E, Haraldsson A. Dietary fish oil supplementation increases survival in mice following Klebsiella pneumoniae infection. Scand J Infect Dis 1997; 29: 491-3.
96. Þórisdóttir A, Sigurðsson JR, Erlendsdóttir H, Einarsson I, Gudmundsson S, Gunnarsson E, et al. Áhrif lýsisneyslu á bakteríuvöxt in vivo. Læknablaðið 2001; 87: 715-8.
97. Chyi A, Yeh SL. Effects of dietary fish oil on survival rate, plasma amino acid pattern, and inflammatory-related mediators in diabetic rats with sepsis. Clin Nutr 2000; 19: 313-8.
98. Bower RH, Cerra FB, Bershadsky B, Licari JJ, Hoyt DB, Jensen GL, et al. Early enteral administration of a formula (Impact) supplemented with arginine, nucleotides, and fish oil in intensive care unit patients: results of a multicenter, prospective, randomized, clinical trial. Crit Care Med 1995; 23: 436-49.
99. Kudsk KA, Minard G, Croce MA, Brown RO, Lowrey TS, Pritchard FE, et al. A randomized trial of isonitrogenous enteral diets after severe trauma. An immune-enhancing diet reduces septic complications. Ann Surg 1996; 224: 531-40.
100. Gadek JE, DeMichele SJ, Karlstad MD, Pacht ER, Donahoe M, Albertson TE, et al. Effect of enteral feeding with eicosapentaenoic acid, gamma-linolenic acid, and antioxidants in patients with acute respiratory distress syndrome. Enteral Nutrition in ARDS Study Group. Crit Care Med 1999; 27: 1409-20.
101. Galban C, Montejo JC, Mesejo A, Marco P, Celaya S, Sanchez-Segura JM, et al. An immune-enhancing enteral diet reduces mortality rate and episodes of bacteremia in septic intensive care unit patients. Crit Care Med 2000; 28: 643-8.
102. Beale RJ, Bryg DJ, Bihari DJ. Immunonutrition in the critically ill: a systematic review of clinical outcome. Crit Care Med 1999; 27: 2799-805.
103. Heyland DK, Novak F, Drover JW, Jain M, Su X, Suchner U. Should immunonutrition become routine in critically ill patients? A systematic review of the evidence. JAMA 2001; 286: 944-53.
104. Harel Z, Biro FM, Kottenhahn RK, Rosenthal SL. Supplementation with omega-3 polyunsaturated fatty acids in the management of dysmenorrhea in adolescents. Am J Obstetr Gynecol 1996; 174: 1335-8.
105. Donadio JV Jr. Omega-3 polyunsaturated fatty acids. a potential new treatment of immune renal disease. Mayo Clin Proc 1991; 66: 1018-28.
106. Rekola S, Bergstrand A, Bucht H. Deterioration of GFR in IgA nephropathy as measured by 51Cr-EDTA clearance. Kidney Int 1991; 40: 1050-4.
107. Hamazaki T, Tateno S, Shishido H. Eicosapentaenoic acid and IgA nephropathy. Lancet 1984; i: 1017-28.
108. Bennett WM, Walker RG, Kincaid-Smith P. Treatment of IgA nephropathy with eicosapentaenoic acid (EPA): a two-year prospective trial. Clin Nephrol 1989; 31: 128-31.
109. Pettersson EE, Rekola S, Berglund L, Sundqvist KG, Angelin B, Diczfalusy U, et al. Treatment of IgA nephropathy with omega-3-polyunsaturated fatty acids: a prospective, double-blind, randomized study. Clin Nephrol 1994; 41: 183-90.
110. Donadio JV Jr, Bergstralh EJ, Offord KP, Spencer DC, Holley KE, for the Mayo Nephrology Collaborative Group. A controlled trial of fish oil in IgA nephropathy. N Engl J Med 1994; 331: 1194-9.
111. Donadio JV Jr., Grande JP, Bergstralh EJ, Dart RA, Larson TS, Spencer DC. The long-term outcome of patients with IgA nephropathy treated with fish oil in a controlled trial. Mayo Nephrology Collaborative Group. J Am Soc Nephrol 1999; 10: 1772-7.
112. Donadio JV Jr., Larson TS, Bergstralh EJ, Grande JP. A randomized trial of high-dose compared with low-dose omega-3 fatty acids in severe IgA nephropathy. J Am Soc Nephrol 2001; 12: 791-9.
113. Cheng IK, Chan PC, Chan MK. The effect of fish-oil dietary supplement on the progression of mesangial IgA glomerulonephritis. Nephrol Dial Transplant 1990; 5: 241-6.
114. Dillon JJ. Fish oil therapy for IgA nephropathy: efficacy and interstudy variability. J Am Soc Nephrol 1997; 8: 1739-44.
115. Hogg RJ. A randomized, placebo-controlled, multicenter trial evaluating alternative-day prednisone and fish oil supplements in young patients with IgA nephropathy. Am J Kidney Dis 1995; 26: 792-6.
116. Thakkar RR, Wang OL, Zerouga M, Stillwell W, Haq A, Kissling R, et al. Docosahexaenoic acid reverses cyclosporin A-induced changes in membrane structure and function. Biochim Biophys Acta 2000; 1474: 183-95.
117. Badalamenti S, Salerno F, Lorenzano E, Paone G, Como G, Finazzi S, et al. Renal effects of dietary supplementation with fish oil in cyclosporine-treated liver transplant recipients. Hepatol 1995; 22: 1695-71.
118. Homan van der Heide JJ, Bilo HJ, Tegzess AM, Donker AJ. The effects of dietary supplementation with fish oil on renal function in cyclosporine-treated renal transplant recipients. Transplantation 1990; 49: 523-7.
119. Maachi K, Berthoux P, Burgard G, Alamartine E, Berthoux F. Results of a 1-year randomized controlled trial with omega-3 fatty acid fish oil in renal transplantation under triple immunosuppressive therapy. Transplant Proc 1995; 27: 846-9.
120. Hanson JM, Hoy CE, Standgaard S. Fish oil and cyclosporin A-induced renal hypoperfusion in kidney-transplanted patients. Nephrol Dial Transpl 1995; 10: 1745-50.
121. Gibson SW, Valente JF, Alexander JW, Custer DA, Babcock GF, Ogle CK. The effect of nutritional immunomodulation on cardiac allograft survival in rats receiving mycophenolate mofetil, cyclosporine A, and donor-specific transfusion. J Heart Lung Transplant 1999; 18: 185-9.
122. Katznelson S, Wilkinson AH. HMGCoA reductase inhibitors and omega-3 fatty acids as adjunctive agents in maintenance immunosuppression after solid organ transplantation. Clin Transplant 1995; 9: 197-200.
123. Buck AC, Lote CJ, Sampson WF. The influence of renal prostaglandins on urinary calcium excretion in idiopathic urolithiasis. J Urol 1983; 139: 421-6.
124. Baggio B, Budakovic A, Nassuato MA, Vezzoli G, Manzato E, Luisetto G, et al. Plasma phospholipid arachidonic acid content and calcium metabolism in idiopathic calcium nephrolithiasis. Kidney Int 2000; 58: 1278-84.
125. Miller PE, Carlton D, Deierhoi MH, Redden DT, Allon M. Natural history of arteriovenous grafts in hemodialysis patients. Am J Kidney Dis (computer file) 2000; 36: 68-74.
126. Schmitz PG, McCloud LK, Reikes ST, Leonard CL, Gellens ME. Prophylaxis of hemodialysis graft thrombosis with fish oil: double-blind, randomized, prospective trial. J Am Soc Nephrol 2002; 13: 184-90.
127. Mischoulon D, Fava M. Docosahexanoic acid and omega-3 fatty acids in depression. Psych Clin N Am 2000; 23: 785-94.
128. Maidment ID. Are fish oils an effective therapy in mental illness-an analysis of the data. Acta Psych Scand 2000; 102: 3-11.
129. Yao JK, Leonard S, Reddy RD. Membrane phospholipid abnormalities in postmortem brains from schizophrenic patients. Schizophrenia Res 2000; 42: 7-17.
130. Salem NJ, Wegher B, Mena P, Uauy R. Arachidonic and docosahexaenoic acids are biosynthesized from their 18-carbon precursors in human infants. Proc Nat Acad Sc USA 1996; 93: 49-54.
131. Sanders TA, Reddy S. The influence of a vegetarian diet on the fatty acid composition of human milk and the essential fatty acid status of the infant. J Ped 1992; 120: Suppl: S71-S77.
132. Emmett PM, Rogers IS. Properties of human milk and their relationship with maternal nutrition. Early Human Develop 1997; 49 Suppl: S7-28.
133. Ólafur Reykdal. Íslenskur gagnagrunnur um efnainnihald matvæla (ÍSGEM). Reykjavík: Rannsóknarstofnun landbúnaðarins. 1998.
134. Farquharson J, Cockburn F, Patrick WA, Jamieson EC, Logan RW. Infant cerebral cortex phospholipid fatty-acid composition and diet. Lancet 1992; 340: 810-3.
135. SanGiovanni JP, Parra-Cabrera S, Colditz GA, Berkey CS, Dwyer JT. Meta-analysis of dietary essential fatty acids and long-chain polyunsaturated fatty acids as they relate to visual resolution acuity in healthy preterm infants. Pediatrics 2000; 105: 1292-8.
136. SanGiovanni JP, Berkey CS, Dwyer JT, Colditz GA. Dietary essential fatty acids, long-chain polyunsaturated fatty acids, and visual resolution acuity in healthy fullterm infants: a systematic review. Early Human Develop 2000; 57: 165-88.
137. Morrow-Tlucak M, Haude RH, Ernhart CB. Breastfeeding and cognitive development in the first 2 years of life. Soc Sci Med 1988; 26: 635-9.
138. O'Connor DL, Hall R, Adamkin D, Auestad N, Castillo M, Connor WE, et al. Growth and development in preterm infants fed long-chain polyunsaturated fatty acids: a prospective, randomized controlled trial. Pediatrics 2001; 108: 359-71.
139. Auestad N, Halter R, Hall RT, Blatter M, Bogle ML, Burks W, et al. Growth and development in term infants fed long-chain polyunsaturated fatty acids: a double-masked, randomized, parallel, prospective, multivariate study. Pediatrics 2001; 108: 372-81.
140. Lucas A, Stafford M, Morley R, Abbott R, Stephenson T, MacFadyen U, et al. Efficacy and safety of long-chain polyunsaturated fatty acid supplementation of infant-formula milk: a randomised trial. Lancet 1999; 354: 1948-54.
141. Makrides M, Neumann MA, Simmer K, Gibson RA. A critical appraisal of the role of dietary long-chain polyunsaturated fatty acids on neural indices of term infants: a randomized, controlled trial. Pediatrics 2000; 105: 32-8.
142. Birch EE, Garfield S, Hoffman DR, Uauy R, Birch DG. A randomized controlled trial of early dietary supply of long-chain polyunsaturated fatty acids and mental development in term infants. Develop Med Child Neurol 2000; 42: 174-81.
143. Stoll AL, Severus WE, Freeman MP, Rueter S, Zboyan HA, Diamond E, et al. Omega 3 fatty acids in bipolar disorder: a preliminary double-blind, placebo-controlled trial. Arch Gen Psych 1999; 56: 407-12.
144. Fenton WS, Hibbeln J, Knable M. Essential fatty acids, lipid membrane abnormalities, and the diagnosis and treatment of schizophrenia. Biol Psych 2000; 47: 8-21.
145. Horrobin DF. The membrane phospholipid hypothesis as a biochemical basis for the neurodevelopmental concept of schizophrenia. Schizophrenia Res 1998; 30: 193-208.
146. Peet M, Brind J, Ramchand CN, Shah S, Vankar GK. Two double-blind placebo-controlled pilot studies of eicosapentaenoic acid in the treatment of schizophrenia. Schizophrenia Res 2001; 49: 243-51.
147. Richardson AJ, Easton T, Puri BK. Red cell and plasma fatty acid changes accompanying symptom remission in a patient with schizophrenia treated with eicosapentaenoic acid. Eur Neuropsychopharmacol 2000; 10: 189-93.
148. Peet M, Murphy B, Shay J, Horrobin D. Depletion of omega-3 fatty acid levels in red blood cell membranes of depressive patients. Biol Psych 1998; 43: 315-9.
149. Tanskanen A, Hibbeln JR, Hintikka J, Haatainen K, Honkalampi K, Viinamaki H. Fish consumption, depression, and suicidality in a general population. Arch Gen Psych 2001; 58: 512-3.
150. Edwards R, Peet M, Shay J, Horrobin D. Omega-3 polyunsaturated fatty acid levels in the diet and in red blood cell membranes of depressed patients. J Aff Disord 1998; 48: 149-55.
151. Laugharne JD, Mellor JE, Peet M. Fatty acids and schizophrenia. Lipids 1996; 31 Suppl: S163-S165.
152. Yao JK, van Kammen DP, Welker JA. Red blood cell membrane dynamics in schizophrenia. II. Fatty acid composition. Schizophrenia Res 1994; 13: 217-26.
153. Horrobin DF, Manku MS, Hillman H, Iain A, Glen M. Fatty acid levels in the brains of schizophrenics and normal controls. Biol Psych 1991; 30: 795-805.
154. Stanley JA, Williamson PC, Drost DJ, Carr TJ, Rylett RJ, Morrison-Stewart S, et al. Membrane phospholipid metabolism and schizophrenia: an in vivo 31P-MR spectroscopy study. Schizophrenia Res 1994; 13: 209-15.
155. Pettegrew JW, Keshavan MS, Panchalingam K, Strychor S, Kaplan DB, Tretta MG, et al. Alterations in brain high-energy phosphate and membrane phospholipid metabolism in first-episode, drug-naive schizophrenics. A pilot study of the dorsal prefrontal cortex by in vivo phosphorus 31 nuclear magnetic resonance spectroscopy. Arch Gen Psych 1991; 48: 563-8.
156. Fukuzako H, Fukuzako T, Hashiguchi T, Kodama S, Takigawa M, Fujimoto T. Changes in levels of phosphorus metabolites in temporal lobes of drug-naive schizophrenic patients. Am J Psych 1999; 156: 1205-8.
157. Horrobin DF, Bennett CN. New gene targets related to schizophrenia and other psychiatric disorders: enzymes, binding proteins and transport proteins involved in phospholipid and fatty acid metabolism. Prostagland Leukotri Ess Fatty Acids 1999; 60: 141-67.
158. Ross BM, Hudson C, Erlich J, Warsh JJ, Kish SJ. Increased phospholipid breakdown in schizophrenia. Evidence for the involvement of a calcium-independent phospholipase A2. Arch Gen Psych 1997; 54: 487-94.
159. Horrobin DF. Lipids and schizophrenia. Br J Psych 1999; 175: 88.
160. Marteinsdóttir I, Horrobin DF, Stenfors C, Theodorsson E, Mathe AA. Changes in dietary fatty acids alter phospholipid fatty acid composition in selected regions of rat brain. Progr Neuro-Psychopharmacol Biol Psych 1998; 22: 1007-21.
161. Bucher H, Rampini S, James RW, Pometta D, Funke H, Wiebusch H, et al. Marked changes of lipid levels during puberty in a patient with lipoprotein lipase deficiency. Eur J Ped 1997; 156: 121-5.
162. Su KSW. Omega-3 fatty acids as a psychotherapeutic agent for a pregnant schizophrenic patient. Eur Neuropsychopharmacol 2001; 11: 295-9.
163. DeCaterina R, Giannessi D, Mazzone A, Bernini W, Lazzerini G, Maffei S, et al. Vascular prostacyclin is increased in patients ingesting omega-3 polyunsaturated fatty acids before coronary artery bypass graft surgery. Circulation 1990; 82: 428-38.
164. Salonen JT, Seppanen K, Nyyssonen K, Korpela H, Kauhanen J, Kantola M, et al. Intake of mercury from fish, lipid peroxidation, and the risk of myocardial infarction and coronary, cardiovascular, and any death in eastern Finnish men. Circulation 1995; 91: 645-55.
165. Kulas E, Ackman RG. Different tocopherols and the relationship between two methods for determination of primary oxidation products in fish oil. J Agricult Food Chem 2001; 49: 1724-9.
166. Schmidt EB, Skou HA, Christensen JH, Dyerberg J. N-3 fatty acids from fish and coronary artery disease: implications for public health. Publ Health Nutr 2000; 3: 91-8.
167. Nestel P. Effects of fish oils and fish on cardiovascular disease. Curr Atherosclerosis Rep 2001; 3:68-73.
168. Stone NJ. The Gruppo Italiano per lo Studio della Sopravvivenza nell'Infarto Miocardio (GISSI)-Prevenzione Trial on fish oil and vitamin E supplementation in myocardial infarction survivors. Curr Cardiol Rep 2000; 2: 445-1.
169. Ackman RG. The absorption of fish oils and concentrates. Lipids 1992; 27: 858-62.
170. Horrocks LA, Yeo YK. Health benefits of docosahexaenoic acid (DHA). Pharmacol Res 1999; 40: 211-25.
171. Crawford MA, Bloom M, Broadhurst CL, Schmidt WF, Cunnane SC, Galli C, et al. Evidence for the unique function of docosahexaenoic acid during the evolution of the modern hominid brain. Lipids 1999; 34 Suppl: S39-S47.
172. Mori TA, Watts GF, Burke V, Hilme E, Puddey IB, Beilin LJ. Differential effects of eicosapentaenoic acid and docosahexaenoic acid on vascular reactivity of the forearm microcirculation in hyperlipidemic, overweight men. Circulation 2000; 102: 1264-9.