Fræðigreinar
Mergskipti. Ígræðsla blóðmyndandi stofnfrumna
Ágrip
Allra síðustu áratugi hefur orðið mikil aukning á fjölda mergskipta en árlega fara mörg þúsund sjúklingar í slíka meðferð. Í dag eru mergskipti framkvæmd fyrr í sjúkdómsferlinu heldur en tíðkaðist í byrjun og hefur það leitt til bætts árangurs meðferðar. Illkynja blóð- og eitilfrumusjúkdómar eru algengustu ábendingar í dag. Helstu sjúkdómaflokkarnir eru hvítblæði, bæði brátt og langvinnt, eitilfrumukrabbamein (Non-Hodgkin´s lymphoma og Hodgkin´s disease), mergfrumuæxli (multiple myeloma) og meðfæddar ónæmistruflanir. Oftast er merggjafinn systkini sjúklings en á síðustu árum hafa alþjóðlegar gjafaskrár gegnt vaxandi hlutverki í leit að gjafa. Tegund vefjaflokkasamræmis milli þega og gjafa er helsti áhættuþáttur fyrir ónæmisröskun sem enn í dag er meginorsök alvarlegra veikinda og dauðsfalla við ígræðslumeðferðina. Höfnun græðlings er mjög sjaldgæf þegar um fullkomið vefjaflokkasamræmi er að ræða. Heildarlifun er einnig háð fjölmörgum öðrum þáttum, svo sem sjúkdómsgreiningu, aldri og framgangi sjúkdómsins. Síðustu ár hafa að meðaltali fjórir Íslendingar farið í mergskipti árlega en öll mergskipti hafa farið fram erlendis. Ábendingar eru svipaðar og í öðrum Evrópulöndum. English Summary |
| Reykdal SEÞ Bone marrow transplantations Læknablaðið 2000; 86: 593-9 For the last few decades there has been a major increase in the number of allogeneic bone marrow transplantations and every year several thousand transplants are performed. In the early days of transplantation the treatment was performed only in terminally ill patients but now transplantation is carried out early in the course of the disease with greatly improved results. The most common indications for treatment today include acute and chronic leukemia, Non-Hodgkin´s lymphoma, Hodgkin´s disease, multiple myeloma and congenital immune deficiencies. Sibling donors are the most common source of stem cells for transplantation but in recent years international donor registries have played an increasing role. Degree of HLA disparity between donor and recipient is the main risk factor for Graft versus Host disease which is still the major cause of morbidity and mortality after transplantation. Graft rejection is very rare when there is complete HLA match between the donor and recipient. Overall survival is also dependent on several other factors including disease stage at time of transplantation, age and disease categories. For the last few years an average of four Icelandic patients have received bone marrow transplantation each year and indicatioons are similar to other European countries. Key words: allogeneic bone marrow transplantation, donor type, stem cells, indications, Graft versus Host disease. Correspondence: Sigrún E.Þ. Reykdal. E-mail: sigrunre@rsp.is |
Inngangur
Notkun beinmergs í lækningaskyni var fyrst lýst 1891 og var mergurinn gefinn til inntöku við meðferð mergbilunar en mergur var fyrst gefinn í æð 1939 (1). Rannsóknir sem hófust 1949 á áhrifum geislunar á blóðmyndun í nagdýrum marka upphaf nútíma stofnfrumuflutninga (2). Upp úr 1950 hófust fyrstu tilraunir til mergskipta hjá mönnum en nær öll mergskipti á þessum tíma mistókust, nema þegar eineggja tvíburar áttu í hlut. Uppgötvun á fyrstu vefjaflokkasameindum mannsins (human leukocyte antigens, HLA) 1958 lagði síðan grundvöllinn að framförum næstu áratuga. Árið 1968 voru framkvæmd fyrstu velheppnuðu mergskiptin milli systkina hjá þremur einstaklingum með ónæmistruflun og eru þeir allir við góða heilsu í dag (2). Undir forystu frumkvöðulsins E. Donnall Thomas, sem hlaut Nóbelsverðlaun í læknisfræði árið 1990, hóf Seattle hópurinn að framkvæma mergskipti árið 1969 hjá sjúklingum með illkynja blóðsjúkdóma. Árið 1977 voru birtar niðurstöður um árangur meðferðar hjá 100 sjúklingum með hvítblæði á lokastigi sem fengið höfðu merg frá systkini úr sambærilegum vefjaflokki. Af 100 einstaklingum voru 17 lifandi einu til þremur árum eftir mergskiptin og átta af þessum 17 einstaklingum eru við góða heilsu í dag (2,3). Flutningi á blóðmyndandi stofnfrumum er skipt í tvo meginflokka: Annars vegar er um að ræða mergskipti (allogeneic bone marrow transplantation) þar sem stofnfrumur úr merg eða blóði frá gjafa með sambærilega vefjaflokka eru græddar í sjúkling. Hitt meðferðarformið er eigin stofnfrumuígræðsla (autologous stem cell transplantation), sem einnig má kalla háskammtalyfjameðferð með stofnfrumustuðningi (high dose therapy with stem cell support), þar sem eigin stofnfrumur sjúklingsins eru notaðar við meðferðina. Í seinna tilvikinu er því ekki um eiginleg mergskipti að ræða, en stofnfrumugjöfin gerir mögulegt að gefa mun hærri skammta af frumudrepandi lyfjum heldur en mögulegt væri án stuðnings frá stofnfrumum sjúklingsins. Eigin stofnfrumuígræðsla heppnaðist fyrst seint á áttunda áratugnum en notkunin fór hratt vaxandi upp úr 1980 og nú er svo komið, að mun fleiri eigin stofnfrumuígræðslur eru framkvæmdar heldur en mergskipti (mynd 1). Af 20.522 ígræðslum á skrá hjá evrópsku ígræðslusamtökunum (European Bone Marrow Transplant Organization, EBMT) fyrir árið 1998 voru 73% eigin stofnfrumuígræðslur og 27% mergskipti (4). Í þessari grein verður fyrst og fremst fjallað um mergskipti.
Ábendingar
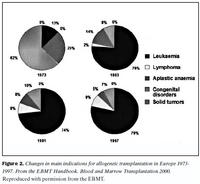
Hlutverki hefðbundinnar stofnfrumuígræðslu má skipta í þrjá meginþætti: 1. Að bæta upp skort á merg- og eitilfrumum, til dæmis við mergbilun og meðfæddar ónæmistruflanir. 2. Vernd gegn aukaverkunum af háskammta frumudrepandi lyfjum og geislameðferð, til dæmis í meðferð eitilfrumukrabbameins, hvítblæðis og ýmissa krabbameinsæxla. 3. Uppræting sjúklegrar blóðmyndunar og endurreisn með eðlilegum stofnfrumum, til dæmis í sigðfrumublóðleysi (5). Hlutverk mergskipta lýtur að öllum þremur þáttunum hér að ofan, en ígræðsla eigin stofnfrumna gegnir eingöngu hlutverki við að vernda gegn aukaverkunum af háskammtameðferð. Illkynja blóð- og eitilfrumusjúkdómar eru algengustu ábendingar þessarar meðferðar í dag. Helstu sjúkdómaflokkarnir eru hvítblæði, bæði brátt og langvinnt, eitilfrumukrabbamein (Non-Hodgkin´s lymphoma og Hodgkin´s disease), mergfrumuæxli (multiple myeloma) og meðfæddar ónæmistruflanir. Ábendingar fyrir mergskipti á skrá hjá EBMT fyrir árið 1998 voru eftirfarandi: bráða mergfrumuhvítblæði (acute myelogenous leukemia, AML) 26%, langvinnt mergfrumuhvítblæði (chronic myelogenous leukemia, CML) 25%, bráða eitilfrumuhvítblæði (acute lymphoblastic leukemia, ALL) 20%, mergrangvaxtarheilkenni (myelodysplastic syndrome, MDS) 6%, eitilfrumukrabbamein 9%, vanmyndunarblóðleysi (aplastic anemia) 5%, ónæmistruflanir 7% og krabbameinsæxli 0,5% tilfella. Á tímabilinu 1987 til febrúar 1998 voru 61% mergskipta fyrir bráða mergfrumuhvítblæði framkvæmd í fyrsta sjúkdómshléi en fyrir bráða eitilfrumuhvítblæði voru 37% mergskipta framkvæmd í fyrsta og 35% í öðru sjúkdómhléi (4). Mynd 2 sýnir breytingarnar sem orðið hafa í Evrópu frá 1973 til 1997 á ábendingum fyrir mergskipti.
Tímasetning ígræðslu
Enn eru skiptar skoðanir um bestu tímasetningu ígræðslumeðferðar. Ljóst er að sjúklingum vegnar betur hafi þeir ekki fengið mikla undanfarandi meðferð, en það er einkum vegna minni áhættu á líffæraskemmdum sem geta orsakast af ígræðslumeðferðinni. Erfitt er að mæla með mergskiptum hjá einstaklingum með lokastigssjúkdóm þar sem lífslíkur eru mjög litlar, nema um sé að ræða tilraunameðferð. Aldur sjúklings skiptir meginmáli fyrir árangur ígræðslu. Gjarna er miðað við 60 ára aldurstakmark fyrir mergskipti frá skyldum gjafa með fullu vefjaflokkasamræmi, 45 ára aldur fyrir óskyldan gjafa og 65 ára aldur fyrir eigin stofnfrumuígræðslu (6). Ávallt verða þó tilfelli þar sem brugðið er frá ofangreindum vinnureglum. Ennþá skortir framskyggnar rannsóknir til að svara spurningum um bestu tímasetningu meðferðar, en margar slíkar eru í vinnslu. Flestir eru þó sammála um eftirfarandi tímasetningar í meðferð illkynja blóð- og eitilfrumusjúkdóma:
l Sjúklingar með langvinnt mergfrumu hvítblæði fari í mergskipti innan árs frá greiningu. Þetta gildir einkum um hægfara fasa sjúkdómsins þegar um fullt vefjaflokkasamræmi er að ræða milli skylds eða óskylds gjafa. Ávallt verður þó að hafa í huga aukna áhættu meðferðar þegar um óskyldan gjafa er að ræða, bæði aukna tíðni ónæmisröskunar og hærri dánartíðni.
l Sjúklingar með bráða mergfrumu hvítblæði fari í mergskipti í fyrsta sjúdómshléi þegar slæmir áhættuþættir eru fyrir hendi.
l Fyrir bráða eitilfrumu hvítblæði hefur stefnan verið mergskipti í fyrsta sjúkdómshléi hjá fullorðnum með slæma áhættuþætti og hjá öllum aldurshópum með Fíladelfía litningabreytinguna.
l Bættar lífslíkur sjúklinga með mergfrumuæxli eftir eigin stofnfrumuígræðslu snemma í sjúkdómsferlinu hafa leitt til breytinga í meðferð á þann veg að eigin stofnfrumuígræðsla er orðin hluti af hefðbundinni meðferð.
l Hjá sjúklingum með eitilfrumukrabbamein (Non-Hodgkin´s lymphoma og Hodgkin´s disease) sem hafa svarað meðferð á ný eftir endurkomu sjúkdóms, er eigin stofnfrumuígræðsla kjörmeðferð (6,7).
Tegundir gjafa
Um er að ræða þrjár tegundir stofnfrumugjafa: eineggja tvíbura, skyldmenni, sem oftast er systkini sjúklings og óskyldan gjafa. Oftast er gjafinn náið skyldmenni sjúklings, en líkurnar á að systkini séu í sama vefjaflokki eru aðeins 25%. Líkurnar stigaukast eftir því sem systkinahópurinn er stærri, og ef miðað er við misræmi eins vefjaflokks þá eru líkurnar rúmlega 30%. Ýmist getur verið um fullkomið vefjaflokkasamræmi milli þega og gjafa að ræða eða ósamræmi í einum eða fleiri vefjaflokkum. Á síðustu árum hafa alþjóðlegar gjafaskrár gegnt vaxandi hlutverki í leit að gjafa. Alþjóðleg merggjafaskrá var upphaflega stofnsett í Bandaríkjunum 1989 með 155.000 vefjaflokkaða einstaklinga á skrá. Í júní á þessu ári var fjöldi mögulegra gjafa hins vegar kominn upp í 6.532.037, en bæði er um vefjaflokkaða einstaklinga og einingar naflastengsblóðs að ræða (Bone Marrow Donors Worldwide, BMDW) (8). Skrárnar hafa því bætt verulega líkurnar á því að finna gjafa fyrir þá einstaklinga sem ekki eiga gjafa úr skyldmennahópi. Í vissum tilvikum hafa mergskipti verið framkvæmd þrátt fyrir helmings vefjaflokkamisræmi en við þær aðstæður eykst verulega hætta á aukaverkunum, einkum er um að ræða viðbrögð græðlings gegn mergþega (Graft versus Host disease) sem hér verður nefnt ónæmisröskun. Stofnfrumum fyrir mergskipti hefur lengst af eingöngu verið safnað úr merg en á síðustu árum hafa bæst við stofnfrumur úr blóði og naflastrengsblóði. Blóðmyndandi stofnfrumur eru upprunnar í mergnum en fyrir mörgum árum gerðu menn sér ljóst að þessar stofnfrumur finnast einnig í blóðrásinni. Síðar kom í ljós að með því að gefa frumudrepandi lyf og ýmsa vaxtarhvata er hægt að örva flutning á stofnfrumum út í blóðið og safna þeim með notkun frumuskilju. Nýleg bandarísk rannsókn sýndi minni líkur á endurkomu sjúkdóms og betri lífslíkur hjá hópnum sem fékk stofnfrumur úr blóði (70% lifandi eftir tvö ár) miðað við samanburðarhóp sem fékk stofnfrumur úr mergnum (45% lifandi eftir tvö ár). Tími blóðkornafæðar var mun styttri í fyrri hópnum en ekki reyndist munur á tíðni ónæmisröskunar (9). Aðrar rannsóknir hafa þó sýnt auknar líkur á ónæmisröskun eftir mergskipti með gjöf stofnfrumna úr blóði. Sérstakir naflastrengsblóðbankar hafa verið stofnsettir víða erlendis, en stofnfrumur úr naflastrengsblóði munu gegna vaxandi hlutverki í framtíðinni fyrir meðferð þeirra barna, sem ekki eiga hefðbundinn gjafa. (10)
Framkvæmd mergskipta
Undirbúningsmeðferð fyrir mergskipti felst í gjöf háskammta frumudrepandi lyfja og jafnframt í mörgum tilvikum heilgeislun (total body irradiation) samfara gjöf ónæmisbælandi lyfa. Tilgangur meðferðar er að eyða sjúkum vef, koma í veg fyrir höfnun græðlingsins og varna árás eitilfrumna úr græðlingnum á líffæri sjúklingsins, en markmiðið er að svokallað ónæmisþol (immune tolerance) nái að þróast. Undirbúningsmeðferðin er venjulega gefin í nokkra daga og ræðst val meðferðar af sjúkdómsgreiningu. Að því loknu fá sjúklingarnir nýju stofnfrumurnar og eru þær gefnar í æð eins og við venjulega blóðgjöf. Þegar hér er komið sögu er starfsemi beinmergs og öll blóðkorn í lágmarki og sjúklingarnir í flestum tilvikum komnir í einangrun. Við tekur biðtími þar til nýi mergurinn hefur tekið til starfa, um tvær til fjórar vikur. Þörf er á margþættri stuðningsmeðferð, til dæmis blóðgjöfum, vaxtarhvötum sem örva blóðmyndun, sýklalyfjum til að fyrirbyggja og meðhöndla sýkingar, næringu í æð og ónæmisbælandi lyfjameðferð. Eftir útskrift af sjúkrahúsi er síðan fylgst mjög náið með sjúklingnum á göngudeild næstu tvo mánuði vegna hættu á tækifærissýkingum og ónæmisröskun. Við hefðbundin mergskipti er yfirleitt stefnt að því að stöðva ónæmisbælandi lyfjameðferð eftir hálft ár nema ónæmisröskun sé enn til staðar (11).Ónæmisröskun
Grundvallarmunur er milli mergskipta og ígræðslu flestra annarra líffæra. Ólíkt mergnum innihalda ígrædd líffæri takmarkaðan fjölda frumna með ónæmisvirkni og ævilöng ónæmisbælandi lyfjameðferð er nauðsynleg til að hindra höfnun ígrædds líffæris. Sú undirbúningsmeðferð sem beitt er við mergskipti gegnir tvöföldu hlutverki, annars vegar að uppræta sjúkan vef og hins vegar að eyða ónæmiskerfi mergþegans sem síðan er byggt upp á nýjan leik með græðlingnum. Málið snýst ekki aðeins um að hindra höfnun græðlingsins, heldur einnig um að koma í veg fyrir líffæraskemmdir vegna áhrifa eitilfrumna í græðlingnum, viðbrögð græðlings gegn mergþega eða ónæmisröskun. Ónæmisröskun, sem var fyrst lýst hjá mönnum 1963, er ennþá ein helsta orsök alvarlegra veikinda og dauðsfalla við mergskipti (12).Skilmerki Billinghams fyrir ónæmisröskun frá 1966 eru enn í fullu gildi: 1. Græðlingurinn verður að innihalda frumur með ónæmisvirkni (eitilfrumur). 2. Mergþeginn verður að tjá vefjaflokkasameindir sem gjafann skortir og þessi framandleiki leiðir til örvunar ónæmiskerfisins. 3. Mergþeginn er ekki fær um að byggja upp virka ónæmissvörun sem leiðir til eyðingar græðlingsins (13). Flestar kyrndar frumur, ásamt blóðflögum tjá vefjaflokkasameindir af flokki I á yfirborði sínu en mun færri frumur tjá sameindir af flokki II, einkum B-eitilfrumur, stoðfrumur (dendritic cells) og sumar æðaþelsfrumur (14). Tjáningu vefjaflokkasameinda af báðum flokkum er síðan unnt að auka fyrir áhrif ýmissa frumuboðefna. Upphaflega var talið að með fullu vefjaflokkasamræmi milli gjafa og þega væri hægt að koma í veg fyrir ónæmisröskun. Þrátt fyrir hátækniaðferðir til vefjaflokkunar, hefur sýnt sig að í 30-50% tilvika þegar um fullkomið vefjaflokkasamræmi (flokkur I og II) er að ræða, koma upp einkenni ónæmisröskunar, ef T-eitilfrumur eru í græðlingi (15). Þessi staðreynd er óbein sönnun fyrir tilvist annarra mótefnavaka, svokallaðra minni vefjaflokkamótefnavaka (minor histocompatibility antigens), sem einnig geta komið af stað ónæmisröskun. Genin sem bera upplýsingar um ofangreinda mótefnavaka eru utan vefjaflokkasvæðisins á litningi 6 en aðeins fáum slíkum mótefnavökum hefur verið lýst nákvæmlega (16).
Í fyrstu var talið að ónæmisröskun orsakaðist eingöngu af íferð T-eitilfrumna græðlingsins í líffæri mergþegans en á síðustu árum hefur komið í ljós að ferlið er mun flóknara. Um er að ræða keðjuverkandi bólguferli sem gjarna er skipt í þrjú stig: 1. Vefjaskemmdir sökum geisla- og lyfjameðferðar leiða til aukinnar framleiðslu frumuboðefna til dæmis interleukin-1 (IL-1) og tumor necrosis factor-a (TNF-a) sem aftur örva T-eitilfrumur í græðlingnum. Boðefnalosunin veldur líka aukinni tjáningu viðloðunar- og vefjaflokkasameinda. 2. Virkjun T-eitilfrumna frá gjafa sem þekkja framandi vefjaflokkasameindir þegans og framleiða fjölmörg frumuboðefni, interleukin-2 (IL-2) og interferon-g (IFN-g) (gerð 1) ásamt IL-10 og IL-4 (gerð 2). 3. Fjölgun T-eitilfrumna ásamt átfrumum, NK-frumum og neutrófílum valda vefjaskaða. Bæði er um bein frumudrepandi áhrif að ræða (frumudrepandi T-eitilfrumur) og óbein áhrif gegnum losun ofangreindra bólgumiðla (17).
Ónæmisröskun er skipt í bráðan sjúkdóm sem kemur fram á fyrstu 100 dögunum eftir mergskipti og langvinnan sjúkdóm að þeim tíma liðnum. Langvinna formið getur ýmist komið í kjölfar bráðrar ónæmisröskunar eða án undanfarandi sjúkdóms. Bráð ónæmisröskun lýsir sér fyrst og fremst með húðútbrotum og einkennum frá meltingarvegi (niðurgangur, kviðverkir) og lifur (brenglun á lifrarstarfsemi, bílírúbínhækkun). Bráða forminu er skipt í stig I-IV eftir fjölda líffæra sem ónæmisröskun nær til og alvarleika einkenna, stig I ef eingöngu koma fram einkenni frá húð og stig II-IV ef einkenni koma frá fleiri líffærakerfum. Einkenni langvinnrar ónæmisröskunar svipar til ýmissa sjálfsónæmissjúkdóma, svo sem rauðra úlfa og iktsýki. Helstu einkennin eru liðverkir, brenglun á lifrarprófum, slímhúðarþurrkur, bólga í húð og slímhúðum og breytingar líkar herslishúð.
Tíðni bráðrar ónæmisröskunar er háð fjölmörgum þáttum þega og gjafa. Tegund vefjaflokkasamræmis er stærsti þátturinn; aðrir eru aldur, kynjamisræmi og fjöldi barneigna kvenkyns gjafa. Þegar gjafi og þegi eru með sömu vefjaflokkaarfgerð er áhætta bráðrar ónæmisröskunar (stig III-IV) 15%, miðað við fyrirbyggjandi meðferð með metótrexati og cýklósporíni. Ef misræmi er í einum vefjaflokkamótefnavaka milli systkina er áhætta bráðrar ónæmisröskunar (stig III-IV) 35% en ef gjafinn er óskyldur er áhættan komin upp í 50%. (16) Helstu áhættuþættir fyrir langvinna ónæmisröskun eru hár aldur þega við mergskipti, undanfarandi bráð ónæmisröskun, kynjamisræmi milli gjafa og þega en einnig virðast sjúklingar með langvinnt mergfrumuhvítblæði fá sjúkdóminn í auknum mæli (18).
Háskammtasterar eru enn grundvöllur meðferðar og árangur hjá þeim einstaklingum sem ekki svara sterameðferð hefur verið lítill. Fyrirbyggjandi meðferð ónæmisröskunar hefur í raun verið árangursríkasta meðferðin. Dánartíðni sjúklinga með illkynja blóðsjúkdóma sem fá bráða ónæmisröskun á stigi I-II hefur verið um 20% fyrstu sex mánuðina, 60% við stig III en stig IV er í flestum tilvikum banvænt (16). Fyrirbyggjandi meðferð er gefin með ónæmisbælandi lyfjum eða með hreinsun græðlingsins af T-eitilfrumum. Ýmsum lyfjasamsetningum hefur verið beitt, oftast er um að ræða cýklósporín og metótrexat með eða án stera.
Græðlingur gegn hvítblæði
Fljótlega var sýnt fram á lægri tíðni endurkomu sjúkdóms hjá þeim sjúklingum sem fengu ónæmisröskun eftir mergskipti, samanborið við þá einstaklinga sem sýndu engin merki ónæmisröskunar (19). Orsökin er viðbrögð eitilfrumna frá gjafa gegn minni vefjaflokkasameindum og ákveðnum sértækum sameindum á yfirborði illkynja frumna sem leiðir til eyðingar illkynja vefs. Þessum viðbrögðum var fyrst lýst í hvítblæði og nefnt græðlingur gegn hvítblæði (Graft versus Leukemia effect) en nú er ljóst að viðbrögðin koma fram við fjölmarga sjúkdóma. Ein sterkasta vísbendingin um þessi áhrif græðlingsins er árangur meðferðar með eitilfrumugjöf frá upprunalegum merggjafa við endurkomu sjúkdóms eftir mergskipti. Af öðrum rökum skal nefna auka tíðni endurkomu sjúkdóms eftir mergskipti hjá eineggja tvíburum (enginn breytileiki í minni vefjaflokkamótefnavökum) og eftir T- frumufækkun græðlings (2,20). Árangur meðferðar sem byggist á gjöf eitilfrumna frá merggjafa sýndi einnig fram á, að ekki var nauðsynlegt að skapa rými í mergnum fyrir græð-linginn með háskammta frumudrepandi lyfjum. Í kjölfarið þróuðust hugmyndir um að hægt væri að lækna illkynja sjúkdóma án háskammtameðferðar, en allra síðustu ár hefur verið beitt nýrri nálgun við mergskipti. Þetta hefur verið nefnt ýmsum nöfnum eins og minni ígræðsla (mini transplant eða non-myeloablative transplant), en við þetta nýja meðferðarform hefur verið dregið verulega úr undirbúningsmeðferðinni. Gefnir eru lágir skammtar af frumudrepandi lyfjum og geislameðferð og síðan eru stofnfrumurnar gefnar í áföngum. Samfara þessu er gefin ónæmisbælandi meðferð en í miklu styttri tíma en við hefðbundin mergskipti. Þannig myndast ástand sem kallað er mixed chimerism en þá eru fyrir hendi bæði frumur frá merggjafa og mergþega. Þetta er gert til að virkja ofangreind áhrif græðlingsins (Graft versus Leukemia), en ónæmisröskun er þó ennþá verulegt vandamál. Hins vegar hefur þessi nálgun haft mikil áhrif á val sjúklinga sem er hægt að veita þessa meðferð en í dag hafa einstaklingar allt upp í 75 ára aldur farið í ofangreinda meðferð (21.
Höfnun
Höfnun græðlings eftir mergskipti getur ýmist komið fram sem blóðkornafæð frá byrjun eða síðkomin blóðkornafæð og mergþurrð eftir að rótun (engraftment) hefur upphaflega átt sér stað. Bæði T-eitilfrumur og NK-frumur þegans geta sett af stað höfnunarferlið sem stjórnast af vefjaflokkasamræmi milli þega og gjafa. Þegar um sömu vefjafokkaarfgerð er að ræða er hættan á höfnun undir 1%, en við misræmi í tveimur eða þremur vefjaflokkamótefnavökum, HLA- A,- B eða -DR, er hættan á höfnun komin upp í 15% (16).Líkurnar á höfnun geta einnig ráðist af mótefnamyndun (alloimmunization) þegans af völdum blóðgjafa fyrir mergskiptin. Þetta getur gerst hafi blóðgjafarnir sameiginlega ígræðslu mótefnavaka með merggjafanum. Höfnun getur orðið fyrir tilstilli minnis T-eitilfrumna sem hafa lifað af undirbúningsmeðferðina eða vegna mótefnamiðlaðrar eyðingar græðlingsins. T-frumu fækkun í græðlingnum ásamt ófullnægjandi ónæmisbælandi lyfjameðferð getur einnig stuðlað að höfnun (16). Algengast er að höfnun verði hjá sjúklingum með vanmyndunarblóðleysi sem ekki hafa fengið undirbúning með heilgeislun (22).
Önnur vandamál
Ýmsa bráða fylgikvilla við mergskipti má fyrst og fremst rekja til undirbúningsmeðferðarinnar. Slímhúðarbólga (mucositis) er mjög algengt vandamál fyrstu tvær til þrjár vikurnar eftir mergskipti en hún ræðst af tegund undirbúningsmeðferðar. Blæðandi þvagblöðrubólga er algengasta aukaverkun af háskammta cýklófosfamíði. Stíflandi bláæðasjúkdómur (veno-occlusive disease) í lifur greinist hjá 10-60% sjúklinga sem fara í mergskipti og orsakast af blóðrásartruflunum í litlum bláæðum lifrarinnar. Æðaþelsskaði af völdum undirbúningsmeðferðar, veldur lifrarskemmdum bæði beint og óbeint í gegnum losun frumuboðefna. Flestir skilgreina stíflandi bláæðasjúkdóm í lifur eftir klínískum skilmerkjum, en þau eru þyngdaraukning, lifrarstækkun og gula. Yfirleitt fylgir þessu ástandi fjölkerfabilun. Mikilvægt er að reyna að fyrirbyggja sjúkdóminn, en meðferðin er fyrst og fremst einkennameðferð (10,22). Lungnabólga er ennþá ein af höfuðdánarorsökum eftir mergskipti. Eftir fyrsta mánuðinn er cýtómegalóveirusýking ein algengasta orsökin, en með vaxandi notkun fyrirbyggjandi meðferðar hefur dregið úr tíðni sýkinga. Lungnabólgu af óþekktri orsök er lýst í 10-20% tilvika við mergskipti og orsökin rakin til áhrifa undirbúningsmeðferðar. Vefjarannsókn hefur einkum sýnt tvenns konar mynstur, millivefslungnabólgu (interstitial pneumonitis) og blæðingar í lungnablöðrum (diffuse alveolar hemorrhage). Nauðsynlegt er að útiloka sýkingar með berkjuspeglun eða opinni lungnasýnatöku. Helstu áhættuþættirnir eru heilgeislun, hár aldur, vefjaflokkamisræmi og ónæmisröskun. Meðferðin er einkennameðferð en dánartíðni er allt upp í 50-70% (23).Langtímafylgikvillar hafa komið betur í ljós á síðustu árum vegna bættrar lifunar sjúklinga. Hjá börnum og unglingum getur meðferðin valdið skerðingu á þroska og eðlilegum vexti. Ófrjósemi er algeng eftir meðferðina og mikilvægt að sjúklingarnir fái upplýsingar um fyrirbyggjandi aðgerðir. Þeir einstaklingar sem þurft hafa langvarandi sterameðferð eru í aukinni áhættu á að fá beindrep, beinþynningu og ský á augastein (10). Af öðrum langtímafylgikvillum má nefna krabbamein, en áhættan á að greinast með krabbameinsæxli er áttfalt aukin meira en 10 árum eftir mergskipti (24).
Lifun
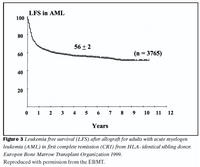
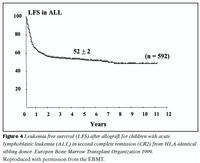
Lifun sjúklinga eftir mergskipti er háð fjölmörgum þáttum en tveir mikilvægustu þættirnir eru ástand sjúkdóms við ígræðslu og aldur sjúklings. Langt gengnum sjúkdómi fylgir hærri dánartíðni vegna bráðra fylgikvilla ígræðslumeðferðar og aukinnar hættu á endurkomu sjúkdóms. Tíu ára lifun getur verið frá 90% hjá börnum sem fara snemma í mergskipti niður í nánast 0% hjá fullorðnum einstaklingum með lokastigssjúkdóm (25). Myndir 3 og 4 sýna árangur meðferðar hjá hvítblæðissjúklingum á skrá hjá evrópsku ígræðslusamtökunum, en skráin nær yfir tímabilið 1987-1998. Fimm ára sjúkdómsfrí lifun (leukemia free survival) hjá sjúklingum með bráða mergfrumuhvítblæði var 56% og 52% hjá sjúklingum með bráða eitilfrumuhvítblæði. (4) Í nýlegri rannsókn frá Seattle í Bandaríkjunum var fimm ára heildarlifun 75% hjá sjúklingum með langvinnt mergfrumuhvítblæði en allir voru undir 50 ára aldri og höfðu fengið merg frá óskyldum gjafa (26).Mergskipti íslenskra sjúklinga
Alls hafa 40 Íslendingar farið í mergskipti frá upphafi 1981 til ársloka 1999 en öll mergskipti hafa farið fram erlendis. Síðustu fimm ár hafa að meðaltali fjórir einstaklingar farið í mergskipti árlega. Í 80% tilvika var gjafinn systkini sjúklings en 20% voru frá óskyldum gjafa. Ábendingar voru eftirfarandi: 40% einstaklinga voru með bráða mergfrumuhvítblæði, 30% með bráða eitilfrumuhvítblæði, 22,5% með langvinnt mergfrumuhvítblæði, 5% með mergrangvaxtar- heilkenni og 2,5% með Wiscott Aldrich heilkenni. Fimm ára heildarlifun alls hópsins var 46% en heildarlifun hafði batnað á seinni hluta rannsóknartímans. Hjá sjúklingum með bráða mergfrumuhvítblæði var fimm ára heildarlifun 44% og fyrir langvinnt mergfrumuhvítblæði 56% (27).Á þeim 50 árum sem liðið hafa frá upphafi stofnfrumuflutninga hafa framfarir verið stórstígar og mikil aukning orðið á fjölda bæði mergskipta og eigin stofnfrumuígræðslna. Í framtíðinni er líklegt að enn frumstæðari stofnfrumum, svokölluðum kímstofnfrumum (mesenchymal stem cells), verði beitt til að flýta blóðmyndun eftir ígræðslu og mögulega við endurnýjun stoðvefs í vissum erfðasjúkdómum. Einnig eru miklar vonir bundnar við genalækningar. Ábendingum fyrir meðferð fjölgar sífellt og ljóst er að hin nýja nálgun við mergskipti á eftir að stækka verulega þann hóp sjúklinga sem mögulegt er að veita meðferð. Undirbúningur fyrir eigin stofnfrumuígræðslu hefur farið fram á Landspítala síðustu ár og vonandi verður þess ekki langt að bíða að stofnfrumuflutningar hefjist hér á landi.
Heimildir
1. Treleaven J, Barret J. Introduction to bone marrow transplantation. In: Treleaven J, Barrett J, eds. Bone Marrow Transplantation in Practice. Edinburgh: Churchill Livingstone; 1992: 3-9.2. Thomas ED. Bone Marrow Transplantation: A Review. Semin Hematol 1999; 36/Suppl. 7: 95-103.
3. Thomas ED, Buckner CD, Banaji M, Clift RE, FeferA, Flournoy N, et al. One hundred patients with acute leukemia treated by chemotherapy, total body irradiation, and allogeneic marrow transplantation. Blood 1977; 49: 511-33
4. EBMT (European Bone Marrow Transplant Organisation), preliminary data 09.1999.
5. Antin JH, Smith BR. Bone Marrow Transplantation. In: Handin RI, Lux SE, Stossel TP, eds. Blood: Principles and Practice of Hematology. Philadelphia: J.B. Lippincott Company; 1995: 2055-60.
6. Goldman JM, Schmitz N, Niethammer D, Gratwohl A. Indications for stem cell transplantations. In: Apperley JF, Gluckman E, Gratwohl A, eds. The EBMT Handbook. Blood and Marrow Transplantation. Paris: European School of Haematology; 2000: 57-67.
7. Vogelsang G. Bone marrow transplantation. In: Jacob H, ed. Hematology MKSAP. 2nd ed. Philadelphia: American society of Hematology American College of Physicians - American Society of Internal Medicine; 1999: 51-65.
8. Bone Marrow Donors Worldwide [cited 2000 July 21]: http://www.BMDW.ORG
9. Bensinger W, Martin P, Clift R, Storer B, Forman S, Blume K, et al. A prospective randomized trial of peripheral blood stem cells (PBSC) or marrow (BM) for patients undergoing allogeneic tansplantation for hematologic malignancies. Blood 1999; 94: 368a.
10. Armitage S, Warwick R, Fehily D, Navarrete C, Contreras M. Cord blood banking in London: the first 1000 collections. Bone Marrow Transplantation 1999; 24: 139-45.
11. Sullivan KM. Graft-Versus-Host Disease. In: Thomas ED, Blume KG, Forman SJ, eds. Hematopoietic cell transplantation. Útgáfustaður: Blackwell Science Inc.; 1999; 515-36.
12. Mathe G, Amiel JL, Schwarzenberg L, Cattan A,Schneider M. Haematopoietic chimera in man after allogenic (homologous) bone-marrow transplantation (Control of the secondary syndrome. Specific tolerance due to the chimerism). BMJ 1963; 5373: 1633-5.
13. Billingham RE. The biology of graft-versus-host reactions. The Harvey lectures. Vol. 62. New York: Academic Press; 1966: 21-78.
14. Rodney GE, Lalezari P. HLA and Neutrophil Antigens and Antibody Systems. In: Hoffman R, Benz EJ, Shattil SJ, Furie B, Cohen HJ, Silberstein LE, McGlave P, eds. Hematology, Basic Principles and Practice. 3rd ed. Útgáfustaður: Churchill Livingstone; 2000: 2220-41
15. Antin JH. Inhibition of dysregulated cytokines to control acute graft-versus-host disease. Hem/Onc Annals 1994; 2: 341-7.
16. Martin PJ. Overview of Marrow Transplantation Immunology. In: Thomas ED, Blume KG, Forman SJ, eds. Hematopoietic cell transplantation. Útgáfustaður: Blackwell Science Inc.; 1999; 19-27.
17. Ferrara JLM. The cytokine modulation of acute graft-versus-host disease. Bone Marrow Transplantation 1998; 21/Suppl. 3: 13-5.
18. Carlens S, Ringdén O, Remberger M, Lönnqvist B, Hägglund N, Klaesson S, et al. Risk factor for chronic graft-versus-host disease after bone marrow transplantation: a retrospective single centre analysis. Bone Marrow Transplantation 1998; 22: 755-61.
19. Weiden PL, Flournoy N, Thomas ED. Anti-leukemic effect of graft-versus-host disease in human recipients of allogeneic-marrow grafts. N Engl J Med 1979; 300: 1068-73.
20. Kolb HJ, Schattenberg A, Goldman JM, Hertenstein B, Jacobsen N, Arcese W, et al. Graft-Versus-Leukemia Effect of Donor Lymphocyte Transfusions in Marrow Grafted patients. Blood 1995; 86: 2041-50.
21. Bacigalupo A. Hematopoietic stem cell transplants after reduced intensity conditioning regimen: report of a workshop of the EBMT. Bone Marrow Transplantation 2000; 25: 03-805.
22. Champlin RE, Ho WG, Nimer SD, Gajewski JG, Selch M, Burnison M, et al. Bone marrow transplantation for severe aplastic anemia: effect of a preparative regimen of cyclophosphamide- low- dose total- lymphoid irradiation and postransplant cyclosporine- methotrexate therapy. Transplantation1990; 49: 720-4.
23. Ribaud P. Early complications. In: Apperley JF, Gluckman E, Gratwohl A, eds. The EBMT Handbook. Blood and Marrow Transplantation, Paris: European School of Haematology; 2000: 153-63.
24. Curtis RE, Rowlings PA, Deeg HJ, Shriner DA, Socié G, Travis LB, et al. Solid cancers after bone marrow transplantation. N Engl J Med 1977; 336: 897-904.
25. Gratwohl A, Hermans J. Outcome of Blood and Marrow Transplants. In: Apperley JF, Gluckman E, Gratwohl A, eds. The EBMT Handbook. Blood and Marrow Transplantation. Paris: European School of Haematology; 2000: 111-8.
26. Hansen JA, Gooley TA, Martin PJ. Bone marrow transplants from unrelated donors for patients with chronic myeloid leukemia. N Engl J Med 1998; 338: 962-8.
27. Jensdóttir M, Haraldsdóttir V, Björnsdóttir J, Jónmundsson GK, Reykdal S. Mergskipti og eigin stofnfrumuflutningur. Árangur meðferðar íslenskra sjúklinga 1981-1999 [ágrip]. Læknablaðið 2000; 86/Fylgirit 39: 32-3.