Fræðigreinar
Árangur kransæðavíkkunaraðgerða á Íslandi 1987-1998
Ágrip
Markmið: Tilgangur rannsóknarinnar var að meta árangur kransæðavíkkana á Íslandi á tímabilinu 1987-1998. Ennfremur að kanna hugsanlegar breytingar á ábendingum fyrir kransæðavíkkunum og á sjúkdómsbakgrunni þeirra sjúklinga sem komu til aðgerðar og hvort breytingar hefðu orðið á árangri, tíðni fylgikvilla og aðgerðartengdum dauðsföllum.Efniviður og aðferðir: Frá því fyrsta kransæðavíkkunin var gerð hér á landi í maí 1987 hefur nákvæm skrá verið haldin yfir alla sjúklinga. Skráð voru aðalatriði úr sjúkrasögu, klínískt ástand sjúklings og aðalábending fyrir aðgerð, áættuþættir fyrir kransæðasjúkdómi, niðurstöður kransæðamyndatöku, tæknileg framkvæmd aðgerðarinnar, árangur, fylgikvillar og aðgerðartengd dauðsföll. Á árunum 1987-1998 voru alls gerðar 2440 kransæðavíkkanir. Rannsóknartímabilinu var skipt í þrjú tímaskeið: I. 1987-1992 (471 aðgerð); fyrstu lærdómsárin, II. 1993-1995 (796 aðgerðir); aukinn fjöldi aðgerða og aðferðin fest í sessi, III. 1996-1998 (1173 aðgerðir); vaxandi notkun stoðneta og ný blóðflöguhamlandi lyf notuð.
Niðurstöður: Frá tímabili I til III minnkaði hlutfall valinna víkkunaraðgerða úr 82% í 52% (p<0,001), hálfbráðum víkkunum fjölgaði úr 14% í 44% (p<0,001), bráðum víkkunum úr 0,8% í 3% (p<0,05), og víkkunum í beinu framhaldi af kransæðamyndatöku fjölgaði úr 0,4% í 28% (p<0,001). Þessar breytingar endurspegla aukningu á víkkunaraðgerðum hjá sjúklingum með bráða kransæðasjúkdóma og hlutfall sjúklinga með hvikula hjartaöng jókst einnig úr 15% í 36% (p<0,001). Ennfremur lækkaði hlutfall víkkunaraðgerða á einni kransæð úr 93% í 83%, en jókst á tveimur og þremur æðum úr 7% í 17% (p<0,001). Sjúklingum 70 ára og eldri fjölgaði úr 7% í 27% (p<0,001). Samtímis jókst tíðni velheppnaðra víkkunaraðgerða úr 83% í 93% (p<0,001) og notkun stoðneta frá því að vera engin í 56%. Hlutfall sjúklinga sem komu til víkkunar vegna endurþrengsla lækkaði úr 15% í 12% (p=0,06). Jafnframt lækkaði tíðni bráðra hjáveituaðgerða vegna fylgikvilla við víkkun úr 4,2% í 0,2% (p<0,001), hækkun á hjartaensímum eftir víkkanir minnkaði úr 4,0% í 2,7% (p<0,05), en tíðni klínískt staðfests hjartadreps eftir víkkunaraðgerð hélst svipuð, 1,3% og 0,9%, svo og dánartíðni á sjúkrahúsi, sem var 0,6% og 0,4%.
Ályktanir: Miðað við fólksfjölda er tíðni kransæðavíkkunaraðgerða á Íslandi með því hæsta í Evrópu. Árið 1998, þegar fólksfjöldi var 275.000, voru gerðar 453 aðgerðir, sem samsvarar staðlað 1647 aðgerðum á milljón íbúa. Á undanförnum árum hefur fjöldi hálfbráðra og bráðra víkkunaraðgerða aukist, fleiri æðar eru oftar víkkaðar í einu og hlutfall eldri sjúklinga fer vaxandi. Þrátt fyrir þetta er hlutfall velheppnaðra víkkunaraðgerða hátt og tíðni fylgikvilla og dauðsfalla eftir aðgerð lág.
English Summary |
| Danielsen R, Eyjólfsson K, Sigurðsson AF, Jónmundsson EH Results of percutaneous coronary interventions in Iceland during 1987-1998 Læknablaðið 2000; 86: 241-9 Purpose: To evaluate potential changes in clinical indications and the composition of the patient population undergoing percutaneous coronary intervention (PCI) in Iceland from 1987 to 1998. Furthermore, to assess changes in success rate and major complications for the procedure during the study interval in a small nation with one PCI centre. Material and methods: The first PCI was performed in Iceland in May 1987. A registry has been kept from the start that includes clinical and procedural data, and records of complications and mortality. During the study interval a total of 2440 PCIs were performed. The annual procedure rate was low at first, with a steep rise during the last years. Based on procedural changes over the years the study interval was divided into three periods: I. 1987-1992 (471 procedures); the learning years, II. 1993-1995 (796 procedures); increasing number of PCIs and the method established, III. 1996-1998 (1173 procedures); increasing use of stents and new antiplatelet regime used. Results: From period I to III, the rate of elective PCI declined from 82% to 52% (p<0.001), subacute procedures increased from 14% to 44% (p<0.001), acute PCI from 0.8% to 3% (p<0.05), and ad hoc procedures from 0.4% to 28% (p<0.001). This reflects an increase in PCI on patients with acute coronary syndromes, as the ratio of patiens with unstable angina increased from 15% to 36% (p<0.001). Also, 1-vessel PCI decreased proportionally from 93% to 83%, while 2 and 3 vessel procedures increased from 7% to 17% (p<0.001). The proportion of patients 70 years or older increased from 7% to 27% (p<0.001). Still, the success rate for PCI increased from 83% to 93% (p<0.001) and the use of stents rose sharply from 0% to 56%. The ratio of PCI due to restenosis declined somewhat between period II and III, from 15% to 12% (p=0.06). Simultaneously, the rate of acute coronary bypass surgery after PCI decreased from 4.2% to 0.2% (p<0.001) and significantly fewer patients had elevated creatinine kinase levels (4.0% vs 2.7%, respectively, p<0.05). However, clinical acute myocardial infarction after PCI remained similar at 1.3% and 0.9%, and the in hospital mortality was 0.6% and 0.4%. Conclusions: On a national basis the rate of PCI in Iceland is amongst the highest in Europe. Thus, in 1998, when the population in Iceland was 275,000, 453 PCIs were done (1647 procedures per million inhabitants). An increased number of subacute and acute PCIs is carried out, more complicated procedures are performed in patients with widespread disease, and the patient population is growing older. Still, the success rate is high and the frequency of complications and mortality relatively low. Key words: coronary artery disease, percutaneous coronary intervention, results, complications. Correspondence: Ragnar Danielsen. E-mail: ragnarda@rsp.is |
Inngangur
Innanæðaviðgerðir á kransæðum, svokallaðar kransæðavíkkanir, hafa þróast ört síðastliðna tvo áratugi. Fyrsta aðgerðin í heiminum þar sem kransæð var víkkuð með þenjanlegum belg var gerð af þýska lækninum Andreas Grüntzig í september 1977 í Zürich í Sviss (1). Aðferð þessi vakti mikla athygli, henni hafði áður verið beitt á útlægar æðar, til dæmis í ganglimun, en ekki í kransæðum (2). Þessi tækni þróaðist á næstu árum og breiddist hratt út bæði í Evrópu, Bandaríkjunum og víðar og olli byltingu í meðferð kransæðasjúkdóma. Í dag er þessi aðferð ennþá hornsteinn víkkunaraðgerða þó mikil tækniþróun hafi orðið á síðari árum. Ber þar hæst vaxandi notkun stoðneta við víkkunaraðgerðir (3,4), en aðrar aðferðir til innanæðaviðgerða á kransæðum hafa líka séð dagsins ljós (5-9). Fyrsta kransæðavíkkunin hér á landi var gerð á æðarannsóknardeild Landspítalans í maí 1987 af læknunum Kristjáni Eyjólfssyni og Einari H. Jónmundsyni. Fyrstu árin voru gerðar fremur fáar kransæðavíkkanir en með aukinni reynslu hefur fjöldi þeirra farið vaxandi á undanförnum árum.Meginmarkmið núverandi rannsóknar var að meta árangur kransæðavíkkana hér á landi á árunum 1987-1998. Ennfremur að kanna hugsanlegar breytingar á ábendingum fyrir kransæðavíkkunum og á sjúkdómsbakgrunni þeirra sjúklinga sem komu til aðgerðar og hvort breytingar hefðu orðið á árangri, tíðni fylgikvilla og aðgerðatengdum dauðsföllum á tímabilinu.
Efniviður og aðferðir
Frá því fyrsta kransæðavíkkunin var gerð 1987 hefur nákvæm skrá verið haldin yfir alla sjúklinga. Aðgerðirnar hafa allar verið gerðar á æðarannsóknardeild Landspítalans í náinni samvinnu milli röntgen- og hjartadeildar. Fyrir núverandi rannsóknaruppgjör voru eftirfarandi þættir kannaðir í sjúkraskrám: aðalatriði úr sjúkrasögu, klínískt ástand sjúklings og aðalábending fyrir aðgerð, upplýsingar um áhættuþætti, niðurstöður kransæðamyndatöku, tæknileg framkvæmd aðgerðarinnar, árangur, fylgikvillar og aðgerðartengd dauðsföll. Leitað var eftir samþykki tölvunefnar og siðanefndar Landspítalans til að framkvæma rannsóknina.Á árunum 1987 til 1998 voru gerðar alls 2440 kransæðavíkkanir. Til að auðvelda samanburð er rannsóknartímabilinu í þessu uppgjöri skipt í þrjú tímaskeið: I. 1987-1992 (471 aðgerð): Þessi ár voru bernskuskeið kransæðavíkkana hér á landi þegar fáar víkkanir voru gerðar árlega og aðferðin var að festa sig í sessi. II. 1993-1995 (796 aðgerðir): Á þessum árum fjölgaði árlegum aðgerðum og verulega reynsla var komin á árangur. III. 1996-1998 (1173 aðgerðir): Stoðnet voru tekin í notkun í vaxandi mæli og fjöldi aðgerða jókst enn frekar. Á þessum árum voru líka einfaldari blóðflöguhamlandi lyf tekin í notkun eftir stoðnetsísetningu, tíklópidín (Ticlid®) og asetýlsalisýlsýra (Magnýl®) notuð saman, í stað flóknari blóðþynningar áður með asetýlsalisýlsýru, heparíni, warfaríni og Rheomacrodex®.
Í þessu uppgjöri er fullnægjandi víkkunarárangur skilgreindur sem minni en 50% þvermálsþrengsli eftir aðgerð. Víkkun telst heppnuð að hluta ef fullnægjandi árangur náðist á einum þrengslum, en 50% eða meiri þvermálsþrengsli eru til staðar eftir víkkun á öðrum stað í sömu eða annarri æð. Ófullnægjandi víkkun telst aðgerð þar sem eftir eru 50% eða meiri þvermálsþrengsli. Endurþrengsli eru skilgreind sem 50% eða meiri þvermálsþrengsli við endurmat á æð sem áður hefur verið fullnægjandi víkkuð. Eftir víkkunaraðgerð er klínískt hjartadrep staðfest ef sjúklingur fær brjóstverki, hjartaensím eru marktækt hækkuð og nýjar ST-breytingar koma fram í hjartalínuriti.
Tölfræðilegur samanburður milli hópa var gerður með kíkvaðratsprófi eða Fishers prófi, eftir því sem við átti. Marktækur munur var skilgreindur sem tvíhliða p<0,05.
Niðurstöður
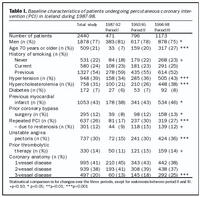
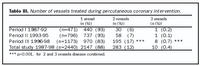
Fjöldi kransæaðvíkkana jókst jafnt og þétt á rannsóknartímabilinu og árið 1998 voru alls framkvæmdar 453 slíkar aðgerðir (mynd 1). Kransæðaviðgerð er unnt að gera bæði með opinni kransæðaaðgerðir (hjáveituaðgerð), eða með kransæðavíkkun og varð veruleg breyting á aðgerðarvali á rannsóknartímabilinu. Árið 1993 var þannig ríflega helmingur allra kransæðaviðgerða gerður með víkkunartækni en árið 1998 var þetta hlutfall komið í 75% (mynd 2). Grunnupplýsingar um þá sjúklinga er komu til kransæðavíkkunar, bæði fyrrir hópinn í heild, og á þeim þremur tímaskeiðum sem samanburður rannsóknarinnar nær til eru sýndar í töflu I.Breytingar á klínískum þáttum frá tímaskeiði I til III: Hlutfall karla er komu til kransæðavíkkunar lækkaði úr 81% í 75% (p<0,05), en hlutfall sjúklinga 70 ára og eldri jókst úr 7% í 27% (p<0,001). Í heildina voru núverandi og fyrrverandi reyktóbaksnotendur 24% og 54%. Hlutfall sjúklinga með háþrýsting jókst úr 34% í 43% (p<0,001), tíðni hækkaðs kólesteróls jókst úr 21% í 38% p<0,001), en hlutfall sykursjúkra hélst svipað og var í heildina 7% (tafla I). Hlutfall sjúklinga sem áður höfðu fengið hjartadrep jókst úr 38% í 46% (p<0,05), þeim sem áður höfðu farið í hjáveituaðgerð fjölgaði úr 8% í 13% (p<0,05), og sjúklingum sem áður höfðu farið í kransæðavíkkun fjölgaði úr 17% í 27% (p<0,001). Hins vegar varð hlutfallslega nokkur lækkun milli tímabils II og III á sjúklingum sem komu aftur til víkkunar vegna endurþrengsla, úr 15% í 12% (p=0,06). Aftur á móti jókst hlutfall sjúklinga með hvikula hjartaöng úr 15% í 36% (p<0,001). Á kransæðamynd fyrir víkkunaraðgerð greindust í heildina marktæk þrengsli í einni, tveimur eða þremur kransæðakvíslum hjá 41%, 38% og 20% sjúklinga, en hlutfall sjúklinga með þriggja-æða sjúkdóm jókst úr 13% í 25% (p<0,001) (tafla I). Tíðni valinna kransæðavíkkana lækkaði úr 82% í 52% (p<0,001), hálfbráðum víkkunum fjölgaði úr 14% í 44% (p<0,001), og bráðum kransæðavíkkunum fjölgaði úr 0,8% í 3% (p<0,05). Vinnulag milli tímaskeiða I og III breyttist einnig á þann veg að hlutfall sjúklinga þar sem gerð var kransæðavíkkun í beinu framhaldi af kransæðamyndatöku jókst úr 0,4% í 28% (p<0,001) (tafla II). Ennfremur lækkaði hlutfall kransæðavíkkana á einni æð úr 93% í 83%, en aðgerðum á tveimur og þremur æðum fjölgaði úr 7% í 17% (p<0,001) (tafla III).
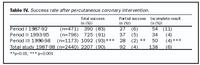
Breytingar á víkkunarárangri milli tímaskeiða I og III: Hlutfall sjúklinga þar sem víkkunarárangur taldist fullnæjandi jókst úr 83% í 93% (p<0,001) og einnig lækkaði tíðni aðgerða þar sem víkkunarárangur náðist aðeins að hluta til úr 6% í 2% (p<0,01). Hlutfall ófullnægjandi víkkunarárangurs lækkaði að sama skapi úr 11% í 4% (p<0,001) (tafla IV). Notkun stoðneta jókst verulega milli þessara tímaskeiða, frá því að vera engin upp í 56% að meðaltali á síðasta tímaskeiðinu. Árið 1998 var notað stoðnet hjá 61% sjúklinga sem komu í kransæðavíkkun (mynd 3).
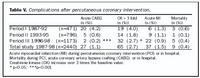
Breytingar á fylgikvillum og dánartíðni milli tímaskeiða I og III: Hlutfall sjúklinga sem urðu að fara í bráða opna kransæðaaðgerð í kjölfar misheppnaðrar kransæðavíkkunar lækkaði úr 4,2% í 0,2% (p<0,001) (tafla V). Marktæk hækkun á kreatínkínasa eftir aðgerð vegna blóðþurrðar eða dreps í hjartavöðva, skilgreind sem þreföld hækkun á ensímgildi fyrir aðgerð, lækkaði hlutfallslega úr 4,0 % í 2,7% (p<0,05) , en tíðni klínískt staðfests hjartadreps hélst svipuð, 1,3% og 0,9%, milli tímaskeiða. Dánartíðni inni á sjúkrahúsi eftir kransæðavíkkun hélst einnig óbreytt, 0,6% og 0,4%, og var í heildina 0,4% yfir öll árin (tafla V).
Umræða
Þróun kransæðaviðgerða: Fjöldi kransæðavíkkana hefur aukist ört undanfarin ár hér á landi og miðað við fólksfjölda er tíðni þessara aðgerða með því hæsta sem þekkist (mynd 4) (10). Athyglisverð er sú þróun að árið 1993 var ríflega helmingur allra kransæðaviðgerða hérlendis gerður með víkkunartækni en árið 1998 var þetta hlutfall komið í 75% og er það í takt við svipaða þróun erlendis (10). Ítarlegur samanburður hefur verið gerður á árangri kransæðavíkkana og opnum kransæðaaðgerðum í stórum slembiröðuðum rannsóknum. RITA-I rannsóknin sýndi að árangur kransæðavíkkana í samanburði við opnar kransæðaaðgerðir er góður, dánartíðni eftir rúmlega sex ár var sambærilegur, bæði hjá sjúklingum með þrengsli í einni eða fleiri kransæðum. Hins vegar versnaði hjartaöng oftar hjá sjúklingunum í víkkunarhópnum og algengara var að þeir færu aftur í kransæðavíkkun eða opna kransæðaaðgerð (11). Í BARI rannsókninni reyndist hjartadauði eftir fimm ár algengari hjá sjúklingahópnum sem fór í kransæðavíkkun en hjá þeim sem fóru í hjáveituaðgerð. Þessi munur reyndist þó alfarið vera vegna aukinnar tíðni hjartadauða hjá sykursjúkum sem fóru í kransæðavíkkun, tíðni hjartadauða var sambærileg í hópunum hjá þeim sem ekki voru með sykursýki (12). Þessi rannsókn hefur verið notuð til að rökstyðja það að sykursjúkum henti ekki að fara í kransæaðvíkkun, einkum ef þrengsli eru í mörgum kransæðum (13). Þess ber þó að gæta að hvorki RITA-I eða BARI rannsóknin notuðu stoðnet og þær endurspegla því ekki það vinnulag sem ríkir í dag. Hjá sjúklingum með útbreiddan kransæðasjúkdóm kann versnandi hjartaöng og þörf á enduraðgerð ekki endilega að stafa af endurþrengslum á víkkunarstað heldur allt eins vegna versnunar á æðakölkun og þrengslum á öðrum stöðum í kransæðunum (14). Notkun statínlyfja hjá sjúklingum sem hafa farið í kranæðaviðgerð gæti hins vegar dregið úr líkum á því, þó ekki hafi verið sýnt fram á að þau minnki beint endurþrengsli á víkkunarstað (15).Nýleg rannsók (ARTS), þar sem kransæðavíkkun með notkun stoðneta er borin saman við hjáveituaðgerð hjá sjúklingum með þrengsli í mörgum kransæðum, sýndi sambærilegan árangur hvað varðar lífshorfur og líkur á kransæðastíflu eða heilaáfalli. Víkkunarhópurinn þurfti samt nokkru oftar að fara aftur í kransæðavíkkun (12%), en nær helmingi sjaldnar en í eldri rannsóknum sem ekki notuðu stoðnet. Þrátt fyrir það var heildarkostnaður hjá víkkunarhópnum lægri eftir eitt ár en hjá þeim er fóru í hjáveituaðgerð (16). Nýrri rannsóknir hafa líka sýnt betri árangur við kransæðavíkkanir hjá sykursjúkum með notkun stoðneta, þó líkur á endurþrengslum og segastíflu í stoðneti séu hærri en hjá þeim sem ekki eru sykursjúkir (17,18). Ýmsar rannsóknir benda til þess að hjáveituaðgerð gefi betri langtímaárangur hjá sjúklingum með útbreiddan kransæðasjúkdóm og skertan vinstri slegil, og kann þetta sér í lagi að gilda fyrir sykursjúka (12,19).
Val á sjúklingum til víkkunaraðgerðar: Sjúkdómsbakgrunnur þeirra sjúklinga sem komu til kransæðavíkkunar breyttist verulega á rannsóknartímabilinu, áhættuþættir hafa aukist og sjúklingum fjölgaði sem hafa fyrri sögu um hjartadrep eða hafa farið í kransæðaviðgerð áður. Hlutfall sjúklinga með háþrýsting eða hækkað kólesteról jókst á rannsóknartímabilinu. Kann það fyrra að endurspegla aukinn fjölda eldri sjúklinga en hið síðara hert skilmerki fyrir því hvað telst hækkað kólesteról. Tíðni sjúklinga með þrengsli í þremur kransæðagreinum hefur aukist, körlum hefur hlutfallslega fækkað, en sjúklingum 70 ára og eldri fjölgað. Áður var í yfir 90% tilfella aðeins gerð víkkun á einni æð en undanfarin ár hefur hlutfall sjúklinga þar sem víkkaðar eru tvær eða fleiri æðar í sömu aðgerð næstum því þrefaldast. Fyrstu árin sem víkkanir voru gerðar var yfirleitt gerð svokölluð valin kransæðavíkkun hjá yfir 80% sjúklinga en þetta hlutfall hefur lækkað um rúmlega helming á meðan hlutur hálfbráðra víkkunaraðgerða hefur aukist. Endurspeglar það vaxandi hóp sjúklinga með bráð kransæðaeinkenni sem ekki lagast á lyfjum og oft þurfa víkkunaraðgerð innan tiltölulega skamms tíma. Er sú meðferðarþróun í samræmi við breytt viðhorf á undanförnum árum og niðurstöður nýlegra rannsókna (20-22).
Kransæðavíkkun við bráða kransæðastíflu: Kransæðavíkkun sem fyrsta meðferð við kransæðastíflu í stað segaleysandi lyfja hefur gefið góða raun í sumum erlendum rannsóknum, aðrar ekki sýnt afgerandi ávinning, en nýleg rannsókn sýndi þó betri langtímaárangur en með segalausn (23-25). Þessi aðferð hefur verið reynd í völdum tilvikum á Landspítalanum en aðstaða til slíkrar meðferðar allan sólarhringinn er þó ekki fyrir hendi (26). Sjúklingar með bráða kransæðastíflu þurfa að fá meðferð sem skjótast og kransæaðvíkkun þarf helst að gera innan tveggja tíma, annars eru litlar líkur á að víkkunaraðgerð bjargi hjartavöðva betur en segaleysandi meðferð (27). Hins vegar, sýna rannsóknir að þó kransæðavíkkun sé gerð allt að 24 tímum eftir ófullnægjandi segaleysandi meðferð þá bætir það starfsemi vinstri slegils en hefur ekki afgerandi áhrif á lífshorfur (28). Nokun stoðneta og blóðflöguhamlandi lyfja eins og abciximab (ReoPro®) hefur verulega bætt árangur við bráðar víkkanir hjá sjúklingum með kransæðastíflu (29,30). Abciximab er einþátta mótefni gegn glýkóprótín IIb/IIIa viðtakanum á blóðflögum sem hefur hraða og kröftuga blóðflöguhamlandi verkun og hindrar þannig segamyndun. Bæði kransæðavíkkanir og segaleysandi meðferð við bráða kransæðastíflu eru í þróun. Alþjóðlegar rannsóknir eru nú í gangi þar sem gefin eru saman abciximab og nýrri segaleysandi lyf og samspil þessara lyfja við kransæðavíkkun, með eða án stoðnetsísetningar, kannað til að fá úr því skorið hvaða meðferð gefi bestan árangur (31,32). Í CADILLAC rannsókninni er gerður slembiraðaður samanburður á belgvíkkun eða ísetningu stoðnets, með eða án abciximabs, hjá sjúklingum með bráða kransæðastíflu. Fyrstu niðurstöður úr milliuppgjöri benda til þess að notkun stoðnets og abciximabs gefi besta blóðflæðið í enduropnaðri kransæð og minni fylgikvilla, en langtímauppgjör er væntanlegt (33).
Árangur og fylgikvillar: Þrátt fyrir það að sjúklingar með erfiðari kransæðasjúkdóm komi til kransæðavíkkunar hefur viðunandi frumárangur við aðgerðina aukist úr 83% í 93% og eru þessar tölur svipaðar og erlendis (34). Einnig þurftu sjúklingar áður stundum að fara í bráða opna hjartaaðgerð ef kransæðavíkkun tókst ekki, eða bráð vandamál komu upp eins og þekjulos og stífla í æðinni, en nú er slíkt fátítt. Aðalskýringin á þessum framförum er líklega aukin reynsla, bætt tækni og vaxandi notkun stoðneta. Kransæðavíkkun er ekki hættulaus en dánartíðni í aðgerð eða inni á sjúkrahúsi eftir aðgerð hefur verið lág hérlendis, um 0,4% yfir öll árin, sem er með því lægsta sem þekkist (34).
Notkun stoðneta og endurþrengsli: Á fyrstu árum kransæðavíkkana var einkum ráðist í víkkanir á einfaldari þrengslum í einni æð og helst á afmörkuðu svæði. Með aukinni reynslu og tækniþróun er nú sífellt tekist á við flóknari tilfelli og gert við fleiri æðar í einu. Tækniframfarir hafa aukið öryggi í aðgerð og ein merkasta byltingin var þróun stoðneta til ísetningar í þrengslasvæðið við víkkun (3,4). Þessi tækni fór hægt af stað á árunum 1993 til 1994 og var þá helst notuð ef æðaþel losnaði og hindraði blóðflæði í æðinni. Eftir 1996 eru stoðnet notuð í auknum mæli hér á landi og nú eru þau sett í um 60% sjúklinga sem fara í kransæðavíkkun, sem er svipað hlutfall og í öðrum rannsóknum (10). Ekki er unnt að meta nákvæmlega endurþrengsli eftir víkkunaðgerð í núverandi uppgjöri þar sem kransæðamynd var ekki endurtekin nema klínískt væri ástæða til þess. Sjúklingum sem komu aftur til víkkunar vegna endurþrengsla virðist þó hlutfallslega hafa fækkað nokkuð með aukinni notkun stoðneta. Samanburðarrannsóknir sýna að notkun stoðneta minnkar líkur á endurþrengslum í víkkunarsvæðinu, en alltaf er nokkur hætta á slíkum endurþrengslum og getur þá þurft að gera víkkun aftur. Áður fyrr voru líkur á endurþrengslum um 30-50% en með tilkomu stoðneta eru þau sjaldgæfari, eða tæplega 15% (35,36). Endurþrengslin koma meðal annars vegna örvefsmyndunar þegar æðaþelið grær eftir víkkunaraðgerðina. Einna mest er hætta á endurþrenglsum hjá sykursjúkum, í litlum æðum og ef þrengslin eru löng og dreifð. Einnig eru þau talin líklegri hjá körlum, ef hvikull kransæðasjúkdómur er fyrir hendi, spasmi í æðinni og hjá sjúklingum sem reykja (18,37). Endurþrengsli virðast líka algengari efst í framveggskvísl vinstri kransæðar, við kransæðaop, í bláæðagræðlingum og ef æðin var áður alveg lokuð (38,39). Reynt hefur verið að hafa áhrif á þróun endurþrengsla með ýmsum lyfjum án sérlegs árangurs (38). Blóðfitulækkandi lyfið próbubúkól var gefið í rannsókn sem sýndi nokkurn árangur en lyfið hefur samt ekki fest sig í sessi og áhrif E-vítamíns til að minnka endurþrengsli hafa ekki sannast (40). Statínlyf hafa í nokkrum minni rannsóknum verið talin minnka líkur á endurþrengslum en stærri rannsóknir hafa ekki staðfest þetta (15). Unnið er að ítarlegri rannsóknum á örvefsmyndun eftir kransæðavíkkun og hér á landi er verið að kanna áhrif lyfsins tranilast á endurþrengsli með þátttöku í fjölþjóðarannsókn sem kallast PRESTO (41). Undanfarið hefur einnig farið fram þróun á staðbundinni geislameðferð inni í kransæðunum, sem minnkar örvefsmyndun í æðaveggnum og hægt er að beita samhliða víkkun. Vonir standa til að unnt verði að einfalda þessa aðferð og gera hana öruggari og minnka þannig líkur á endurþrengslum eftir víkkunaraðgerð (42).
Önnur tækni við kransæðavíkkanir: Af öðrum tækninýjungum við kransæðavíkkanir sem beitt hefur verið hér á landi má nefna æðaborun (rotablation). Þá er leggur með demantsbor á endanum færður eftir stýrivír í gegnum kransæðaþrengslin og holrúm æðarinnar borað upp. Notkunarsvið borunar er einkum á kalkaðar æðar, við löng og óregluleg þrengsli, í þrengslum við kransæðaop og á endurþrengsli í stoðneti (7). Í völdum tilfellum hefur verið reynt að skafa æðakölkunarskellur innan úr kransæðum (atherectomy) en þeirri aðferð hefur ekki verið beitt á Landspítalanum og notkun hennar erlendis minnkaði með tilkomu stoðneta (5,6). Reynt hefur verið að þróa sérstaka leysimeðferð til þess að opna erfið þrengsli eða jafnvel æðar sem hafa lokast. Svokallaður excimer-leysir hefur verið einna mest notaður, en í samanburðarrannsóknum hefur þessi aðferð þó ekki gefið þann árangur sem vonast var eftir þó hún kunni að henta við vissar aðstæður (8). Segar eru algengir í kransæðum hjá sjúklingum með bráð kransæðaeinkenni og valda oft tæknilegum örðugleikum og auka líkur á fylgikvillum í víkkunaraðgerð. Sérstök tæki hafa verið hönnuð til að soga sega úr kransæðum (Angiojet®) og gefið góða raun í rannsóknum (43). Smásegar geta losnað við kransæðavíkkun og borist lengra út í smáæðar kransæðarinnar, truflað blóðflæði og skemmt hjartavöðva. Eins konar segahlífar, til að setja inn í kransæðar, hafa verið hannaðar til að grípa smásega við víkkunaraðgerð og minnka þannig líkur á blóðflæðistruflun og smádrepi, en þessi tækni er enn í þróun (44).
Innanæðaómun er athyglisverð nýjung sem tekin hefur verið í notkun á Landspítalanum, en þá er fíngerður ómleggur þræddur inn í kransæðina eftir stýrivír. Kransæðaómun sýnir ekki aðeins holrúm æðarinnar heldur einnig útlit æðaveggsins og lög hans sem ekki sjást við venjulega kransæðamynd, sem aðeins er röntgenskuggamynd af holrúmi æðarinnar. Innanæðaómun bætir mat á þrengslum og æðakölkunarskellum, leiðbeinir við val á þeirri tækni sem beita á til viðgerðar á æðinni, auðveldar mat á fylgikvillum við kransæðavíkkun og gefur nákvæmar upplýsingar um hvort stoðnet er nægjanlega vel þanið (45,46).
Lyfjameðferð við kransæðavíkkanir: Samhliða þróun í kransæðavíkkunum hefur einnig orðið breyting á lyfjameðferð. Áður var beitt mun öflugri blóðþynningarmeðferð, einkum við stoðnetsísetningar. Var það gert til þess að minnka líkur á að segamyndun yrði í stoðneti og stíflaði þannig æðina. Kröftug blóðþynningarmeðferð gat leitt til fylgikvilla, einkum alvarlegrar blæðingar frá stungustað á náraslagæð, og leiddi á árum áður venjulega til sjúkrahúsdvalar í fimm til sex daga eftir víkkunaraðgerð. Með notkun nýrra blóðflöguhamlandi lyfja sem minnka verulega líkur á segamyndun í stoðnet er hægt að minnka og einfalda blóðþynningarmeðferð og stytta legutíma sjúklinga svo nú fara flestir þeirra heim daginn eftir kransæðavíkkun (47). Grunnlyf sem allir sjúklingar eftir víkkunarðgerð nota er asetýlsalisýlsýra (Magnýl®) um óákveðinn tíma, en þeir sem fá stoðnet nota að auki önnur kröftugri blóðflöguhamlandi lyf í um þrjár vikur eftir aðgerð. Áður var tíklópidín (Ticlid®) notað, en lyfið gaf alloft aukaverkanir, einkum húðútbrot, en einnig er möguleiki á alvarlegri hvítkornafæð og fækkun blóðflagna við lengri notkun lyfsins. Því hefur nýrra afbrigði af þessum lyfjaflokki, klópídógrel (Plavix®), nýlega verið tekið í notkun en góð verkun þess hefur verið staðfest í samanburðarrannsóknum og aukaverkanir eru mun fátíðari (48). Ef upp koma bráð vandamál við kransæðavíkkun, til dæmis hætta á segamyndun í æð eða stoðneti, er í aðgerð hægt að gefa beint í æð blóðflöguhamlandi lyfið abciximab sem virkar tiltölulega skjótt. Notkun þessa lyfs hefur í nýlegum rannsóknum (EPIC, EPILOG, EPISTENT) verulega aukið öryggi þeirra sjúklinga sem koma í kransæðavíkkun með bráð kransæðaeinkenni eða hjartadrep, og einnig við valdar víkkunaraðgerðir (49-51). Þetta hefur verið ítarlegra staðfest í ADMIRAL rannsókninni frá Frakklandi þar sem 300 sjúklingum með bráða kransæðastíflu var slembiraðað í hópa sem fengu abciximab eða lyfleysu, gefið í neyðarbíl, á bráðamóttöku eða þræðingarstofu (52). Síðan var gerð kransæðavíkkun með eða án ísetningar stoðnets. Þeir sem fengu abciximab reyndust vera með betra blóðflæði í stífluðu kransæðinni sólarhring síðar og hærra útstreymisbrot á vinstri slegli. Besti árangurinn fékkst hjá þeim sem bæði fengu stoðnet og abciximab. Þrjátíu dögum eftir aðgerð voru einnig minni líkur á dauða, endurstíflu og nýrri kransæðaviðgerð, bæði hjá þeim sem fóru í venjulega víkkun eða fengu stoðnet. Abciximab getur hugsanlega líka bætt meðferðarárangur í samspili við segaleysandi meðferð hjá sjúklingum með bráða kransæðastíflu og er unnið að stórri fjölþjóðlegri rannsókn á því sviði (GUSTO IV) (53).
Lokaorð
Þróun kransæðavíkkunaraðgerða hefur verið byltingarkennd undanfarna tvo áratugi. Tíðni þessara aðgerða hérlendis er há miðað við fólksfjölda, árangur hefur verið góður og jafnan kappkostað að taka nýjungar í tækni og lyfjameðferð í notkun þegar þær hafa sannað sig í erlendum rannsóknum. Kransæðavíkkanir eru sérhæfðar hátækniaðgerðir sem eiga eftir að þróast enn frekar á næstu öld. Aukin tækni, reynsla og framfarir í meðferð hafa orðið til þess að sá sjúklingahópur sem gagn hefur af kransæðavíkkun fer ört vaxandi. Mikilvægt er að búið sé vel að þessari meðferð hér á landi og vinnubrögð samhæfð.Heimildir
1. Grüentzig AR. Transluminal dilatation of coronary artery stenosis [letter to editor]. Lancet 1978; 1: 263.2. Myler RK, Stertzer SH. Coronary and peripheral angioplasty: historical perspective. In: Topol EJ, ed. Textbook of interventional cardiology. London: WB Saunders Company; 1990: 187-98.
3. Altmann DB, Racz M, Battleman DS, Bergman G, Spokojny A, Hannan EL, et al. Reduction in angioplasty complications after the introduction of coronary stents: results from a consecutive series of 2242 patients. Am Heart J 1996; 132: 503-7.
4. Eeckhout E, Wijns W, Meier B, Goy JJ. Indications for intracoronary stent placement: the European view. Eur Heart J 1999; 20: 1014-9.
5. Topol EJ, Leya F, Pinkerton CA, Withlow PL, Hofling B, Simonton CA, et al. A comparison of direct atherectomy with coronary angioplasty in patients with coronary artery disease. The CAVEAT Study Group. N Engl J Med 1993; 329: 221-7.
6. Baim DS, Cutlip DE, Sharma SK, Ho KK, Fortuna R, Schreiber TL, et al. Final results of the Balloon vs Optimal Atherectomy Trial (BOAT) [see comments]. Circulation 1998; 97: 322-31.
7. Kini A, Marmur JD, Duvvuri S, Dangas G, Choudhary S, Sharma S. Rotational atherectomy: improved procedural outcome with evolution of technique and equipment. Single-center results of first 1,000 patients. Cathet Cardiovasc Intervent 1999; 46: 305-11.
8. Stone GW, de Marchena E, Dageforde D, Foschi A, Muhlestein JB, McIvor M, et al. Prospective, randomized, multicenter comparison of laser facilitated balloon angioplasty versus stand-alone balloon angioplasty in patients with obstructive coronary artery disease. The Laser Angioplasty Versus Angioplasty (LAVA) Trial Investigators. J Am Coll Cardiol 1997; 30: 1714-21.
9. Safian RD, Freed M. Overview of interventional devices. In: Freed M, Grines C, Safian RD, eds. The new Manual of Interventional Cardiology. Birmingham, Michigan: Physicians' Press; 1996: 195-215.
10. Windecker S, Maier-Rudolph W, Bonzel T, Heyndrickx G, Lablanche JM, Morice MC, et al. Interventional Cardiology in Europe 1995. Eur Heart J 1999 20: 484-95.
11. Henderson RA, Pocock SJ, Sharp J, Nanchahal K, Sculpher MJ, Buxton MJ. Long-term results of RITA-I trial: clinical and cost comparison of coronary angioplasty on coronary bypass surgery grafting. Randomised Intervention for Treatment of Angina. Lancet 1998; 352: 1419-25.
12. The BARI Investigators. Comparison of coronary bypass surgery with angioplasty in patients with multivessel disease. N Engl J Med 1996; 335: 217-25.
13. Stein B, Weintraub WS, Gebhart SP, Cohen-Bernstein CL, Grosswald R, Liberman HA, et al. Influence of diabetes mellitus on early and late outcome after percutaneous transluminal coronary angioplasty. Circulation. 1995; 91: 979-89.
14. Kurbaan AS, Bowker TJ, Ilsley CD, Rickards AF. Impact of postangioplasty restenosis on comparison of outcome between angioplasty and bypass grafting: CABRI investigators. Am J Cardiol 1998; 82: 272-6.
15. DeFeyter PJ. Lipids and coronary restenosis: an elusive link [editorial]. Eur Heart J 1999; 20: 1371-4.
16. Van den Brand MJBM, Nreeman A, Rensing B, Boersma E, van den Heuvel P, Penn I, et al. Comparison of the extent of revascularization and event free survival in the angioplasty arms of two randomized trials of coronary angioplasty versus surgery for multivessel coronary artery disease [abstract]. Eur Heart J 1999; 20/Suppl.: 153.
17. Van Belle E, Bauters C, Hubert E, Bodrt JC, Abolmaalik K, Meurice T, et al. Restenosis rates in diabetic patients:a comparison of coronary stenting and balloon angioplasty in native coronary vessels [see comments]. Circulation 1997; 96: 1454-60.
18. Kornowski R, Mintz GS, Kent KM, Pichard AD, Satler LF, Bucher TA, et al. Increased restenosis in diabetes mellitus after coronary interventions is due to exaggerated intimal hyperplasia. A serial intravascular ultrasound study. Circulation 1997; 95: 1366-9.
19. Gum PA, O'Keefe JH, Jr., Borkon AM, Spertus JA, Bateman TM, McGraw JP, et al. Bypass surgery versus coronary angioplasty for revascularization of treated diabetic patients. Circulation 1997; 96/Suppl. 9: II-7-10.
20. The TIMI IIIB Investigators. Effects of tissue plasminogen activator and a comparison of early invasive and conservative strategies in unstable angina and non-Q-Wave myocardial infarction: Results of the TIMI IIIB trial. Circulation 1994; 89: 1545-56.
21. Boden WE, O'Rourke RA, Crawford MH, Blaustein AS, Deedwania PC, Zoble RG, et al. Outcomes in patients with acute non-Q-wave myocardial infarction randomly assigned to an invasive as compared with a conservative management strategy. Veterans Affairs Non-Q-Wave Infarction Strategies in Hospital (VANQWISH) Trial Investigators [see comments]. N Engl J Med 1998; 338: 1785-92.
22. FRISC II Investigators. Invasive compared with non-invasive treatment in unstable coronary-artery disease: FRISC II prospective randomised multicentre study. Lancet 1999; 354: 708-15.
23. Michels KB, Yusuf S. Does PTCA in acute myocardial infarction affect mortality and reinfarction rates? A quantitative overview (meta-analysis) of the randomized clinical trials. Circulation 1995; 91: 476-85.
24. A clinical trial comparing primary coronary angioplasty with tissue plasminogen activator for acute myocardial infarction. The Global Use of Strategies to Open Occluded Coronary Arteries in Acute Coronary Syndromes (GUSTO IIb) Angioplasty Substudy Investigators [published erratum appears in N Engl J Med 1997; 337: 287] [see comments]. N Engl J Med 336: 1621-8.
25. Zijlstra F, Hoorntje JCA, de Boer M-J, Reiffers S, Miedema K, Ottervanger JP, et al. Long-term benefit of primary angioplasty as compared with thrombolytic therapy for acute myocardial infarction. N Engl J Med 1999; 341: 1413-9.
26. Guðnason Þ, Þorgeirsson G, Eyjólfsson K, Jónmundsson EH. Tafarlaus kransæðavíkkun. Nýjung í meðferð bráðrar kransæðastíflu á Íslandi. Læknablaðið 1996; 82: 269-75.
27. van't Hof AW, Liem A, Suryapranata H, Hoorntje JC, de Boer MJ, Zijlstra F. Clinical presentation and outcome of patients with early, intermediate and late reperfusion therapy by primary coronary angioplasty for acute myocardial infarction. Eur Heart J 1998; 19: 118-23.
28. Garot J, Scherrer-Crosbie M, Monin JL, Du Pouy P, Bourachot ML, Teiger E, et al. Effect of delayed percutaneous transluminal coronary angioplasty of occluded coronary arteries after acute myocardial infarction. Am J Cardiol 1996; 77: 915-21.
29. Stone GW, Brodie BR, Griffin JJ, Costantini C, Morice MC, St. Goar FG, et al. Clinical and angiographic follow-up after primary stenting in acute myocardial infarction: the Primary Angioplasty in Myocardial Infarction (PAMI) stent pilot trial. Circulation 1999; 99: 1548-54.
30. Brener SJ, Barr LA, Burchenal JE, Katz S, George BS, Jones AA, et al. Randomized, placebo-controlled trial of platelet glycoprotein IIb/IIIa blockade with primary angioplasty for acute myocardial infarction. ReoPro and Primary PTCA Organization and Randomized Trial (RAPPORT) Investigators. Circulation 1998; 98: 734-41.
31. Zeymer U, Neuhaus K-L. Clinical trials in acute myocardial infarction. Curr Opin Cardiol 1999; 14: 392-402.
32. Popma JJ, Piana RN, Prpic R. Clinical trials in interventional cardiology. Curr Opin Cardiol 1999; 14: 412-8.
33. Stone GW. CADILLAC trial. Plenary Session XII. Late-breaking clinical trials. Presented at the American Heart Association 72nd Scientific Sessions, November 7-10, 1999, http://www.medscape.com
34. Maier W, Enderlin MF, Bonzel T, Danchin N, Heyndrickx G, Mühlberger V, et al. Audit and quality control in angioplasty in Europe: procedureal results of the AQUA Study 1997. Eur Heart J 1999; 20: 1261-70.
35. Erbel R, Haude M, Hopp HW, Franzen D, Rupprecht HJ, Henblein B, et al. Coronary-artery stenting compared with balloon angioplasty for restenosis after initial balloon angioplasty. Restenosis Stent Study Group [see comments]. N Engl J Med 1998; 339: 1672-8.
36. Antoniucci D, Valenti R, Santoro GM, Bolognese L, Trapani M, Cerisano G, et al. Restenosis after coronary stenting in current clinical practice. Am Heart J 1998; 135: 510-8.
37. Schwartz RS. Pathophysiology of restenosis: interaction of thrombosis, hyperplasia, and/or remodeling. Am J Cardiol 1998; 81(7A): 14E-17E.
38. Califf RM, Ohman EM, Frid DJ, Fortin DF, Mark DB, Hlatky MA, et al. Restenosis: The Clinical Issues. In: Topol EJ, ed. Textbook of Interventional Cardiology. London: WB Saunders Company; 1999: 363-94.
39. Sirnes PA, Molstad P, Myreng Y, Golf S. Predictors for restenosis after angioplasty of chronic coronary occlusions. Int J Cardiol 1998; 67: 111-8.
40. Tardif JC, Cote G, Lespèrance J, Bonrassa M, Cambert J, Doucet S, et al. Probucol and multivitamins in the prevention of restenosis after coronary angioplasty. Multivitamins and Probucol Study Group [see comments]. N Engl J Med 1997; 337: 365-72.
41. Kosuga K, Tamai H, Ueda K, Hsu YS, Ono S, Tanaka S, et al. Effectiveness of tranilast on restenosis after directional coronary atherectomy. Am Hear J 1997; 134: 7712-8.
42. Teirstein PS, Massullo V, Jani S, Russo RJ, Cloutier DA, Schatz RA, et al. Two-year follow-up after catheter-based radiotherapy to inhibit coronary restenosis [see comments]. Circulation 1999; 99: 243-7.
43. Hamburger JN, Serruys PW. Treatment of thrombus containing lesions in native coronary arteries and saphenous vein bypass grafts using the AngioJet Rapid Thrombectomy System. Herz 1997; 22: 318-21.
44. Grube E, Gerckens U, Müller R, Rowold S. The SAFE study: Multicenter evaluation of a protection catheter system for distal embolization in coronary venous bypass grafts (SVGs). Am J Cardiol 1999; 84/Suppl. 6A: 19P.
45. Yock PG, Fitzgerald PJ. Intravascular ultrasound: state of the art and future directions. Am J Cardiol 1998; 81(7A): 27E-32E.
46. Colombo A, Kobayashi Y. Intravascular ultrasound-guided PTCA [editorial comment]. Eur Heart J 1998; 19: 196-8.
47. Leon MB, Baim DS, Popma JJ, Gordon PC, Cutlip DE, Ho KKL, et al. A clinical trial comparing three antithrombotic-drug regimens after coronary stenting (STARS-trial). N Engl J Med 1998; 339: 1665-71.
48. Moussa I, Oetgen M, Roubin G, Colombo A, Wang X, Iyer S, et al. Effectiveness of clopidogrel and aspirin versus ticlopidine and aspirin in preventing stent thrombosis after coronary stent implantation. Circulation 1999; 99: 2364-6.
49. The EPIC Investigators. Use of monoclonal antibody directed against the platelet glycoprotein IIb/IIIa receptor in high-risk coronary angioplasty. N Engl J Med 1994; 330: 956-61.
50. Lincoff AM, Tcheng JE, Califf RM, Kereiakes DJ, Kelly TA, Timmis GC, et al. Sustained suppression of ischemic complications of coronary intervention by platelet GP IIb/IIIa blockade with abciximab: one-year outcome in the EPILOG trial. Evaluation in PTCA to Improve Long-term Outcome with abciximab GP IIb/IIIa blockade. Circulation 1999; 99: 1951-8.
51. EPISTENT Investigators. Randomized placebo controlled and balloon angioplasty controlled trial to assess safety of coronary stenting with use of platelet glycoprotein IIb/IIIa blockade. Lancet 1998; 352: 87-92.
52. Montalescot G. ADMIRAL study: Abciximab with PTCA and Stent in acute myocardila infarction. Late-breaking clinical trials in interventional cardiology. Presented at the American Collage of Cardiology 48th Scientific Session, March 7-10, 1999. http://www.medscape.com
53. Califf RM. Glycoprotein IIb/IIIa blockade and thrombolysis: early lessons from SPEED and GUSTO IV trials. Am Heart J 1999; 138: S12-5.