10. tbl. 111. árg. 2025
Fræðigrein
Rannsókn. Hjálparhjörtu á Íslandi 2010-2024
Greinin barst 22. júlí 2025, samþykkt til birtingar 12. september 2025
Fyrirspurnum svarar Martin Ingi Sigurðsson
Ágrip
Inngangur
Hjálparhjörtu (ventricular assist device) eru notuð í auknum mæli sem meðferðarmöguleiki hjá sjúklingum með alvarlega hjartabilun en upplýsingar skortir um fjölda, ábendingar og afdrif þessa sjúklingahóps á Íslandi.
Efniviður og aðferðir
Afturskyggn rannsókn sem náði yfir tímabilið 01.01.2010-31.12.2024. Þýðið samanstóð af einstaklingum sem höfðu fengið hjálparhjarta og verið í meðferð eða eftirliti á Íslandi fyrir eða eftir ígræðslu á hjálparhjarta. Klínískar upplýsingar fengust úr sjúkraskrá og voru skráðar breytur fyrir ígræðslu og afdrif eftir ígræðslu.
Niðurstöður
Sex einstaklingar fengu ígrætt hjálparhjarta á árunum 2010-2024, allt karlmenn. Aldursbilið á tíma ígræðslu hjálparhjarta var 17-66 ár. Ábendingarnar voru brú til hjartaígræðslu (3/6) og brú til ígræðsluhæfis (3/6). Orsakavaldar hjartabilunar voru ofþensluhjartavöðvakvilli (5/6) og blóðþurrðar hjartavöðvakvilli (1/6). Fjórir fengu vinstra hjálparhjarta og tveir fengu tvíslegla hjálparhjarta. Fjórir fóru í kjölfarið í hjartaígræðslu, einn lést með hjálparhjarta og einn var enn með hjálparhjarta þegar rannsókn lauk. Meðaltími frá ígræðslu hjálparhjarta til hjartaígræðslu var 249 dagar. Á rannsóknartímabilinu voru 1704 dagar þar sem einn eða fleiri einstaklingar voru með hjálparhjarta á Íslandi og er það 31% af rannsóknartímanum. Fjórir fylgikvillar hjá þremur sjúklingum voru skráðir á rannsóknartímabilinu, en það voru driflínusýking, sleglahraðtaktur, meltingarvegsblæðing og innanskúmsblæðing eftir yfirlið.
Ályktanir
Vel gekk að meðhöndla sjúklinga með hjálparhjarta á Íslandi og niðurstöður þessar benda til þess að ígræðsla og notkun á hjálparhjörtum sé mögulega vannýttur möguleiki sem meðferð við alvarlegri og langvinnri hjartabilun á Íslandi.
Inngangur
Hjartabilun er algengt vandamál og er algengið hjá fullorðnum á heimsvísu talið vera 1-3%.1 Tæplega 14% af sjúklingum með hjartabilun uppfylla skilgreiningu fyrir alvarlegri hjartabilun.2 Til þess að uppfylla skilgreiningu á alvarlegri hjartabilun samkvæmt klínískum leiðbeiningum frá Evrópska hjartalæknafélaginu (European Society of Cardiology) þarf einstaklingurinn að vera með öll þau skilmerki til staðar sem er lýst í töflu I, þrátt fyrir kjörlyfjameðferð við hjartabilun.3

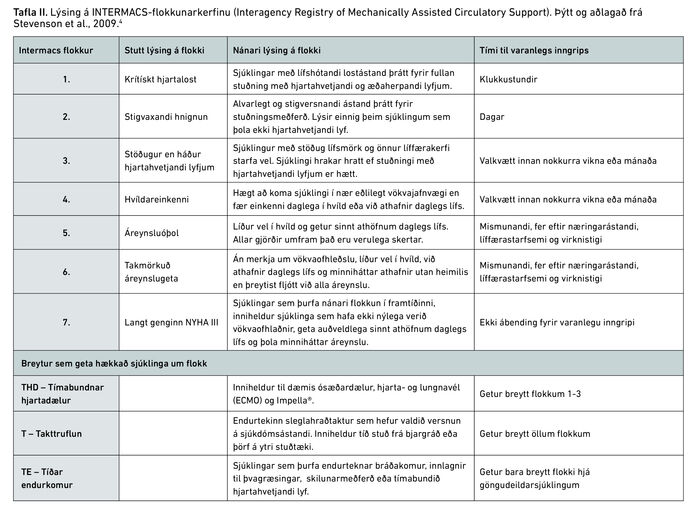
Hægt er að flokka einstaklinga með alvarlega hjartabilun enn frekar samkvæmt Interagency Registry of Mechanically Assisted Circulatory Support (INTERMACS)-flokkunarkerfinu (tafla II). Þar er sjúklingum raðað í sjö flokka eftir mælingum á dælu- og viðnámseiginleikum hjarta- og æðakerfisins, notkun hjartahvetjandi lyfja, notkun á tímabundnum hjartadælum (til dæmis hjarta- og lungnavél (ECMO) eða ósæðardælu), takttruflunum og einkennum. Í flokki eitt eru einstaklingar í hjartalosti, þrátt fyrir hækkandi skammta af hjartahvetjandi lyfjum eða notkun á tímabundum hjartadælum, sem þurfa varanlegt hjálparhjarta innan nokkurra klukkustunda, og í flokki sjö eru einstaklingar sem eru í stöðugu klínísku ástandi en gætu þurft hjartaígræðslu eða hjartadælu í framtíðinni. Flest hjálparhjörtu eru grædd í sjúklinga í flokki tvö (þeir sem versna þrátt fyrir hjartahvetjandi lyf) eða sjúklinga í flokki þrjú (þeir sem eru í stöðugu ástandi en háðir hjartahvetjandi lyfjum).4
Meðferð við alvarlegri langvinnri hjartabilun með lækkuðu útfallsbroti (HFrEF, LVEF <40%) felst í því að stilla inn lyfjameðferð með fjórum lyfjaflokkum: 1) Beta viðtaka hemlum, 2) SGLT2 (sodium-glucose cotransporter 2) hemlum, 3) saltsteraviðtaka hemlum (mineralocorticoid receptor antagonist), 4) Angíótensín-neprilysin viðtaka hemil (ARNI), angíótensín breytihvata hemil (ACEi) eða angíótensín II viðtaka hemil (ARB) ef ARNI eða ACEi þolast ekki. Notkun á þvagræsilyfjum er einnig mikilvæg til að sporna við vökvaofhleðslu.
Mikilvægt er að meðhöndla hjartsláttartruflanir, til dæmis að takt- eða hraðastilla sjúklinga sem eru í gáttatifi. Ef sjúklingur hefur fengið sleglahraðtakt sem hefur valdið óstöðugleika í blóðrásarkerfi og engar afturkræfar orsakir eru til staðar eða koma eftir meira en 48 klukkustundir í kjölfar hjartaáfalls, þá getur verið ábending fyrir bjargráðsísetningu. Sé sjúklingur í sínustakti með ósamhæfðan samdrátt á hægri og vinstri slegli, það er með greinrof, og þá sérstaklega vinstra greinrof með QRS-breidd yfir 150 ms (Class I ráðlegging) eða 130-149 ms (Class IIa ráðlegging) og útfallsbrot ≤35% þrátt fyrir hjartabilunarmeðferð, þá er ábending fyrir meðhöndlun með tvíslegla gangráð (CRT-P). Hafi sjúklingur einnig verið með hjartsláttartruflanir frá sleglum og/eða verið með ófullnægjandi svörun við hjartabilunarmeðferð er rétt að græða í sjúkling tvíslegla gangráð með bjargráð (CRT-D).3 Sömuleiðis eru sjúkdómar í hjartalokum meðhöndlaðir með skurðaðgerð eða þræðingarinngripum. Mikilvægt er að útiloka aðra viðsnúanlega þætti eins og viðvarandi blóðþurrð í hjarta, áfengismisnotkun og meðhöndla aðra fylgisjúkdóma. Dugi þessi meðferð ekki eru aðrar sértækar og meira íþyngjandi meðferðir íhugaðar, svo sem notkun hjartahvetjandi eða æðaherpandi lyfja og ígræðsla hjálparhjarta (ventricular assist device). Hluti sjúklinganna kann einnig að hafa ávinning af hjartaígræðslu og hluti þeirra getur haft gagn af notkun hjálparhjarta.5
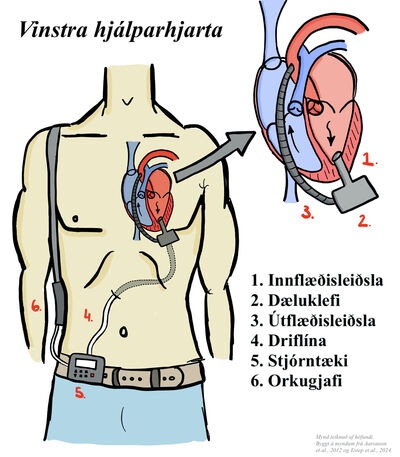
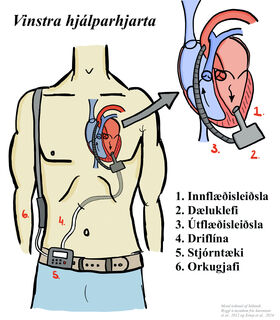
Hjálparhjörtu geta verið eins slegils dælur sem styðja við hægri eða vinstri slegilstarfsemi, eða tvíslegla dælur (til dæmis BiVAD Berlin Heart EXCOR®). Flest hjálparhjörtu í dag eru sístreymis dælur en fyrstu tegundir af hjálparhjörtum voru sláandi/sláttar (pulsatile) dælur. Algengasta tegundin af hjálparhjarta í dag er vinstra hjálparhjarta (til dæmis HeartMate 2® og HeartMate 3®). Venjulegt sístreymis vinstra hjálparhjarta samanstendur af innflæðisleiðslu, útflæðisleiðslu, dæluklefa, driflínu í gegnum húð (percutaneous driveline), stjórntæki og orkugjafa. Innflæðisleiðslan er tengd í vinstri slegilinn og við dæluklefann, út frá honum fer blóðið í gegnum útflæðisleiðsluna í rishluta ósæðarinnar. Driflínan fer frá dæluklefanum út í gegnum kviðvegginn og tengist stjórntækinu.6
Hjálparhjörtu má nýta sem meðferðarmöguleika hjá sjúklingum með lokastigs hjartabilun sem brú fram að öðrum meðferðarmöguleika eins og hjartaígræðslu. Einnig er hægt að nýta hjálparhjörtu til langtímameðferðar (destination therapy) hjá þeim sjúklingum þar sem ígræðsla er ekki heppileg.9 Í Bandaríkjunum og Kanada er langtímameðferð hjartabilunar algengasta ábendingin fyrir ígræðslu hjálparhjarta (74,4%),10 en í Evrópu er algengasta ábendingin brú til hjartaígræðslu (43,2%) og langtímameðferð hjartabilunar er ábending fyrir einungis 21,4% af einstaklingum með ígrætt hjálparhjarta.11 Jafnframt er hægt að nota hjálparhjörtu sem brú til ígræðsluhæfis þar sem notkun þeirra getur í sumum tilfellum snúið við takmarkandi þáttum eins og nýrnabilun eða hárri mótstöðu í lungnablóðrás, sem annars væru frábendingar fyrir ígræðslu.12 Í völdum tilvikum er einnig hægt að nota slíka meðferð sem brú til bata, til dæmis við hjartavöðvabólgu (myocarditis),13 eða meðgöngu- og fæðingartengdri hjartabilun (peripartum cardiomyopathy).14 Vegna tæknilegra framfara eru sjúklingar með hjálparhjarta nú í mun minni hættu á að fá fylgikvilla, einkum með tilkomu nýrrar tegundar af dælum, svo kallaðar segulmagnaðar svifdælur (HeartMate 3®), þar sem er minni snerting milli dælubúnaðarins og blóðs, þar af leiðandi minni skerspenna (shear stress) og kyrrstaða blóðs.15–17 Sjúklingar öðlast einnig aukin lífsgæði18 og upplifa minni hjartabilunareinkenni.19 Um 80% sjúklinga sem fá sístreymis vinstra hjálparhjarta lækka einkennamat sitt úr flokki III-IV niður í flokk I-II samkvæmt New York Heart Association (NYHA)-flokkun hjartabilunar á fyrstu sex mánuðum eftir ígræðslu.19
Lifun eftir ígræðslu á vinstra hjálparhjarta hefur aukist gífurlega síðustu áratugi,15,16,20 og er eins árs dánartíðni sjúklinga með hjálparhjarta sambærileg við sjúklinga sem fá hjartaígræðslu, sama hvort ábendingin sé brú til hjartaígræðslu eða langtímameðferð.21 Fimm ára lifun er þó hærri hjá þeim sjúklingum sem fá hjálparhjarta sem brú til ígræðslu (68,2%) eða brú til ígræðsluhæfis (66%) en hjá þeim sem fá hjálparhjarta sem langtímameðferð (57,3%). Lifun hjá einstaklingum yngri en 50 ára sem hafa fengið nýrri tegund dælna (segulmögnuð svifdæla, HeartMate 3®) er sérstaklega góð eða 91,6% eftir eitt ár og 72,6% eftir fimm ár.10
Algengustu fylgikvillar hjálparhjartameðferðar eru blæðing, sýking, takttruflun, slag, öndunarbilun og nýrnabilun. Aðrir mikilvægir fylgikvillar eru bilun í dælubúnaði, blóðsegamyndun í dælubúnaði,10 hægri hjartabilun22 og ósæðarlokuleki.23 Tveir algengstu fylgikvillarnir eru sýking (23% innan 90 daga, 34% eftir 90 daga) og blæðing (17% innan 90 daga og 17% eftir 90 daga). Bilun í dælubúnaði eða blóðtappi í dælunni eru nokkuð sjaldgæfir fylgikvillar (1% innan 90 daga og 5% eftir 90 daga).10 Þær sýkingar sem eru sértækar fyrir hjálparhjartað eru sýkingar í dælubúnaðinum sjálfum, samskeytum milli dælubúnaðar og hjarta- og æðakerfis, í dæluvasa og driflínusýkingar. Algengastar eru driflínusýkingar.24 Ástæðan fyrir auknum blæðingum er margþætt. Sjúklingar með sístreymisdælur eru oftast á bæði vítamín K hemli og blóðflöguhemli til að koma í veg fyrir blóðsegamyndun í dælunni en einnig verða ýmsar blóðmeinafræðilegar breytingar vegna skerspennu (shear stress) frá dælunni á blóðið, eins og áunninn von Willebrand sjúkdómur og virkjun blóðflagna.25
Nýting hjálparhjartameðferðar á Íslandi hefur ekki verið kortlögð áður. Markmið rannsóknarinnar var að kanna algengi, ábendingar og afdrif sjúklinga sem hafa fengið hjálparhjarta og verið í meðferð á Íslandi fyrir eða eftir ígræðslu hjálparhjarta.
Efniviður og aðferðir
Framkvæmd var afturskyggn rannsókn sem náði yfir tímabilið 01.01.2010-31.12.2024. Áður en gagna var aflað var fengið leyfi frá Siðanefnd vísindarannsókna (37/2024) og framkvæmdastjóra lækninga á Landspítala. Þýðið samanstóð af einstaklingum sem höfðu fengið hjálparhjarta og verið í meðferð eða eftirliti á Íslandi fyrir eða eftir ígræðslu á hjálparhjarta. Leit að einstaklingum var gerð í rafrænni sjúkraskrá Landspítala þar sem leitað var eftir ICD10 greiningarkóðanum Z95.8 (Presence of other cardiac and vascular implants and grafts). Einnig var leit að einstaklingum gerð á göngudeild hjartabilunar. Klínískar upplýsingar fengust úr rafrænni sjúkraskrá og Sögukerfi Landspítala. Eftirfarandi gögnum var safnað: Aldur, kyn, dagsetning ígræðslu, aldur við ígræðslu, ábending ígræðslu, orsakavaldur hjartabilunar, NYHA-flokkur fyrir ígræðslu, INTERMACS-flokkur fyrir ígræðslu, hámarks súrefnisupptaka fyrir ígræðslu, sjúkdómsgreiningar fyrir ígræðslu (háþrýstingur, gáttatif, blóðfituröskun), hjartabilunarlyf og skammtar þeirra fyrir ígræðslu, niðurstöður úr síðustu hjartaómskoðun fyrir ígræðslu, niðurstöður úr síðustu hægri hjartaþræðingu fyrir ígræðslu, niðurstöður úr blóðrannsóknum fyrir ígræðslu (bilirubin, INR, kreatínín, NT-proBNP), tilvist gangráðs eða bjargráðs fyrir ígræðslu, tegund hjálparhjarta, tími með hjálparhjarta, afdrif og fylgikvillar eftir ígræðslu. Þar sem gögn um fylgikvilla fyrst eftir ígræðslu á meðan einstaklingar dvöldu enn á sjúkrahúsi erlendis lágu oft ekki fyrir reyndist ekki mögulegt að birta þau og því einungis birt gögn sem eru aðgengileg í sjúkraskrá Landspítala.
Niðurstöður
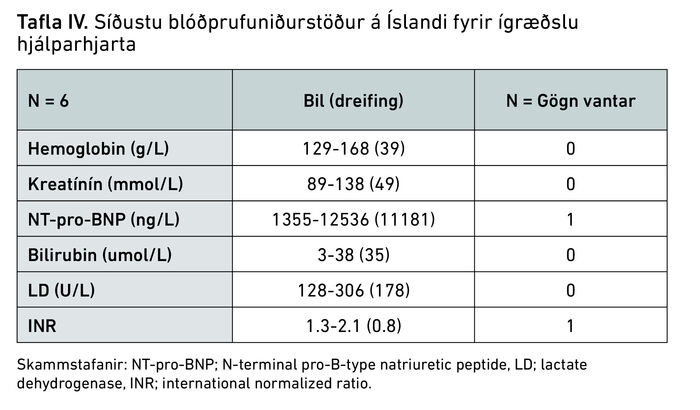
Alls fengu sex einstaklingar ígrætt hjálparhjarta á árunum 2010-2024 og voru það allt karlmenn. Aldursbil sjúklinga á tíma ígræðslu var 17-66 ár. Yfirlit yfir heilsufar sjúklinga fyrir ígræðslu á hjálparhjarta má sjá í töflu III og síðustu blóðprufuniðurstöður fyrir ígræðslu á hjálparhjarta má sjá í töflu IV.
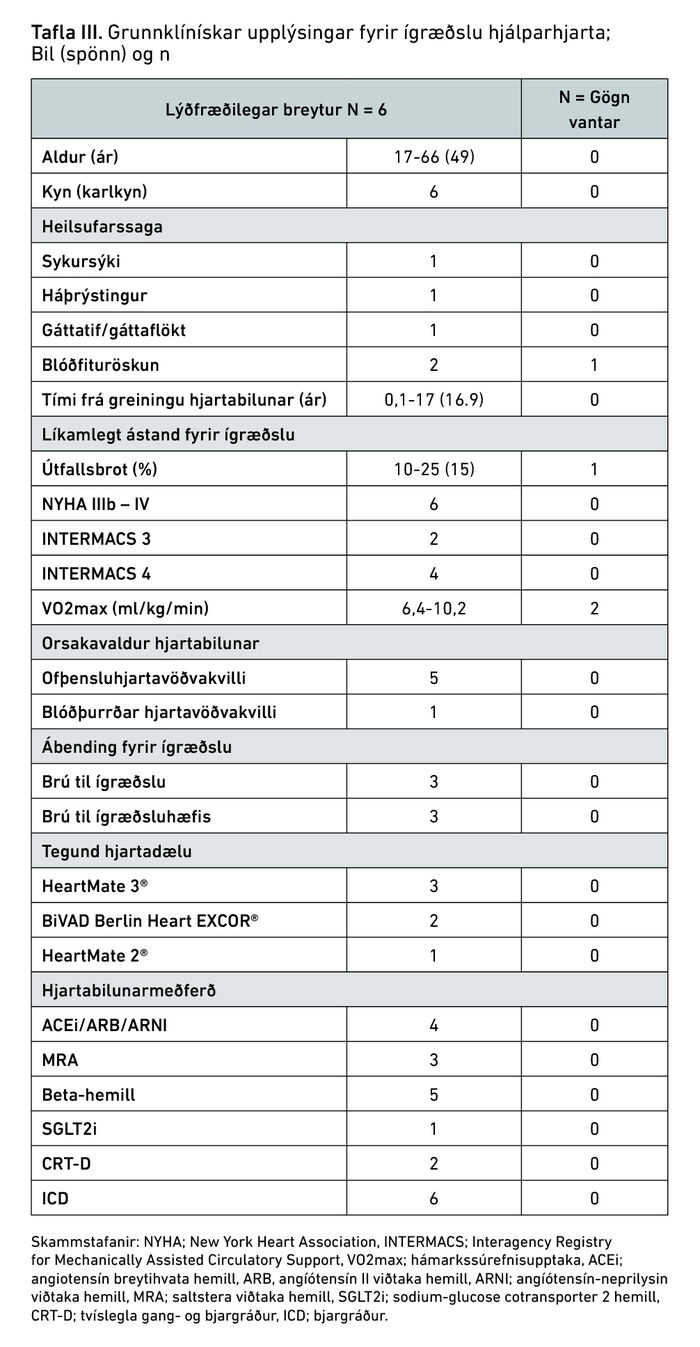
Ábendingarnar voru brú til hjartaígræðslu (3/6) og brú til ígræðsluhæfis (3/6). Ástæður hjartabilunar voru ofþensluhjartavöðvakvilli (5/6) og blóðþurrðar hjartavöðvakvilli (1/6). Almennt voru sjúklingar með skert útfallsbrot vinstri slegils (spönn 10-25%) og víkkun á vinstri slegli (spönn 6,1-9,3 cm). Hægri hjartaþræðing var framkvæmd hjá fimm sjúklingum og leiddi í ljós hækkaðan lungnafleygþrýsting og lungnaháþrýsting. Samkvæmt INTERMACS-flokkunarkerfinu voru tveir í flokki þrjú og fjórir í flokki fjögur. Fjórir fengu vinstra hjálparhjarta og tveir fengu tvíslegla hjálparhjarta. Þrír fengu HeartMate 3® dælu, tveir BiVAD Berlin Heart EXCOR® og einn HeartMate 2®.
Ekki var hægt að lýsa fylgikvillum strax eftir ígræðslu á meðan einstaklingar dvöldu erlendis þar sem gögn yfir sjúkrahúslegu erlendis voru almennt ekki skráð í sjúkraskrá Landspítala. Því eru einungis birt gögn yfir þá fylgikvilla sem gerðust á meðan einstaklingar dvöldu á Íslandi með hjálparhjarta. Fjórir einstaklingar voru meðhöndlaðir á Íslandi með hjálparhjarta meðan þeir biðu ígræðslu eða ígræðsluhæfis, en tveir komu ekki
aftur til Íslands á milli þess sem þeir fengu hjálparhjarta og fengu ígrætt hjarta eða þeir létust. Þeir sjúklingar sem komu til Íslands eftir ígræðslu á hjálparhjarta dvöldu að meðaltali 35 daga (spönn 5-72 dagar) erlendis eftir ígræðslu. Fjórir fylgikvillar voru skráðir á eftirfylgdartímanum hjá þremur sjúklingum, þrír af þeim flokkast sem alvarlegur fylgikvilli (sleglahraðtaktur, meltingarvegsblæðing og innanskúmsblæðing eftir yfirlið). Einn minniháttar fylgikvilli greindist; húðsýking í tengslum við dælubúnaðinn, sem þarfnaðist sýklalyfjameðferðar um munn.
Fjórir sjúklingar sem voru meðhöndlaðir með hjálparhjarta fóru í hjartaígræðslu í kjölfar meðferðarinnar, einn lést með hjálparhjarta og einn var enn með hjálparhjarta þegar rannsókn lauk. Meðaltími frá ígræðslu hjálparhjarta og í hjartaígræðslu var 249 dagar (spönn 90-408 dagar). Sá sem var lengst með hjálparhjarta var með það í 956 daga, og var enn með hjálparhjarta þegar eftirfylgdartímabili lauk. Á rannsóknartímabilinu voru 1704 dagar (31% af rannsóknartímanum) þar sem einn eða fleiri einstaklingar á Íslandi voru til meðferðar með hjálparhjarta.
Umræða
Á heimsvísu fá yfir 40% af sjúklingum sem fara í hjartaígræðslu hjálparhjarta sem brú til ígræðslu,26 en á Íslandi, samkvæmt nýlegri grein í Læknablaðinu, fengu 21% (5/24) hjálparhjarta fyrir hjartaígræðslu,27 sem bendir til þess að þetta sé mögulega vannýttur meðferðarmöguleiki sem brú í hjartaígræðslu. Á Íslandi á árunum 2010-2024 fengu sex einstaklingar ígrætt hjálparhjarta sem gerir 0,12 ígræðslur fyrir hverja 100.000 íbúa á ári.28 Í Svíþjóð á árunum 2015-2023 voru 0,19 til 0,34 ígrædd hjálparhjörtu fyrir hverja 100.000 íbúa á ári.29,30 Ástæðan fyrir þessum mun er óljós og líklega margþætt en mögulega er þessi meðferðarmöguleiki vannýttur þar sem ígræðslur hjálparhjarta eru ekki framkvæmdar hér á landi og þar með hefur ekki fengist nægileg reynsla við notkun þeirra. Einstaklingar með hjálparhjarta þurfa sérhæft eftirlit og því er mikilvægt að nægjanlega mikill fjöldi einstaklinga með hjálparhjarta séu staddir á Íslandi hverju sinni til að viðhalda þekkingu og reynslu, þó heilbrigðisstarfsmenn afli sér hennar upphaflega erlendis. Þessi rannsókn sýnir þó fram á að á árunum 2010-2024, eða 31% af rannsóknartímabilinu (1704 dagar), voru einn eða fleiri einstaklingar á Íslandi með hjálparhjarta.
Ef horft er til ábendinga fyrir ígræðslu fékk enginn hjálparhjarta sem langtímameðferð í rannsókninni. Í Bandaríkjunum og Kanada er langtímameðferð hjartabilunar algengasta ábendingin fyrir ígræðslu hjálparhjarta (74,4%), á meðan aðeins 16,2% fá hjálparhjarta sem brú í hjartaígræðslu og 7,5% sem brú til ígræðsluhæfis.10 Í Evrópu fá 21,4% hjálparhjarta sem langtímameðferð, 43,2% sem brú til hjartaígræðslu og 29,9% sem brú til ígræðsluhæfis.11 Þetta sýnir að í Evrópu, Bandaríkjunum og Kanada eru hjálparhjörtu notuð í miklu magni sem meðferðarmöguleiki hjá sjúklingum með lokastigs hjartabilun með frábendingu fyrir hjartaígræðslu, en sýnt hefur verið fram á lengri lifun hjá þeim sem fá hjálparhjarta með lokastigs hjartabilun og frábendingu fyrir hjartaígræðslu þegar borið er saman við þá sem fá bestu mögulegu lyfjameðferð.31,32 Þessi hlutfallslegi mikli munur milli Bandaríkjanna og Evrópu skýrist líklega af því að ekki hafa öll lönd í Evrópu samþykkt notkun á hjálparhjörtum sem langtímameðferð.33
Af þeim fjórum sjúklingum sem fengu vinstra hjálparhjarta voru tveir í INTERMACS-flokki þrjú og tveir í flokki fjögur, enginn var í flokki eitt eða tvö. Í Evrópu, á árunum 2011 til 2020, var um helmingur sjúklinga sem fékk ígrætt vinstra hjálparhjarta í flokkum þrjú (28%) og fjögur til sjö (23-33%) en einnig var stór hluti í flokkum eitt (14-16%) og tvö (26-34%).11 Möguleg útskýring á þessu er að gríðarflókið og krefjandi getur verið að flytja svo veika sjúklinga landa á milli til aðgerðar, en sjúklingar í flokki eitt þurfa hjálparhjarta innan nokkurra klukkustunda og sjúklingar í flokki tvö innan nokkurra daga. Því er afar mikilvægt að læknar, sér í lagi á Íslandi, séu vakandi fyrir því að grípa inn í versnandi hjartabilun nægilega snemma svo hægt sé að nýta þann tímabundna glugga þar sem meðferð með hjálparhjörtum getur komið að gagni, áður en það verður of seint.
Það er áhugavert að ígræðsla tvíslegla hjálparhjarta dreifist öðruvísi milli flokka. Í Evrópu, á árunum 2011 til 2020, voru 29-71% í flokki eitt, 14-53% í flokki tvö, 14-25% í flokki þrjú og 9,4% í flokkum fjögur til sjö.11 Í þessari rannsókn voru tveir sem fengu tvíslegla hjálparhjarta og voru báðir í flokki fjögur og því í þeim flokki sem er sjaldgæfast að sjúklingar fái tvíslegla hjálparhjarta. Ástæðan fyrir því er óljós en þess ber að geta að í þessari rannsókn voru sjúklingar flokkaðir í INTERMACS-flokk áður en þeir fóru erlendis og sjúkdómsástand þeirra gæti hafa breyst áður en ígræðsla fór fram.
Allir þeir sem komu til Íslands eftir ígræðslu á hjálparhjarta fengu á endanum ígrætt hjarta eða voru enn með hjálparhjarta þegar rannsókn lauk, tveir sjúklingar komu ekki til Íslands eftir ígræðslu á hjálparhjarta þar sem þeir fóru í hjartaígræðslu eða létust á meðan þeir dvöldu enn erlendis. Viðbúið er að einhverjir fái fylgikvilla en okkar mat er að hér hafi gengið vel að greina og meðhöndla fylgikvillana og heilt yfir hafi verið vel staðið að meðferð sjúklinga með hjálparhjarta. Vegna smæðar þýðisins er þó ekki hægt að bera árangur saman við aðrar þjóðir.
Aðeins helmingur sjúklinga í rannsókninni fékk segulmagnaða svifdælu (HeartMate 3®) en eins og fram hefur komið eru fylgikvillar mun sjaldgæfari í þeim en í eldri dælunum.10 Allir þeir sjúklingar sem fá ígrætt hjálparhjarta í dag fá segulmagnaða svifdælu og því viðbúið að tíðni fylgikvilla muni lækka enn frekar.
Helstu veikleikar rannsóknarinnar voru smæð þýðisins og því erfitt að bera saman árangur og útkomur við önnur lönd. Jafnframt vantaði mikið af gögnum um sjúkrahúslegu einstaklinga strax eftir ígræðslu á meðan þeir voru enn staddir erlendis og því óljóst hvort upplýsingar um fylgikvilla strax eftir ígræðslu séu til staðar. Einnig vantaði ýmis gögn um uppvinnslu áður en einstaklingar voru sendir erlendis, sem er að sumu leyti skiljanlegt þar sem uppvinnsla á árum áður fór að stórum hluta fram erlendis. Undanfarið hafa þó leiðbeiningar um uppvinnslu þessara sjúklinga verið samræmdar á Íslandi, því sem gerist erlendis og fer uppvinnsla nú alfarið fram á Íslandi, sem er til mikilla hagsbóta fyrir þennan veika sjúklingahóp ásamt því að vera mun hagkvæmara.
Af niðurstöðum þessum og eftir samanburð við nágrannalönd okkar verður ekki annað séð en að ígræðsla og notkun á hjálparhjörtum sé mögulega vannýttur möguleiki sem meðferð við alvarlegri og langvinnri hjartabilun á Íslandi.

Mynd 1. Hefðbundið vinstra hjálparhjarta. Mynd teiknuð af höfundi, Magnúsi Ara Brynleifssyni, byggt á myndum frá Aaronson et al., 2012,7 og Estep et al.8
Heimildir
| 1.
Savarese G, Becher PM, Lund LH, et al. Global burden of heart failure: a
comprehensive and updated review of epidemiology. Cardiovasc Res.
2022;118(17):3272-87. https://doi.org/10.1093/cvr/cvac013 PMid:35150240 | ||||
| | ||||
| 2.
Dunlay SM, Roger VL, Killian JM, et al. Advanced Heart Failure
Epidemiology and Outcomes: A Population-Based Study. JACC Hear Fail.
2021;9(10):722-32. https://doi.org/10.1016/j.jchf.2021.05.009 PMid:34391736 PMCid:PMC8487916 | ||||
| | ||||
| 3.
McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the
diagnosis and treatment of acute and chronic heart failure. Eur Heart J.
2021;42(36):3599-726. https://doi.org/10.1093/eurheartj/ehab368 PMid:34447992 | ||||
| | ||||
| 4.
Stevenson LW, Pagani FD, Young JB, et al. INTERMACS Profiles of
Advanced Heart Failure: The Current Picture. J Hear Lung Transplant.
2009;28(6):535-41. https://doi.org/10.1016/j.healun.2009.02.015 PMid:19481012 | ||||
| | ||||
| 5.
Truby LK, Rogers JG. Advanced Heart Failure: Epidemiology, Diagnosis,
and Therapeutic Approaches. JACC Hear Fail. 2020;8(7):523-36. https://doi.org/10.1016/j.jchf.2020.01.014 PMid:32535126 | ||||
| | ||||
| 6.
Long B, Robertson J, Koyfman A, et al. Left ventricular assist devices
and their complications: A review for emergency clinicians. Am J Emerg
Med. 2019;37(8):1562-70. https://doi.org/10.1016/j.ajem.2019.04.050 PMid:31072684 | ||||
| | ||||
| 7.
Aaronson KD, Slaughter MS, Miller LW, et al. Use of an
intrapericardial, continuous-flow, centrifugal pump in patients awaiting
heart transplantation. Circulation. 2012;125(25):3191-200. https://doi.org/10.1161/CIRCULATIONAHA.111.058412 PMid:22619284 | ||||
| | ||||
| 8.
Estep JD, Nicoara A, Cavalcante J, et al. Recommendations for
multimodality imaging of patients with left ventricular assist devices
and temporary mechanical support: Updated recommendations from the
American Society of Echocardiography. J Am Soc Echocardiogr.
2024;37(9):820-71. https://doi.org/10.1016/j.echo.2024.06.005 PMid:39237244 | ||||
| | ||||
| 9.
Crespo-Leiro MG, Metra M, Lund LH, et al. Advanced heart failure: a
position statement of the Heart Failure Association of the European
Society of Cardiology. Eur J Heart Fail. 2018;20(11):1505-35. https://doi.org/10.1002/ejhf.1236 PMid:29806100 | ||||
| | ||||
| 10.
Jorde UP, Saeed O, Koehl D, et al. The Society of Thoracic Surgeons
Intermacs 2023 Annual Report: Focus on Magnetically Levitated Devices.
Ann Thorac Surg. 2024;117(1):33-44. https://doi.org/10.1016/j.athoracsur.2023.11.004 PMid:37944655 | ||||
| | ||||
| 11.
de By TMMH, Schoenrath F, Veen KM, et al. The European Registry for
Patients with Mechanical Circulatory Support of the European Association
for Cardio-Thoracic Surgery: third report. Eur J Cardio-thoracic Surg.
2022;62(1):ezac032. https://doi.org/10.1093/ejcts/ezac350 PMid:35748813 | ||||
| | ||||
| 12.
Shaw SM, Venkateswaran R, Rushton SN, et al. LVADs as Bridge to
Candidacy in the UK. J Hear Lung Transplant. 2018;37(4):S266. https://doi.org/10.1016/j.healun.2018.01.665 | ||||
| | ||||
| 13.
Atluri P, Ullery BW, Macarthur JW, et al. Rapid onset of fulminant
myocarditis portends a favourable prognosis and the ability to bridge
mechanical circulatory support to recovery. Eur J Cardiothorac Surg.
2013;43(2):379-82. https://doi.org/10.1093/ejcts/ezs242 PMid:22564805 | ||||
| | ||||
| 14.
Bauersachs J, Arrigo M, Hilfiker-Kleiner D, et al. Current management
of patients with severe acute peripartum cardiomyopathy: practical
guidance from the Heart Failure Association of the European Society of
Cardiology Study Group on peripartum cardiomyopathy. Eur J Heart Fail.
2016;18(9):1096-105. https://doi.org/10.1002/ejhf.586 PMid:27338866 | ||||
| | ||||
| 15.
Goldstein DJ, Meyns B, Xie R, et al. Third Annual Report From the ISHLT
Mechanically Assisted Circulatory Support Registry: A comparison of
centrifugal and axial continuous-flow left ventricular assist devices. J
Hear Lung Transplant. 2019;38(4):352-63. https://doi.org/10.1016/j.healun.2019.02.004 PMid:30945637 | ||||
| | ||||
| 16.
Mehra MR, Uriel N, Naka Y, et al. A Fully Magnetically Levitated Left
Ventricular Assist Device - Final Report. N Engl J Med.
2019;380(17):1618-27. https://doi.org/10.1056/NEJMoa1900486 PMid:30883052 | ||||
| | ||||
| 17.
Mehra MR, Goldstein DJ, Uriel N, et al. Two-Year Outcomes with a
Magnetically Levitated Cardiac Pump in Heart Failure. N Engl J Med.
2018;378(15):1386-95. https://doi.org/10.1056/NEJMoa1800866 PMid:29526139 | ||||
| | ||||
| 18.
Cowger JA, Naka Y, Aaronson KD, et al. Quality of life and functional
capacity outcomes in the MOMENTUM 3 trial at 6 months: A call for new
metrics for left ventricular assist device patients. J Hear Lung
Transplant. 2018;37(1):15-24. https://doi.org/10.1016/j.healun.2017.10.019 PMid:29153637 | ||||
| | ||||
| 19.
Rogers JG, Aaronson KD, Boyle AJ, et al. Continuous flow left
ventricular assist device improves functional capacity and quality of
life of advanced heart failure patients. J Am Coll Cardiol.
2010;55(17):1826-34. https://doi.org/10.1016/j.jacc.2009.12.052 PMid:20413033 | ||||
| | ||||
| 20.
de By TMMH, Mohacsi P, Gahl B, et al. The European Registry for
Patients with Mechanical Circulatory Support (EUROMACS) of the European
Association for Cardio-Thoracic Surgery (EACTS): Second report. Eur J
Cardiothorac Surg. 2018;53(2):309-16. https://doi.org/10.1093/ejcts/ezx320 PMid:29029117 | ||||
| | ||||
| 21.
Theochari CA, Michalopoulos G, Oikonomou EK, et al. Heart
transplantation versus left ventricular assist devices as destination
therapy or bridge to transplantation for 1-year mortality: A systematic
review and meta-analysis. Ann Cardiothorac Surg. 2018;7(1):3-11. https://doi.org/10.21037/acs.2017.09.18 PMid:29492379 PMCid:PMC5827119 | ||||
| | ||||
| 22. Argiriou M, Kolokotron SM, Sakellaridis T, et al. Right heart failure post left ventricular assist device implantation. J Thorac Dis. 2014;6 Suppl1(Suppl 1):S52-59. | ||||
| | ||||
| 23.
Jorde UP, Uriel N, Nahumi N, et al. Prevalence, significance, and
management of aortic insufficiency in continuous flow left ventricular
assist device recipients. Circ Hear Fail. 2014;7(2):310-9. https://doi.org/10.1161/CIRCHEARTFAILURE.113.000878 PMid:24415682 | ||||
| | ||||
| 24.
Hannan MM, Husain S, Mattner F, et al. Working formulation for the
standardization of definitions of infections in patients using
ventricular assist devices. J Hear Lung Transplant. 2011;30(4):375-84. https://doi.org/10.1016/j.healun.2011.01.717 PMid:21419995 | ||||
| | ||||
| 25.
Leebeek FWG, Muslem R. Bleeding in critical care associated with left
ventricular assist devices: Pathophysiology, symptoms, and management.
Hematology Am Soc Hematol Educ Program. 2019;2019(1):88-96. https://doi.org/10.1182/hematology.2019000067 PMid:31808855 PMCid:PMC6913502 | ||||
| | ||||
| 26.
Khush KK, Hsich E, Potena L, et al. The International Thoracic Organ
Transplant Registry of the International Society for Heart and Lung
Transplantation: Thirty-eighth adult heart transplantation report - 2021 https://doi.org/10.1016/j.healun.2021.07.015 PMid:34419370 PMCid:PMC10282986 | ||||
| | ||||
| Focus on recipient characteristics. J Hear Lung Transplant. 2021;40(10):1035-1049. https://doi.org/10.1016/j.healun.2021.07.015 PMid:34419370 PMCid:PMC10282986 | ||||
| | ||||
| 27.
Valgardsson AS, Hrafnkelsdóttir TJ, Kristjánsson TT, et al.
Hjartaígræðslur og hjartagjafir Íslendinga. Laeknabladid.
2022;108(11):487-92. https://doi.org/10.17992/lbl.2022.11.714 PMid:36321931 | ||||
| | ||||
| 28. Hagstofa Íslands. Mannfjöldi eftir þéttbýlisstöðum, kyni og aldri 2010-2024 [Internet]. [cited 2025 Aug 13]. Available from: http://px.hagstofa.is/pxis/pxweb/is/Ibuar/Ibuar__mannfjoldi__2_byggdir__Byggdakjarnar/MAN03105.px/ | ||||
| | ||||
| 29. Sweden S. Sweden's population in summary 1960-2024 [Internet]. [cited 2025 Aug 13]. Available from: https://www.scb.se/en/finding-statistics/statistics-by-subject-area/population-and-living-conditions/population-composition-and-development/population-statistics/pong/tables-and-graphs/population-statistics---summary/swedens-population-in-summary-1960-202 | ||||
| | ||||
| 30. SWEDEHEART. Annual reports [Internet]. Uppsala Clinical Research Center. [cited 2025 Aug 13]. Available from: https://www.ucr.uu.se/swedeheart/dokument-sh/arsrapporter-sh/arsrapporter-sh-aldre | ||||
| | ||||
| 31.
Rose EA, Gelijns AC, Moskowitz AJ, et al. Long-term use of a left
ventricular assist device for end-stage heart failure. N Engl J Med.
2001;345(20):1435-43. https://doi.org/10.1056/NEJMoa012175 PMid:11794191 | ||||
| | ||||
| 32.
Rogers JG, Butler J, Lansman SL, et al. Chronic mechanical circulatory
support for inotrope-dependent heart failure patients who are not
transplant candidates: Results of the INTrEPID Trial. J Am Coll Cardiol.
2007;50(8):741-7. https://doi.org/10.1016/j.jacc.2007.03.063 PMid:17707178 | ||||
| | ||||
| 33.
Karason K, Lund LH, Dalén M, et al. Randomized trial of a left
ventricular assist device as destination therapy versus
guideline-directed medical therapy in patients with advanced heart
failure. Rationale and design of the SWEdish evaluation of left
Ventricular Assist Device (SweVAD) trial. Eur J Heart Fail.
2020;22(4):739-50. https://doi.org/10.1002/ejhf.1773 PMid:32100946 | ||||