0708. tbl. 111. árg. 2025
Fræðigrein
Yfirlitsgrein. Úlfur í sauðargæru – birtingarmynd og fjölbreytileiki aukaverkana með ónæmisörvandi krabbameinslyfjameðferð
doi 10.17992/lbl.2025.0708.849
Fyrirspurnum svarar Sigurdís Haraldsdóttir, sigurdih@landspitali.is
Greinin barst 8. september 2024, samþykkt 21. maí 2025
Ágrip
Tilkoma ónæmisörvandi meðferðar, þá sérstaklega varðstöðvahemla, hefur leitt til framfara í meðferð krabbameina með því að auka hæfni ónæmiskerfisins til að bera kennsl og ráðast á krabbameinsfrumur. Hins vegar geta þessi lyf leitt til aukaverkana sem krefjast sérstakrar meðferðar vegna mögulegra áhrifa á mörg líffærakerfi. Aukaverkanirnar geta komið fram meðan á meðferð stendur eða jafnvel eftir að meðferð lýkur og haft áhrif á líffæri eins og til dæmis meltingarveg, innkirtla, lungu og lifur, og verið allt frá vægum einkennum til lífshættulegra.
Þessar aukaverkanir skera sig frá aukaverkunum af hefðbundnum krabbameinslyfjum og er því mikilvægt að greina þær snemma og meðhöndla. Meðferð með sykursterum eða öðrum ónæmisbælandi lyfjum er oft nauðsynleg til að draga úr áhrifum aukaverkana. Klínískar leiðbeiningar frá samtökunum ESMO og ASCO mæla með skipulagðri nálgun við mat og meðferð á aukaverkunum þar sem alvarleiki er stigaður, útiloka á aðrar mismunagreiningar og lagðar eru til leiðir til að laga meðferð að sjúklingi.
Læknar verða að vera á varðbergi þar sem ábendingar fyrir ónæmisörvandi meðferðir halda áfram að aukast. Seinkun aukaverkana vegna ónæmisörvandi meðferðar getur jafnvel orðið til þess að þær koma ekki fram fyrr en mánuðum eftir að meðferð er hætt, þannig að mikilvægt er að halda aukaverkunum af þessari meðferð áfram á mismunagreiningarlista yfir lengri tíma.
Inngangur
Straumhvörf hafa orðið í meðhöndlun krabbameina á síðasta áratug. Aukinn skilningur á ónæmiskerfinu hefur gert læknavísindum kleift að þróa lyf sem hjálpa ónæmiskerfinu að bera kennsl á og ráðast gegn krabbameinsfrumum.1 Í sumum tegundum krabbameina er notuð ónæmisörvandi lyfjameðferð eina og sér án þess að beita hefðbundnum frumudrepandi lyfjum, skurðaðgerð eða geislameðferð.2 Í öðrum tegundum krabbameina eru þessi lyf nýtt samhliða öðrum meðferðum.3 Sífellt fleiri ábendingar eru fyrir ónæmisörvandi meðferð við krabbameinum, þar með talið blóðkrabbameinum, og búast má við að ábendingum fyrir slíkri meðferð muni fjölga á komandi árum.3 Aukaverkanir þessara lyfja eru frábrugðnar hefðbundnum frumudrepandi lyfjum og mikilvægt er að varpa ljósi á fjölbreytta birtingarmynd þeirra. Allt frá 10-20% sjúklinga leggjast inn á spítala vegna aukaverkana af völdum einlyfjameðferðar og upp í 50-60% vegna samsettrar meðferðar með tveimur ónæmisörvandi lyfjum. Í þessari samantekt verður farið yfir þrjú sjúkratilfelli, rætt um verkunarmáta lyfjanna og farið yfir klíníska nálgun hjá sjúklingum sem leita til læknis á ónæmisörvandi lyfjum.
Sjúkratilfelli
Tilfelli I
79 ára karlmaður leitaði á göngudeild krabbameinslækninga vegna niðurgangs. Hann hafði fengið fjóra kúra af atezolizumab (PD-L1 viðtakahemill) sem formeðferð við staðbundnu vélindakrabbameini með óvirkjun á DNA-mispörunarpróteinum vegna metýleringar á MLH1-geninu (mismatch repair deficiency). Eftir fyrstu tvær lyfjagjafirnar fór að bera á lausum hægðum og eftir þriðju og fjórðu lyfjagjöfina hafði hann haft niðurgang að minnsta kosti fjórum sinnum á dag og lést um 10 kg á um það bil sex vikum. Hann var að auki lystarlaus, klínískt þurr og blóðprufa sýndi fram á of lágt kalíum. Í kjölfarið var hann lagður inn. Saursýni reyndist neikvætt fyrir helstu bakteríu- og veirumeinvöldum. Talið var að um væri að ræða ristilbólgu af gráðu 3 (G3) vegna ónæmisörvandi meðferðar og því var hafin meðferð með prednisólon 40 mg x 1-(0,5 mg/kg) um munn ásamt því að veita stuðningsmeðferð með kalíumbættu saltvatni og lóperamíði. Á fyrsta og öðrum degi meðferðar dró verulega úr niðurgangi og voru hægðir orðnar eðlilegar á degi þrjú. Ristilspeglun var ekki framkvæmd. Sterar voru trappaðir niður á fjórum vikum og atezolizumab-meðferð hafin aftur sjö vikum eftir að einkenni gengu niður án þess að niðurgangur tæki sig upp.
Tilfelli II
73 ára karlmaður með sögu um sortuæxli á stigi IIIB kom í reglubundið eftirlit á göngudeild krabbameinslækninga. Hann hafði farið í brottnám á æxlinu þremur árum áður og fékk í framhaldinu viðbótarmeðferð í eitt ár með nivolumab (PD-1 viðtakahemill). Nýlega hafði hann greinst með meinvarp í lifur ásamt því að hnútur í lunga var stækkandi milli rannsókna. Eftir samráðsfund var talið æskilegast að skipuleggja fjóra kúra af ónæmisörvandi meðferð með ipilimumab (CTLA-4 viðtakahemill) og nivolumab. Í göngudeildarviðtali eftir tvær lyfja-gjafir lýsti viðkomandi þreytu, beinverkjum ásamt kvefsækni og stöðugum vægum höfuðverk. Blóðprufa sýndi miðlægan skjaldvakabrest með lækkuðu TSH ásamt lækkuðu kortisóli og því vaknaði grunur um heiladingulsbólgu (hypophysitis). Segulómun sýndi þrútinn heiladingul og á göngudeild innkirtlalækninga var synachten-próf framkvæmt sem sýndi að grunngildi kortisóls var enn lágt en nýrnahetturnar örvuðust eðlilega, sem benti til nýtilkominnar miðlægrar bilunar. Að auki sýndi blóðprufa lágt LH, FSH og testósterón ásamt því að skjaldkirtilsprufur voru eins og fyrr var lýst. Því var talið að þrír innkirtlaöxlar að lágmarki væru vanvirkir og aukaverkunin metin af gráðu 2. Hann var meðhöndlaður með hýdrókortisóni 10 mg x1, levótýroxíni 100 mg x1 og testógel 50 mg x1. Í framhaldinu var ekki hægt að beita ónæmisörvandi meðferð vegna undirliggjandi veikinda viðkomandi.
Tilfelli III
48 ára karlmaður með sögu um tærfrumunýrnakrabbamein með meinvörpum í lungum og eitlum hafði fengið samsetta meðferð með nivolumab og ipilimumab þar til sjúkdómur var í vexti og hafði þá byrjað á marksækinni meðferð með sunitinib. Hann leitaði á bráðamóttöku þremur vikum síðar með hita og niðurgang. Hitinn og niðurgangurinn var unninn upp á bráðamóttöku með tilliti til sýkingar og sjúklingurinn lagður inn á vegum lyflækninga Landspítala. Á fjórða degi innlagnar fóru blóðlifrar að gúlpast upp úr vélinda og niðurgangurinn að dökkna. Í blóðprufu sást skyndileg lækkun á blóðflögum, úr 190/µL í 4/µL, á rúmum einum sólarhring. Ekki sást lækkun á öðrum blóðfrumulínum. Til uppvinnslu á blóðflögufæð voru rannsökuð kjarnamótefni (ANA-próf) og algengir veiruorsakavaldar eins og CMV, EBV, parvoveira B19, HIV og lifrarbólga C. Sú uppvinnsla reyndist neikvæð og sjúklingurinn svaraði ekki blóðflögugjöfum. Því var talið að um væri að ræða blóðflögufæð af sjálfsofnæmistoga og þá líklegast aukaverkun af völdum nivolumab og ipilimumab af gráðu 4. Hann fékk því sykurstera sem samsvara prednisólon 2mg/kg/dag ásamt ónæmisglóbulíni í æð (Intra-Venous Immunoglobulin, IVIG). Blóðflögur voru komnar yfir 150/µL einungis fimm dögum eftir upphaf sterameðferðarinnar og var sú meðferð tröppuð niður á 14 vikum án þess að hann fengi aftur einkenni blóðflögufæðar.
Umræða
Virkni ónæmiskerfisins undir eðlilegum kringumstæðum
Það er vel þekkt að krabbameinsfrumur safna stökkbreytingum sem valda því að gen sem stýra frumufjölgun missa tök á frumuskiptingum.4 Þannig geta krabbameinsfrumur vaxið án neikvæðra lifunarboða og tekið yfir eðlilega starfsemi annarra heilbrigðra frumna.2 Í ljósi þessara stökkbreytinga myndar krabbameinið fjölda ónæmisvaka (antigens) sem hafa ekki farið í gegnum neikvætt val við þroska T- og B-fruma og því eru ónæmisvakarnir ókunnir ónæmiskerfinu. Meðferð sem beinist að því að örva ónæmiskerfið gagnast oft vel í tilfelli sortuæxla og lungnakrabbameina sem orsakast af útfjólubláu ljósi og reykingum. Það er vegna fjölda stökkbreytinga (high tumor mutational burden) í gegnum DNA-skemmdir og því er mikill fjöldi ónæmisvaka til staðar í æxlunum. Grundvallarregla ónæmiskerfisins er að ráðast á það sem er því framandi og því ætti ónæmiskerfið að ráðast á krabbameinið samkvæmt þessari reglu. Þær meðferðir gegn krabbameinum sem komið hafa fram á sjónarsviðið síðustu ár hafa einkum beinst að ónæmis-kerfinu.2
Varðstöðvar
Til að geta eytt krabbameinsfrumum þurfa T-drápsfrumur að komast í kynni við mótefnavaka (tumor antigen presentation), fjölga sér og fá skilaboð um hvar krabbameinið sé að finna með flakkboðum (chemokine).5 Ásamt því þurfa þær að geta bundist krabbameinsfrumunni með viðeigandi viðtökum og fá skilaboð um að drepa viðkomandi frumu. Í mörgum krabbameinum verður binding milli PD-1-viðtaka á T-drápsfrumunni og PD-L1-bindils (ligand) á krabbameinsfrumunni sem sendir skilaboð um að ekki eigi að ráðast á frumuna. Á mynd 1 má sjá þennan eiginleika krabbameinsfrumna en þar að auki er þetta ómissandi eiginleiki heilbrigðra frumna svo eðlilegar frumur verði ekki fyrir barðinu á T-drápsfrumum. Því mætti segja að krabbameinsfrumur leiki á ónæmiskerfið, en PD-L1-bindillinn er gjarnan yfirtjáður í krabbameinum. Varðstöðvahemlar (immune checkpoint inhibitors) eru einstofna mótefni gegn PD-1 og PD-L1 og eru notaðir sem meðferð við krabbameinum.5 Virkni PD-1- og PD-L1-gena hefur ekki verið að fullu kortlögð en er talin mikilvæg. Músarannsóknir þar sem genin eru óvirkjuð hafa sýnt að ýmist geta komið fram vægar liðbólgur eða jafnvel hjartavöðvakvilli eftir 5-30 vikna líftíma.6
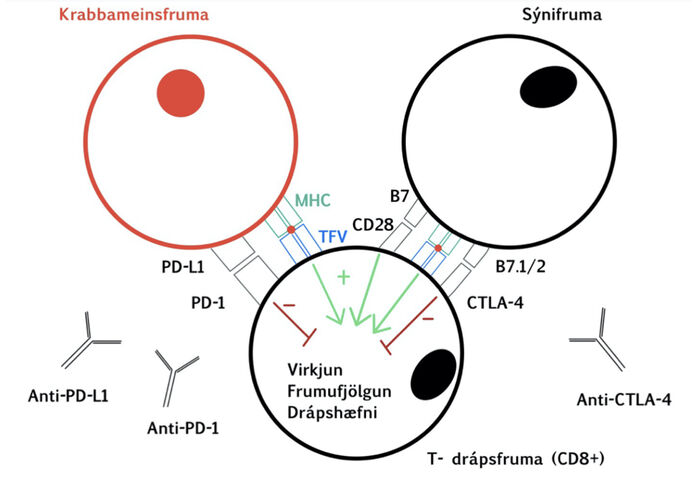
Mynd 1. Hér sést hvernig sýnifruma gefur neikvætt lifunarboð í gegnum CTLA-4-viðtaka á T-drápsfrumum með bindingu við B7-bindil á sýnifrumunni. Einnig sést hvernig krabbameinsfruma notar tengingu milli PD1-viðtaka og PD-L1-bindil til að gefa neikvætt lifunarboð til T-drápsfrumu. TFV merkir T-frumu viðtaki. MHC merkir vefjaflokkasameind (major histocompatibility complex) af flokki I (MCH class I).
Einnig er að finna bindla á yfirborði sýnifruma (antigen presenting cells) sem geta bundist sérstökum viðtökum á yfirborði T-frumna sem hafa ýmist örvandi eða hamlandi áhrif á drápshæfni T-frumunnar. Á mynd 1 má sjá hvernig T-fruma getur bundist með CD28-próteini á yfirborði sínu við B7 bindil á yfirborði sýnifrumunnar sem hvetur drápshæfni hennar. Þar að auki hefur T-fruma svokallaðan CTLA-4-viðtaka sem getur einnig bundist við B7 en þegar sú binding á sér stað dregur úr drápshæfni T-frumunnar.7 Því voru einstofna mótefni gegn CTLA-4-viðtakanum hönnuð og komu á markað 2-3 árum fyrr en PD-1 og PD-L1-hemlar og hefur slík meðferð reynst gagnlegust ef hún er notuð samsett með PD-1 eða PD-L1-hemli til dæmis í meðferð sortuæxla.8 Rannsóknir á músum þar sem genið Ctla4 hefur verið óvirkjað hafa sýnt fram á mikla fjölgun allra eitilfruma og mýs deyja úr fjölkerfabilun af völdum sjálfsónæmis á fyrstu vikum lífsins.6 Bæði CTLA-4- og PD-1-viðtakarnir eru kallaðir varðstöðvar fyrir ónæmiskerfið.
Ábendingar fyrir notkun ónæmisörvandi lyfja í krabbameinslækningum
Sífellt fleiri meðferðir eru í þróun sem miða að því að virkja ónæmiskerfið gegn eigin krabbameinsfrumum. Í ágúst 2024 voru 8 hópar ónæmisfræðilegra meðferða í boði gegn 29 tegundum krabbameina9 en einn hópur slíkra meðferða eru varðstöðvahemlar. Viðbúið er að ónæmisörvandi meðferðum muni fjölga hratt á komandi árum en einnig eru ábendingar fyrir lyfjunum að þróast. Varðstöðvahemlum hefur aðallega verið beitt í sjúkdómum með meinvörpum, í sumum ábendingum er meðferðin gefin ein sér og fyrir aðrar eru lyfin gefin með frumudrepandi lyfjameðferð. Nýlega hefur komið í ljós að í ákveðnum tegundum krabbameina geta sjúklingar haft gagn af þessari meðferð sem viðbótarmeðferð eftir aðgerð,10 en nýjustu rannsóknir sýna að enn betri áhrif virðast fást ef varðstöðvahemlar eru gefnir fyrir aðgerð þegar æxlið með sína mótefnavaka og eitilfrumur kringum æxlið ( tumor-infiltrating lymphocytes) eru til staðar.11 Því má gera ráð fyrir því að þessum meðferðum verði beitt í vaxandi mæli hjá sjúklingum sem mögulega læknast af sínu krabbameini og því er enn mikilvægara að vera á varðbergi gagnvart mögulegum ónæmisaukaverkunum á meðan á meðferð stendur og eftir meðferð. Ipilimumab var fyrst gefið sjúklingi á Íslandi árið 2013 og nivolumab fyrst árið 2015.
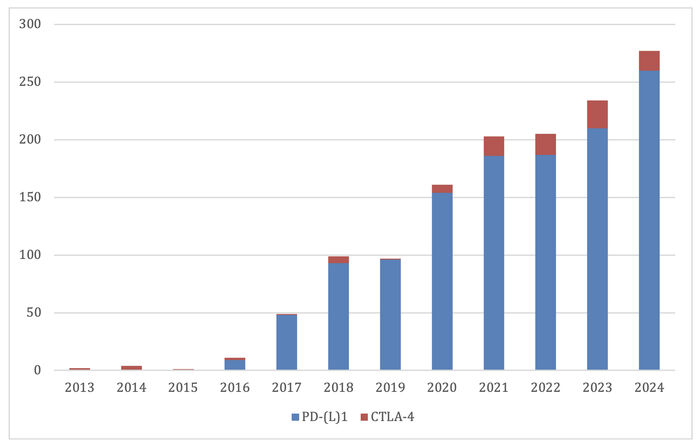
Mynd 2. Fjöldi sjúklinga sem fengu ónæmisörvandi meðferðir á Landspítala eftir ári. Gögn fengin frá Hagdeild Landspítala.
Mynd 2 sýnir árlegan fjölda sjúklinga sem fékk ónæmisörvandi meðferð en árið 2024 fór fjöldinn yfir 250, sem undirstrikar þá hröðu breytingu sem orðið hefur í meðferð krabbameinssjúkra á Vesturlöndum.
Aukaverkanir
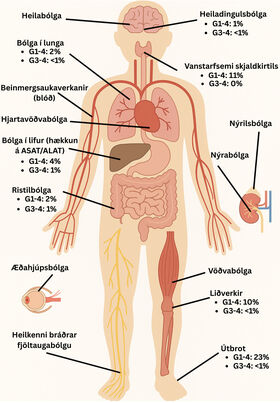
Aukaverkanir þessara lyfja eru fjölbreyttar og geta komið fram sem bólga í nánast hvaða líffæri og líffærakerfi sem er. Algengast er að aukaverkanir komi fyrir í meltingarvegi, húð, lifur, innkirtlum, liðum og lungum3 eins og endurspeglast í tilfelli I og II að framan með ristilbólgu og bólgu í heiladingli.
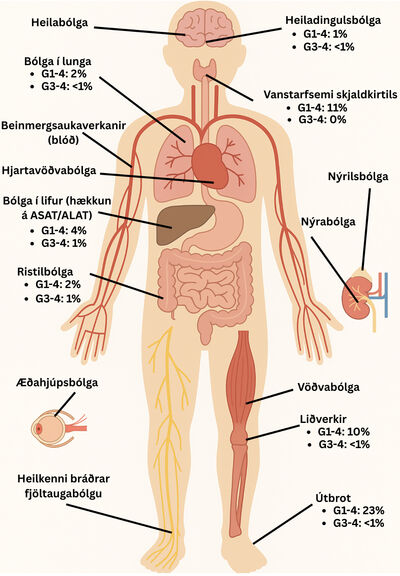 Á mynd 3 má sjá algengi aukaverkana í þessum líffærakerfum þegar PD-1-varðstöðvahemill er gefinn einn sér.12 Einnig geta aukaverkanir af völdum varðstöðvahemla komið fram hvenær sem er á meðferðinni og jafnvel mörgum mánuðum eftir að meðferð lýkur eins og lýst er í tilfelli III að framan þar sem blóðflögufæð kom fram mánuðum eftir að meðferð lauk.13 Dæmi eru um að aukaverkanir komi fram innan fárra daga en einnig eru þekkt dæmi um seinkaða tilkomu aukaverkana, jafnvel eftir að meðferð hefur verið hætt í yfir 24 mánuði. Líkur eru á að slíkum tilfellum fari fjölgandi á heimsvísu vegna þess að ábendingum fyrir ónæmisörvandi meðferð fjölgar og verið er að nýta lyfin á fyrri stigum, meðal annars sem undirbúningsmeðferð fyrir skurðaðgerð. Hvað varðar algengi aukaverkana þá fá um 10-20% sjúklinga á PD-1- eða PD-L1-hemla meðferð G3-4 aukaverkun sem leiðir til innlagnar en alvarlegar aukaverkanir eru algengari á samsettri meðferð (CTLA-4- og PD-1-hemill) þar sem um 50-60% fá G3-4 aukaverkun. Ef CTLA-4-hemill er notaður einn sér fá um 33% G3-4 aukaverkun.14 Sjúklingar með þekkta ónæmissjúkdóma, líffæraþegar og sjúklingar með krónískar veirusýkingar eru í aukinni áhættu á ónæmisaukaverkunum sem geta leitt til versnunar á undirliggjandi sjúkdómi eða líffærahöfnunar.15 Því þarf alltaf að meta mögulegan ávinning á móti áhættu meðferðar hjá hverjum og einum einstaklingi.
Á mynd 3 má sjá algengi aukaverkana í þessum líffærakerfum þegar PD-1-varðstöðvahemill er gefinn einn sér.12 Einnig geta aukaverkanir af völdum varðstöðvahemla komið fram hvenær sem er á meðferðinni og jafnvel mörgum mánuðum eftir að meðferð lýkur eins og lýst er í tilfelli III að framan þar sem blóðflögufæð kom fram mánuðum eftir að meðferð lauk.13 Dæmi eru um að aukaverkanir komi fram innan fárra daga en einnig eru þekkt dæmi um seinkaða tilkomu aukaverkana, jafnvel eftir að meðferð hefur verið hætt í yfir 24 mánuði. Líkur eru á að slíkum tilfellum fari fjölgandi á heimsvísu vegna þess að ábendingum fyrir ónæmisörvandi meðferð fjölgar og verið er að nýta lyfin á fyrri stigum, meðal annars sem undirbúningsmeðferð fyrir skurðaðgerð. Hvað varðar algengi aukaverkana þá fá um 10-20% sjúklinga á PD-1- eða PD-L1-hemla meðferð G3-4 aukaverkun sem leiðir til innlagnar en alvarlegar aukaverkanir eru algengari á samsettri meðferð (CTLA-4- og PD-1-hemill) þar sem um 50-60% fá G3-4 aukaverkun. Ef CTLA-4-hemill er notaður einn sér fá um 33% G3-4 aukaverkun.14 Sjúklingar með þekkta ónæmissjúkdóma, líffæraþegar og sjúklingar með krónískar veirusýkingar eru í aukinni áhættu á ónæmisaukaverkunum sem geta leitt til versnunar á undirliggjandi sjúkdómi eða líffærahöfnunar.15 Því þarf alltaf að meta mögulegan ávinning á móti áhættu meðferðar hjá hverjum og einum einstaklingi.
Mynd þrjú sýnir hvernig aukaverkanir vegna ónæmisörvandi lyfja geta lagst á eftirfarandi líffærakerfi: heila, skjaldkirtil, lungu, hjarta, lifur, beinmerg, meltingarveg, nýra, nýril (adrenal gland), ristil, vöðva, liði, húð, augu og úttaugakerfi (til dæmis heilkenni bráðrar fjöltaugabólgu (Guillain–Barré syndrome)). Ekki er þó um að ræða tæmandi lista. Einnig má sjá algengi aukaverkana fyrir þau líffæri þar sem algengt er að aukaverkanir komi fram. Tölurnar gilda fyrir PD-1/PD-L1-hemla sem einlyfjameðferð, en það er algengasta lyfjaskotmarkið á Íslandi, samanber mynd 2. Aukaverkanir eru stigaðar eftir gráðum, en G1 er vægasta formið og G5 er alvarlegasta formið og veldur andláti.12
Almenn uppvinnsla þeirra sem grunaðir eru um aukaverkanir
Evrópsku krabbameinslæknasamtökin (ESMO) auk Amerísku krabbameins-læknasamtakanna (ASCO) hafa gefið út leiðbeiningar, hvort í sínu lagi, um uppvinnslu og meðferð aukaverkana af völdum ónæmisörvandi lyfja, en leiðbeiningarnar eru mjög áþekkar.
Uppvinnsla og nálgun á þessum aukaverkunum má skipta upp í fjögur skref samkvæmt ESMO16:
a) Að greina og stiga alvarleika aukaverkana.
b) Útiloka aðrar mismunagreiningar til að geta hafið
meðferð með ónæmisbælandi lyfjum.
c) Velja viðeigandi lyf með tilliti til alvarleika
aukaverkana.
d) 72 klukkustunda virkt eftirlit og aðlögun á meðferð.
Þær mismunagreiningar sem þarf að útiloka eru háðar því líffærakerfi sem er einkennagefandi hverju sinni. Sem dæmi má nefna að ef sjúklingur kemur á spítala með brjóstverk og er á ónæmisörvandi lyfjum, þarf viðkomandi að fara í hefðbundna uppvinnslu á bráðu kransæðaheilkenni en auk þess þarf hjartavöðvabólga af völdum ónæmisörvandi lyfja að vera á mismunagreiningalistanum. Einnig er mikilvægt að útiloka aðrar algengar greiningar þar sem frábending væri fyrir sykursterameðferð, eins og ef um sýkingu er að ræða. Þar að auki þarf að útiloka að einkenni geti tengst öðrum lyfjum, brenglun á blóðsöltum eða aukinni dreifingu á krabbameininu. Með það í huga er greiningin oft fengin með útilokun annarra mismunagreininga en mikilvægt er að greina aukaverkanirnar snemma og hefja viðeigandi meðferð þar sem þær geta valdið ótímabæru andláti.3
Stigun alvarlegra aukaverkana er háð viðmiðunargildum fyrir það líffærakerfi sem um ræðir og byggir á National Cancer Institute Common Terminology Criteria for Adverse Events (NCI-CTCAE) kerfinu. Dæmi um það er lifrarbólga sem miðast við hækkun á ALAT og ASAT og aukaverkanir í meltingarvegi eins og niðurgangur sem miðast við fjölda hægða á sólarhring.16
Meðferð aukaverkana vegna ónæmisörvandi meðferðar fer eftir alvarleikaflokkun sem skiptist í 5 gráður. Með þeirri flokkun er hægt að að átta sig á hvernig bæla eigi ónæmissvarið og hátta áframhaldandi gjöf ónæmisörvandi lyfja eftir að einkennin ganga niður. Þessar meginreglur eru dregnar fram í töflu I.
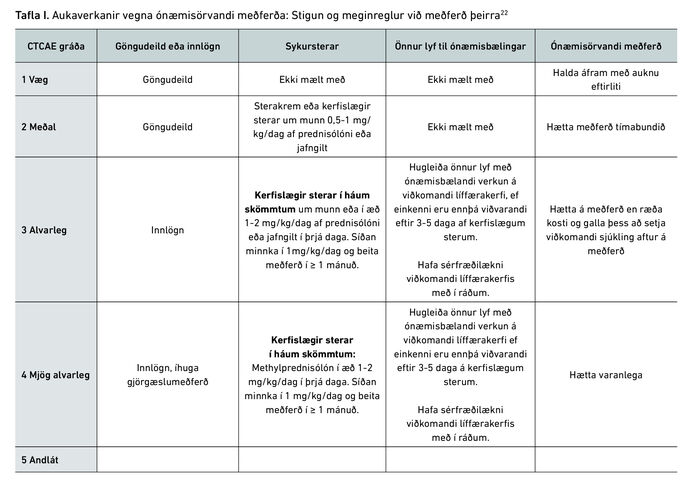
Hafa ber í huga að ef tilfellið er miðlungs til mjög alvarlegt (CTCAE gráðu 2-4) er líklegt að gjöf sykurstera sé ákjósanlegasta meðferðin. Mikilvægt er að trappa sterana ekki út hraðar en á fjórum til sex vikum, annars er hætta á endurtekinni bólgu.3 Undantekningin frá notkun stera er ef röskun verður á innkirtlakerfinu en þá er mikilvægast að gefa viðkomandi hormón ef bilun verður á framleiðslu þess.6 Í alvarlegustu tilfellunum, þegar sykursterameðferð dugar ekki til, þarf að bæta við öðrum lyfjum og í sumum tilfellum gagnast að bæta við mótefnum gegn bólguhvetjandi frumuboðefnum eins og með gjöf infliximab (TNF-a-hemill) eða tocilizumab (IL-6-viðtakahemill).16 Önnur lyf sem koma til greina ef sykursterar þykja ekki ákjósanlegir eru hefðbundin ónæmisbælandi lyf eins og mycofenólat mofetil en einnig er hægt að gefa IVIG.16 Ef sjúklingur hefur fengið alvarlegar aukaverkanir getur verið áskorun að hefja aftur meðferð með ónæmisörvandi lyfjum og þarf að meta hvert tilfelli fyrir sig. Mögulegur ávinningur er metinn á móti áhættu, en um 40% sjúklinga fá endurteknar ónæmisaukaverkanir þegar meðferð er hafin aftur, þar af fá um 75% sams konar aukaverkun, en 25% fá aðra ónæmistengda aukaverkun.16-18 Setja má þessar upplýsingar í samhengi með því að taka dæmi um hvernig viðhafa á klíníska nálgun í einu líffærakerfi.
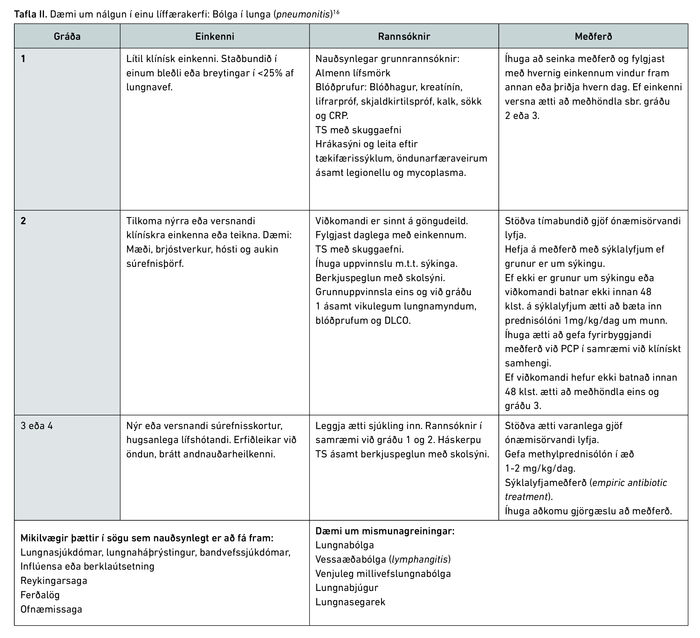
Í töflu II má sjá hvernig ákjósanlegt er að bregðast við grun um bólgu í lunga.
Banvænar aukaverkanir
Algengi banvænna aukaverkana (fatal irAEs) var lýst í safngreiningu (meta-analysis) með gögnum úr lyfjagagnagrunni Alþjóðaheilbrigðisstofnunarinnar (WHO), klínískum rannsóknum og fjölsetra klínískum sjúkraskrárupplýsingum. Algengi banvænna aukaverkana er 0,3-1,3% en þær koma yfirleitt fram hratt og því þarf að vera sérstaklega vakandi fyrir aukaverkunum fyrstu 2 mánuði eftir upphaf meðferðar. Algengasta dánarmein þeirra sem fengu banvæna aukaverkun af völdum CTLA-4-hemla var ristilbólga (70%) en fjölbreyttari orsakir voru fyrir banvænni aukaverkun af völdum PD-1/PD-L1-hemla þó algengastar séu bólga í lunga (35%) og lifur (22%). Í samsettri meðferð er algengi lífshættulegra aukaverkana hærra og er dánartíðni vegna hjartavöðvabólgu hæst allra líffærakerfa, eða um 40%. Aukaverkanir í taugakerfi, lifur, vöðvum, nýrum, beinmerg og lungum eru að auki alvarlegar og ollu andláti í um 10-17% tilfella. Einn mikilvægur áhrifaþáttur þróunar aukaverkana sem valda andláti var seinkuð greining og meðferð. Einnig reyndist hækkandi aldur vera áhættuþáttur fyrir andláti, sem kann að stafa af minnkandi getu líkamans til að bregðast við veikindum eða vegna annarra fylgisjúkdóma.19
Hugsanleg virkni á bak við aukaverkanir
Í ljósi þess að lyfin auka virkni ónæmiskerfisins með því að hamla neikvæðum boðum þess er rökrétt að þessum lyfjum fylgi aukin bólgusvörun.6 Verkunarmáti þessara aukaverkana er ekki að fullu þekktur20 en líklegt er að bólgan geti myndast með fjölbreyttum hætti. Í fyrsta lagi hefur verið sýnt fram á að T-frumur sýni virkni gegn vöðvafrumum í hjarta og geti þannig valdið hjartavöðvabólgu án þess að B-frumur eða mótefni séu til staðar í hjartanu. Sambærilegar T-frumur hafa fundist í hjarta sjúklings og í krabbameininu sem þýðir að hugsanlega geta T-frumurnar virkjast í gegnum svipaða ónæmisvaka á þessum tveimur stöðum. Í öðru lagi eru dæmi þess að eftir lyfjagjöf aukist framleiðsla á sjálfsmótefnum gegn skjaldkirtli sem veldur skjaldkirtilsbólgu. Í þriðja lagi hafa forklínískar rannsóknir sýnt fram á að meðferð með CTLA--4-viðtakahemlum geti aukið IL-17-framleiðslu og þar af leiðandi valdið ristilbólgu. Í fjórða og síðasta lagi er algengara að fá heiladingulsbólgu vegna CTLA-4-viðtakahemla samanborið við PD-1- og PD-L1-viðtakahemla, en það tengist því að -CTLA-4 er tjáð í heiladingli.20
Þessi dæmi sýna ólíka ónæmisfræðilega verkunarmáta sem leiða til aukaverkana og því getur reynst erfitt að spá fyrir um hvaða sjúklingar fá aukaverkanir af lyfjunum. Ennfremur er fram kominn fjöldi rannsókna sem sýna fram á forspárgildi þessara aukaverkana fyrir virkni meðferðar á krabbameinið, það er sjúklingar sem fá ónæmisaukaverkanir hafa oft á tíðum meira gagn af meðferðinni, í formi betri svörunar krabbameins við meðferð og lengri lifunar sjúklings.21
Lokaorð
Ljóst er að tilfellum krabbameina mun fjölga á næstu árum, fyrst og fremst vegna aldurssamsetningar þjóðarinnar. Lyf sem örva ónæmiskerfið hafa gjörbreytt meðferð krabbameina og eru notuð í auknum mæli bæði við sjúkdómi á dreifðu stigi og sem viðbótarmeðferð. Þau geta hins vegar valdið aukaverkunum í formi bólgu sem geta birst á margvíslegan hátt, bæði meðan á meðferð stendur og einnig nokkrum mánuðum eftir að meðferð lýkur. Mikilvægt er að læknar í framlínu séu meðvitaðir um verkanir og aukaverkanir þessara lyfja því skjót meðferð við þeim getur skipt sköpum.
Heimildir
| 1. Mellman I, Coukos G, Dranoff G. Cancer immunotherapy comes of age. Nature, 2011. 480(7378): p. 480-9. https://doi.org/10.1038/nature10673 PMid:22193102 PMCid:PMC3967235 |
||||
| 2. Chen DS, Mellman I, Oncology meets immunology: the cancer-immunity cycle. Immunity, 2013. 39(1):1-10. https://doi.org/10.1016/j.immuni.2013.07.012 PMid:23890059 |
||||
| 3. Schneider BJ, Santomasso BD, Adkins S, et al. Management of Immune-Related Adverse Events in Patients Treated With Immune Checkpoint Inhibitor Therapy: ASCO Guideline Update. J Clin Oncol., 2021. 39(36):64. https://doi.org/10.1200/JCO.21.01440 PMid:34724392 |
||||
| 4. Alexandrov LB, Nik-Zainal S, Wedge DC, et al. Signatures of mutational processes in human cancer. Nature, 2013. 500(7463):415-21. | ||||
| 5. Chen DS, Irving BA, Hodi FS. Molecular pathways: next-generation immunotherapy--inhibiting programmed death-ligand 1 and programmed death-1. Clin Cancer Res, 2012. 18(24):6580-7. https://doi.org/10.1158/1078-0432.CCR-12-1362 PMid:23087408 |
||||
| 6. Johnson DB, Nebhan CA, Moslehi JJ, et al. Immune-checkpoint inhibitors: long-term implications of toxicity. Nat Rev Clin Oncol, 2022. 19(4):254-267. https://doi.org/10.1038/s41571-022-00600-w PMid:35082367 PMCid:PMC8790946 |
||||
| 7. Singh PP, Sharma PK, Krishnan G, et al. Immune checkpoints and immunotherapy for colorectal cancer. Gastroenterol Rep (Oxf), 2015. 3(4):289-97. https://doi.org/10.1093/gastro/gov053 PMid:26510455 PMCid:PMC4650981 |
||||
| 8. Snyder A, Makarov V, Merghoub T, et al. Genetic basis for clinical response to CTLA-4 blockade in melanoma. N Engl J Med, 2014. 371(23):2189-2199. https://doi.org/10.1056/NEJMoa1406498 PMid:25409260 PMCid:PMC4315319 |
||||
| 9. Cancer Research Institute,. Regulatory Approval Timeline of Active Immunotherapies. 2024 29. ágúst 2024. https://www.cancerresearch.org/regulatory-approval-timeline-of--active-immunotherapies - ágúst 2024. | ||||
| 10. Forde, PM, Spicer J, Lu S, et al. Neoadjuvant Nivolumab plus Chemotherapy in Resectable Lung Cancer. N Engl J Med, 2022. 386(21):1973-1985. https://doi.org/10.1056/NEJMoa2202170 PMid:35403841 PMCid:PMC9844511 |
||||
| 11. Blank CU, Lucas MW, Scolyer RA, et al. Neoadjuvant Nivolumab and Ipilimumab in Resectable Stage III Melanoma. N Engl J Med, 2024. 391(18):1696-1708. | ||||
| 12. Wolchok JD, Chiarion-Sileni V, Gonzalez R, et al. Overall Survival with Combined Nivolumab and Ipilimumab in Advanced Melanoma. N Engl J Med, 2017. 377(14):1345-1356. https://doi.org/10.1056/NEJMoa1709684 PMid:28889792 PMCid:PMC5706778 |
||||
| 13. Couey MA, Bell RB, Patel AA, et al. Delayed immune-related events (DIRE) after discontinuation of immunotherapy: diagnostic hazard of autoimmunity at a distance. J Immunother Cancer, 2019. 7(1):165. https://doi.org/10.1186/s40425-019-0645-6 PMid:31269983 PMCid:PMC6609357 |
||||
| 14. Larkin J, Chiarion-Sileni V, Gonzalez R, et al. Combined Nivolumab and Ipilimumab or Monotherapy in Untreated Melanoma. N Engl J Med, 2015. 373(1):23-34. https://doi.org/10.1056/NEJMoa1504030 PMid:26027431 PMCid:PMC5698905 |
||||
| 15. Johnson DB, Sullivan RJ, Menzies AM, Immune checkpoint inhibitors in challenging populations. Cancer, 2017. 123(11):1904-1911. https://doi.org/10.1002/cncr.30642 PMid:28241095 PMCid:PMC5445005 |
||||
| 16. Haanen J, Obeid M, Spain L, et al. Management of toxicities from immunotherapy: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol, 2022. 33(12):1217-1238. https://doi.org/10.1016/j.annonc.2022.10.001 PMid:36270461 |
||||
| 17. Allouchery M, Lombard T, Martin M, et al. Safety of immune checkpoint inhibitor rechallenge after discontinuation for grade ≥/=2 immune-related adverse events in patients with cancer. J Immunother Cancer, 2020. 8(2):e001622. https://doi.org/10.1136/jitc-2020-001622 PMid:33428586 PMCid:PMC7768965 |
||||
| 18. Liu SJ, Jan LJ, Wang HC, et al. Safety, efficacy, and survival outcomes of immune checkpoint inhibitors rechallenge in patients with cancer: a systematic review and meta-analysis. Oncologist, 2024. 29(11):e1425-e1434. https://doi.org/10.1093/oncolo/oyae134 PMid:38940446 PMCid:PMC11546642 |
||||
| 19. Wang DY, Salem JE, Cohen JV, et al. Fatal Toxic Effects Associated With Immune Checkpoint Inhibitors: A Systematic Review and Meta-analysis. JAMA Oncol, 2018. 4(12):1721-1728. | ||||
| 20. Postow MA, Sidlow R, Hellmann MD, Immune-Related Adverse Events Associated with Immune Checkpoint Blockade. N Engl J Med, 2018. 378(2):158-168. https://doi.org/10.1056/NEJMra1703481 PMid:29320654 |
||||
| 21. Das S, Johnson DB, Immune-related adverse events and anti-tumor efficacy of immune checkpoint inhibitors. J Immunother Cancer, 2019. 7(1):306. https://doi.org/10.1186/s40425-019-0805-8 PMid:31730012 PMCid:PMC6858629 |
||||
| 22. Champiat S, Lambotte O, Barreau E, et al. Management of immune checkpoint blockade dysimmune toxicities: a collaborative position paper. Ann Oncol, 2016. 27(4):559-74. https://doi.org/10.1093/annonc/mdv623 PMid:26715621 |
||||