04. tbl. 111. árg. 2025
Fræðigrein
Rannsókn. Clostridioides difficile iðrasýkingar á Landspítala 2017-2022
Greinin barst 6. desember 2024, samþykkt til birtingar 14. febrúar 2025
Ágrip
Tilgangur
Að kanna faraldsfræði, alvarleika, meðferð og horfur sjúklinga með Clostridioides difficile iðrasýkingar (CDI) sem greindust á Landspítala árabilið 2017-2022.
Efniviður og aðferðir
Rannsóknarþýðið voru fullorðnir sjúklingar á Landspítala með tvíjákvæð (PCR + ELISA) greiningarpróf. Ef sami sjúklingur var með tvö eða fleiri jákvæð sýni innan 28 daga tímabils voru seinni sýnin talin endurspegla sömu sýkingu.
Niðurstöður
Alls greindust 358 sýkingar hjá 301 sjúklingi. Meiri hluti sýkinga greindist meðal kvenna (59,5%). Meðalnýgengi heilbrigðistengdra CDI á tímabilinu var 3,23 sýkingar/10.000 legudagar á vefrænum deildum Landspítala. Nýgengi samfélagstengdra CDI var 0,57 sýkingar/10.000 íbúa höfuðborgarsvæðisins. Nýgengið fylgdi hækkandi aldri og hélst svipað í gegnum rannsóknartímabilið. Endursýkingar greindust hjá 15,3% og meðaleftirfylgnitími var 1,6 persónuár. Að minnsta kosti 85,5% sjúklinga höfðu tekið sýklalyf innan mánaðar fyrir greiningu og höfðu flestir tekið lyf af flokki penicillína (57,8%) og þar á eftir úr flokki cefalósporína (51,5%). Ríflega helmingur sjúklinga (54,7%) hafði notað prótónupumpuhemla áður en sýkingin greindist. Algengasta upphafsmeðferð við CDI var metrónídazól (63,0%). Af þeim hópi þurftu 29,4% á frekari meðferð að halda innan 28 daga frá upphafi meðferðar. Hægðaflóruflutningur var framkvæmdur í 13 tilfellum. Heildardánartíðni innan 30 daga frá greiningu var 7,3%.
Ályktanir
Nýgengi C. difficile iðrasýkinga á Landspítala hélst stöðugt yfir rannsóknartímabilið og var sambærilegt og á sjúkrahúsum í Evrópu. Flestir þeirra sem sýktust höfðu einn eða fleiri áhættuþátt. Flestir fengu meðferð með sýklalyfjum og var metrónídazól þar algengast. Niðurstöður þessarar rannsóknar benda til að nýgengi sýkingarinnar sé stöðugt og birtingarmynd hennar hafi lítið breyst, en nýir meðferðarmöguleikar lofa góðu.
Inngangur
Sýkillinn Clostridioides difficile (áður Clostridium difficile) er ein helsta orsök spítalatengdra iðrasýkinga á Vesturlöndum. Rannsóknir hafa sýnt fram á talsverða umframdánartíðni og lengingu á spítalalegu af hennar völdum ásamt háum en þó nokkuð breytilegum umframkostnaði sem rekja má til sýkinganna og valda þær því miklu viðbótarálagi á heilbrigðisþjónustu víða um heim.1-5
Klínísk birtingarmynd C. difficile iðrasýkinga (CDI) er gríðarlega fjölbreytt og geta einkenni verið allt frá vægum vatnskenndum niðurgangi yfir í svæsna garna- og ristilbólgu sem getur leitt til dauða.6,7,8 Helsti áhættuþáttur CDI er sýklalyfjanotkun, sem leiðir til röskunar á örveruflóru og getur skapað umhverfi sem gerir bakteríunni kleift að fjölga sér og framleiða úteitrin toxin A og toxin B, sem valda eyðileggingu á þekjufrumum og ristilbólgu í kjölfarið.7,9 Sum sýklalyf eru líklegri til þess að leiða til CDI en önnur. Hins vegar hefur verið sýnt fram á að nánast öll sýklalyf geta stuðlað að sýkingu.10,11 Aðrir þekktir áhættuþættir sýkingar eru nýleg spítaladvöl, hærri aldur og notkun prótonupumpuhemla.8 Til eru mismeinvirkir stofnar af C. difficile. Meinvirkari stofnar eru þolnari gagnvart sýklalyfjum, framleiða meira af eiturefnum og/eða mynda harðgerðari gró.7 Því getur einkennaróf og dánartíðni verið mismunandi eftir því hvaða stofnar eru algengir á hverjum tíma, sem getur gert samanburð við erlendar rannsóknir erfiðan. Líklega er stofninn NAP1/B1/027 (ribotype 27) algengastur og best þekktur slíkra stofna og hefur hann valdið faröldrum víða um heim.12 Einkennandi fyrir hann (ásamt nokkrum öðrum) er stökkbreyting í TcdC sem er neikvætt stjórngen á framleiðslu toxína A og B. Stökkbreyting í geninu leiðir því til aukinnar toxínframleiðslu og hefur hann verið tengdur við aukna smithættu ásamt auknum alvarleika sýkinga.12 Ekki eru til rannsóknir um stofna C. difficile hérlendis og getur samanburður við erlendar rannsóknir því verið erfiður.
Hægt er að nota mörg próf til sjúkdómsgreiningar, en ekki er til stakt próf með nægjanlega gott næmi og sértæki.13 Af þessum sökum mæla Samtök evrópskra sérfræðinga í sýklafræði og smitsjúkdómum (European Society of Clinical Microbiology and Infectious Disease, ESCMID) með að tvö mismunandi próf séu notuð í tveggja þrepa greiningarferli.13 Á Landspítala hefur slíkt greiningarferli verið notað frá því í október 2016. Byrjað er að leita að úteiturs-erfðavísum bakteríunnar í saur með kjarnsýrumögnun (PCR) og ef það reynist jákvætt er leitað að fríu úteitri með ELISA-prófi til staðfestingar á virkri sýkingu.14
Hornsteinn meðferðar við CDI er sýklalyf. Í evrópsku meðferðarleiðbeiningum ESCMID var árið 2014 mælt með metrónídazóli eða vankómýsíni við frumsýkingum, – hinu fyrra við mildum sýkingum og hinu síðara í alvarlegum tilvikum.15 Meðferðarleiðbeiningarnar voru uppfærðar árið 2021 og er nú mælt með nýju sýklalyfi, fidaxómísíni eða vankómýsíni, þegar kemur að frumsýkingum.16 Sú breyting var gerð í ljósi niðurstaða rannsókna sem sýndu lakari árangur af metrónidazól-meðferð samanborið við vankómýsín.17,18
Ef um er að ræða alvarleg eða endurtekin tilvik, getur þurft að grípa til annarra meðferðarúrræða við CDI. Einn slíkra meðferðarmöguleika, sem beitt hefur verið í vaxandi mæli á síðastliðnum árum, er hægðaflóruflutningur (fecal microbiota transplantation). Inngripið felur í sér flutning örveruflóru meltingarvegar úr heilbrigðum gjafa í sýktan einstakling í þeim tilgangi að endurheimta eðlilegt jafnvægi í meltingarvegi og stöðva þannig fjölgun og eiturefnamyndun C. difficile.9 Rannsóknir á virkni hægðaflóruflutnings sýna almennt góðan árangur og í uppfærðum meðferðarleiðbeiningum ESCMID er nú mælt með hægðaflóruflutningi sem fyrstu meðferð sjúklinga sem fengið hafa tvær eða fleiri endursýkingar.16,19,20 Síðasta meðferðarúrræði við afar alvarlegum sýkingum, til að mynda þegar sjúklingar fá risaristil (toxic megacolon), er hins vegar skurðaðgerð þar sem ristill er numinn á brott að fullu eða að hluta.
Tvær rannsóknir hafa verið birtar um CDI á Landspítala.21,22 Sú fyrri rannsakaði faraldsfræði og alvarleika CDI-sýkinga á árunum 1998-2008.21 Meðalnýgengi var 4,9 sýkingar / 10.000 legudaga og 9% sjúklinga létust í sömu legu og sýkingin greindist. Flestar sýkingar læknuðust með sýklalyfjameðferð og var metrónídazól algengast (84%).
Sú seinni er framskyggn tilfella-viðmiðarannsókn sem skoðaði 111 tilfelli á Landspítala á árunum 2010-2011.22 Nýgengi heilbrigðisþjónustutengdra sýkinga var 19,7 sýkingar / 10.000 spítalainnlagnir á tímabilinu og var 30 daga dánarhlutfall 9,9%. Líkt og í fyrri rannsókn voru flestar sýkingar upprættar með sýklalyfjum og fékk yfirgnæfandi meirihluti (96%) upphafsmeðferð með metrónídazóli. Flestir (75%) þeirra sem fengu metrónídazól náðu bata eftir staka meðferð.
Í ljósi framfara í greiningartækni, breytinga í spítalaumhverfinu, breyttrar aldurssamsetningar, framfara í meðferð og tímans sem liðinn er frá fyrri rannsóknum er mikilvægt að kanna hver þróunin hefur verið undanfarin ár. Markmið rannsóknarinnar var að kanna faraldsfræði, alvarleika, meðferð og horfur sjúklinga með CDI sem greindust á Landspítala árabilið 2017-2022.
Efniviður og aðferðir
Skilgreiningar og afmörkun þýðis
Rannsóknarþýðið voru allir þeir sjúklingar 18 ára og eldri sem voru með jákvæð greiningarpróf fyrir C. difficile í saur, þar sem viðkomandi saursýni var tekið innan Landspítala á árabilinu 2017-2022. Jákvætt greiningarpróf fól í sér jákvætt PCR-próf fyrir C. difficile ásamt greinanlegu eiturefni A og/eða B í saur.
Ef sami sjúklingur var með tvö eða fleiri jákvæð sýni fyrir C. difficile innan 28 daga tímabils voru þau talin endurspegla sömu sýkingu.23 Ef meira en 28 dagar liðu á milli jákvæðra sýna frá sama sjúklingi var talið að um aðskildar sýkingar væri að ræða.
Á rannsóknartímabilinu voru notuð þrjú mismunandi PCR-próf til greiningar á erfðaefni C. difficile. Frá árinu 2017 þar til í febrúar 2022 var notað innanhúss PCR sem greindi erfðaefni toxíns A og/eða B. Frá febrúar 2022 til ársloka 2022 var notað EntericBio PCR sem greinir erfðaefni toxíns B. Ef framkvæma þurfti greiningarpróf utan dagvinnutíma var notað BD Max PCR sem greinir erfðaefni toxíns B og var það gert allt rannsóknartímabilið. Notað var eitt og sama ELISA-prófið (Premier Toxins A&B (Meridian Bioscience Inc)) allan tímann. Öll sýni voru skimuð fyrir TcdC-stökkbreytingu með PCR-prófi sem hannað var innanhúss.
Notuð voru gögn frá Sýkla- og veirufræðideild Landspítala sem innihéldu upplýsingar um öll þau sýni sem tekin voru. Því var hægt að fylgja sjúklingum eftir með tilliti til endursýkinga. Eftirfylgnitími hófst við fyrstu sýkingu sjúklings og lauk við lok rannsóknartímabilsins, eða við dánardag ef andlát varð fyrir árslok 2022.
Sýkingarnar voru einnig flokkaðar í sýkingar tengdar heilbrigðisþjónustu og samfélagssýkingar. Sýkingar tengdar heilbrigðisþjónustu voru skilgreindar sem sýkingar hjá einstaklingum sem legið höfðu inni í meira en tvo daga við sýnatöku jákvæðs sýnis, eða voru með skráða sjúkrahúslegu (yfir nótt) á undanförnum 90 dögum. Ef hvorugur ofantalinna þátta átti við, voru sýkingar flokkaðar sem samfélagssýkingar.
Klínískar upplýsingar
Farið var yfir sjúkraskrár og eftirfarandi upplýsingar skráðar: Kyn, aldur við greiningu, dagsetning sýnatöku jákvæðs sýnis, einkenni sýkingarinnar, spítalalegur undanfarna 90 daga fyrir sýkingu, lengd þeirrar legu sem sýkingin var greind í, notkun prótonupumpuhemla við innlögn, hvort sjúklingar höfðu legið inni á gjörgæslu við sýkingu eða lagst inn á gjörgæslu í kjölfar greiningar. Skráð voru öll sýklalyf (tegund, skammtur, meðferðartími) sem sjúklingar höfðu tekið á undanförnum 30 dögum fyrir greiningu sýkingar. Einnig voru lífsmörk við greiningu og valdar niðurstöður blóðrannsókna skráðar ef upplýsingar voru til staðar innan sólarhrings frá sýnatöku. Langvinnir sjúkdómar sem sjúklingar höfðu voru jafnframt skráðir. Loks var upplýsinga aflað um þá meðferð sem sjúklingar fengu og var sjúklingum skipt upp í þrjá hópa eftir vali upphafsmeðferðar: 1) Metrónídazól. 2) Vankómýsín. 3) Vankómýsín og metrónídazól samhliða. Sjúklingum var fylgt eftir í 28 daga eftir upphaf meðferðar og skráð hvort þörf hafi verið á frekari meðferð en þeirri sem ávísað var.
Leyfi
Leyfi fyrir rannsókninni fengust frá Siðanefnd heilbrigðisrannsókna á Landspítala 10/2023 (dags. 13. febrúar 2023) og vísindarannsóknanefnd Landspítala 17. janúar 2023 (Tilv. 16).
Tölfræði
Breytur voru skráðar í Excel við gagnasöfnun. Við tölfræðiúrvinnslu var einnig notað Excel ásamt tölfræðiforritinu R (R foundation for statistical computing, Vín, Austurríki, útgáfa 4.1.2). Við samanburð flokkabreyta var notað Kí-kvaðratpróf. Nýgengi var reiknað út frá mannfjöldatölum frá Hagstofu Íslands (uppfært 21.3.2024) og voru upplýsingar um fjölda legudaga fengnar frá hagdeild Landspítala.24
Niðurstöður
Yfirlit um hvernig rannsóknarþýðið var afmarkað má sjá á mynd 1. Rannsóknarstofu Sýkla- og veirufræðideildar bárust 10.533 sýni á tímabilinu þar sem óskað var eftir leit að C. difficile. Af heildarfjölda sýna komu 7041 (66,8%) frá sjúklingum Landspítala. Flest sýni frá Landspítala bárust árið 2019 (1284) og fæst árið 2020 (1077). Af þeim voru 583 (8,3%) jákvæð á PCR-prófi eingöngu, en 476 (6,8%) jákvæð á bæði PCR- og ELISA-prófi. Af þessum sýnum tilheyrðu 56 (11,7%) börnum og 62 (13,0%) voru endurtekin jákvæð sýni (innan 28 daga frá fyrri greiningu). Eftir stóðu því 358 sýkingar sem voru rannsakaðar nánar.
Sýkingarnar 358 sem voru rannsakaðar greindust hjá 301 sjúklingi og voru 57 þeirra því skilgreindar sem endursýkingar. Endursýkingarnar 57 voru meðal 46 einstaklinga sem voru með staðfestar sýkingar fyrr á rannsóknartímabilinu. Af þessum 46 sjúklingum fengu 36 eina endursýkingu, fimm fengu tvær endursýkingar og þrjú fengu þrjár endursýkingar (fjórar sýkingar alls). Endursýkingartíðni meðal sjúklinga rannsóknarinnar reiknaðist því 15,3%. Miðgildi þess tíma sem leið á milli endurtekinna sýkinga hjá sama einstaklingi voru 83 dagar (bil 31-1553 dagar). Stofn með TcdC-stökkbreytingu greindist hjá fjórum (1,3%) einstaklingum.
Heildareftirfylgnitími sjúklinga rannsóknarinnar var 614,8 persónuár. Alls létust 110 sjúklinganna á rannsóknartímabilinu. Þá voru þrír sem ekki voru búsettir hérlendis sem ekki var hægt að fylgja eftir. Miðgildi eftirfylgnitíma sjúklinga var 1,6 persónuár.
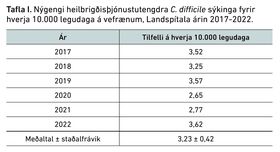
Af 358 sýkingum voru 213 (59,5%) greindar í konum og 145 (40,5%) í körlum og af 358 voru 282 (78,8%) tengdar heilbrigðisþjónustu, þar sem sjúklingar höfðu annað hvort legið inni lengur en í tvo daga fyrir sýnatökudag, eða höfðu legið inni á sjúkrahúsi innan 90 daga fyrir greiningu. Meðalnýgengi heilbrigðisþjónustutengdra sýkinga reiknaðist 3,23 sýkingar á hverja 10.000 legudaga á vefrænum legudeildum Landspítala (legudeildir Landspítala að undanskildu geðsviði, meðgöngu- og fæðingarþjónustu, og biðdeild aldraðra) (bil 2,65-3,62) (tafla I).
Samfélagssýkingar voru því 76 (21,2%) talsins og reiknaðist meðalnýgengi samfélagstendra sýkinga á rannsóknartímabilinu 0,57±0,21 sýkingar á hverja 10.000 íbúa höfuðborgarsvæðisins (bil 0,33-0,96). Nýgengi samfélagfélagstendra sýkinga var hæst árið 2018 og lægst árið 2017.
Upplýsingar um lengd þeirrar legu sem sýkingarnar greindust í fundust í sjúkraskrám 353 (98,6%) tilfella og greindist einn og sami sjúklingurinn með tvær aðskildar sýkingar í sömu legu í 10 tilfellum. Eins og sjá má í töflu II var miðgildi legulengdar 11 dagar (bil 0-610 dagar).

Miðgildi þess tíma sem leið frá staðfestingu greiningar að útskrift var 7,5 dagar (bil 0-519 dagar). Meðalaldur einstaklinga við greiningu var 67,8 ár og miðgildi 71 ár; voru flestir á aldrinum 71-80 ára eða 112 (31,3%). Meðalaldur karla við greiningu sýkingar var 71,1 ár en meðalaldur kvenna 65,6 ár. Enn fremur voru 11,7% kvenna yngri en 40 ára við sýkingu samanborið við einungis 5,5% karla.
Upplýsingar um einkenni sýkingarinnar fundust í sjúkraskrám 340 (95,0%) af þeim 358 tilfellum sem rannsökuð voru. Lýsing á þýðinu, einkennum og niðurstöðum blóðrannsókna má sjá í töflu III. Nánast allir sjúklingar fengu niðurgang (99,7%), en innan við helmingur fékk kviðverki (39,7%), eða ógleði með eða án uppkasta (28,2%). Um 28% sjúklinga höfðu hita og um 57,1% voru með hækkun á hvítum blóðkornum í blóði (tafla III).

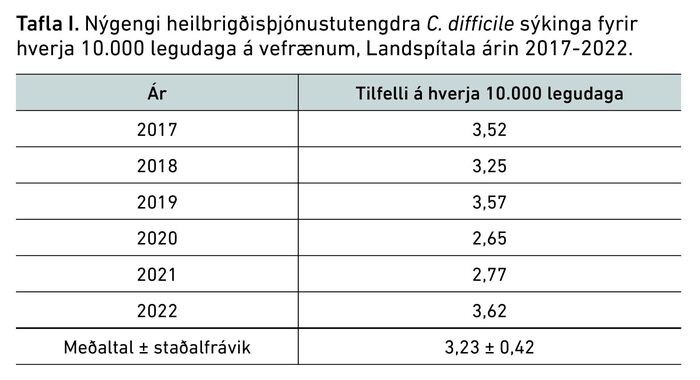
30 daga dánarhlutfall eftir greiningu var 7,3% og hækkaði með aldri eins og má sjá í töflu IV. Sjúklingar greindust á gjörgæsludeild, eða þurftu að leggjast inn á gjörgæslu í kjölfar greiningar í 8,4% tilfella.
Mikill meirihluti sjúklinga eða 306 (85,5%) að lágmarki, höfðu sannanlega tekið sýklalyf innan mánaðar fyrir greiningu. Eins og sjá má á mynd 2 höfðu flestir tekið lyf af flokki pencillína (57,8%) og þar á eftir úr flokki cefalosporína (51,5%). Úr flokki pencillína höfðu flestir fengið amoxicillin með clavúlansýru (35,6%), en úr flokki cefalosporína var ceftríaxón algengasta lyfið (38,6%). Ríflega helmingur, eða 196 (54,7%) voru að taka prótónupumpuhemla við innlögn og voru 231 (64,5%) 65 ára eða eldri.
Upplýsingar um þá meðferð sem veitt var við sýkingunum fundust í sjúkraskrám 319 (89,1%) þeirra tilfella sem rannsökuð voru og fengu allir sýklalyf sem upphafsmeðferð. Yfirlit má sjá á mynd 3. Flestir, eða 63,0%, fengu upphafsmeðferð með metrónídazóli, 29,8% með vankómýcíni, og 7,2% með báðum lyfjum. Í hópi þeirra sem fengu metrónídazól sem upphafsmeðferð þurftu 29,4% á frekari meðferð að halda innan 28 daga frá upphafi meðferðar. Í hinum hópunum tveimur var frekari meðferðar þörf á meðal 24,2% þeirra sem hlutu upphafsmeðferð með vankómýcíni og 13,0% þeirra sem hlutu upphafsmeðferð með báðum lyfjum (p=0,2).
Hægðaflóruflutningur frá gjafa var framkvæmdur í 13 tilfellum og einn sjúklingur gekkst undir ristilbrottnám. Meðalaldur þeirra sem fengu hægðaflóruflutning frá gjafa var 71,5 ár og voru 11 (84,6%) þeirra konur. Miðgildi í fjölda fyrri sýkinga fyrir hægðaflóruflutning var þrír. Af þeim sem fengu hægðaflóruflutning voru þrír (23%) sem fengu endursýkingu seinna á rannsóknartímabilinu og tveir þeirra þurftu endurtekinn hægðaflóruflutning.
Umræður
Nýgengi CDI á Landspítala var svipað í upphafi og við lok rannsóknartímabilsins. Athygli vekur hinsvegar fækkun tilfella árin 2020-2021. Hægt er að velta fyrir sér hvort þessa lækkun megi að einhverju leyti rekja til COVID-19 heimsfaraldursins sem hafði óneitanlega í för með sér breytta hegðun bæði í þjóðfélaginu og á sjúkrahúsum. Í skýrslu frá Embætti landlæknis kemur fram að heildarsala sýklalyfja hér á landi hafi dregist saman um 16,5% á milli 2019 og 2020.25 Eins og hefur komið fram er sýklalyfjanotkun sterkasti áhættuþátturinn fyrir CDI og er því líklegt að fækkun tilfella megi að einhverju leyti rekja til minnkaðrar sýklalyfjanotkunar á ofangreindu tímabili.
Meðalnýgengi heilbrigðistengdra CDI á rannsóknartímabilinu var 3,23 sýkingar á hverja 10.000 legudaga á vefrænum legudeildum Landspítala (tafla I).
Það er áþekkt nýgengi og birt hefur verið frá Evrópu og Kanada.26,27 Það er hins vegar nokkur lækkun frá fyrri rannsókn á Landspítala þar sem meðalnýgengi reiknaðist 4,90 sýkingar á hverja 10.000 legudaga árabilið 1998-2008.21 Líklegt er að breyttar aðferðir við sjúkdómsgreiningu CDI hafi áhrif og geri erfitt fyrir að bera rannsóknirnar saman með tilliti til nýgengis.
Tíðni sýkingarinnar var mjög tengd hækkandi aldri eins og áður hefur verið lýst. Flestar sýkingar voru meðal kvenna, og er það í samræmi við það sem hefur verið lýst hérlendis.21,22 Einnig var talsverður munur á aldursdreifingu eftir kyni. Í skýrslu frá Embætti landlæknis kemur fram að konur hafi fengið um 40% fleiri sýklalyfjaávísanir en karlar árið 2022.28 Í rannsókn sem birt var árið 2020 var borið saman nýgengi C. difficile samfélagssýkinga og sýklalyfjanotkun utan spítala meðal karla og kvenna í Suður-Karolínu.29 Nýgengi C. difficile samfélagssýkinga á hverja 100.000 íbúa reyndist nálægt tvöfalt hærra á meðal kvenna á aldrinum 18-39 ára samanborið við karla í sama aldursflokki (31,9 borið saman við 16,4 sýkingar), sem skýrist sennilega af meiri sýklalyfjanotkun meðal kvenna á þessum aldri.
Lengd sjúkralegu meðal sjúklinga rannsóknarinnar var á breiðu bili. Einnig var talsverður munur á heildarlegutíma og tímanum sem leið frá staðfestingu greiningar til útskriftar. Margir sjúklingar rannsóknarinnar höfðu því legið inni í talsverðan tíma við greiningu enda eykst hættan á sýkingu eftir því sem legan er lengri.
Mikill meirihluti sjúklinga, eða að minnsta kosti 85,5%, hafði tekið sýklalyf fyrir greiningu. Í fyrri rannsóknum 1998-2008 og 2010-2011 var þetta hlutfall lægra, eða 72% og 79%.21,22 Líklegt má telja að breytingin skýrist af betri og aðgengilegri upplýsingum um lyfjanotkun nú. Einnig er talsverð breyting á milli tímabila þegar kemur að þeim sýklalyfjaflokkum sem sjúklingar höfðu tekið fyrir sýkingu. Á árunum 1998-2008 höfðu langflestir þeirra sem höfðu tekið sýklalyf fyrir greiningu, eða um 90%, fengið lyf úr pensillínflokki, 42% höfðu fengið lyf úr flokki annarrrar og þriðju kynslóðar kefalósporína og 25% úr flokki flúórókínólóna.21 Það sama má segja um rannsókn 2010-2011 þar sem lyf úr pensillínflokki voru langalgengust.22 Þrátt fyrir að notkun lyfja úr pensillínflokki hafi einnig verið algengust í okkar rannsóknarþýði, höfðu aðeins tæp 58% fengið ávísað lyfjum úr þeim flokki. Rúmur helmingur sjúklinga tóku prótónupumpuhemla við greiningu og er það í samræmi við niðurstöður annarra.22,30
Eins og áður hefur komið fram var frá árinu 2021 ekki lengur mælt með metronídazóli í evrópskum meðferðarleiðbeiningum16, þar sem rannsóknir höfðu sýnt fram á lakari árangur þeirrar meðferðar. Metrónídazól var því skráð sem kjörmeðferð við vægum sýkingum stærstan hluta rannsóknartímabilsins og meirihluti sjúklinga (63%) í okkar rannsókn fékk metrónídazól sem upphafsmeðferð við CDI. Umrætt hlutfall hefur því lækkað verulega frá 2010-2011 þar sem 96% (97/101) upphafsmeðferða við CDI voru með metronídazóli.22 Af þeim sem fengu metrónídazól í okkar rannsókn þurfti tæpur þriðjungur (29,4%) á frekari meðferð að halda vegna bakslags, sem er sambærilegt hlutfall og hjá þeim sem fengu vankómýsín. Ofangreind rannsókn greindi frá 75% lækningarhlutfalli með stökum metrónídazól kúr.22 Í framtíðinni gætu nýjar meðferðarleiðbeiningar leitt til frekari aukningar á notkun vankómýsíns og fidaxómísíns á kostnað metrónídazóls. Vert er þó að hafa í huga að aðeins 1,3% einstaklinga greindust með TcdC-stökkbreyttan stofn, sem er mun lægra en víða erlendis.31 Það bendir til þess að meinvirki stofninn (ribotype 27) sé ekki algengur á Landspítala og eru ríkjandi stofnar hérlendis því líklega ekki eins meinvirkir og víða annars staðar.
Hér á landi er einnig gríðarlegur kostnaðarmunur á lyfjum sem notuð eru við CDI. Samkvæmt lyfjaverðskrá er hámarksheildsöluverð á einni 10 daga meðferð með metrónídazóli um munn (30 töflur) 1.038 krónur.32 Hámarksheildsöluverð fyrir eina jafnlanga meðferð með vankómýsíni um munn (40 töflur) er 24.248 krónur og 205.561 krónur fyrir eina meðferð með fidaxómísín (20 töflur).32 Erlendis hafa kostnaðarvirknirannsóknir sýnt að unnt sé að fækka bakslögum með notkun fidaxómísíns og þar með spara fjármagn til lengri tíma.33 Ísland er hins vegar í ákveðinni sérstöðu samanborið við sambærileg ríki að því leyti að Sjúkratryggingar taka ekki þátt í niðurgreiðslu sýklalyfja utan sjúkrahúsa undir venjulegum kringumstæðum (það er nema samþykki SÍ liggi fyrir um greiðsluþátttöku). Þarna geta því leynst skaðlegir hvatar til sparnaðar sem kann að leiða til kostnaðaraukingar annars staðar í heilbrigðiskerfinu. Hátt verð lyfjanna gæti jafnvel í einhverjum tilfellum komið í veg fyrir að fólk leysi þau út og væru sýkingarnar þá ómeðhöndlaðar. Ómeðhöndlaðar sýkingar geta orðið alvarlegar og leitt til sjúkrahúsinnlagnar sem felur í sér meiri kostnað.
Stórstígar framfarir hafa átt sér stað í meðferð C. difficile með flutningi á hægðaflóru undanfarin ár og hefur þeirri nálgun verið beitt í vaxandi mæli á Landspítala, fyrst og fremst í sérvöldum tilvikum þar sem endurtekin lyfjameðferð hefur ekki skilað tilætluðum árangri. Allt bendir til að ábendingum fyrir hægðaflóruflutningi eigi eftir að fjölga á næstu árum, enda hefur nýlega verið sýnt fram á að hún er betri en hefðbundin sýklalyfjameðferð í fyrstu eða annarri sýkingu.34 Víða erlendis hafa nýlega verið opnaðir sérstakir bankar sem sjá um að útvega hægðaflóru til gjafar og er módelið ekki ósvipað og í blóðbönkum. Verðandi gjafar þurfa að undirgangast ítarlegar skimanir með það fyrir augum að tryggja gæði gjafaflórunnar og minnka líkur á aukaverkunum sem geta stafað af inngripinu.35 Hollendingar hafa starfrækt slíkan banka frá árinu 2015 með góðum árangri og greindu þeir frá 89% lækningarhlutfalli tveimur mánuðum eftir fyrsta hægðaflóruflutning.36
Í okkar rannsókn var 30 daga dánarhlutfall 7,3%, sem er áþekkt því sem hefur sést hérlendis og víða erlendis og undirstrikar alvarleika sýkingarinnar.21,22,37
Takmarkanir rannsóknarinnar eru að hún var afturskyggn. Því var skráningu upplýsinga stundum ábótavant og rannsóknir sem gerðar voru á sjúklingum voru ósamræmdar og misítarlegar. Við útreikninga í okkar rannsókn var alvarleiki CDI ekki flokkaður kerfisbundið. Rannsóknarsnið og gögn sem liggja fyrir gera okkur því ekki kleift að bera saman virkni og árangur lyfja og meðferðar nema án tölfræðilegrar leiðréttingar.
Í samantekt veitir þessi rannsókn mikilvægar upplýsingar um faraldsfræði C. difficile sýkinga á Landspítala undanfarin ár. Niðurstöður benda ekki til hækkandi nýgengis samanborið við fyrri ár, né til þess að birtingarmynd hafi breyst. Ljóst er að meðferð muni taka breytingum hérlendis á næstu misserum með endurskoðuðum meðferðarleiðbeingum, nýjum sýklalyfjum og aukinni áherslu á hægðaflóruflutning.
Þakkir
Rannsóknin var styrkt af Vísindasjóði Landspítala.
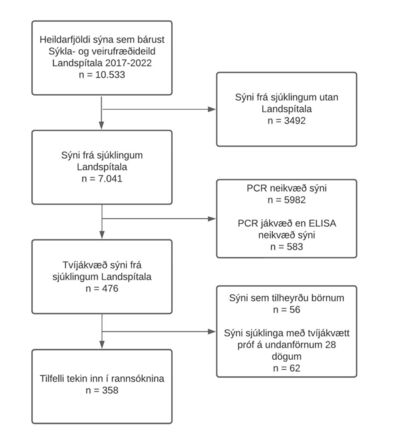 Mynd 1. Flæðirit sem sýnir afmörkun rannsóknarþýðis.
Mynd 1. Flæðirit sem sýnir afmörkun rannsóknarþýðis.
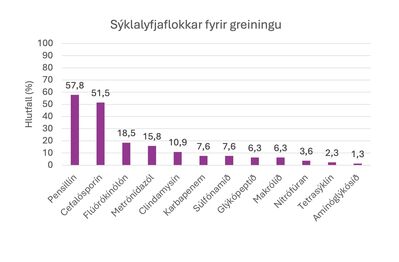 Mynd 2. Sýklalyf sem sjúklingar höfðu tekið á undanfarna 30 daga fyrir C. difficile iðrasýkingu.
Mynd 2. Sýklalyf sem sjúklingar höfðu tekið á undanfarna 30 daga fyrir C. difficile iðrasýkingu.
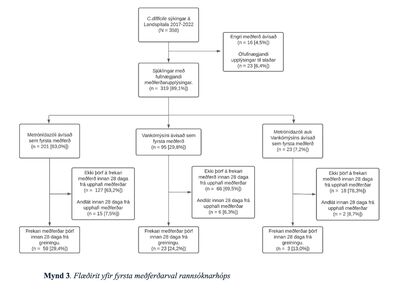 Mynd 3. Flæðirit yfir fyrsta meðferðarval rannsóknarhóps.
Mynd 3. Flæðirit yfir fyrsta meðferðarval rannsóknarhóps.
Heimildir
| 1. Boven A, Vlieghe E, Engstrand L, et al. Clostridioides difficile infection-associated cause-specific and all-cause mortality: a population-based cohort study. Clin Microbiol Infect. 2023;29(11):1424-30. https://doi.org/10.1016/j.cmi.2023.07.008 PMid:37473840 |
||||
| 2. Kimura T, Stanhope S, Sugitani T. Excess length of hospital stay, mortality and cost attributable to Clostridioides (Clostridium) difficile infection and recurrence: a nationwide analysis in Japan. Epidemiol Infect. 2020;148:e65. https://doi.org/10.1017/S0950268820000606 PMid:32115019 PMCid:PMC7118723 |
||||
| 3. Kenneally C, Rosini JM, Skrupky LP, et al. Analysis of 30-day mortality for clostridium difficile-associated disease in the ICU setting. Chest. 2007;132(2):418-24. https://doi.org/10.1378/chest.07-0202 PMid:17573523 |
||||
| 4. Zhang S, Palazuelos-Munoz S, Balsells EM, et al. Cost of hospital management of Clostridium difficile infection in United States-a meta-analysis and modelling study. BMC Infect Dis. 2016;16(1):447. https://doi.org/10.1186/s12879-016-1786-6 PMid:27562241 PMCid:PMC5000548 |
||||
| 5. Le Monnier A, Duburcq A, Zahar JR, et al. Hospital cost of Clostridium difficile infection including the contribution of recurrences in French acute-care hospitals. J Hosp Infect. 2015;91(2):117-22. https://doi.org/10.1016/j.jhin.2015.06.017 PMid:26253518 |
||||
| 6. Di Bella S, Sanson G, Monticelli J, et al. Clostridioides difficile infection: history, epidemiology, risk factors, prevention, clinical manifestations, treatment, and future options. Clin Microbiol Rev. 2024;37(2):e0013523. https://doi.org/10.1128/cmr.00135-23 PMid:38421181 PMCid:PMC11324037 |
||||
| 7. Pumiglia L, Wilson L, Rashidi L. Clostridioides difficile Colitis. Surg Clin North Am. 2024;104(3):545-56. https://doi.org/10.1016/j.suc.2023.11.005 PMid:38677819 |
||||
| 8. Czepiel J, Drozdz M, Pituch H, et al. Clostridium difficile infection: review. Eur J Clin Microbiol Infect Dis. 2019;38(7):1211-21. https://doi.org/10.1007/s10096-019-03539-6 PMid:30945014 PMCid:PMC6570665 |
||||
| 9. Minkoff NZ, Aslam S, Medina M, et al. Fecal microbiota transplantation for the treatment of recurrent Clostridioides difficile (Clostridium difficile). Cochrane Database Syst Rev. 2023;4(4):CD013871. https://doi.org/10.1002/14651858.CD013871.pub2 PMid:37096495 PMCid:PMC10125800 |
||||
| 10. Teng C, Reveles KR, Obodozie-Ofoegbu OO, et al. Clostridium difficile Infection Risk with Important Antibiotic Classes: An Analysis of the FDA Adverse Event Reporting System. Int J Med Sci. 2019;16(5):630-5. https://doi.org/10.7150/ijms.30739 PMid:31217729 PMCid:PMC6566741 |
||||
| 11. Mullish BH, Williams HR. Clostridium difficile infection and antibiotic-associated diarrhoea. Clin Med (Lond). 2018;18(3):237-41. https://doi.org/10.7861/clinmedicine.18-3-237 PMid:29858434 PMCid:PMC6334067 |
||||
| 12. Fatima R, Aziz M. The Hypervirulent Strain of Clostridium Difficile: NAP1/B1/027 - A Brief Overview. Cureus. 2019;11(1):e3977. https://doi.org/10.7759/cureus.3977 |
||||
| 13. Crobach MJ, Planche T, Eckert C, et al. European Society of Clinical Microbiology and Infectious Diseases: update of the diagnostic guidance document for Clostridium difficile infection. Clin Microbiol Infect. 2016;22 Suppl 4:S63-81. https://doi.org/10.1016/j.cmi.2016.03.010 PMid:27460910 |
||||
| 14. Bætt greining Clostridium difficile sýkinga. Landspítali, Reykjavík 2016. https://www.landspitali.is/um-landspitala/fjolmidlatorg/frettir/stok-frett/2016/10/26/Baett-greining-Clostridium-difficile-sykinga/. 3. desember 2024. | ||||
| 15. Debast SB, Bauer MP, Kuijper EJ, et al. European Society of Clinical Microbiology and Infectious Diseases: update of the treatment guidance document for Clostridium difficile infection. Clin Microbiol Infect. 2014;20 Suppl 2:1-26. https://doi.org/10.1111/1469-0691.12418 PMid:24118601 |
||||
| 16. van Prehn J, Reigadas E, Vogelzang EH, et al. European Society of Clinical Microbiology and Infectious Diseases: 2021 update on the treatment guidance document for Clostridioides difficile infection in adults. Clin Microbiol Infect. 2021;27 Suppl 2:S1-S21. https://doi.org/10.1016/j.cmi.2021.09.038 PMid:34678515 |
||||
| 17. Johnson S, Louie TJ, Gerding DN, et al. Vancomycin, metronidazole, or tolevamer for Clostridium difficile infection: results from two multinational, randomized, controlled trials. Clin Infect Dis. 2014;59(3):345-54. https://doi.org/10.1093/cid/ciu313 PMid:24799326 |
||||
| 18. Allegretti JR, Marcus J, Storm M, et al. Clinical Predictors of Recurrence After Primary Clostridioides difficile Infection: A Prospective Cohort Study. Dig Dis Sci. 2020;65(6):1761-6. https://doi.org/10.1007/s10620-019-05900-3 PMid:31667694 PMCid:PMC8630805 |
||||
| 19. van Nood E, Vrieze A, Nieuwdorp M, et al. Duodenal infusion of donor feces for recurrent Clostridium difficile. N Engl J Med. 2013;368(5):407-15. https://doi.org/10.1056/NEJMoa1205037 PMid:23323867 |
||||
| 20. Kelly CR, Khoruts A, Staley C, et al. Effect of Fecal Microbiota Transplantation on Recurrence in Multiply Recurrent Clostridium difficile Infection: A Randomized Trial. Ann Intern Med. 2016;165(9):609-16. https://doi.org/10.7326/M16-0271 PMid:27547925 PMCid:PMC5909820 |
||||
| 21. Kvaran RB, Valsdottir EB, Sigurdsson HK, et al. Clostridium difficile sýkingar á Landspítala 1998-2008. Læknablaðið. 2010;96(9):523-9. https://doi.org/10.17992/lbl.2010.09.312 PMid:20820068 |
||||
| 22. Vesteinsdottir I, Gudlaugsdottir S, Einarsdottir R, et al. Risk factors for Clostridium difficile toxin-positive diarrhea: a population-based prospective case-control study. Eur J Clin Microbiol Infect Dis. 2012;31(10):2601-10. https://doi.org/10.1007/s10096-012-1603-0 PMid:22441775 |
||||
| 23. 30 day all-cause mortality following MRSA, MSSA and Gram-negative bacteremia and C.difficile infections: 2022 to 2023 report. UK Health Security Agency, London 2024. | ||||
| 24. Mannfjöldi eftir kyni og aldri 1841-2024. Hagstofa Íslands, Reykjavík 2024. https://px.hagstofa.is/pxis/pxweb/is/Ibuar/Ibuar__mannfjoldi__1_yfirlit__Yfirlit_mannfjolda/MAN00101.px. 3. desember 2024. | ||||
| 25. Sýklalyfjanotkun og sýklalyfjanæmi baktería hjá mönnum og dýrum á Íslandi 2020. Embætti landlæknis, Reykjavík 2021. island.is/syklalyfjaanaemi-og-syklalyfjanotkun/skyrslur. | ||||
| 26. European Centre for Disease Prevention and Control. Clostridioides difficile infections: Annual epidemiological report for 2016-2017. ECDC, Stockholm 2022. | ||||
| 27. Antimicrobial resistance (AMR) - Results. Government of Canada, Ottawa 2024. health-infobase.canada.ca/carss/amr/results.html?ind=08. 3. desember 2024 | ||||
| 28. Sýklalyfjanotkun og sýklalyfjanæmi baktería hjá mönnum og dýrum á Íslandi 2022. Embætti Landlæknis, Reykjavík 2023. island.is/syklalyfjaanaemi-og-syklalyfjanotkun/skyrslur. | ||||
| 29. Younas M, Royer J, Weissman SB, et al. Clostridioides difficile infection and antibiotic prescription rates in the community: Explaining the gender gap. Infect Control Hosp Epidemiol. 2021;42(5):622-4. https://doi.org/10.1017/ice.2020.1268 PMid:33239121 |
||||
| 30. Choudhry MN, Soran H, Ziglam HM. Overuse and inappropriate prescribing of proton pump inhibitors in patients with Clostridium difficile-associated disease. QJM. 2008;101(6):445-8. https://doi.org/10.1093/qjmed/hcn035 PMid:18411220 |
||||
| 31. Giancola SE, Williams RJ, 2nd, Gentry CA. Prevalence of the Clostridium difficile BI/NAP1/027 strain across the United States Veterans Health Administration. Clin Microbiol Infect. 2018;24(8):877-81. https://doi.org/10.1016/j.cmi.2017.11.011 PMid:29174729 |
||||
| 32. Lyfjaverðskrá 1. desember 2024. Lyfjastofnun, Reykjavík 2024. www.lyfjastofnun.is/verd-og-greidsluthatttaka/lyfjaverdskra/. 3. desember 2024 | ||||
| 33. Jiang Y, Sarpong EM, Sears P, et al. Budget Impact Analysis of Fidaxomicin Versus Vancomycin for the Treatment of Clostridioides difficile Infection in the United States. Infect Dis Ther. 2022;11(1):111-26. https://doi.org/10.1007/s40121-021-00583-8 https://doi.org/10.1007/s40121-021-00480-0 PMid:34292496 PMCid:PMC8847493 |
||||
| 34. Baunwall SMD, Andreasen SE, Hansen MM, et al. Faecal microbiota transplantation for first or second Clostridioides difficile infection (EarlyFMT): a randomised, double-blind, placebo-controlled trial. Lancet Gastroenterol Hepatol. 2022;7(12):1083-91. https://doi.org/10.1016/S2468-1253(22)00276-X PMid:36152636 |
||||
| 35. van Lingen, E., Terveer E. M., van der Meulen-de Jong A. E., et al., Advances in stool banking. Microb Health Dis, 2020; 2: e182. | ||||
| 36. Terveer EM, Vendrik KE, Ooijevaar RE, et al. Faecal microbiota transplantation for Clostridioides difficile infection: Four years' experience of the Netherlands Donor Feces Bank. United European Gastroenterol J. 2020;8(10):1236-47. https://doi.org/10.1177/2050640620957765 PMid:32990503 PMCid:PMC7724536 |
||||
| 37. Lessa FC, Mu Y, Bamberg WM, et al. Burden of Clostridium difficile infection in the United States. N Engl J Med. 2015;372(9):825-34. https://doi.org/10.1056/NEJMoa1408913 PMid:25714160 PMCid:PMC10966662 |
||||