05. tbl. 94. árg. 2008
Fræðigrein
Tengsl magnakerfis við algenga bandvefssjúkdóma - yfirlit
The association of complement with common connective tissue diseases - a review
Ágrip
Sterk tengsl hafa greinst milli magnakerfis og algengra bandvefssjúkdóma, svo sem rauðra úlfa og Henoch Schönlein Purpura. Þetta hefur leitt til hugmynda um að galli í virkni magnakerfis geti átt þátt í meinferli slíkra sjúkdóma, og er þá einkum litið til hlutverks kerfisins í eyðingu mótefnafléttna. Til að varpa ljósi á málið var þróað próf sem mælir getu blóðvökva til að halda mótefnafléttum í lausn. Þessu prófi hefur verið beitt á ýmsa hópa íslenskra sjúklinga og reyndist gölluð meðhöndlun mótefnafléttna algeng í rauðum úlfum og herslismeini. Vantjáð afurð C4A-gens (C4A*Q0) nægir ekki til að skýra þennan galla því hann finnst ekki í sjúklingum með sykursýki, glútenóþol eða skjaldkirtilssjúkdóm, þrátt fyrir háa tíðni C4A*Q0 í þessum hópum. Gallinn hefur á hinn bóginn sterka fylgni við hækkuð mótefni gegn C1q. Frekari rannsókna er þörf til að skera úr um hvort mótefni gegn C1q geti átt þátt í meinþróun sjúkdómsins.
Inngangur
Magnakerfið (complement) er einn af hornsteinum varnarkerfis mannsins (1). Sameindir þess hvarfast hver við aðra í nærveru sýkla og mynda afurðir sem stuðla að útrýmingu sýklanna með áhrifum sínum á æðar og mastfrumur (bólguáhrif) og á átfrumustarfsemi (áthúðun sýkla, efnatog, tjáning viðloðunarsameinda á æðaþeli). Sameindir kerfisins geta líka borað gat á frumuhimnu sýkilsins og sprengt hann beint, án hjálpar frá frumum varnarkerfisins.
Áhrif kerfisins voru lengi talin tengjast sýkladrápi einvörðungu, en síðar kom í ljós að kerfið gegnir einnig mikilvægu hlutverki í að halda mótefnafléttum í lausn og stuðla að eyðingu þeirra í lifur. Þegar mótefni bindast lítilli sameind eða ónæmisvaka er yfirleitt talað um mótefnafléttu (immune complex). Slík flétta er í eðli sínu leysanleg í líkamsvökvum. En mótefni hafa yfirleitt tvö eða fleiri bindiset, og sama gildir um mótefnavaka, og með víðtækri krossbindingu getur myndast löng og jafnvel greinótt keðja eða grind, þar sem skiptast á mótefni og mótefnavakar. Magnakerfið hindrar þetta með því að bindast inn í grindina og breyta bindieiginleikum mótefna (2). Fléttur haldast þá litlar og leysanlegar og samanstanda líklega oftast af einum mótefnavaka og einu mótefni, auk C1q, C4, C2 og C3 úr magnakerfi (3).
Hægt er að ræsa magnakerfið eftir þrem leiðum, langferli, lektínferli eða stuttferli (1). Það sem fyrst vísaði á mikilvægi magnakerfis í eyðingu mótefnafléttna voru athuganir á einstaklingum með algeran skort á einni af sameindum langferlis (C1, C4, C2). Skortur á fyrstu þáttunum (C1, C4) tengist gigtsjúkdómi (rauðum úlfum eða áþekkum einkennum) í 56 af 70 einstaklingum sem greinst hafa með slíkan galla (4), og sama gildir um þriðjung þeirra fjölmörgu sem skortir C2 (5). Sterkar vísbendingar eru um að magnaþátturinn fB geti komið í stað C2 þegar síðari sameindin er ekki til staðar (6) og má telja líklegt að það skýri hvers vegna C2-skortur er einkennalaus í meirihluta tilvika. En niðurstöðurnar í heild benda til þess að megintilgangur langferlis sé að hindra útfellingu mótefnafléttna í vefjum líkamans og tryggja að þær skili sér í staðinn til lifrar. Í lifur taka átfrumur við þeim og eyða þeim án þess að bólga hljótist af, en ef mótefnafléttur falla út í öðrum vefjum veldur það bólgu (4).
Skortur á C1 eða C4 veldur yfirleitt rauðum úlfum eða áþekkum einkennum, það er bólgu í liðum, húð, brjósthimnu, nýrum eða miðtaugakerfi. Alger skortur á C1 eða C4 er afar sjaldgæfur, en C4 sameindin er til staðar í tveim eintökum, C4A og C4B, sem táknað er fyrir af samhliða genum á MHC-svæði sjötta litnings mannsins, og hlutaskortur C4, það er galli í C4A eða C4B-geni (C4A*Q0, C4B*Q0) er algengur í erfðamengi mannsins (7). Afar sterk fylgni er milli C4A*Q0 og rauðra úlfa og hefur það leitt til hugmynda um að sjúkdómurinn geti skýrst af slakri meðhöndlun mótefnafléttna vegna skorts eða hlutaskorts sameinda úr langferli (2, 8-9).
Athuganir á íslenskum sjúklingahópum
Til að prófa ofannefnda tilgátu liggur beinast við að mæla getu blóðvökva til að halda mótefnafléttum í lausn, og skoða þessa virkni í sjúklingum með rauða úlfa. Þá þarf hins vegar næmara próf en það sem upphaflega var notað til rannsókna á þessari virkni; prófið sýnir ekki línulega fylgni við þynningar blóðvökva nema á mjög þröngu þynningarbili (0-1%) (10). Því var þróað nýtt próf til mælinga á getu blóðvökva til að halda mótefnafléttum í lausn. Þetta var gert með því að láta alkalískan fosfatasa (AP) bindast mótefnum gegn alkalískum fosfatasa (a-AP) í viðurvist blóðvökva (mynd 1). Í þessu prófi þjónar AP tvöföldu hlutverki, það er sem ígildi ónæmisvaka, og einnig sem ensím sem hentar til að fá fram litarsvar í prófinu. Næmi prófsins er afburðagott því fylgnin milli þynninga blóðvökva og virkni í prófinu er línuleg fyrir allar þynningar blóðvökva (11).

Mynd 1. Næmi prófs sem metur hæfni blóðvökva til að hindra útfellingu mótefnafléttna (PIP, prevention of immune precipitation; AU=arbitrary units). Línulegt samband er milli þynningar blóðvökva og þessarar virkni blóðvökva (9).
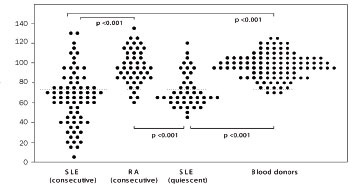
Mynd 2. Sjúklingar með rauða úlfa (systemic lupus erythematosus, SLE) sýna vanvirkni í prófi sem metur hæfni blóðvökva til að halda mótefnafléttum uppleystum (PIP). Þessi virkni var lækkuð í 74 sjúklingum sem skoðaðir voru án tillits til virkni sjúkdóms, m.v. 46 sjúklinga með liðagigt (rheumatoid arthritis, RA) og 102 blóðgjafa. Virkni var einnig marktækt minni í 44 sjúklingum sem skoðaðir voru þegar sjúkdómurinn var lítt virkur (SLEDAI skor < 10). Lægri viðmiðunarmörk (2 SD) eru sýnd með strikalínu (10).
Þessu prófi var beitt til að athuga sjúklinga með rauða úlfa (N=74), og reyndist hæfni þeirra til að halda mótefnafléttum smáum og leysanlegum verulega skert miðað við 46 sjúklinga með liðagigt og 102 heilbrigða blóðgjafa (mynd 2) (12). Þar sem magnakerfið ræsist yfirleitt í virkum fasa sjúkdómsins þurfti að greina á milli þess hvort galli í meðhöndlun mótefnafléttna væri afleiðing sjúkdómsins (vegna þurrðar magnaþátta í kjölfar ræsingar kerfisins) eða hvort hann væri þáttur í meinmyndun sjúkdómsins. Nánari athugun leiddi í ljós marktækan galla jafnvel þegar sjúkdómurinn var lítt virkur og styrkur sameinda úr magnakerfinu eðlilegur (N=44) (mynd 2). Þetta styður þá hugmynd að vanvirkni í getu blóðvökva til að meðhöndla mótefnafléttur geti verið undirrót rauðra úlfa í verulegum fjölda tilvika. Hins vegar er ljóst að þetta getur ekki verið eina undirrót sjúkdómsins þar sem um helmingur sjúklinga var með eðlilega virkni í þessu ferli. Rannsóknir á 24 íslenskum sjúklingum með herslismein leiða til svipaðrar niðurstöðu (mynd 3), en sá sjúkdómur er einnig sterkt tengdur C4A*Q0 og einkennist meðal annars af útfellingu mótefnafléttna í smærri æðum (13). Sterk fylgni greindist milli galla í fléttumeðhöndlun og beinna mælinga á styrk C4A í blóði (r=0,78, p<0,0001 fyrir rauða úlfa; r=0,65, p<0,0001 fyrir herslismein) (12-13).
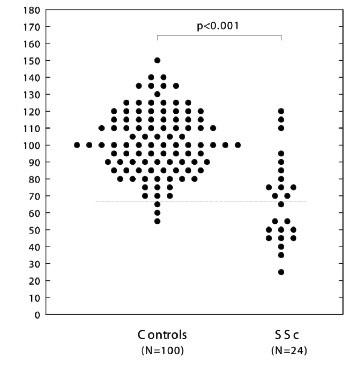
Mynd 3. Hindrun fléttuútfellingar (PIP) í sjúklingum með herslismein (systemic sclerosis, SSc) m.v. blóðgjafa. Lægri viðmiðunarmörk (2 SD) eru sýnd með strikalínu (11).
Þessar rannsóknir samrýmast hugmyndum um að vanvirkni í langferli magnakerfis geti leitt til fléttusjúkdóma. Hins vegar er erfitt að trúa því að vanvirknin sé beinlínis vegna skorts á C4A, því C4A*Q0 arfgerðin er tiltölulega algeng í heilbrigðu þýði (7). Til þess benda einnig athuganir á íslenskum sjúklingum með skjaldkirtilsbólgu (autoimmune thyroid disease) (N=28) og insúlínháða sykursýki (N=24), og íslenskum og enskum sjúklingum með glútenóþol (coeliac disease/dermatitis herpetiformis) (N=45), en þessir sjúkdómar hafa allir sterk tengsl við C4A*Q0. Geta blóðvökva til að halda mótefnafléttum uppleystum var eðlileg í þessum sjúklingum (mynd 4) (14). Engin fylgni var á milli þessarar virkni og C4A-styrks, hins vegar greindist sterk fylgni við C4B-styrk (r=0,51, p<0,0001), öfugt við það sem sást í rauðum úlfum og herslismeini.
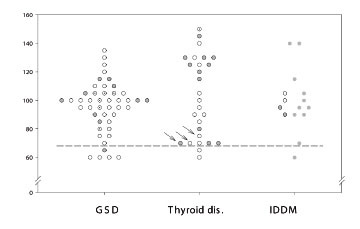
Mynd 4. Hindrun fléttuútfellingar (PIP) í sjúklingum með iðramein vegna glútenóþols (gluten sensitive enteropathy, GSD), sjálfsofnæmissjúkdóm í skjaldkirtli (autoimmune thyroid disease, thyroid dis.) og sykursýki (insulin-dependent diabetes mellitus, IDDM). C4A*Q0 arfberar eru merktir með opnum hringjum (arfblendinn galli) eða með punktmerktum hringjum (arfhreinn galli). Sjúklingar með Hashimotos sjúkdóm eru merktir með ör (12).
Þetta sýnir að engin bein tengsl eru milli C4A*Q0 og hæfni blóðvökva til að halda mótefnafléttum uppleystum. Þetta leiddi til athugunar á öðrum möguleika, að mótefni gegn C1q, sem eru til staðar í hækkuðum styrk í um þriðjungi sjúklinga með rauða úlfa, gætu verið að verki. Slík mótefni eru líkleg til að binda áthúðaðar mótefnafléttur og gætu þá krossbundið slíkar fléttur og fellt þær út. Mótefni gegn C1q reyndust vera til staðar í hluta sjúklinga (20/84) með glútenóþol, skjaldkirtilsbólgu eða sykursýki og sjúklingar með slík mótefni höfðu marktækt minni getu til að hindra útfellingu mótefnafléttna heldur en afgangur hópsins (14). Í hópi sjúklinga með rauða úlfa reyndust slík mótefni vera til staðar í fimmtungi hópsins (9/44) þegar sjúkdómur var vægur (15). Þessir sjúklingar voru allir með galla í meðhöndlun mótefnafléttna, og sterk fylgni reyndist milli gallans og mótefna gegn C1q (r=-0,623, p=0,000023). Blóðvökvi úr sjúklingi með háan styrk C1q-mótefna og nánast algera vanvirkni í fléttumeðhöndlun hafði sterk hindrandi áhrif á getu heilbrigðs blóðvökva til að halda mótefnafléttum í lausn. Þessi hindrunaráhrif greindust einnig í IgG mótefnum sem einangruð voru úr viðkomandi blóðvökva.
Niðurlag
Rannsóknir á íslenskum sjúklingahópum sýna að verulegur hluti sjúklinga með rauða úlfa eða herslismein er með skerta hæfni til að halda mótefnafléttum uppleystum. Þessar niðurstöður fengust með því að beita næmara prófi en áður hafði verið þróað til mælinga á þessari virkni. Niðurstöðurnar samrýmast ekki þeirri hugmynd að vantjáð afurð C4A-gens nægi til að skýra þennan galla. Gallinn hefur á hinn bóginn sterka fylgni við hækkuð mótefni gegn C1q. Frekari rannsókna er þörf til að skera úr um hvort mótefni gegn C1q geti átt þátt í meinþróun sjúkdómsins, en ljóst er að slíkt gæti einungis gilt fyrir hluta sjúklingahópsins þar sem meirihluti sjúklinga hefur eðlilega getu til fléttumeðhöndlunar. Erlendar rannsóknir hafa sýnt að styrkur mótefna gegn C1q vex þegar sjúkdómur er í virkum fasa (16) og gætu slík mótefni því komið á fleiri en einn veg inn í meinþróunina.
Niðurstöður okkar og annarra hafa sýnt að sterk tengsl eru milli ákveðinna afbrigða magnaþátta og algengra bandvefssjúkdóma (2-9, 11-18). Þær rannsóknir sem hér er lýst hafa aðallega beint spjótunum að þeirri hugmynd að slík tengsl geti orsakast af vangetu blóðvökva til að halda mótefnafléttum í lausn. Hugmyndin er að nokkru leyti studd af þessum rannsóknum, en þó er ljóst að galli í þessari virkni blóðvökva hlýtur að eiga sér flóknari ástæður en beinan skort á ákveðnum þáttum magnakerfis. Til viðbótar mætti nefna fjölmargar rannsóknir, þar á meðal íslenskar, sem styðja að sambandið milli magnakerfis og bandvefssjúkdóma eigi sér flóknar skýringar (18-23); rannsóknum ber þó saman um að þetta samband sé til staðar og talið er víst að um orsakasamband sé að ræða (24). Frekari rannsókna er þörf til að ganga endanlega úr skugga um að svo sé, og útskýra sambandið til fulls.
Þakkir
Þessi grein er yfirlit yfir niðurstöður sem aflast hafa í samstarfi við Alfreð Árnason, Árna Jón Geirsson, Ásbjörn Sigfússon, Ástráð B. Hreiðarsson, Hallgrím Guðjónsson, Helga Valdimarsson, Kristján Erlendsson, Kristján Steinsson, Ragnhildi Kolka og Þóru Víkingsdóttur, auk nokkurra erlendra samstarfsmanna (sjá heimildir). Öllu þessu ágæta fólki færi ég mínar bestu þakkir fyrir gott samstarf.
Heimildir
1. Arason GJ. Magnakerfið. Læknaneminn 2008; xx:x-x
2. Lachmann PJ, Walport, MJ. Deficiency of the effector mechanisms of the immune response and autoimmunity. Ciba Found Symp.1987; 129: 149-71.
3. Naama JK, Niven IP, Zoma A, Mitchell WS, Whaley K. Complement, antigen-antibody complexes and immune complex disease. J Clin Lab Immunol 1985; 17: 59-67.
4. Sullivan KE. Complement deficiency and autoimmunity. Curr Opin Pediatr 1998; 10: 600-6.
5. Pickering MC, Walport MJ. Links between complement abnormalities and systemic lupus erythematosus. Rheumatology 2000; 39: 133-41.
6. Traustadóttir KH, Rafnar BO, Steinsson K, Valdimarsson H, Erlendsson K. Participation of factor B in residual immune complex red cell binding activity observed in serum from a C2-deficient systemic lupus erythematosus patient may delay the appearance of clinical symptoms. Arthritis Rheum 1998; 41: 427-34.
7. Blanchong CA, Zhou B, Rupert KL, et al. Deficiencies of human complement component C4A and C4B and heterozygosity in length variants of RP-C4-CYP21-TNX (RCCX) modules in caucasians. The load of RCCX genetic diversity on major histocompatibility complex-associated disease. J Exp Med 2000; 191: 2183-96.
8. Steinsson K, Árnason A, Erlendsson K, et al. A study of the major histocompatibility complex in a Caucasian family with multiple cases of systemic lupus erythematosus: association with the C4AQ0 phenotype. Rheumatol 1995; 22: 1862-6.
9. Steinsson K, Jónsdóttir S, Arason GJ, et al. A study of the association of HLA DR, DQ, and complement C4 alleles with systemic lupus erythematosus in Iceland. Ann Rheum Dis. 1998; 57: 503-5.
10. Schifferli JA, Steiger G, Paccaud JP, Sjoholm AG, Hauptmann G. Difference in the biological properties of the two forms of the fourth component of human complement (C4). Clin Exp Immunol 1986; 63: 473-7.
11. Arason GJ, D'Ambrogio MS, Víkingsdóttir Þ, Sigfússon Á, Valdimarsson H. Enzyme immunoassays for measuring complement-dependent prevention of immune precipitation (PIP) and solubilization of preformed antigen-antibody complexes (SOL). J Immunol Methods 1999; 223: 37-46.
12. Arason GJ, Steinsson K, Kolka R, Víkingsdóttir Þ, D'Ambrogio MS, Valdimarsson H. Patients with systemic lupus erythematosus are defective in complement-dependent prevention of immune precipitation. Rheumatology 2004; 43: 783-9.
13. Arason GJ, Geirsson ÁJ, Kolka R, Víkingsdóttir Þ, Valdimarsson H. Deficiency of complement-dependent prevention of immune precipitation in systemic sclerosis. Ann Rheum Dis 2002; 61: 257-60.
14. Arason GJ, Kolka R, Hreiðarsson ÁB, et al. Defective prevention of immune precipitation in autoimmune diseases is independent of C4*AQ0. Clin Exp Immunol 2005; 140: 572-9.
15. Arason GJ, Kolka R, Nilsson-Ekdahl K, Nilsson B, Steinsson K, Rönnelid J. Enhanced immune complex precipitation in SLE is mediated by antibodies to C1q. Immunobiology 2005; 210: 488.
16. Walport MJ. Complement and systemic lupus erythematosus. Arthritis Res 2002;4 Suppl 3:S279-93.
17. Stefánsson Thors V, Kolka R, Sigurðardóttir SL, Eðvardsson VO, Arason G, Haraldsson Á. Increased frequency of C4B*Q0 alleles in patients with Henoch-Schönlein purpura. Scand J Immunol 2005; 61: 274-8.
18. McLean RH, Wyatt RJ, Julian BA. Complement phenotypes in glomerulonephritis: increased frequency of homozygous null C4 phenotypes in IgA nephropathy and Henoch-Schönlein purpura. Kidney Int 1984; 26: 855-60.
19. Sævarsdóttir S, Steinsson K, Lúðvíksson BR, Gröndal G, Valdimarsson H. Mannan-binding lectin may facilitate the clearance of circulating immune complexes--implications from a study on C2-deficient individuals. Clin Exp Immunol 2007; 148: 248-53.
20. Traustadóttir KH, Sigfússon Á, Steinsson K, Erlendsson K. C4A deficiency and elevated level of immune complexes: the mechanism behind increased susceptibility to systemic lupus erythematosus. J Rheumatol 2002; 29: 2359-66.
21. Kristjánsdóttir H, Bjarnadóttir K, Hjálmarsdóttir IB, Gröndal G, Árnason A, Steinsson K. A study of C4AQ0 and MHC haplotypes in Icelandic multicase families with systemic lupus erythematosus. J Rheumatol 2000; 27: 2590-6.
22. Traustadóttir KH, Steinsson K, Erlendsson K. C4AQ0 superimposed on a primary defect increases the susceptibility to systemic lupus erythematosus (SLE) in a family with association between C4AQ0 and SLE. J Rheumatol 1998; 25: 2118-25.
23. Steinsson K, Arnason A, Erlendsson K, et al. A study of the major histocompatibility complex in a Caucasian family with multiple cases of systemic lupus erythematosus: association with the C4AQ0 phenotype. J Rheumatol 1995; 22: 1862-6.
24. Manderson AP, Botto M, Walport MJ. The role of complement in the development of systemic lupus erythematosus. Annu Rev Immunol 2004; 22: 431-56.
garason@lsh.is
