12. tbl 93. árg. 2007
Umræða og fréttir
Tilkynningar um aukaverkanir lyfja auka öryggi í notkun þeirra. Elín Ingibjörg Jacobsen
 Hvers vegna er mikilvægt að tilkynna aukaverkanir?
Hvers vegna er mikilvægt að tilkynna aukaverkanir?
Lyfjagát (Pharmacovigilance) er eftirlit með aukaverkunum lyfja og felst meðal annars í því að finna áður óþekkt og óvænt tengsl á milli lyfs og aukaverkunar. Vert er að minna lækna og annað heilbrigðisstarfsfólk á að fyrstu fimm árin eftir að nýtt lyf kemur á markað eru talin þau mikilvægustu í skráningu aukaverkana. Lyfið hefur einungis verið notað af takmörkuðum fjölda þátttakenda í klínískum rannsóknum, en eftir að það kemur á markað fjölgar notendum yfirleitt hratt og þá fyrst koma sjaldgæfari aukaverkanir í ljós. Lyfjagát er oft eina leiðin til að uppgötva mjög sjaldgæfar aukaverkanir.
Mikilvægt er að uppgötva nýjar aukaverkanir snemma, sérstaklega ef þær varða almannaheill og kalla á aðgerðir heilbrigðisyfirvalda.
Lyfjastofnun hvetur lækna til þess að tilkynna aukaverkanir. Þess ber að geta að tilkynna skal þó aðeins sé grunur um tengsl lyfs og aukaverkunar. Fyllsta trúnaðar er gætt gagnvart þeim sem tilkynna um aukaverkun.
Einfalt er að tilkynna aukaverkun rafrænt á heimasíðu Lyfjastofnunar www.lyfjastofnun.is og þar má einnig finna allar leiðbeiningar um hvað skal tilkynna.
Tekið skal fram að tilkynna skal allar alvarlegar aukaverkanir lyfja þó að umrædd aukaverkun sé þekkt fyrir viðkomandi lyf. Fleiri alvarlegar aukaverkanir vegna ákveðins lyfs geta breytt upplýsingum um lyfið á þann veg að sjaldgæf alvarleg aukaverkun getur orðið algeng alvarleg aukaverkun.
Hvernig stöndum við okkur í samanburði önnur Norðurlönd?
Árið 2006 birtist í Læknablaðinu samantekt Lyfjastofnunar á fjölda tilkynninga aukaverkana á tímabilinu 1999-2004 en þá hafði verið í gangi sérstakt átak til að hvetja lækna til að tilkynna aukaverkanir.
Á því tímabili hafði tilkynningum farið fjölgandi en Ísland var þó eftirbátur í samanburði við önnur Norðurlönd. Í greininni kom fram að umreiknað á hverja 300.000 íbúa var fjöldi tilkynntra aukaverkana fyrir árið 2004 nálægt 115 í Noregi og 135 í Svíþjóð en aðeins 24 á Íslandi.
Markmiðið er að ná svipuðum árangri í fjölda tilkynninga og er í nágrannalöndum okkar.
Mynd 1 sýnir þróunina á Íslandi miðað við önnur Norðurlönd á árunum 2004-2006 miðað við milljón íbúa.
Þar sést að fjöldi tilkynninga á Íslandi er svipaður og í Finnlandi en nokkuð á eftir hinum Norðurlöndunum.
Hver er staðan í dag á Íslandi?
Árið 2005 fjölgaði tilkynningum á Íslandi verulega úr 24 í 84 og árið 2006 voru þær 71. Á þessu ári stefnir í að fjöldi tilkynninga verði svipaður og teljum við að betur megi gera ef duga skal.
Alvarleg aukaverkun: Aukaverkun hjá mönnum sem leiðir til dauða, lífshættulegs ástands, veldur fötlun, fjarveru frá vinnu, fæðingargalla, sjúkrahúsvist eða lengingar á sjúkrahúsvist.
Óvænt aukaverkun: Allar óvæntar aukaverkanir sem grunur leikur á að tengist lyfinu, bæði alvarlegar og ekki, og ekki eru skráðar í samantekt á eiginleikum lyfs (SPC).
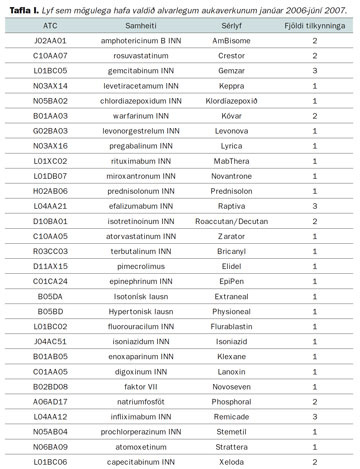
Tafla I sýnir hvaða lyf (raðað í starfrófsröð eftir sérlyfjaheitum) tengdust tilkynningum um alvarlegar aukaverkanir frá janúar 2006 - júní 2007 og hversu margar tilkynningar bárust á tímabilinu vegna þessara lyfja. Þessar upplýsingar eru birtar tvisvar á ári á heimasíðu Lyfjastofnunar þar sem fjallað er um tölfræði.
Hvað verður um tilkynningar um aukaverkanir?
Ísland er þátttakandi í Evrópusamstarfi lyfjastofnana og er hluti þessa samstarfs fólginn í því að senda tilkynningar um aukaverkanir í sameiginlegan gagnagrunn, EudraVigilance. Frá og með 1. janúar 2007 hefur Lyfjastofnun sent allar tilkynningar sem henni berast í EudraVigilance gagnagrunninn, hvort sem þær eru alvarlegar eða ekki. Fyrir þann tíma voru eingungis sendar alvarlegar tilkynningar í grunninn.
Lyfjastofnun sendir einnig allar tilkynningar í gagnagrunn Alþjóðaheilbrigðisstofnunarinnar (WHO), Vigibase.
WHO safnar á ári yfir 200.000 tilkynningum um aukaverkanir.
Á árinu 2001 voru 55.038 nýjar ætlaðar aukaverkanir lyfja tilkynntar til WHO þar af voru 746 tilvik sem kölluðu á nánari skoðun. Sérfræðingar meta hvort raunverulega sé um að ræða nýja aukaverkun, hversu óvænt verkunin er miðað við verkunarhátt lyfsins og hver einkenni aukaverkunarinnar eru.
Í báðum þessum gagnagrunnum er sjálfvirk skimun til að finna vísbendingar um nýja aukaverkun (signal detection).
Komi fram vísbending um nýja aukaverkun sem virðist mikilvæg fer af stað ferill til að rannsaka tengsl lyfs og aukaverkunar og áhrif á öryggi viðkomandi lyfs. Slíkt mat byggist á læknisfræði, faraldsfræði, lyfjafræði og öryggissjónarmiðum.
Vísbending um nýja aukaverkun er því meira en tölfræðileg tengsl lyfs og aukaverkunar. Vísbending leiðir til tilgátu ásamt rökum með og á móti tilgátunni.
Í stuttu máli má segja að vísbending sé sterkur grunur um hugsanleg tengsl lyfs og aukaverkunar. Rannsaka þarf öll tengsl með því að meta þau gögn sem fyrir liggja. Mikilvægt er að fylgja eftir slíkum vísbendingum.
Venjulega þarf fleiri en eina tilkynningu til að grunur vakni en það fer eftir því hversu alvarleg aukaverkunin er. Sé aukaverkun mjög alvarleg nægja fá tilfelli til að nánari skoðun fari fram. Niðurstaða slíkrar skoðunar eða vísindalegs mats getur leitt til breytinga í samantekt á eiginleikum lyfsins, SPC (Summary of Product Characteristics) og upplýsingum til sjúklinga. Í alvarlegum tilvikum getur þurft að taka lyfið af markaði. Niðurstaðan getur einnig verið sú að ekki sé um raunveruleg tengsl á milli lyfs og aukaverkunar að ræða.
Komi fram vísbending um mjög alvarlega aukaverkun fer í gang samskiptanet lyfjastofnana innan Evrópu (Rapid Alert) og kallað er eftir upplýsingum frá aðildarlöndum um tilkynntar auka?verkanir fyrir viðkomandi lyf. Lyfjagátarhópur EMEA (PharmacoVigilance Working Party, PhVWP) og sérfræðinefnd EMEA um lyf fyrir menn (Committee for Medicinal Products for Human Use , CHMP) fara yfir málið og kalla eftir upplýsingum og gögnum frá markaðsleyfishafa lyfsins.
Hver sem niðurstaðan verður er það sérfræðinefnd EMEA um lyf fyrir menn sem gefur út álit þar að lútandi.
Komi í ljós að um bráða hættu fyrir almannaheill er að ræða (serious threat to public health) er sent bréf til lækna, svonefnt "Dear Healthcare Professional Letter", þar sem þeim er gerð grein fyrir málinu. Það er því mjög mikilvægt að ætlaðar aukaverkanir séu tilkynntar.
Tilkynningum aukaverkana á Íslandi hefur fjölgað undanfarin ár. Læknar hafa orðið meðvitaðri um mikilvægi þess að tilkynna. Á undanförnum árum eru þekkt dæmi um alvarlegar aukaverkanir eftir að lyf kom á markað. Á Íslandi er ekki lagaleg skylda að tilkynna aukaverkanir en hins vegar er um siðferðislega skyldu að ræða og faglega ábyrgð. Þó að um fáar tilkynningar sé að ræða er Ísland hluti að alþjóðasamstarfi og leggur sitt af mörkum í samstarfi þjóða um lyfjagát.
Sjá nánar
Jóhannsson M, Ágústsdóttir E. Tilkynningar um aukaverkanir lyfja á Íslandi á árunum 1999-2004. Læknablaðið 2006; 92: 283-7.
EMEA, Eudravigilance humanhttp://eudravigilance.org/human/index.asp
EMEA, Committee for Medicinal Products for Human Use (CHMP)
www.emea.europa.eu/htms/general/contacts/CHMP/CHMP.html
Meyboom RBH Lindquist M, Egberts ACG, Ralph Edwards I. Signal Selection and Follow-Up in Pharmacovigilance. Drug Safety 2002; 25: 459-65.
Årsrapport, Legemiddelbivirkninger i Norge www.legemiddelverket.no
Läkemedelsverket, Biverkningsarbetet
www.lakemedelsverket.se
Legemiddelsstyrelsen. Meddelelser om bivirkninger i Danmark.
www.laegemiddelstyrelsen.dk
Finland, Läkemedelsverket. www.nam.fi
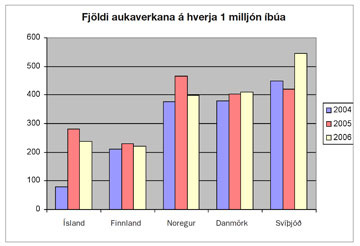
Mynd 1. Fjöldi tilkynntra aukaverkana á Norðurlöndum 2004-2006. Athugið að tölurnar miðast við hverja 1 milljón íbúa.
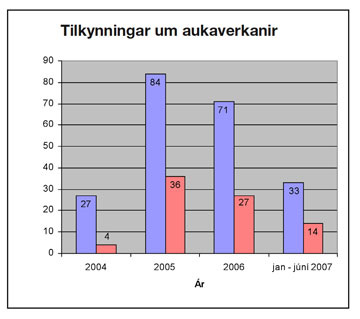
Mynd 2. Bláa súlan sýnir heildarfjölda tilkynninga á Íslandi á árunum 2004-júní 2007 og rauða súlan sýnir fjölda alvarlegra aukaverkana.