Fræðigreinar
Hjartaígræðsla
Ágrip
Hjartaígræðsla er í dag viðurkennd meðferð við hjartasjúkdómum á lokastigi, bæði í börnum og fullorðnum. Horfur eftir hjartaígræðslu eru almennt góðar, 85% þeirra sem ganga undir slíka aðgerð eru á lífi eftir eitt ár og um 65% eftir fimm ár. Langvinn höfnun í formi kransæðasjúkdóms er stórt vandamál og veldur flestum dauðsföllum hjartaþega. Fylgikvillar ónæmisbælingar eru hvimleiðir, en lífsgæði eftir hjartaígræðslu eru almennt mjög góð.English Summary |
| Sigfússon G Heart transplantation Læknablaðið 2000; 86: 583-6 Heart transplantation has been established as an accepted treatment for end-stage heart disease, in both adults and children. Survival following heart transplantation today is good, one year actuarial survival is 85% and approximately 65% after five years. Chronic rejection presenting as an post-transplant coronary artery disease is the main limiting factor for long term survival. Complications from immunosuppression are troublesome, but quality of life is generally very good. Key words: heart transplantation, heart diseases. Correpondence: Gunnlaugur Sigfússon. E-mail: gulli@rsp.is |
Inngangur
Hjartaígræðsla er í dag viðurkennd meðferð við hjartasjúkdómum á lokastigi. Þessi aðgerð hefur gjörbreytt viðhorfi okkar til margra hjartavöðvasjúkdóma og meðfæddra hjartagalla, sem áður voru taldir ólæknanlegir. Lífshorfur einstaklinga sem gengið hafa undir hjartaígræðslu fara sífellt batnandi, en aðgerðin er þó engan veginn fullkomin lækning. Þótt nýtt hjarta geti umbreytt lífi viðkomandi einstaklings eru mörg vandamál samfara þessu nýja framandi líffæri. Við tekur varanlegt eftirlit hjá læknum og ævilöng lyfjameðferð, sem ekki er án aukaverkana (1). Sögulegt yfirlit
Árið 1967 framkvæmdi Dr. Barnard í Cape Town í Suður Afríku fyrsta hjartaflutninginn í mann og vakti þessi aðgerð mikla athygli (2). Næstu árin voru margir hjartaflutningar framkvæmdir víða um heim en árangur af hjartaígræðslu á þessum árum var hins vegar mjög slakur, einkum sökum vanþekkingar á höfnun og/eða sýkingum samfara ónæmisbælingu. Vegna þessa bönnuðu margar stofnanir þessa aðgerð og annars staðar lognaðist hún út af. Nokkrar stofnanir héldu þó áfram rannsóknum og tilraunastarfsemi með þessa líffæraflutninga. Með tilkomu cýklósporíns um 1980 vaknaði áhugi manna aftur á hjartaígræðslu og öðrum líffæraflutningum (3). Ígræðsla á bavíanahjarta í nýbura með ólæknanlegan meðfæddan hjartagalla (vanþroska vinstri slegil) á árinu 1984 bar þessa aðgerð á forsíður dagblaða og á ný inn í vísindarit læknisfræðinnar (4). Frá þessum tíma hefur fjöldi hjartaflutninga í heiminum aukist mikið og náði fjöldi þeirra hámarki um 1990 með um 4500 aðgerðum á ári (mynd 1). Síðan hefur aðgerðum fækkað, einkum vegna skorts á líffærum, en árlega eru nú framkvæmdar um 4000 slíkar aðgerðir í Evrópu og Bandaríkjunum (5).Àbendingar fyrir hjartaígræðslu
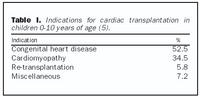
Val á sjúklingum fyrir hjartaígræðslu er einn erfiðasti og mest krefjandi hluti þessarar aðgerðar, sérlega ef haft er í huga að aðgerðin er ekki varanleg lækning. Á það ekki síður við í börnum og ungu fólki sem gera má ráð fyrir að eigi sér annars langt líf fyrir höndum. Almennt þarf viðkomandi að hafa hjartasjúkdóm á lokastigi og þannig vart hugað líf lengur en 6-12 mánuði. Önnur hefðbundin læknismeðferð þarf að vera fullreynd og ekki mega vera neinar frábendingar fyrir aðgerðinni.Helstu ábendingar fyrir hjartaígræðslu í börnum eru hjartagallar og hjartavöðvasjúkdómar (tafla I). Hjá yngri börnum eru hjartagallar algengasta ástæðan fyrir hjartaígræðslu, en hjá eldri börnum og unglingum eru hjartavöðvasjúkdómar algengari ábending (1,5). Þeir hjartagallar sem leitt hafa til ígræðslu eru fyrst og fremst vanþroska vinstri slegill í nýburum, en hjá eldri börnum eru það hjartagallar sem reynt hefur verið að gera við en ekki gengið sem skyldi. Þeir hjartavöðvasjúkdómar í börnum sem eru ábendingar fyrir ígræðslu eru bæði bráð hjartavöðvabólga, en einnig aðrir hjartavöðvasjúkdómar, ýmist sem hluti af meðfæddum efnaskiptasjúkdómi eða hjartavöðvaslen (cardiomyopathy) (1) af óþekktum orsökum.
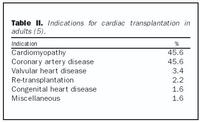
Helstu ábendingar fyrir hjartaígræðslu í fullorðna eru hjartavöðvasjúkdómar og kransæðasjúkdómar eða afleiðingar þeirra, en í mun færri tilfellum meðfæddir hjartasjúkdómar eða lokusjúkdómar (tafla II) (5). Þeir hjartavöðvasjúkdómar sem leiða til ígræðslu í fullorðnu fólki eru hinir sömu og hjá unglingum, það er hjartavöðvasjúkdómur sem hluti af efnaskiptasjúkdómi eða hjartavöðvaslen af óþekktum orsökum.
Um helmingur af hjartaígræðslum í fullorðnu fólki er vegna blóðþurrðarsjúkdóma sem ekki er hægt að meðhöndla á annan hátt í hjartaþræðingu eða með skurðaðgerð.
Frábendingar fyrir hjartaígræðslu
Frábendingar fyrir hjartaígræðslu geta verið algerar til dæmis ef um óafturkræfa lifrar-, nýrna-, eða öndunarbilun er að ræða. Þá er lungnaháþrýstingur frábending fyrir hjartaígræðslu en slíkir einstaklingar geta gengist undir lungna- eða hjarta- og lungnaígræðslu. Útlægur æðasjúkdómur eða heilaæðasjúkdómur eru frábendingar en einnig geta önnur veikindi, svo sem sýkingar eða illkynja sjúkdómar verið frábending í vissum tilfellum. Geðsjúkdómar, taugasjúkdómar og slæm meðferðarheldni geta verið frábending fyrir hjartaígræðslu. Aldur er umdeild og afstæð frábending.Undirbúningur fyrir aðgerð
Mat hjartalæknisins snýr að því að staðfesta fyrri greiningu, meta almennar horfur sjúklingsins og huga að öðrum meðferðarmöguleikum. Nær allir gangast undir hjartaþræðingu til greiningar á æðatengingu hjartans, til að ákvarða stærð lungnaslagæða og ákvarða sérstaklega þrýsting og viðnám í lungnablóðrás. Hækkað viðnám í lungnablóðrás eykur áhættu í aðgerðinni og getur verið frábending. Mikilvægt er að meta samdráttarhæfni hjartavöðvans og hjartaútfall en niðurstöður þess geta verið hjálplegar upplýsingar við tímasetningu aðgerðarinnar. Hjarta líffæragjafans er skoðað með hjartaómun fyrir líffæraflutninginn og góð virkni líffærisins án aðstoðar samdráttarhvetjandi lyfja er venjulega skilyrði fyrir líffæragjöf. Aðrir þættir sem þarf að huga að eru blóðflokkun og stærð líffærisins.
Hjartaígræðslan
Hjartaígræðslan sjálf er almennt talin frekar auðveld hjartaskurðaðgerð og er hægt að framkvæma við nær öllum gerðum meðfæddra hjartagalla þar sem staðsetning ósæðarinnar, lungnaslagæðarinnar og vinstri gáttar er alltaf hin sama. Hjarta líffæragjafans er venjulega ekki utan líkama lengur en fjórar til sex klukkustundir eftir að það hefur verið tekið út og þann tíma er það geymt í sérstakri lausn. Með sjúklinginn tengdan hjarta- og lungnavél er hjarta líffæraþegans numið brott og hið nýja hjarta er grætt í. Ósæð og lungnaslagæð hins nýja líffæris eru tengdar samsvarandi æðum og vinstri og hægri gátt eru tengdar gáttum líffæraþegans. Hjartað byrjar svo að slá í hinu nýja umhverfi þegar líkamshita hefur verið náð og samtímis er sjúklingurinn vaninn af hjarta- og lungnavélinni.
Eftir aðgerðina er oftast tímabundin þörf á samdráttarhvetjandi lyfjum enda minniháttar vanvirkni hjartavöðvans algeng fyrst eftir aðgerðina. Þessi vanvirkni er talin vera vegna blóðþurrðarskemmda og skorts á hvatningu frá ósjálfráða taugakerfinu. Gjörgæslumeðferð eftir líffæraflutninginn er í öllum meginatriðum svipuð gjörgæslumeðferð eftir opnar hjartaaðgerðir ef frá er talin ónæmisbælingin. Ónæmisbælandi meðferð þarf að byrja um leið og hið nýja líffæri er grætt í og samanstendur hún í upphafi af háum skömmtum af barksterum ásamt öðrum ónæmisbælandi lyfjum.
Lífeðlisfræði hins ígrædda líffæris
Þar sem hluti hægri gáttar er skilinn eftir við hjartaflutning eru í raun tveir hlutar af hægri gátt eftir í hjartaþeganum. Þar með eru líka tveir sínus hnútar óháðir hvor öðrum og má greina það á hjartalínuriti hjartaþega. Hægra greinrof er einnig mjög algengt á hjartalínuriti hjartaþega. Hið nýja hjarta hefur enga beina tengingu við ósjálfráða taugakerfið þar sem skorið er á taugar við ígræðsluna. Skortur á boðum frá skreyjutaug (vagus nerve) veldur óvenju hröðum grunnhjartslætti og einnig breytist svörun hjartsláttar við áreynslu. Vöntun á taugaboðum veldur því einnig að engin sársaukaboð eru samfara blóðþurrð í hjartavöðva. Þótt ótrúlegt sé, virðist sem áðurnefnd taugatenging eða hluti hennar geti endunýjast (6). Þrátt fyrir þessa umbreytingu á lífeðlisfræðilegri svörun og hegðun hins nýja hjarta, er starfsemi þess undir flestum kringumstæðum eðlileg.Lyfjameðferð hjartaþega
Grunnónæmisbæling er venjulega cýklósporín eða takrólímus, sem eru bæði sérhæfð ónæmisbælandi lyf og hafa þau svipaðan verkunarmáta og aukaverkanir. Azatíóprín eða mýkófenólat mófetíl er oftast bætt við, sem frekari ónæmisbælingu. Barksterar eru notaðir fyrst eftir ígræðsluna en reynt er að hætta notkun þeirra eftir fyrstu sex mánuðina þar sem þeir valda óæskilegum aukaverkunum, einkum í börnum. Flestir hjartaþegar eru einnig á lyfjum sem miða að því að draga úr aukaverkunum af ónæmisbælandi lyfjum. Þannig eru flestir á fyrirbyggjandi sýklalyfjameðferð og lyfjameðferð við háum blóðþrýstingi og hækkaðri blóðfitu.
Eftirlit
Eftirlit hjartaþega er sérhæft og miðast einkum við að fylgjast með mögulegri höfnun á hinu nýja líffæri, möguleika á sýkingu eða aukaverkunum frá ónæmisbælandi lyfjum. Almenn líkamsskoðun, blóðrannsóknir og ómskoðun á hjarta eru framkvæmdar mánaðarlega fyrst eftir ígræðsluna og á sex mánaða fresti eftir fyrsta árið. Mikilvægt er að fylgjast náið með ónæmisbælingu og fylgikvillum hennar.Einn flóknasti þátturinn í eftirliti hjartaþega, er að fylgjast með höfnun í hinu nýja líffæri. Það er gert með því að taka vefjasýni úr hjartavöðvanum (endomyocardial biopsy). Hjartaþræðing er gerð á venjubundinn hátt og þar til gerð töng er þrædd inn í hægri slegil þar sem vefjasýnin eru tekin. Þetta er venjulega gert á sex mánaða millibili, örar fyrst eftir ígræðslu eða ef vandamál verða, en sjaldnar þegar lengra líður frá ígræðslunni.
Höfnun
Höfnun líkamans á hinu framandi líffæri er ætíð yfirvofandi hjá líffæraþegum og eru hjartaþegar þar engin undantekning. Höfnun má skipta í bráða og langvinna höfnun, sem tekur á sig mismunandi form. Bráð höfnun kemur fram þegar ónæmisbæling er minnkuð eða ef aðrar ytri aðstæður eru ónæmissvörun í vil. Klínísk einkenni höfnunar eru ósértæk og lúmsk og því mikilvægt fyrir þá sem annast slíka sjúklinga að hafa þann möguleika ávallt í huga. Aukaslög frá hjarta og hjartsláttartruflanir eða fyrstu gráðu leiðslurof þarf að taka alvarlega í hjartaþegum þar sem slíkt geta verið fyrstu einkenni um höfnun. Grunur um bráða höfnun vaknar oft á klínískum grunni en greiningin sjálf byggist á sérstöku vefjafræðiútliti á vefjasýni úr hjartavöðvanum, eins og kemur fram að ofan. Til er alþjóðlegur staðall eða kerfi þar sem hjartavefjasýnin eru metin eftir vefjafræðilegu útliti þeirra og gráða frá 1 til 4 ákvörðuð eftir því hversu slæm höfnunin er (8).
Langvinn höfnun er talin vera orsökuð af endurteknum bráðum höfnunum eða viðvarandi höfnun og kemur fram sem kransæðasjúkdómur í hinu ígrædda líffæri (9). Þessi kransæðasjúkdómur (post transplant coronary artery disease) er vefjafræðilega ólíkur venjulegum kransæðasjúkdómi. Orsakir hans eru enn óþekktar en miklar rannsóknir eru á þessu sviði í dag þar sem augu manna hafa beinst meðal annars að hækkaðri blóðfitu og cýtómegalóveiru sem hugsanlegum orsakavöldum (10,11). Útbreidd þrengsli í smáum kransæðum gera þennan kvilla mjög erfiðan í greiningu (9,12). Kransæðamyndataka er ennþá helsta greiningaraðferðin og er hún gerð í hjartaþræðingu, árlega eða annað hvert ár. Greining þessa sjúkdóms er ekki aðeins erfið og flókin, heldur er meðferð einnig mjög erfið og oft takmörkuð. Lyfjameðferð, kransæðavíkkun í þræðingu eða hjáveituskurðaðgerð bera oft takmarkaðan árangur þar sem sjúkdómurinn er aðallega í smáum æðum og oft ekki eins staðbundinn og venjulegur kransæðasjúkdómur (9). Endurtekin hjartaígræðsla er því oft eini meðferðarmöguleikinn. Þessi langvinna höfnun í formi kransæðasjúkdóms veldur flestum dauðsföllum hjartaþega (5).
Árangur eftir hjartaígræðslu
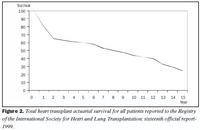
Horfur eftir hjartaígræðslu í dag verða að teljast góðar og víðast eru um 85% sjúklinga á lífi ári eftir aðgerðina. Fimm ára lifun er í dag um 65% og 10 ára um 45-50% (mynd 2). Lifun hefur heldur farið batnandi undanfarin ár (1,5). Langvinn höfnun veldur flestum dauðsföllum hjartaþega, eða fjórðungi. Bráð höfnun, sýkingar og krabbamein eru aðrar helstu dánarorsakir hjartaþega (5).
Þættir sem sýnt hefur verið fram á að geti haft áhrif á lifun eru aldur og langur blóðþurrðartími gjafahjarta (5). Aldur hjartaþega getur líka haft áhrif á lifun en yngstu og elstu einstaklingunum hefur farnast verr. Þá hefur ástand hjartaþega, einkum ef þörf er á öndunarvél eða hjarta- og lungnavél fyrir aðgerð, neikvæð áhrif á lifun (5).
Lífsgæði eftir hjartaígræðslu eru yfirleitt góð þó ætíð sé erfitt að finna mælikvarða til að meta slíkt (13). Líkamleg færni eftir hjartaígræðslu, byggð á áreynslugetu er góð og athuganir á hinu ígrædda líffæri sýna að virkni þess helst mjög góð mörgum árum eftir ígræðslu (1).
Hjartaígræðslur í Íslendinga
Níu Íslendingar hafa gengist undir hjarta- eða hjarta- og lungnaígræðslu. Fyrsta aðgerðin var framkvæmd 1988 en sú síðasta 1997. Flestir voru þessir einstaklingar ungir þegar þeir fóru í aðgerð og þar á meðal eru tvö börn. Fimm einstaklingar hafa fengið ígrætt hjarta en fjórir hjarta og lungu. Þrjár fyrstu aðgerðirnar voru gerðar í Englandi en hinar sex síðari í Svíþjóð. Þessar hjartaígræðslur hafa verið vegna meðfædds hjartagalla, hjartavöðvasjúkdóms og bráðrar hjartavöðvabólgu. Tveir einstaklingar hafa látist, annar eftir hjartaígræðslu og hinn eftir hjarta- og lungnaígræðslu, báðir á fyrsta ári eftir aðgerð. Hinum sjö hefur farnast vel.Heimildir
1. Sigfusson G, Fricker FJ, Bernstein D, Addonizio LJ, Webber SA, Baum D, et al. Long term survivors of pediatric heart transplantation: a multicenter report of 68 children who have survived greater than five years. J Pediatr 1997; 6: 862-71.2. Barnard CN. The operation. A human cardiac transplant: An interim report of a successful operation performed at Groote Schuur Hospital, Cape Town. S Afr J 1967; 41: 1271-4.
3. Reitz BA, Bieber CP, Raney AA, Pennock JL, Jamieson SW, Oyer PE, et.al. Orthotopic heart and combined heart-lung transplantation with cyclosporine A immunosuppression. Transplant Proc 1981; 13: 393-6.
4. Bailey LL, Nehlsen-Cannarella SL, Conception W, Jolley WB. Baboon-to-human cardiac xenotransplantation in a neonate. JAMA 1985; 254: 3321-9.
5. Hosenpud JD, Bennett LE, Keck BM, Fiol B, Boucek MM, Novick RJ. The registry of the international society for heart and lung transplantation: sixteenth official report-1999. J Heart Lung Transplant 1999; 18: 611-27.
6. Stark RP, McGinn AL, Wilson RF. Chest pain in cardiac transplant recipients: Evidence of sensory reinnervation after cardiac transplantation. N Engl J Med 1991; 324: 1791-4.
7. Billingham ME. Diagnosis of cardiac rejection by endomyocardial biopsy. Heart Transplant 1982; 1: 25-30.
8. Billingham ME, Cary NRB, Hammond ME, Kemnitz J, Marboe C, McCalliester HA, et al. A working formulation for the standardization of nomenclature in the diagnosis of heart and lung rejection: Heart rejection study group. J Heart Lung Transplant 1990; 9: 587-93.
9. Johnson DE, Alderman EL, Schroeder JS. Transplant coronary artery disease: Histopathologic correlation with angiographic morphology. J Am Coll Cardiol 1991; 17: 449-56.
10. Barbir M, Kushwaha S, Hunt B, Macken A, Thompson GR, Mitchell A, et al. Lipoprotein (a) and accelerated coronary artery disease in cardiac transplant recipients.. Lancet 1992; 340: 1500-2.
11. Melnick JL, Adam E, DeBakey ME. Possible role of cytomegalovirus in atherogenesis. JAMA 1990; 263: 2204-7.
12. Uretsky BF, Kormos RL, Zerbe TR, Lee A, Tokarczyk TR, Murali S, et al. Cardiac events after heart transplantation: Incidence and predictive value of coronary angiography. J Heart Lung Transplant 1992; 11: S45-51.
13. Lawrence KS, Fricker FJ. Pediatric heart transplantation: Quality of life. J Heart Transplant 1987; 6: 329-33.