Fræðigreinar
Bandvefsstofnfrumur. Yfirlitsgrein
Ágrip
Í beinmergnum er að finna ýmsar gerðir stofnfrumna. Meðal þeirra eru blóðmyndandi stofnfrumur (hematopoietic stem cells) og bandvefsstofnfrumur (mesenchymal stem cells). Rannsóknir á líffræði bandvefsstofnfrumna benda til að þær hafi hæfileika til að endurnýja sjálfar sig, fjölga sér og sérhæfast í margar mismunandi frumugerðir: beinfrumur, fitufrumur, brjóskfrumur, frumur sina, taugafrumur og stoðfrumur beinmergs (stromal cells).Mögulegt er að rækta þessar frumur in vitro þó ekki sé til fullnustu þekkt hvernig sérhæfing þeirra á sér stað. Í fjölmörgum dýratilraunum hafa bandvefsstofnfrumur verið græddar í dýrin með það fyrir augum að laga mismunandi tegundir bandvefs og/eða ýta undir blóðmyndun. Tilraunir í mönnum hafa verið gerðar í svipuðum tilgangi. Bandvefsstofnfrumur eru taldar geta eflt ígræðslur með blóðmyndandi stofnfrumum með því að byggja upp beinmergsumhverfið sem verður fyrir skemmdum við geisla- og/eða lyfjameðferð.
Bandvefsstofnfrumur eru ákjósanlegar sem markfrumur í genameðferð. Hægt er að setja inn í þær gen sem skráir fyrir ákveðnu prótíni sem skortur er á, til dæmis kollageni I í beinbrotasýki (osteogenesis imperfecta). Síðan eru frumurnar látnar fjölga sér ex vivo og græddar í sjúkling þar sem þær rata sjálfkrafa í beinmerginn, sérhæfast og mynda það prótín sem vantar. Bandvefsstofnfrumur munu væntanlega nýtast við meðhöndlun ýmissa sjúkdóma í framtíðinni.
English Summary |
| Sigurjónsson ÓE, Guðmundsson KO, Guðmundsson S Mesenchymal stem cells. A review Læknablaðið 2001; 87: 627-32 The bone marrow contains various types of stem cells. Among them are hematopoietic stem cells, which are the precursors of all blood cells, and mesenchymal stem cells. Mesenchymal stem cells have recently received a lot of attention in biological research because of their capability to self renewal, to expand and transdifferentiate into many different cell types; bone cells, adipocytes, chondrocytes, tendocytes, neural cells and stromal cells of the bone marrow. Mesenchymal stem cells can be cultured in vitro although their differentiation potential is not yet fully understood. Several experiments have been conducted in animal models where mesenchymal stem cells have been transplanted in order to enhance hematopoiesis or to facilitate the repair of mesenchymal tissue. Similar experiments are being conducted in humans. Mesenchymal stem cells are believed to be able to enhance hematopoietic stem cells transplantation by rebuilding the bone marrow microenvironment which is damaged after radiation- and/or chemotherapy. Mesenchymal stem cells are promising as vehicles for gene transfer and therapy. It may prove possible to tranduce them with a gene coding for a defective protein i.e. collagen I in osteogenesis imperfecta. The cells could then be expanded ex vivo and transplanted to the patients where they home to the bone marrow, differentiate and produce the intact protein. Future medicine will probably involve mesenchymal stem cells in various treatment settings. Keywords: mesenchymal stem cells, bone marrow microenviroment, hematopoietic stem cells, gene therapy, transplantation. Correspondence: Ólafur E. Sigurjónsson. E-mail: oes@landspitali.is |
Inngangur
Í beinmerg er að finna blóðmyndandi stofnfrumur (hematopoietic stem cells) sem geta myndað allar frumur blóðsins þar með talið blóðflögur, rauðfrumur, einkjarna átfrumur (monocytes), lútfíkla (basophiles), daufkyrninga (neutrophiles), NK-frumur, B-frumur og T-frumur. Í beinmerg er líka að finna aðra tegund stofnfrumna sem geta sérhæfst í beinmyndandi frumur (osteoblasts), fitufrumur, brjóskfumur (chondrocytes), vöðvafrumur (myocytes), ýmsar frumur taugakerfisins (astrocytes, oligodendrocytes) og stoðfrumur beinmergs (stromal cells) (1-3). Þessar stofnfrumur hafa verið kallaðar ýmsum nöfnum til dæmis merg-strómal frumur (4), mesenchymal forverafrumur (5), colony forming unit-fibroblast (CFU-F) (6), mesenchymal stofnfrumur (7) og íslenska heitið, bandvefskímsstofnfrumur. Í þessari grein verður notað heitið bandvefsstofnfruma (mesenchymal stem cell) þó taugafrumur teljist ekki til bandvefs.
Umhverfi beinmergs er myndað úr fitufrumum, stoðfrumum beinmergs, beinforverum, grisjufrumum (reticular cells), æðaþelsfrumum (endothel cells), kleyfkjarna átfrumum (granulocytes) og millifrumuefni. Beinmergsumhverfið er nauðsynlegt til þess að blóðmyndandi stofnfrumur nái að endurnýja sjálfar sig og sérhæfast. Gallar á þessu umhverfi leiða til skertrar blóðmyndunar (8,9). Mýs með stökkbreytingu í geni (SL/Sld), sem veldur galla í myndun stoðfrumna beinmergs, hafa skert blóðfrumukerfi auk þess að svara illa ígræðslu með blóðmyndandi stofnfrumum (10,11).
Þroska blóðmyndandi stofnfrumna er meðal annars stýrt af vaxtarþáttum sem framleiddir eru meðal annars af stoðfrumum beinmergs (12) auk þess sem samskipti við aðrar frumur í gegnum viðtaka á millifrumuefni (matrix receptors) skipta miklu máli fyrir eðlilegan þroska (3,13).
Háskammta lyfja- og geislameðferð veldur verulegum skaða á beinmergsumhverfinu (14,15). Nýleg rannsókn sýndi að fjöldi CFU-F þyrpinga í beinmergsþegum eftir ígræðslu var 60-90% minni en CFU-F þyrpinga heilbrigðra einstaklinga (16). Þetta gefur til kynna að bandvefsstofnfrumur skaðist við slíka meðferð.
Notkun bandvefsstofnfrumna í læknisfræðilegum tilgangi getur orðið margvísleg. Hægt er að auka fjölda bandvefsstofnfrumna í in vitro ræktum án þess að breytingar verði á svipgerð eða hæfni þeirra til sérhæfingar. Þetta gefur fyrirheit um að mögulegt sé að nota frumurnar til ígræðslu í læknisfræðilegri meðferð (3,17). Þar sem bandvefsstofnfrumur geta myndað svo margar mismunandi frumutegundir er mögulegt að nota þær til viðgerðar á skemmdum sem orðið hafa í vefjum, svo sem beinum, brjóski og vöðvum. Í ýmsum sjúkdómum hafa menn reynt að nota genameðferð til að hafa áhrif á gang sjúkdóma með misjöfnum árangri. Bandvefsstofnfrumur eru ákjósanlegar til meðhöndlunar sjúkdóma með genameðferð. Ástæðan er fyrst og fremst sú að hægt er að fjölga þeim ex vivo án þess að þær sérhæfist.
Hugtakið um teygjanleika (plasticity) í frumumyndun er frekar nýtt af nálinni og hefur aðallega verið bundið við fósturþroskun. Gott dæmi um slíkan teygjanleika er að hægt er að klóna heila kind frá einni mjólkurkirtilsfrumu (18) og búa til bein og taugar frá bandvefsstofnfrumum (19). Hæfileiki blóðmyndandi stofnfrumna til að mynda mismunandi frumutegundir, til dæmis megakarýócýta og B-frumur, hefur verið mikið rannsakaður. Rannsóknir á bandvefsstofnfrumum eru skammt á veg komnar og er mikið verk óunnið þar.
Bandvefsstofnfrumur
Bandvefsstofnfrumur er aðallega að finna í beinmerg og í minna magni í naflastrengsblóði (20). Bandvefsstofnfrumur er að finna í hærra hlutfalli í naflastrengsblóði fyrirbura en annarra nýbura (21) og er álitið að bandvefsstofnfrumur flytjist með naflastrengsblóði frá helstu blóðmyndunarstöðum fósturs (lifur, milta) til beinmergs snemma í fósturþroskanum (22). Ekki eru allir á eitt sáttir um hvort bandvefsstofnfrumur sé að finna í blóðrás fullorðinna. Ein rannsókn sýndi fram á að í blóði sjúklinga með brjóstakrabbamein, sem fengið höfðu vaxtarþætti til að ýta blóðmyndandi stofnfrumum úr beinmerg út í blóðrás, var að finna frumur sem höfðu sum svipgerðareinkenni bandvefsstofnfrumna. Þær var ekki að finna í blóðrás heilbrigðra einstaklinga sem fengið höfðu vaxtarþáttargjöf en ekki gengist undir lyfja- og/ eða geislameðferð (23). Sambærilegar niðurstöður hafa ekki fengist í öðrum rannsóknum (24). Þegar skoðuð er tjáning yfirborðssameinda á bandvefsstofnfrumum kemur í ljós munur á þeim og blóðmyndandi stofnfrumum. Bandvefsstofnfrumur ræktaðar in vitro tjá ekki sameindirnar CD34 og CD45 sem eru tjáðar á blóðmyndandi stofnfrumum (25). Eldri rannsóknir, á fósturstofnfrumum í lifur, benda þó til þess að blóðmyndandi stofnfrumur og bandvefsstofnfrumur gæti átt sameiginlega forverafrumu sem tjái CD34 sameindina á yfirborði sínu (26). Hugsanlegt er að CD34 tjáningin sé á bandvefsstofnfrumum þegar þær eru einangraðar úr beinmerg en hverfi þegar frumunum er fjölgað í rækt (27). Líklegt verður þó að telja að þær bandvefsstofnfrumur sem er að finna í beinmerg séu CD34 neikvæðar eða að sameiginlegur forveri bandvefsstofnfrumna og blóðmyndandi stofnfrumna sé CD34 neikvæður (28). Annað sem greinir bandvefsstofnfrumur frá blóðmyndandi stofnfrumum er hæfileiki bandvefsstofnfruma til að mynda frumur margra mismunandi vefja.
Mögulegt er að nota einstofna mótefnin SH2, SH3 og SH4 til að greina bandvefsstofnfrumur frá öðrum CD34-neikvæðum frumum í beinmerg (25). Auk þess tjá bandvefsstofnfrumur, sem einangraðar hafa verið frá einkjarna hvítfrumum úr beinmerg, CD44 (H-CAM), CD71 (viðtaki fyrir transferrin), CD90 (Thy-1) auk nokkurra sameinda sem hafa áhrif á viðloðun (25). Bindistaður SH2 er mótefnavaki (epitope) á endóglín viðtakanum (CD105) en hann er einnig að finna á æðaþelsfrumum, stoðfrumum beinmergs og kleyfkjarna átfrumum (29). CD105 er viðtaki fyrir tumor growth factor b III (TGF-b III). Talið er að CD105 stjórni sérhæfingu bandvefsstofnfrumna yfir í beinforvera og miðli samskiptum á milli bandvefsstofnfrumna og blóðfrumna í beinmergnum þar á meðal blóðmyndandi stofnfrumna (29). Hlutverk viðtaka SH3 og SH4 eru ekki þekkt.
Bandvefsstofnfrumur tjá viðloðunarsameindir (integrin), millifrumuefnisviðtaka (matrix receptors) og seyta ýmsum vaxtarþáttum (cytokines), mikilvægum fyrir blóðmyndun (27). Viðloðunarsameindir eru himnuprótín sem eru mikilvæg í innbyrðis tengslum frumna og tengslum frumna við millifrumuefni. Bandvefsstofnfrumur tjá viðloðunarsameindir -a1, -a2, -b1, -b2, og -b3. Þær tjá ennfremur viðtaka fyrir intracellular adhesion molecule-1 (ICAM-1), vascular cell adhesion molecule-1 (VCAM-1) og platelet endothelial cell adhesion molecule-1 (PECAM-1). Þessar viðloðunarsameindir er að finna á blóðmyndandi stofnfrumum og eru þær taldar gegna mikilvægu hlutverki í viðloðun blóðmyndandi stofnfrumna við stoðfrumur beinmergs (27) og stýringu blóðmyndandi stofnfrumna aftur inn í beinmerginn við stofnfrumuígræðslu (homing) (30).
Bandvefsstofnfrumur seyta ýmsum vaxtarþáttum og efnatogum (chemokines) sem hafa áhrif á þroska og sérhæfingu blóðmyndandi stofnfrumna. Bandvefsstofnfrumur hafa áhrif á stoðfrumur beinmergs með því að örva þær til að seyta ýmsum vaxtarþáttum sem hafa áhrif á þroska og sérhæfingu blóðmyndandi stofnfrumna (31,32). Það sem er þó öllu merkilegra er að bandvefsstofnfrumur hafa fjöldann allan af viðtökum fyrir vaxtarþætti, þá sömu og þær seyta. Þetta getur bent til þess að bandvefsstofnfrumur hafi áhrif á sérhæfingu og fjölgun með virkni efna framleiddum af þeim sjálfum (autocrine-virkni) (25). Meðal vaxtarþátta sem bandvefsstofnfrumur seyta eru interleukin (IL)-1a, -1b, -6, -7, -8, -11, -14 og -15. Þær framleiða ýmsa vaxtarþætti sem hafa áhrif á blóðmyndun; stem cell factor (SCF), thrombopoietin (TPO), Flk-2/Flt-3 ligand (FL-ligand), macrophage-colony stimulating factor (M-CSF), granulocyte- colony stimulating factor (G-CSF) og granulocyte-macrophage-colony stimulating factor (GM-CSF) auk ýmissa fleiri (25).
Sú staðreynd að bandvefsstofnfrumur framleiða thrombópóietin sem stjórnar megakarýócýtaþroska ásamt því að á bandvefsstofnfrumum er að finna megakarýócýtasameindina CD41 styður þá skoðun að bandvefsstofnfrumur stuðli að þroskun megakarýócýta og blóðflagna in vivo þó þær séu ekki nauðsynlegar in vitro (33). Rannsóknir benda til að bandvefsstofnfrumur eigi þátt í því að örva myndun á forstigum blóðflagna (pro-platelets) (33).
Sérhæfing bandvefsstofnfrumna
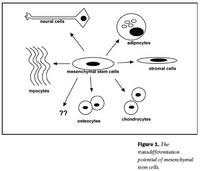
Bandvefsstofnfrumur hafa hæfileika til fjölbreyttari sérhæfingar en þekkt er meðal annarra frumna fullorðinna einstaklinga (34). Fyrstu vísbendingarnar um þennan eiginleika komu fram í dýratilraun þar sem hundur, sem gengist hafði undir ósamgena (allogeneic) beinmergsígræðslu, dó skyndilega vegna beinmyndunar í lungum (35). Í kjölfarið komu nokkrar rannsóknir sem sýndu að bandvefsstofnfrumur geta sérhæfst í margar tegundir bandvefs svo sem bein (36,37), brjósk (37,38), sinar (39), vöðva (40), fituvef (41), stoðvef beinmergs (36) og taugar (42) (mynd 1). Þeir sameindafræðilegu þættir sem eru að verki við þessa sérhæfingu hafa ekki verið skýrðir til fullnustu. In vitro ræktanir á bandvefsstofnfrumum hafa gefið tækifæri til að fylgjast með þroska og sérhæfingu þeirra. Lýst hefur verið aðferðum til þess að rækta brjósk (43,44), fitu- (17) og beinvef (45,46). Þessar ræktunaraðferðir hafa meðal annars sýnt að við myndun brjósks frá bandvefsstofnfrumum fara frumurnar að tjá kollagen af gerð II og ýmis próteóglýkön eftir tvær til þrjár vikur í rækt (43). Þegar fitufrumur myndast frá bandvefsstofnfrumum in vitro tjá frumurnar meðal annars perxisome proliferation-activated receptor (PPARg), lipoprotein lipase (LPL), C/EBPa, fitusýrubindiprótín aP2 og leptín (25). Við myndun beinfrumna frá bandvefsstofnfrumum in vitro verður vart við aukna virkni alkalín fosfatasa, aukna tjáningu á osteókalcíni, osteópontíni, kollageni af gerð I og kalsíumútfellingar eru greinanlegar.
Ígræðslur með bandvefsstofnfrumum
Hlutfall bandvefsstofnfrumna í beinmerg er um það bil 0,001% af einkjarna hvítfrumum (47) og miklu erfiðara er að einangra þær þaðan en CD34+ blóðmyndandi stofnfrumur. Ein leið til að einangra bandvefsstofnfrumur úr beinmerg er að rækta þær úr beinmergssúpunni í viðloðunarræktum. Í þessum ræktunum er mögulegt að viðhalda endurnýjunarhæfileika bandvefsstofnfrumna og láta þær fjölga sér án þess að sérhæfing verði. Þetta er grundvöllur þess að hægt sé að nota bandvefsstofnfrumur til ígræðslu. Ákveðnum spurningum verður að svara áður en hægt er að hefja slíkar ígræðslur í mönnum. Hversu margar bandvefsstofnfrumur þarf til slíkrar ígræðslu? Duga bandvefsstofnfrumur án utanaðkomandi þátta í slíkar ígræðslur? Hafa ígræðslur bandvefsstofnfrumna jákvæð eða neikvæð áhrif á ígræðslu blóðmyndandi stofnfrumna? Fara frumurnar þangað sem þeim er ætlað að fara? Er einhver sérstök hætta fyrir mannslíkamann samfara slíkum ígræðslum? Þessum spurningum hafa menn reynt að svara með ígræðslum bandvefsstofnfrumna í dýr (3).Í músum hefur verið sýnt fram á að gjöf á bandvefsstofnfrumum stuðlar að langtímaígræðslu (longterm engraftment) í beinmerg (37). Einnig hefur verið sýnt fram á að bandvefsstofnfrumur, gefnar öpum og hundum í æð, skila sér að mestu til beinmergs og beina. Bandvefsstofnfrumur er einnig að finna í skamman tíma í öðrum líffærum eins og lungum og lifur, án þess þó að valda þar nokkrum skaða (3,48). Þessar niðurstöður eru studdar af annarri rannsókn í músum þar sem bandvefsstofnfrumur frá gjafanum voru enn greinanlegar í beinmerg þegans rúmum 450 dögum eftir ígræðslu (48). Ekki hefur verið sýnt fram á að dýr hafi hlotið nokkurn skaða af slíkum ígræðslum.
Þar sem beinmergsumhverfið er talið hljóta greinanlegan skaða við háskammta geisla- og/eða lyfjameðferðir hafa menn velt fyrir sér hver sé uppruni stoðfrumna beinmergs eftir ósamgena ígræðslu með blóðmyndandi stofnfrumum (16). Flestar rannsóknir benda til þess að stoðfrumur beinmergs komi frá beimergsþeganum sjálfum, þrátt fyrir bágborið ástand beinmergsumhverfis eftir ígræðslu (16,47,49-51). Þó eru til rannsóknir sem gefa vísbendingu um hið gagnstæða (52,53). Líklegt verður þó að telja að bandvefsstofnfrumur séu upprunnar frá þeganum og þessar mismunandi niðurstöður geti byggt á öðrum þáttum. Meðal þessara þátta eru mismunandi aðferðir manna við að skilgreina bandvefsstofnfrumur, meðhöndlun á stofnfrumugræðlingunum og ástandi beinmergsumhverfisins eftir geisla- og/eða lyfjameðferð (54).
Bandvefsstofnfrumur á hvíldarstigi frumuhringsins (G0) og frumur í skiptingu gegna mismunandi hlutverkum við ígræðslu. Frumur á hvíldarstigi fara líklega beint í beinmerginn, fjölga sér og viðhalda bandvefsfjöldanum til langframa á meðan bandvefsstofnfrumur, sem eru í skiptingu, sjá um viðhald á vefjum þegar til skemmri tíma er litið (55).
Ígræðsla bandvefsstofnfrumna ásamt blóðmyndandi stofnfrumum hefur gefið góða raun í dýrum. Svo virðist sem bandvefsstofnfrumur tryggi betri og áhrifameiri ígræðslu blóðmyndandi stofnfrumna með því að flýta fyrir endurnýjun á beinmergsumhverfinu (56). Dæmi um þetta er tilraun þar sem bandvefsstofnfrumur, ræktaðar ex vivo, voru græddar í ónæmisbældar mýs ásamt blóðmyndandi stofnfrumum úr naflastrengsblóði. Þegar áhrif bandvefsstofnfrumna og ígræðslu blóðmyndandi stofnfrumna voru metin, þá voru CFU-F 10-20 falt meiri miðað við mýs sem einungis fengu blóðmyndandi stofnfrumur (56). Svipaðar niðurstöður hafa fengist í hundum og öpum (48,57).
Bandvefsstofnfrumur í mönnum tjá hvorki HLA- (human leukocyte antigen) flokks II sameindir né hjálparsameindina B7 sem er að finna á angalöngum sýnifrumum (dendritc cells). Þetta eru nokkrar hugsanlegar skýringar þess að bandvefsstofnfrumur eru ekki mjög ónæmisvekjandi (immunogeneic). Sýnt hefur verið fram á að hægt er að bæta árangur ósamgena húðígræðslu í bavíönum með því að gefa þeim bandvefsstofnfrumur að auki. Þessar niðurstöður og fleiri gefa í skyn að bandvefsstofnfrumur hafi ónæmisbælandi áhrif, in vivo, þótt ekki sé vitað um hvernig þeim er miðlað (3).
Klínískar tilraunir
Klínískar tilraunir með samgena (autologous) og ósamgena ígræðslur bandvefsstofnfrumna í menn hafa komið í kjölfar dýratilrauna. Kannað var í sjúklingum með ýmsa illkynja blóðsjúkdóma hvort mögulegt væri að safna bandvefsstofnfrumum og rækta þær ex vivo og gefa síðan sjúklingunum aftur (17). Þetta tókst í flestum sjúklinganna án nokkurra vandkvæða. Í annarri tilraun voru athuguð áhrif þess að gefa konum, með brjóstakrabbamein á háu stigi, samgena bandvefsstofnfrumur ásamt samgena blóðmyndandi stofnfrumum (58). Bandvefsstofnfrumum fjölgaði vel ex vivo og ekki varð vart við neinar aukaverkanir við gjöf bandvefsstofnfrumnanna. Níu dögum eftir ígræðsluna voru bæði blóðflögu- og daufkyrnaframleiðsla komnar í gang (58). Ekki hefur þó verið sýnt fram á langtímaáhrif ígræðslu bandvefsstofnfrumna í mönnum.Ekki hafa verið framkvæmdar margar klínískar tilraunir til að meta áhrif ígræðslu bandvefsstofnfrumna á bein, sinar eða brjósk. Í einni slíkri rannsókn voru börnum með beinbrotasýki gefnar bandvefsstofnfrumur eftir að hafa fengið háskammta lyfja- og geislameðferð. Þetta leiddi til árangurs sem mælanlegur var með aukinni þéttni beina, örari vexti og minni brotatíðni (59).
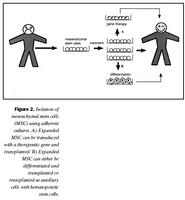
Þessar niðurstöður gefa fyrirheit um að hægt verði að nota bandvefsstofnfrumur til að meðhöndla ýmsa galla í bandvef (mynd 2).
Bandvefsstofnfrumur og genameðferð
Genameðferð er möguleg meðferðarleið til þess að laga galla í genum sem geta leitt til skorts á nauðsynlegum prótínum. Ekki hefur enn orðið mikill árangur af slíkri meðferð, sér í lagi vegna þess að erfitt hefur reynst að þróa góðar genaferjur (27). Kosturinn við genameðferð með blóðmyndandi stofnfrumum og bandvefsstofnfrumum er sá að nægilegt er að koma geninu inn í örfáar frumur sem geta síðan sérhæfst í mismunandi frumugerðir og borið nýja genið með sér (mynd 2). Sá eiginleiki bandvefsstofnfrumna að geta fjölgað sér í rækt án sérhæfingar gerir það möulegt að nota víxlveiru- (retroviral) genaferjur til að koma geni inn í litninga frumnanna (60,61). Víxlveiruferjurnar virðast ekki hafa nein áhrif á hæfileika bandvefsstofnfrumna til sérhæfingar eða fjölgunar (62). Í ónæmisbældum músum hefur tekist að koma interleukin-3 geninu fyrir í stoðfrumum beinmergs, einangruðum úr beinmerg og fá þær til að framleiða interleukin-3 í allt að átta vikur (63). Einnig hefur verið sýnt fram á að merktar bandvefsstofnfrumur, sem gefnar voru ónæmisbældum músum, þroskuðust í sérhæfðar vöðvafrumur sem höfðu merkigenið (40).
Genameðferð með bandvefsstofnfrumum er á frumstigi sem læknisfræðileg meðferð. Möguleikar slíkrar meðferðar eru óþrjótandi hvað varðar bandvefstengda sjúkdóma eins og beinbrotasýki .
Lokaorð
Mikið verk er óunnið í rannsóknum á bandvefsstofnfrumum og því eru þær spennandi og líflegur rannsóknarvettvangur. Þeir ferlar sem stýra fjölbreytni (plasticity) í sérhæfingu eru að miklu leyti óskýrðir. Ekki er heldur ljóst hvað stýrir ferð bandvefsstofnfrumna inn í beinmerginn eftir ígræðslu, og hvernig þær losa tengsl og leita til vefja sem sérhæfðar bandvefsfrumur.Gera má ráð fyrir vaxandi notagildi bandvefsstofnfrumna sem hjálparfrumna við ígræðslur á blóðmyndandi stofnfrumum í framtíðinni. Ennfremur má gera ráð fyrir notkun á bandvefsstofnfrumum til viðgerðar á göllum í beinum, brjóski, sinum og fleiri vefjum. Því er mikilvægt að geta komið upp stöðluðum aðferðum við að einangra, fjölga og rækta bandvefsstofnfrumur með sérhæfingu þeirra í huga. Í nánustu framtíð má búast við því að blóðbankar gegni mikilvægu hlutverki við vinnslu, ræktun og geymslu stofnfrumna með hæfileika til bandvefsmyndunar til viðbótar við hefðbundið hlutverk við vinnslu blóðhluta og blóðmyndandi stofnfrumna.
Þakkir
Dr. Torstein Egeland og Hlíf Steingrímsdóttir fá þakkir fyrir yfirlestur á handriti og góðar ábendingar.Heimildir
1. Caplan AI. Mesenchymal stem cells. J Orthop Res 1991; 9: 641-50.2. Haynesworth SE, Goshima J, Goldberg VM, Caplan AI. Characterization of cells with osteogenic potential from human marrow. Bone 1992; 13: 81-8.
3. Devine SM, Hoffman R. Role of mesenchymal stem cells in hematopoietic stem cell transplantation. Curr Opin Hematol 2000; 7: 358-63.
4. Prockop DJ. Marrow stromal cells as stem cells for nonhematopoietic tissues. Science 1997; 276: 71-4.
5. Conget PA, Minguell JJ. Adenoviral-mediated gene transfer into ex vivo expanded human bone marrow mesenchymal progenitor cells. Exp Hematol 2000; 28: 382-90.
6. Castro-Malaspina H, Gay RE, Resnick G, Kapoor N, Meyers P, Chiarieri D, et al. Characterization of human bone marrow fibroblast colony-forming cells (CFU-F) and their progeny. Blood 1980; 56: 289-301.
7. Caplan AI. The mesengenic process. Clin Plast Surg 1994; 21: 429-35.
8. Dexter TM. Stromal cell associated haemopoiesis. J Cell Physiol Suppl 1982; 1: 87-94.
9. Owen M, Friedenstein AJ. Stromal stem cells: marrow-derived osteogenic precursors. Ciba Found Symp 1988; 136: 42-60.
10. Anklesaria P, Kase K, Glowacki J, Holland CA, Sakakeeny MA, Wright JA, et al. Engraftment of a clonal bone marrow stromal cell line in vivo stimulates hematopoietic recovery from total body irradiation. Proc Natl Acad Sci USA 1987; 84: 7681-5.
11. Anklesaria P, FitzGerald TJ, Kase K, Ohara A, Greenberger JS. Improved hematopoiesis in anemic Sl/Sld mice by splenectomy and therapeutic transplantation of a hematopoietic microenvironment. Blood 1989; 74: 1144-51.
12. Dexter TM, Heyworth CM. Growth factors and the molecular control of haematopoiesis. Eur J Clin Microbiol Infect Dis 1994; 13/Suppl 2: S3-S8.
13. Metcalf D. Regulatory mechanisms controlling hematopoiesis: principles and problems. Stem Cells 1998; 16/Suppl 1: 3-11.
14. Domenech J, Roingeard F, Binet C. The mechanisms involved in the impairment of hematopoiesis after autologous bone marrow transplantation. Leuk Lymphoma 1997; 24: 239-56.
15. Carlo-Stella C, Tabilio A, Regazzi E, Garau D, La Tagliata R, Trasarti S, et al. Effect of chemotherapy for acute myelogenous leukemia on hematopoietic and fibroblast marrow progenitors. Bone Marrow Transplant 1997; 20: 465-71.
16. Galotto M, Berisso G, Delfino L, Podesta M, Ottaggio L, Dallorso S, et al. Stromal damage as consequence of high-dose chemo/radiotherapy in bone marrow transplant recipients. Exp Hematol 1999; 27: 1460-6.
17. Lazarus HM, Haynesworth SE, Gerson SL, Rosenthal NS, Caplan AI. Ex vivo expansion and subsequent infusion of human bone marrow-derived stromal progenitor cells (mesenchymal progenitor cells): implications for therapeutic use. Bone Marrow Transplant 1995; 16: 557-64.
18. Wilmut I, Schnieke AE, McWhir J, Kind AJ, Campbell KH. Viable offspring derived from fetal and adult mammalian cells. Nature 1997; 385: 810-3.
19. Pittenger MF, Mosca JD, McIntosh KR. Human mesenchymal stem cells: progenitor cells for cartilage, bone, fat and stroma. Curr Top Microbiol Immunol 2000; 251: 3-11.
20. Erices A, Conget P, Minguell JJ. Mesenchymal progenitor cells in human umbilical cord blood. Br J Haematol 2000; 109: 235-42.
21. Shields LE, Andrews RG. Gestational age changes in circulating CD34+ hematopoietic stem/progenitor cells in fetal cord blood. Am J Obstet Gynecol 1998; 178: 931-7.
22. Tavassoli M. Embryonic origin of hematopoietic stem cells [editorial; comment]. Exp Hematol 1994; 22: 7.
23. Fernandez M, Simon V, Herrera G, Cao C, Del Favero H, Minguell JJ. Detection of stromal cells in peripheral blood progenitor cell collections from breast cancer patients [see comments]. Bone Marrow Transplant 1997; 20: 265-71.
24. Lazarus HM, Haynesworth SE, Gerson SL, Caplan AI. Human bone marrow-derived mesenchymal (stromal) progenitor cells (MPCs) cannot be recovered from peripheral blood progenitor cell collections. J Hematother 1997; 6: 447-55.
25. Pittenger MF, Mackay AM, Beck SC, Jaiswal RK, Douglas R, Mosca JD, et al. Multilineage potential of adult human mesenchymal stem cells. Science 1999; 284: 143-7.
26. Huang S, Terstappen LW. Formation of haematopoietic microenvironment and haematopoietic stem cells from single human bone marrow stem cell. Nature 1992; 360: 745-9.
27. Deans RJ, Moseley AB. Mesenchymal stem cells: biology and potential clinical uses. Exp Hematol 2000; 28: 875-84.
28. Huss R. Isolation of primary and immortalized CD34-hematopoietic and mesenchymal stem cells from various sources. Stem Cells 2000; 18: 1-9.
29. Barry FP, Boynton RE, Haynesworth S, Murphy JM, Zaia J. The monoclonal antibody SH-2, raised against human mesenchymal stem cells, recognizes an epitope on endoglin (CD105). Biochem Biophys Res Commun 1999; 265: 134-9.
30. Blair A, Thomas DB. Preferential adhesion of fetal liver derived primitive haemopoietic progenitor cells to bone marrow stroma. Br J Haematol 1997; 99: 726-31.
31. Majumdar MK, Thiede MA, Mosca JD, Moorman M, Gerson SL. Phenotypic and functional comparison of cultures of marrow-derived mesenchymal stem cells (MSCs) and stromal cells. J Cell Physiol 1998; 176: 57-66.
32. Haynesworth SE, Baber MA, Caplan AI. Cytokine expression by human marrow-derived mesenchymal progenitor cells in vitro: effects of dexamethasone and IL-1 alpha. J Cell Physiol 1996; 166: 585-92.
33. Cheng L, Qasba P, Vanguri P, Thiede MA. Human mesenchymal stem cells support megakaryocyte and pro-platelet formation from CD34(+) hematopoietic progenitor cells. J Cell Physiol 2000; 184: 58-69.
34. Weissman IL. Translating stem and progenitor cell biology to the clinic: barriers and opportunities. Science 2000; 287: 1442-6.
35. Sale GE, Storb R. Bilateral diffuse pulmonary ectopic ossification after marrow allograft in a dog. Evidence for allotransplantation of hemopoietic and mesenchymal stem cells. Exp Hematol 1983; 11: 961-6.
36. Kuznetsov SA, Friedenstein AJ, Robey PG. Factors required for bone marrow stromal fibroblast colony formation in vitro. Br J Haematol 1997; 97: 561-70.
37. Pereira RF, Halford KW, O'Hara MD, Leeper DB, Sokolov BP, Pollard MD, et al. Cultured adherent cells from marrow can serve as long-lasting precursor cells for bone, cartilage, and lung in irradiated mice. Proc Natl Acad Sci USA 1995; 92: 4857-61.
38. Kadiyala S, Young RG, Thiede MA, Bruder SP. Culture expanded canine mesenchymal stem cells possess osteochondrogenic potential in vivo and in vitro. Cell Transplant 1997; 6: 125-34.
39. Awad HA, Butler DL, Boivin GP, Smith FN, Malaviya P, Huibregtse B, et al. Autologous mesenchymal stem cell-mediated repair of tendon. Tissue Eng 1999; 5: 267-77.
40. Ferrari G, Cusella-De Angelis G, Coletta M, Paolucci E, Stornaiuolo A, Cossu G, et al. Muscle regeneration by bone marrow-derived myogenic progenitors. Science 1998; 279: 1528-30.
41. Beresford JN, Bennett JH, Devlin C, Leboy PS, Owen ME. Evidence for an inverse relationship between the differentiation of adipocytic and osteogenic cells in rat marrow stromal cell cultures. J Cell Sci 1992; 102 (Pt 2): 341-51.
42. Kopen GC, Prockop DJ, Phinney DG. Marrow stromal cells migrate throughout forebrain and cerebellum, and they differentiate into astrocytes after injection into neonatal mouse brains. Proc Natl Acad Sci U S A 1999; 96: 10711-6.
43. Mackay AM, Beck SC, Murphy JM, Barry FP, Chichester CO, Pittenger MF. Chondrogenic differentiation of cultured human mesenchymal stem cells from marrow. Tissue Eng 1998; 4: 415-28.
44. Yoo JU, Barthel TS, Nishimura K, Solchaga L, Caplan AI, Goldberg VM, et al. The chondrogenic potential of human bone-marrow-derived mesenchymal progenitor cells. J Bone Joint Surg Am 1998; 80: 1745-57.
45. Jaiswal N, Haynesworth SE, Caplan AI, Bruder SP. Osteogenic differentiation of purified, culture-expanded human mesenchymal stem cells in vitro. J Cell Biochem 1997; 64: 295-312.
46. Bruder SP, Jaiswal N, Haynesworth SE. Growth kinetics, self-renewal, and the osteogenic potential of purified human mesenchymal stem cells during extensive subcultivation and following cryopreservation. J Cell Biochem 1997; 64: 278-94.
47. Koc ON, Peters C, Aubourg P, Raghavan S, Dyhouse S, DeGasperi R, et al. Bone marrow-derived mesenchymal stem cells remain host-derived despite successful hematopoietic engraftment after allogeneic transplantation in patients with lysosomal and peroxisomal storage diseases. Exp Hematol 1999; 27: 1675-81.
48. Devine S, Bartholom A. Studies of mesenchymal stem cells in non-human primates: evaluation of toxicity and engraftment [abstract]. Blood 1999; 94/Suppl 1: 391a.
49. Laver J, Jhanwar SC, O'Reilly RJ, Castro-Malaspina H. Host origin of the human hematopoietic microenvironment following allogeneic bone marrow transplantation. Blood 1987; 70: 1966-8.
50. Gordon MY. The origin of stromal cells in patients treated by bone marrow transplantation. Bone Marrow Transplant 1988; 3: 247-51.
51. Santucci MA, Trabetti E, Martinelli G, Buzzi M, Zaccaria A, Pileri S, et al. Host origin of bone marrow fibroblasts following allogeneic bone marrow transplantation for chronic myeloid leukemia. Bone Marrow Transplant 1992; 10: 255-9.
52. Pereira RF, O'Hara MD, Laptev AV, Halford KW, Pollard MD, Class R, et al. Marrow stromal cells as a source of progenitor cells for nonhematopoietic tissues in transgenic mice with a phenotype of osteogenesis imperfecta. Proc Natl Acad Sci USA 1998; 95: 1142-7.
53. Almeida-Porada G, Flake AW, Glimp HA, Zanjani ED. Cotransplantation of stroma results in enhancement of engraftment and early expression of donor hematopoietic stem cells in utero. Exp Hematol 1999; 27: 1569-75.
54. Minguell JJ, Conget P, Erices A. Biology and clinical utilization of mesenchymal progenitor cells. Braz J Med Biol Res 2000; 33: 881-7.
55. Blazsek I, Delmas Marsalet B, Legras S, Marion S, Machover D, Misset JL. Large scale recovery and characterization of stromal cell-associated primitive haemopoietic progenitor cells from filter-retained human bone marrow. Bone Marrow Transplant 1999; 23: 647-57.
56. Brandt JE, Galy AH, Luens KM, Travis M, Young J, Tong J, et al. Bone marrow repopulation by human marrow stem cells after long-term expansion culture on a porcine endothelial cell line. Exp Hematol 1998; 26: 950-61.
57. Sandmaier B, Storb R, Kniley J. Evidence of allogenic stomal engraftment in bone marrow using canine mesenchymal stem cells [abstract]. Blood 1998; 92/Suppl 1: 116a .
58. Koc ON, Gerson SL, Cooper BW, Dyhouse SM, Haynesworth SE, Caplan AI, et al. Rapid hematopoietic recovery after coinfusion of autologous-blood stem cells and culture-expanded marrow mesenchymal stem cells in advanced breast cancer patients receiving high-dose chemotherapy. J Clin Oncol 2000; 18: 307-16.
59. Horwitz EM, Prockop DJ, Fitzpatrick LA, Koo WW, Gordon PL, Neel M, et al. Transplantability and therapeutic effects of bone marrow-derived mesenchymal cells in children with osteogenesis imperfecta [see comments]. Nat Med 1999; 5: 309-13.
60. Prockop DJ. Marrow stromal cells as stem cells for continual renewal of nonhematopoietic tissues and as potential vectors for gene therapy. J Cell Biochem Suppl 1998; 31: 284-5.
61. Keating A, Berkahn L, Filshie R. A Phase I study of the transplantation of genetically marked autologous bone marrow stromal cells. Hum Gene Ther 1998; 9: 591-600.
62. Schwarz EJ, Alexander GM, Prockop DJ, Azizi SA. Multipotential marrow stromal cells transduced to produce L-DOPA: engraftment in a rat model of Parkinson disease. Hum Gene Ther 1999; 10: 2539-49.
63. Brouard N, Chapel A, Neildez-Nguyen TM, Granotier C, Khazaal I, Peault B, et al. Transplantation of stromal cells transduced with the human IL3 gene to stimulate hematopoiesis in human fetal bone grafts in non-obese, diabetic-severe combined immunodeficiency mice. Leukemia 1998; 12: 1128-35.