Fræðigreinar
Nýraígræðsla
Ágrip
Nýraígræðsla er kjörmeðferð fyrir flesta sjúklinga með nýrnabilun á lokastigi. Framfarir í ónæmisbælandi lyfjameðferð hafa einkum leitt til þess að árangur nýraígræðslu hefur batnað á síðustu áratugum. Vaxandi nýgengi lokastigsnýrnabilunar hefur aukið þörf fyrir nýraígræðslur en fjöldi þeirra ígræðslna sem unnt er að framkvæma takmarkast af skorti á nýrnagjöfum. Vaxandi eftirspurn eftir nýrum til ígræðslu hefur verið svarað með aukinni notkun á nýrum úr lifandi gjöfum. Græðlingslifun hefur batnað með árunum, þótt tap græðlinga vegna langvinnrar höfnunar sé enn verulegt vandamál. Eins árs og fimm ára lifun nýragræðlinga úr lifandi gjöfum eru um 94% og 72% en 88% og 60% þegar græðlingar fást úr látnum gjafa. Að undanskildum dauða sjúklings er langvinn græðlingsbilun (langvinn höfnun) meginörsök fyrir missi græðlings þegar til langs tíma er litið og er fjallað um helstu áhættuþætti sem liggja þar að baki. Að lokum er fjallað um árangur nýraígræðslu hjá íslenskum sjúklingum. English Summary |
| Andrésdóttir MB, Pálsson R Renal transplantation Læknablaðið 2000; 86: 571-6 Renal transplantation is the treatment of choice for most patients with end-stage renal disease. The improved success of this treatment modality over the past four decades can large part be attributed to advances in immunosuppressive therapy. However, while the demand for renal transplantation has been steadily growing due to the rising incidence of end-stage renal disease, shortage of organ donors is a major limitation. The shortage of kidneys for transplantation has been met with an increase in the use of living donors. Renal allograft survival has improved over the years, although late graft loss is still a significant problem. One and five-year survival of living donor grafts is approximately 94% and 72%, and 88% and 60% for cadaveric donor grafts, respectively. The main causes of late graft loss are death of the patient and chronic allograft nephropathy. Risk factors for chronic allograft nephropathy are complex and include both immunlogic and non-immunologic mechanisms. Finally, the results of renal transplantation in Icelandic recipients are discussed. Key words: renal transplantation, cadaveric donor, living donor, end-stage renal disease. Correspondence: Margrét B. Andrésdóttir: E-mail: margret@hjarta.is |
Inngangur
Fyrsta árangursríka nýraígræðslan var framkvæmd árið 1954 af Joseph Murray og samverkamönnum hans á Peter Bent Brigham sjúkrahúsinu í Boston er þeir fluttu nýra milli eineggja tvíbura (1). Það var þó ekki fyrr en með tilkomu ónæmisbælandi lyfsins azatíópríns snemma á sjöunda áratugnum að nýraígræðsla milli óskyldra einstaklinga varð árangursrík. Meðferð með azatíópríni og barkstera reyndist bæla ónæmiskerfið að því marki að verulega dró úr höfnun ígræddra nýrna (2). Bylting í ónæmisbælandi meðferð nýraþega átti sér stað í kringum 1980 er cýklósporín kom til sögunnar og bætti það lifun nýragræðlinga verulega, einkum til skemmri tíma (3). Í dag er nýraígræðsla í flestum tilfellum kjörmeðferð við lokastigsnýrnabilun. Sjúklinga með lokastigsnýrnabilun er reyndar líka hægt að meðhöndla með blóð- eða kviðskilun og að því leyti er staða þeirra ólík stöðu sjúklinga sem þurfa á ígræðslu annarra líffæra að halda. Sýnt hefur verið nokkuð óyggjandi fram á betri lifun sjúklinga sem fá ígrætt nýra samanborið við skilunarmeðferð (4). Ennfremur hafa rannsóknir sýnt að lífsgæði sjúklinga með lokastigsnýrnabilun eru betri eftir nýraígræðslu en hjá sjúklingum í skilun (5). Loks er nýraígræðsla ódýrara meðferðarform en skilun þegar til lengri tíma er litið (6).
Nýgengi lokastigsnýrnabilunar hefur aukist á undanförnum árum meðal flestra Vesturlandaþjóða en jafnframt er skortur á nýrum til ígræðslu og hafa langir biðlistar eftir nýrum myndast víða. Sem dæmi má nefna að í Bandaríkjunum voru árið 1999 framkvæmdar 12.529 nýraígræðslur en í lok sama árs voru 44.391 sjúklingur á biðlista (7) og á Norðurlöndum voru framkvæmdar 892 nýraígræðslur árið 1998 en 1423 sjúklingar voru á biðlista í árslok (8). Fjöldi nýraígræðslna takmarkast nú helst af skorti á nýragjöfum.
Ábendingar nýraígræðslu
Flestir sjúklingar með nýrnabilun á lokastigi koma til álita fyrir nýraígræðslu óháð undirliggjandi sjúkdómi. Algengustu orsakir lokastigsnýrnabilunar á Vesturlöndum eru sykursýkinýrnamein, gauklabólga og háþrýstingsnýrnahersli. Hlutdeild sykursýkinýrnameins hefur aukist mjög á undanförnum árum, einkum í Bandaríkjunum þar sem það er orsök lokastigsnýrnabilunar hjá um 40% sjúklinga (7). Orsakir lokastigsnýrnabilunar á Norðurlöndum á árunum 1992-1996 eru sýndar á mynd 1 (9).Frábendingar nýraígræðslu
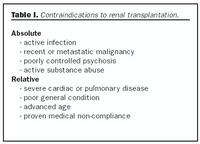
Helstu frábendingar nýraígræðslu tengjast ígræðsluaðgerðinni og þeirri ónæmisbælandi meðferð sem fylgir í kjölfarið (tafla I). Eins og gefur að skilja eru ómeðhöndlaður illkynja sjúkdómur eða virk sýking algerar frábendingar fyrir nýraígræðslu. Ennfremur alvarlegir sjúkdómar í öðrum líffærum sem takmarka lífshorfur. Vegna álags sem fylgir svæfingu og skurðaðgerð geta alvarlegir hjarta- og æðasjúkdómar og lungnasjúkdómar verið frábending. Loks eru alvarlegar geðraskanir og vímuefnamisnotkun frábending, einkum þar sem meðferðarheldni slíkra einstaklinga er oft ábótavant. Engin aldursmörk eru sett fyrir nýraígræðslu en mikilvægt er að huga vel að almennu heilsufari og færni við val á sjúklingum sem eru eldri en 60 ára. Á síðustu árum hafa nýru verið grædd í eldri einstaklinga með góðum árangri og hefur nýleg rannsókn sýnt að lifun sjúklinga 60-74 ára er marktækt betri eftir ígræðslu heldur en hjá þeim sem eru í skilun (4,10). Skortur á nýrum til ígræðslu leiðir þó oft til þess að elstu einstaklingunum er hafnað.Val og undirbúningur þega
Væntanlegur nýraþegi þarf að gangast undir ítarlegar rannsóknir til að meta hvort hann sé hæfur til að gangast undir nýraígræðslu. Einkum er mikilvægt að útiloka þær frábendingar sem greint er frá hér að framan. Þá þarf að huga að tæknilegum þáttum sem lúta að ígræðsluaðgerðinni. Tryggja þarf að ástand slagæða þegans sé nægilega gott til að unnt sé að tengja æðar nýragræðlingsins. Ennfremur er rannsókn á ástandi neðri þvagvega nauðsynleg hjá mörgum sjúklingum, einkum til mats á starfhæfni þvagblöðrunnar og til að útiloka bakflæði upp í þvagleiðara. Ef um er að ræða alvarlegt bakflæði með endurteknum sýkingum getur þurft að fjarlægja annað eða bæði nýrun fyrir ígræðslu. Blöðrunýru þarf stundum að fjarlægja vegna mikillar fyrirferðar eða endurtekinna sýkinga. Loks eru nýru stöku sinnum fjarlægð vegna illviðráðanlegs háþrýstings. Greining sjúkdómsins sem leiddi til nýrnabilunar er mikilvæg vegna tilhneigingar ákveðinna sjúkdóma til að birtast á ný í græðlingnum (11).Nýragjafar
Nýru til ígræðslu fást bæði úr látnum og lifandi einstaklingum. Nýru frá látnum gjöfum hafa víðast hvar verið í meiri hluta en þau fást úr einstaklingum sem deyja heiladauða, oftast af völdum slysa. Biðtími eftir slíkum nýrum hefur stöðugt verið að lengjast og er nú víðast um eða yfir tvö ár. Lifandi gjafar eru oftast náskyldir þeganum, það er foreldrar, systkini eða jafnvel börn, en á síðustu árum hefur færst í vöxt að græða í nýru úr óskyldum en tengdum einstaklingum, oftast mökum. Notkun lifandi gjafa er mjög mismunandi milli þjóða og eru þeir um 30-40% þar sem best gerist (7,8). Helstu kostir við ígræðslu nýrna úr lifandi gjöfum eru að hægt er að tímasetja aðgerðina auk þess sem sjúklingar geta stundum komist hjá skilunarmeðferð. Þá er minni hætta á höfnun auk þess sem lifun sjúklings og græðlings er talsvert betri en eftir ígræðslu nýra úr látnum gjafa. Lifandi nýragjafar þurfa að gangast undir ítarlegar rannsóknir áður en tekin er ákvörðun um hæfni þeirra. Við valið er þess gætt að engir nýrnasjúkdómar séu til staðar og að nýrnastarfsemi sé algjörlega eðlileg. Einnig er mikilvægt að útiloka sjúkdóma sem auka áhættu samfara skurðaðgerð og ganga verður úr skugga um að ákvörðunin að gefa nýra sé tekin af einlægum ásetningi. Ef völ er á fleiri en einum gjafa, þá er oftast valinn sá sem hefur mest vefjaflokkasamræmi og er best á sig kominn. Á síðustu árum hefur þróun á sviði myndgreiningar og skurðaðgerða verið til bóta fyrir nýragjafa. Er nú mögulegt að meta nýrnaslagæðar með segulómun og því ekki lengur þörf á að framkvæma æðaþræðingu (12). Einnig færist í vöxt að fjarlægja nýrað um holsjá (laparoscopic nephrectomy), en það hefur í för með sér styttri sjúkrahúslegu, minni verki og skjótari bata sem gerir það að verkum að gjafinn getur fyrr hafið vinnu á ný (13). Dánartíðni við nýrabrottnámsaðgerðina er mjög lág eða um 0,03% (14) og meiri háttar fylgikvillar eru fátíðir (15). Rannsóknir hafa sýnt að langtímahorfur nýragjafa eru góðar og tíðni skertrar nýrnastarfsemi er ekki teljandi aukin (14,16,17). Í nýlegri rannsókn á nýragjöfum, kom í ljós að þrátt fyrir erfiðar rannsóknir og sársaukafulla aðgerð fundu þeir flestir fyrir aukinni vellíðan og sjálfsstyrkingu við gjöfina (18).
Ígræðsluaðgerðin
Ígrædda nýrað er oftast staðsett utan lífhimnu í mjaðmargróf og eru slagæð og bláæð nýrans tengd við ytri slagæð og bláæð mjaðmar. Þvagleiðari ígrædda nýrans er oftast tengdur í þvagblöðru þegans en í stöku tilvikum er nýraskjóða græðlingsins tengd við þvagleiðara þegans. Þegar þvagleiðari ígrædda nýrans er tengdur í þvagblöðru þegans er sérstökum aðferðum beitt til að hindra bakflæði og til dæmis er algengt að þvagleiðarinn sé leiddur í gegnum göng sem eru búin til í slímbeði blöðrunnar. Ónæmisbælandi meðferð
Eftir að cýklósporín kom til sögunnar varð það grundvöllur ónæmisbælandi meðferðar nýraþega enda dró lyfið úr tíðni bráðrar höfnunar og skammtímaárangur batnaði (3). Venja hefur verið að nota saman tvö eða þrjú lyf sem bæla ónæmiskerfið með mismunandi hætti. Til skamms tíma voru cýklósporín, azatíóprín og prednisólon jafnan notuð, en á síðasta áratug hafa nýrri lyf eins og takrólímus og mýkófenólat mófetíl verið beitt í vaxandi mæli. Með þessum nýju lyfjum hefur enn dregið úr tíðni bráðrar höfnunar, þótt enn sé ekki ljóst hvort þau bæti langtímaárangur (19,20). Þá má geta þess að á sumum ígræðslustofnunum eru andeitilfrumumótefni notuð við innleiðslu ónæmisbælingar, ýmist fjölstofna mótefni eða einstofna músamótefnið OKT3, til viðbótar við hefðbundna meðferð. Er þá unnt að bíða með gjöf cýklósporíns eða takrólímus fyrstu dagana eftir ígræðslu og komast hjá skaðlegum áhrifum þeirra á nýragræðlinginn. Innleiðsla með mótefni gegn eitilfrumum minnkar tíðni bráðrar höfnunar en ekki hefur verið sýnt fram á bætta græðlingslifun (21,22).Skerðing á starfsemi nýragræðlings
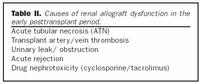
Skerðing á starfsemi nýragræðlings er algengt vandamál eftir nýraígræðslu. Orsakir þessa eru nokkuð mismunandi eftir því hve langt er liðið frá ígræðslu og er nauðsynlegt að hafa það í huga við mismunagreiningu þessa vandamáls. Helstu orsakir skerðingar á starfsemi græðlings snemma eftir ígræðslu eru sýndar í töflu II.Veruleg seinkun á starfsemi nýragræðlings (delayed graft function) eftir ígræðslu á sér stað í um 20-30% tilfella þegar notuð eru nýru frá látnum gjöfum (23). Langalgengasta orsök þess er brátt pípludrep (acute tubular necrosis, ATN) af völdum blóðþurrðaráverka (24). Þetta ástand getur varað mislengi, allt frá nokkrum dögum upp í nokkrar vikur. Ýmsir þættir eru taldir auka hættuna á bráðu pípludrepi, svo sem blóðrásarbilun hjá nýrnagjafa og langur kaldur blóðþurrðartími. Þá getur lélegt vökvaástand nýraþegans við ígræðslu haft áhrif, svo og notkun cýklósporíns eða takrólímus. Svæsin bráð höfnun er einnig mikilvæg orsök seinkaðrar græðlingsstarfsemi.
Tæknilegir fylgikvillar ígræðsluaðgerðarinnar geta valdið snemmkominni skerðingu á starfsemi græðlings. Blóðsegi getur myndast í nýraslagæð, oftast vegna hlykks á æðinni eða flysjunar innlags æðaþels. Einnig getur myndast stífla í þvagvegum eða leki þvags út fyrir safnkerfi ígrædda nýrans. Lekinn er oftast frá samskeytum þvagleiðara og blöðru, en hindrun á þvagflæði getur orsakast af bjúg, sega eða hlykk á þvagleiðaranum. Þá fær lítill hluti nýraþega vessahaul (lymphocele) eftir ígræðsluna vegna sköddunar á vessaæðum þegans og getur þetta vökvasafn þrýst á þvagleiðara eða mjaðmaæðar. Mikilvægt er að skjótt sé brugðist við þessum vandamálum og er skurðaðgerðar oftast þörf. Þótt reynt sé að fjarlægja sega í nýraslagæð með skurðaðgerð, tekst sjaldan að bjarga græðlingnum. Aðra ofangreinda fylgikvilla tekst oftast að leiðrétta.
Þegar starfsemi græðlingsins skerðist skyndilega meira en einni viku eftir ígræðslu er orsökin oftast bráð höfnun, eiturvirkni cýklósporíns eða takrólímus eða vökvaskortur. Bráð höfnun nýragræðlings er eitt alvarlegasta vandamálið sem kemur upp eftir nýraígræðslu. Talsvert hefur dregið úr tíðni bráðrar höfnunar á síðustu árum þótt enn sé hún um 20-40% (25). Hún sést einkum á fyrstu þremur til fjórum mánuðunum eftir ígræðslu, en er sjaldgæf eftir fyrsta árið. Hún er oftast einkennalaus og kemur fram sem hækkun kreatíníns í sermi. Við meðferð bráðrar höfnunar er oftast beitt háskammta sterameðferð en ef svörun fæst ekki eru notuð mótefni gegn eitilfrumum (fjölstofna mótefni eða OKT3). Unnt er að snúa við bráðri höfnun í yfir 90% tilfella (26). Bráð höfnun hefur neikvæð áhrif á langtímalifun græðlings (27,28).
Langvinn höfnun er langalgengasta orsök síðkominnar græðlingsbilunar og er meginorsök græðlingstaps þegar til lengri tíma er litið. Talið er að 35-70% af ígræddum nýrum hafi merki um langvinna höfnun fimm árum eftir ígræðslu (29). Klíníska myndin einkennist af hægt vaxandi skerðingu á starfsemi nýragræðlingsins ásamt prótínmigu og háþrýstingi. Bráð höfnun er mikilvægasti forspárþáttur langvinnrar höfnunar, einkum ef hún er alvarleg eða gerist meira en sex mánuðum eftir ígræðslu (30,31). Þá hefur komið í ljós að fleiri þættir en ónæmisskaði virðast eiga þátt í því ástandi sem nefnt hefur verið langvinn höfnun og ýmsir telja því réttara að kalla það langvinna græðlingsbilun (tafla III). Af þessum þáttum má nefna langan kaldan blóðþurrðartíma græðlings og seinkun á starfi græðlings eftir ígræðslu, háan eða mjög ungan aldur nýragjafa (minni nýrungamassi) og hækkaðar blóðfitur (32). Einnig hefur verið sýnt fram á að blóðþrýstingur nýraþega eftir ígræðslu hefur marktæk tengsl við langvinna bilun græðlingsins (33). Engin meðferð er þekkt sem getur snúið langvinnri græðlingsbilun við og verður því að huga að því að fyrirbyggja þetta ferli með því að takmarka ónæmisskaða og aðra þá þætti sem nefndir eru hér að framan.
Endurkoma grunnsjúkdóms í ígrædda nýrað er sjaldgæf orsök skertrar græðlingsstarfsemi. Þó er þetta fyrirbæri þekkt fyrir nær allar tegundir gauklasjúkdóma. Gera verður skýran mun á því hvort sjúkdómurinn birtist eingöngu í vefjasýni án nokkurra klínískra einkenna eða hvort samfara sé prótínmiga og skerðing á starfsemi græðlings, sem oftast leiðir til græðlingsbilunar. Talið er að sumar tegundir gauklabólgu séu líklegri til að koma aftur eftir ígræðslu nýra frá skyldum lifandi gjöfum (34,35). Í einni rannsókn reyndist endurkoma gauklabólgu vera aðalorsök græðlingsbilunar hjá þeim sem höfðu þegið nýra frá systkini með sömu HLA-vefjaflokka (HLA-identical) (36). Þessa vitneskju ber að hafa í huga við val á nýragjafa fyrir sjúklinga sem hafa gauklabólgu sem grunnsjúkdóm. Talið er að endurkoma gauklabólgu sé orsök 4-5% græðlingsbilunar eftir ígræðslu nýra úr látnum gjafa en 17% ef um lifandi gjafa er að ræða (11). Þrengsli í slagæð nýragræðlingsins, stífla í þvagvegum og skaðleg áhrif cýklósporíns eða takrólímus eru aðrar mögulegar orsakir síðkominnar skerðingar á starfsemi græðlingsins.
Árangur nýraígræðslu
Árangur nýraígræðslu hefur stöðugt batnað með árunum. Árið 1996 var eins árs lifun sjúklinga í Bandaríkjunum 98% eftir ígræðslu nýrna úr lifandi gjöfum og 96% hjá þeim er fengu nýru frá látnum gjöfum (7). Nýleg bandarísk rannsókn hefur einnig sýnt að eins árs græðlingslifun og áætlaður helmingunartími græðlinga hefur stöðugt aukist frá 1988-1996 (25). Árið 1996 reyndist eins árs lifun græðlinga frá látnum gjöfum 88% og frá lifandi gjöfum 94%. Fimm ára lifun græðlinga frá látnum gjöfum, sem voru ígræddir á árunum 1990-1991 var 60% og 72% frá lifandi gjöfum (7).Orsakir bættrar lifunar sjúklinga og græðlinga eru margþættar og tengjast aðallega framförum í ónæmisbælandi lyfjameðferð ásamt bættri vefjaflokkun og skurðtækni (37). Þá á markvissari meðferð gegn sýkingum þátt í betri lifun sjúklinga.
En þrátt fyrir að græðlingslifun hafi batnað umtalsvert, þá er tap græðlinga í tímans rás enn verulegt vandamál. Helstu orsakir fyrir missi græðlings þegar til langs tíma er litið, eru langvinn höfnun, dauði sjúklings og endurkoma grunnsjúkdóms í græðlinginn.
Rannsóknir á stórum hópum nýraþega hafa sýnt mikilvægi HLA-samræmis fyrir lifun græðlinga (38,39). Lifun græðlinga frá lifandi gjöfum er betri en frá látnum og er best þegar algert samræmi er milli HLA-vefjaflokka þega og gjafa. Lifun græðlinga úr látnum gjöfum er einnig betri eftir því sem HLA-samræmi er meira milli nýraþega og gjafa. Þá er eins árs græðlingslifun 15-20% lakari hjá þeim nýraþegum sem hafa seinkaða græðlingsstarfsemi fyrst eftir ígræðslu samanborið við þá sem ekki lenda í þessum vanda (40). Bráð höfnun hefur einnig áhrif á græðlingslifun en hún er 15-25% verri en ef engin höfnun á sér stað (41). Hlutfallsleg stærð ígrædda nýrans hefur nokkra þýðingu því græðlingslifun karlkynsþega nýrna frá kvenkynsgjöfum er lægri en hjá kvenkynsþegum nýrna frá karlkynsgjöfum (42). Loks hefur áhrif hver stofnunin er sem framkvæmir ígræðsluna. Aðaldánarorsakir nýraþega eru hjarta- og æðasjúkdómar, sýkingar og krabbamein.
Árangur nýraígræðslu hjá
íslenskum sjúklingum
Fyrsta nýraígræðsla í íslenskan sjúkling fór fram í London 1970 en síðan hafa ígræðsluaðgerðirnar aðallega farið fram í Kaupmannahöfn, Gautaborg og Boston. Á árabilinu 1970 til 1997 hlaut 201 sjúklingur meðferð við lokastigsnýrnabilun hér á landi og af þeim fengu 96 (46%) ígrætt nýra (9). Fjöldi nýraígræðslna fór vaxandi með hverjum áratugi, úr 13 á þeim fyrsta í 50 á síðasta áratugi. Jafnframt fjölgaði ígræðslum nýrna úr lifandi gjöfum og voru þeir um 65% græðlinga á síðasta áratugi. Í lok 1997 voru starfandi nýragræðlingar 59 og af þeim voru 45 úr lifandi gjöfum. Sjúklingar með ígrædd nýru voru þá 70% allra í meðferð vegna lokastigsnýrnabilunar. Meðalaldur sjúklinga við ígræðslu var 36 ár en aðeins þrír voru yfir 60 ára aldri og var sá elsti 61 árs.
Eins og sést á mynd 1 eru gauklabólga og langvinn millivefsnýrabólga algengustu orsakir lokastigsnýrnabilunar hérlendis, en vakið hefur athygli að hér á landi er sykursýkinýrnamein tiltölulega sjaldgæf orsök nýrnabilunar á lokastigi.
Á áðurnefndu tímabili hefur eins árs lifun græðlinga úr lifandi gjöfum verið 96% og fimm ára lifun 89% sem telst góður árangur. Lifun græðlinga úr látnum gjöfum reyndist fremur slök en eins árs lifun var aðeins 61% og fimm ára lifun 48%. Engin skýring liggur fyrir á þessari slöku lifun græðlinga frá látnum gjöfum en rannsóknir standa nú yfir sem beinast að því að finna orsök þess.
Niðurlag
Miklar framfarir hafa átt sér stað síðan fyrsta nýraígræðslan var gerð fyrir rúmum 40 árum. Í dag er nýraígræðsla kjörmeðferð sjúklinga með nýrnabilun á lokastigi. Skortur á nýrum til ígræðslu og tap græðlinga vegna langvinnrar höfnunar eru þó enn veruleg vandamál sem hafa leitt til myndunar langra biðlista eftir nýrum til ígræðslu. Rannsóknir miða nú að því að bæta langtímaárangur nýraígræðslu meðal annars með þróun sértækari ónæmisbælandi lyfja. Heimildir
1 Merrill JP, Harrison JH, Murray JE, Guild WR. Successful homotransplantation of the kidney in an identical twin. Trans Am Clin Climatol Assoc 1955; 67: 167.
2. Murray JE, Merrill JP, Harrison JH. Prolonged survival of human-kidney homografts by immunosuppressive drug therapy. N Engl J Med 1963; 268: 1315-23.
3. Beveridge T, Calne RY. Cyclosporine (Sandimmun) in cadaveric renal transplantation. Ten-year follow-up of a multicenter trial. European Multicentre Trial Group. Transplantation 1995; 59: 1568-70.
4. Wolfe RA, Ashby VB, Milford EL, Ojo AO, Ettenger RE, Agodoa LYC. Comparison of mortality in all patients on dialysis, patients on dialysis awaiting transplantation, and recipients of a first cadaveric transplant. N Engl J Med 1999; 341: 1725-30.
5. Evans R, Mannien D, Garrison L, Hart L, Blagg C. The quality of life of patients with end-stage renal failure. N Engl J Med 1985; 312: 553-9.
6. Eggers P. Comparison of treatment costs between dialysis and transplantation. Semin Nephrol 1992; 12: 284-9.
7. Renal Data System. USRDS 1999 annual data report. Am J Kidney Dis 1999; 34: S1-176.
8. Organ donation, allocation and transplantation in the Nordic countries: Scandiatransplant [Annual report] 1998. Scandiatransplant; 1999.
9. Ásmundsson P, Pálsson R. Meðferð við lokastigsnýrnunbilunar á Íslandi 1968-1997. Læknablaðið 1999; 85: 9-24.
10. Roodnat JI, Zietse R, Mulder PG, Rischen-Vos J, van Gelder T, Ijzermans JN, et al. The vanishing importance of age in renal transplantation. Transplantation 1999; 67: 576-80.
11. Kotanko P, Pusey C, Levy J. Recurrent glomerulonephritis following renal transplantation. Transplantation 1997; 63: 1045-52.
12. Nelson HA, Gilfeather M, Holman JM, Nelson EW, Yoon HC. Gadolinium-enhanced breathhold three-dimensional time-of-flight renal MR angiography in the evaluation of potential renal donors. J Vasc Intervent Radiol 1999; 10: 175-81.
13. Flowers JF Jacobs S, Cho E. Comparison of open and laparoscopic live donor nephrectomy. Ann Surg 1997; 226: 438.
14. Najarian JS, Chavers BM, McHugh LE, Matas AJ. 20 years or more of follow-up of living kidney donors. Lancet 1992; 340: 807-10.
15. Melchor JL, Gracida C, Lopez A. Living donors in kidney transplantation: five-year follow-up. Transplant Proc 1998; 30: 2869-70.
16. Fehrman-Ekholm I, Elinder CG, Stenbeck M, Tyden G, Groth CG. Kidney donors live longer. Transplantation 1997; 64: 976-8.
17. Saran R, Marshall SM, Madsen R, Keavey P, Tapson JS. Long-term follow-up of kidney donors: a longitudinal study. Nephrol Dial Transplant 1997; 12: 1615-21.
18. Johnson E, Anderson J, Jacobs C, Suh G, Humar A. Long-term follow-up of living kidney donors; quality of life after donation. Transplantation 1999; 67: 717-21.
19. Pirsch JD, Miller J, Deierhoi MH, Vincenti F, Filo RS. A comparison of tacrolimus (FK506) and cyclosporine for immunosuppression after cadaveric renal transplantation. FK506 Kidney Transplant Study Group. Transplantation 1997; 63: 977-83.
20. Sollinger H. Mycophenolate mofetil for the prevention of acute rejection in primary cadaveric renal allograft recipients. Transplantation 1995; 60: 225-32.
21. Norman DJ, Kahana L, Stuart FP Jr, Thistlewaite JR Jr, Shield CF, Monaco A, et al. A randomized clinical trial of induction therapy with OKT3 in kidney transplantation. Transplantation 1993; 55: 44-50.
22. Suthanthiran M, Strom TB. Renal transplantation. N Eng J Med 1994; 331: 365-76.
23. Peters T, Shaver T, Ames JI, Santiago-Delpin E, Jones K, Blanton J. Cold ischemia and outcome in 17,937 cadaveric kidney transplants. Transplantation 1995; 59: 191-6.
24. Lechvallier E, Dussol B, Luccioni A, Thirion X, Vacher-Copomat H, Jaber K, et al. Posttransplantation acute tubular necrosis: risk factors and implications for graft survival. Am J Kidney Dis 1999; 32: 984-91.
25. Hariharan S, Johnson CP, Bresnahan BA, Taranto SE, McIntosh MJ, Stablein D. Improved graft survival after renal transplantation in the United States, 1988 to 1996. N Engl J Med 2000; 342: 605-12.
26. Ortho Multicenter Transplant Study Group. A randomized clinical trial of OKT3 monoclonal antibody for acute rejection of cadaveric renal transplants. N Engl J Med 1985; 313: 337-42.
27. Pirsch JD, Ploeg RJ, Gange S, D´Alessandro AM, Knechtle SJ, Sollinger HW, et al. Determinants of graft survival after renal transplantation. Transplantation 1996; 61: 1581-6.
28. Ishikawa A, Flechner SM, Goldfarb DA, Myles JL, Modlin CS, Boparai N, et al. Quantitative assessment of the first acute rejection as a predictor of renal transplant outcome. Transplantation 1999; 68: 1318-24.
29. Fellström B. Transplant atherosclerosis. J Intern Med 1996; 240: 253-7.
30. Cosio FG, Pelletier RP, Falkenhain ME, Henry ML, Elkhamas EA, Davies EA, et al. Impact of acute rejection and early allograft function on renal allograft survival. Transplantation 1997; 63: 1611-5.
31. Humar A, Kerr S, Gillingham KJ, Matas AJ. Features of acute rejection that increase risk for chronic rejection. Transplantation 1999; 68: 1200-3.
32. Carpenter CB. Long-term failure of renal transplants: Adding insult to injury. Kidney Int 1995; 48/Suppl. 50: S40-S44.
33. Opelz G, Wujciak T, Ritz E. Association of chronic kidney graft failure with recipient blood pressure. Collaborative Transplant Study. Kidney Int 1998; 53: 217-22.
34. Michielsen P. Recurrence of the original disease. Does this influence renal graft failure? Kidney Int 1995; 48/Suppl. 52: S-79-S-84.
35. Andresdottir MB, Assmann KJM, Hoitsma AJ, Koene RAP, Wetzels JFM. Recurrence of type I membranoproliferative glomerulonephritis after renal transplantation. Transplantation 1997; 63: 1-5.
36. Andresdottir MB, Hoitsma AJ, Assman KJM, Koene RAP, Wetzels JFM. The impact of recurrent glomerulonephritis on graft survival in recipients of HLA-identical living related donor grafts. Transplantation 1999; 68: 623-7.
37. Diethelm A, Deierhoi M, Hudson S. Progress in renal transplantation. A single center study of 3359 patients over 25 years. Ann Surg 1995; 221: 446-57.
38. Opelz G. Collaborative Transplant Study -10-year report. Transplant Proc 1992; 24: 2342-55.
39. Annual report 1999: UNOS registry 1999. Richmond, Va.: United Network for Organ Sharing; 1999.
40. Cecka JM, Yong WC, Terasaki PI. Analyses of the UNOS Scientific Renal Transplant Registry at three years - early events affecting transplant success. Transplantation 1992; 53: 59-64.
41. Cecka JM, Terasaki PI. The UNOS Scientific Renal Transplant Registry. Clinical Transplants. Los Angeles: UCLA Tissue Typing Laboratory 1993; 1: 16.
42. Terasaki PI, Cecka JM, Gjertson DW, Cosio FG, Takemoto S, Cosio FG. Clinical transplants 1992. Los Angeles: UCLA Tissue Typing Laboratory; 1993.