11. tbl. 109. árg. 2023
Fræðigrein
Vaxandi máttleysi í ganglimum hjá fimmtugum manni • Sjúkratilfelli •
Höfundar fengu leyfi sjúklingsins fyrir þessari umfjöllun og birtingu.
Ágrip
Lambert-Eaton myasthenic syndrome (LEMS) er sjaldgæfur sjúkdómur sem verður til vegna skertrar starfsemi í taugavöðvamótum. Eins og aðrir sjúkdómar í þessum hópi veldur hann meðal annars máttminnkun í útlimum. LEMS orsakast af truflun í fortaugavöðvamótunum og einkenni eru því mest áberandi eftir að sjúklingur hefur verið í hvíld. Sjúkdómurinn verður til vegna myndunar sjálfsónæmismótefna og geta þau verið á grunni illkynja meins sem mikilvægt er að útiloka. Taugalífeðlisfræðilegar rannsóknir gegna lykilhlutverki í greiningu. Talið er að þessir sjúkdómar séu vangreindir og mikilvægt er að þekkja ákveðin mynstur sem geta sterklega bent til LEMS-sjúkdómsins. Meðferð beinist að undirliggjandi orsök og hefur henni fleygt fram undanfarin ár. Án meðferðar getur sjúkdómurinn skert mjög lífsgæði. Í þessari grein verður farið yfir einkenni, greiningu og meðferð sjúkdómsins í stuttu máli.
Greinin barst til blaðsins 11. september 2023, samþykkt til birtingar 26. september 2023.
Tilfellið
Fimmtugur karlmaður hafði gengið á milli lækna í 10 ár vegna hægt versnandi vöðvaverkja og vaxandi máttleysis í ganglimum. Hann lýsti þrálátum verkjum í stærri vöðvum beggja ganglima sem versnuðu við áreynslu, fætur gáfu sig undan honum þegar verst lét. Afar væg einkenni voru í handleggjum. Einkenni voru sveiflukennd, alltaf verri á morgnana en hann var skástur á kvöldin og næturnar. Engin skyntruflun var til staðar og engin áberandi einkenni voru frá ósjálfráða taugakerfinu. Hann hafði ekki verið að tapa þyngd. Hann var hættur að gera sjálfsagða daglega hluti og farinn að halda kyrru fyrir vegna verkja við alla hreyfingu.
Við skoðun kom fram greinileg máttminnkun í ganglimum við styrkprófun en göngulag var kjagandi (Trendelenburg) og óvenju seinlegt fyrir mann á hans aldri. Dálitlir erfiðleikar voru við fulla bakbeygju (dorsiflexion) um báða ökkla. Skyn var eðlilegt og jafnvægi gott. Engin sinaviðbrögð fengust fram við skoðun (areflexia). Sjúklingur var í eðlilegu holdafari. Almennar blóðprufur voru eðlilegar, CK og myoglóbín eðlilegt. Rótarmein í lendhrygg hafði verið útilokað með segulómun og uppvinnsla hjá æðaskurðlækni var neikvæð með tilliti til æðaþrenginga. Leit að illkynja sjúkdómi var neikvæð.
Maðurinn var með þekkta insúlínháða sykursýki frá 10 ára aldri undir góðri stjórn, háþrýsting og vanstarfsemi skjaldkirtils. Hann var í fullri kyrrsetuvinnu fram að þessu en hafði dregið úr allri almennri virkni utan vinnu. Á þessu 10 ára tímabili voru einkenni skrifuð á sykursýkina þar til greining fékkst loks eftir tilvísun til taugalæknis. Taugalífeðlisfræðilegar rannsóknir sýndu lága vöðvaspennu (compound muscle action potential, CMAP). Marktæk aukning varð á spennu eftir 10 sekúndna virkjun á vöðvanum. Einnig sást mynstur með vaxandi spennu við 30 Hz raðörvun. Mótefnamæling sýndi jákvæð mótefni gegn VGCC-jónagöngum.
Umræða
Einkenni sjúklings voru nokkuð almenns eðlis í byrjun með breytilegum verkjum og máttminnkun í neðri útlimum og var erfitt að setja greiningu án frekari rannsókna. Var þetta sjúkdómur í taugum eða vöðvum? Mögulega einkenni á grunni langvarandi sykursýki? Engin skyneinkenni voru til staðar, engir krampar eða erfiðleikar við að slaka á vöðvum eftir áreynslu (myotonia). Þar sem ekki var um viðvarandi og hratt vaxandi máttminnkun að ræða mátti setja taugasjúkdóma á borð við hreyfitaugungahrörnun (motor neuron disease, MND) eða vöðvasjúkdóma á borð við erfðar vöðvadystrofiur mjög neðarlega á listann. Einkenni bentu frekar til vöðvakvilla (myopathy) af einhverri gerð með (vöðva)verkjum og máttleysi mest í aðlægum (proximal) vöðvum. Önnur möguleg mismunagreining væri samhverfur fjöltaugakvilli af hreinni mótorískri gerð.
Vöðvakvilli er sjúkdómur í vöðvum og eru þekktar yfir 100 mismunandi tegundir slíkra sjúkdóma.1 Klínískt getur verið nær ómögulegt að greina vöðvakvilla frá úttaugakvillum (peripheral neuropathy) og þar koma taugalífeðlisfræðilegar rannsóknir á borð við tauga- og vöðvarit sterkar inn. Taugakvilli er ástand sem verður vegna truflunar í virkni taugasíma (axon), þess hluta taugarinnar sem flytur rafboðin áleiðis. Slíkt getur orsakast af beinum skaða á taugasímanum, til dæmis vegna sykursýki, eða vegna niðurbrots á mýelínslíðrinu sem umlykur taugasímann (demyelination).2 Meðal einkenna taugakvilla eru máttminnkun og minnkuð sinaviðbrögð en máttminnkunin er þá almennt meira áberandi í fjarlægum (distal) vöðvum ólíkt því sem sást í þessu tilfelli. Taugakvilla fylgir oft skyntruflun sem eðli málsins samkvæmt sést ekki í vöðvakvillum.3 Í umræddu tilfelli varð mikil töf á greiningu þar sem einkenni voru lengi talin stafa af undirliggjandi sykursýki.
Í mismunandi tauga- og vöðvakvillum geta lífeðlisfræðilegar rannsóknir verið mjög breytilegar, stundum sést lág spenna vegna truflunar í starfsemi tauga- og/eða vöðvaþráða og hún eykst ekki með endurtekinni örvun sem er mikilvægt atriði í þessu tilviki. Í umræddu tilfelli sýndu lífeðlisfræðilegar rannsóknir mynstur sem er einkennandi fyrir Lambert-Eaton myasthenic syndrome (LEMS), sjúkdóm sem verður vegna truflunar í fortaugavöðvamótunum (pre-synaptic). Klíníkin gaf líka góða vísbendingu um þennan sjúkdóm eins og verður farið í hér á eftir.
Orsök og einkenni
LEMS-sjúkdómurinn verður vegna myndunar sjálfsónæmismótefna gegn jónagöngum (voltage-gated calcium channels, VGCC) í taugaendum taugavöðvamóta, svokölluðum fortaugamótum (pre-synaptic). Undir eðlilegum kringumstæðum losa þessi göng nægilegt kalsíum til að valda losun á boðefninu acetýlkólín sem síðan veldur samdrætti í viðtakandi vöðva. Í LEMS fækkar þessum jónagöngum vegna myndunar mótefna gegn alfa-1-undireiningu þeirra, losun kalsíums minnkar og þar með losun acetýlkólíns, niðurstaðan verður minni örvun á vöðvasamdrætti.4 Einkenni LEMS eru því máttminnkun án skyntruflunar, mest áberandi í stórum aðlægum vöðvum útlima. Truflun í ósjálfráða taugakerfinu er algeng þar sem þessi göng gegna sambærilegu örvunarhlutverki þar. Þau einkenni eru í formi hægðatregðu, ójafns blóðþrýstings, munnþurrks, minnkaðrar svitamyndunar, ristruflana hjá karlmönnum og svima. Sjaldan verður truflun í andlitsvöðvum. Undirliggjandi orsök myndunar sjálfsónæmismótefna gegn VGCC-jónagöngunum er í um helmingi tilfella illkynja mein og þá oftast smáfrumulungnakrabbamein (SCLC, krabbameinsfrumur af neuroendocrine-uppruna).5 Þannig tilheyrir LEMS sjúkdómum af flokki æxlishjákenna (paraneoplastic) sem öll eru afar sjaldgæf. Þó er mikilvægt að hafa í huga að greininguna er hægt að setja þótt ekki finnist þessi sjálfsónæmismótefni. Í helmingi tilfella er engin þekkt orsök fyrir tilurð sjúkdómsins, viss tenging er við ákveðna HLA-hópa (HLA-B8, HLA-DR3 og HLA-DQ2) sem hafa síðan tengingu við aðra sjálfsónæmissjúkdóma eins og vöðvaslensfár (myasthenia gravis, MG).6 Greining LEMS byggir þannig á klínískri skoðun, taugalífeðlisfræðilegum rannsóknum og leit mótefna í blóði. Vöðvasýni getur verið eðlilegt eða sýnt vöðvarýrnun (atrophy) og hjálpar ekki við greininguna.
Faraldsfræði
LEMS er sjaldgæfur sjúkdómur, rannsóknir hafa sýnt algengi um 2,6 staðfest tilfelli á hverja milljón íbúa.7 Hjá LEMS-sjúklingum með undirliggjandi illkynja mein eru 60-75% sjúklinga karlmenn og meðalaldur við greiningu er 58 ár. Hjá öðrum LEMS-sjúklingum er aldursdreifing líkari því sem sést í MG með tvítoppa dreifingu í kringum 35 ára aldur og hærri toppi í kringum 50-60 ára aldur og flestir sjúklingar eru konur.8
Greining
Klíník
Klínísk einkenni LEMS geta verið nokkuð almenns eðlis en ákveðin einkenni ættu að vekja grun um sjúkdóminn. Sjúklingar finna oft fyrir máttminnkun í nærvöðvum neðri útlima og lýsa gjarnan óþægindum og stífleika í vöðvum, sérstaklega eftir hvíld en komast síðan í gang og liðkast með hverju skrefi (post-activation facilitation). Þetta skýrist af truflun í fortaugamótum í LEMS, ólíkt MG þar sem truflunin er í eftirtaugamótunum. Þrenningin: 1. göngulagstruflanir/máttminnkun í fótum, 2. minnkuð eða horfin sinaviðbrögð (hypo-reflexia/areflexia) og 3. truflun á ósjálfráða taugakerfinu ætti að vekja grun um LEMS (þótt vissulega séu ekki öll einkenni endilega til staðar). Ólíkt MG eru áhrif á augn-, kyngingar- og öndunarvöðva yfirleitt væg eða engin. Áhrif á ósjálfráða taugakerfið eru einnig oft væg og sjúklingar vekja sjálfir ekki endilega athygli á þeim en þau geta komið fram ef spurt er um þau (munnþurrkur, lágþrýstingur, hægðatregða og ristruflanir). Talið er að slík einkenni megi finna hjá meirihluta sjúklinga. Mikilvæg vísbending um LEMS er þegar kvartanir sjúklings eru úr hlutfalli við það sem kemur fram við klíníska skoðun og er þetta ólíkt því sem yfirleitt sést í MG. Kraftaprófun getur verið nær eðlileg, sérstaklega ef sjúklingur er ekki að koma beint úr hvíld við skoðunina. Sinaviðbrögð koma oft betur fram eftir smávægilega áreynslu (og því best að prófa eftir hvíld, „reflex augmentation“ er vísbending um sjúkdóminn). Við skoðun getur truflun á ósjálfráða taugakerfinu komið fram sem léleg ljósviðbrögð sjáaldra.
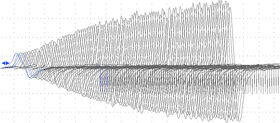
 Mynd 1. Myndin sýnir stigvaxandi spennu við 30 Hz raðörvun á n.ulnaris og skrásetningu yfir m.abductor digiti minimi hjá sjúklingnum.
Mynd 1. Myndin sýnir stigvaxandi spennu við 30 Hz raðörvun á n.ulnaris og skrásetningu yfir m.abductor digiti minimi hjá sjúklingnum.
Taugalífeðlisfræðin
Taugarit sýnir mynstur með lágri spennu sem kemur fram vegna minnkaðrar vöðvavirkni en aukin spenna sést með endurtekinni örvun (mynd 1). Þetta mynstur er einkennandi fyrir sjúkdóma sem verða vegna truflana á fortaugavöðvamótum líkt og LEMS. Spennan helst samt alltaf lægri hjá þessum sjúklingum en í heilbrigðu fólki þrátt fyrir endurtekna örvun. Sú truflun sem er á taugaboðunum í LEMS sker sig því frá hreinum taugakvilla enda er um að ræða truflun í fortaugavöðvamótunum, ekki í sjálfum taugunum. Þarna sést greinilegt misræmi milli niðurstöðu á taugariti og útlits vöðva en ætla mætti að einstaklingur með svo lága spennu væri almennt mjög vöðvarýr, sem er alls ekki tilfellið hjá LEMS-sjúklingum. Vöðvaritið getur sýnt ósértæk frávik sem benda til vöðvakvilla og merki um óstöðugan boðefnaflutning á tauga- og vöðvamótunum (aukið jitter).
Mótefnaleit
Um 85-95% sjúklinga með LEMS eru með jákvæð mótefni gegn P/Q-tegund VGCC (nær 100% þeirra sjúklinga sem eru með undirliggjandi krabbamein, oftast SCLC).4 Þessi mótefni eru þó ekki sértæk fyrir LEMS heldur geta tengst öðrum tauga- og sjálfsónæmissjúkdómum. Sjaldgæfara er að finna mótefni gegn N-tegund VGCC (30-40%)4. Mótefnaleit ætti að innihalda æxlishjákennamótefni sem og mótefni gegn -acetýlkólín-viðtaka. Neikvæð mótefni útiloka þó alls ekki sjúkdóminn og eins er mikilvægt að vita að einstaklingar geta verið með jákvæð mótefni án þess að greinast með LEMS, hjá þeim sjúklingum ætti þó að gera ítarlega leit að undirliggjandi illkynja sjúkdómi.9
Leit að undirliggjandi krabbameini
Vegna sterkrar fylgni ætti LEMS-greining strax að setja af stað leit að undirliggjandi illkynja meini, leitin ætti alltaf að minnsta kosti að innihalda tölvusneiðmynd (TS) af brjóst-, kviðar- og grindarholi. Ef fyrsta leit er neikvæð er ráðlagt að taka PET TS ef slíkt er í boði en það er svokölluð jáeindarannsókn sem getur auðkennt aukna sjúklega virkni í líkamanum, til dæmis á grunni illkynja meins. Leit ætti að endurtaka á 3-6 mánaða fresti í að minnsta kosti tvö ár eftir LEMS-greiningu áður en undirliggjandi illkynja mein (æxlishjákenni) er útilokað. Tíðari skimun er ráðlögð hjá sjúklingum með DELTA-P skor yfir 4 eða jákvæð SOX-mótefni sem hafa sterka fylgni við SCLC-LEMS10. Í umræddu tilfelli var sjúklingur með DELTA-P skor 1 og skimaður með tölvusneiðmynd af hálsi, brjóst- og kviðarholi (tvívegis með árs millibili) án þess að nokkur merki um illkynja mein sæjust þar. SOX-mótefni voru neikvæð. Þar sem um langa sögu sjúkdómseinkenna var að ræða var sjálfs-ónæmissjúkdómur mun líklegri undirliggjandi orsök. Í tilfellum sem þessum sem hafa skemmri sjúkdómsgang mætti bæta við PET TS til frekari útilokunar á LEMS sem æxlishjákennis.
Mismunagreining
Sá sjúkdómur sem líkist hvað mest LEMS er vöðvaslensfár (myasthenia gravis, MG), annar taugavöðvasjúkdómur. Í þeim sjúkdómi beinast sjálfsmótefni gegn vöðvahlið taugavöðvamótanna (eftirtaugamótunum, post-synaptic) og einkenni birtast oft fyrst sem máttminnkun í andliti, augnlokum og augnvöðvum. Sjúkdómurinn hefur ekki áhrif á ósjálfráða taugakerfið.12 Klínískt getur verið erfitt að greina á milli þessara sjúkdóma, máttminnkunin getur verið í aðlægum vöðvum í báðum tilvikum. Sjúklingar með LEMS lýsa oft erfiðleikum eftir hvíld og skána með hreyfingu, þveröfugt við MG-sjúklinga. Þetta skýrist einmitt af því að í MG eru boðefnin að vinna á viðtökum sem sitja á eftirtaugamótunum, sjálfsónæmismótefnin herja á þessa viðtaka og fækka þeim og á einföldu máli má segja að með aukinni notkun/hreyfingu brotni boðefnin smátt og smátt niður í taugavöðvamótunum og vöðvavirkjunin verður því minni. Í LEMS er truflun á losun boðefnanna í fortaugamótunum og með aukinni örvun verður uppsöfnun boðefna í taugavöðvamótunum sem auðveldar þá örvun vöðvans. Góð vísbending um LEMS eru vöðvaverkir eins og sjúklingur lýsti í þessu tilfelli, slíkt sést nánast aldrei í MG.
Horfur og meðferð
Horfur sjúklinga með LEMS eru mismunandi og augljóslega mjög háðar því hvort um undirliggjandi illkynja sjúkdóm er að ræða, meðferð snýr þá í fyrsta lagi að því meini en meðferðin bætir ekki endilega taugaeinkenni LEMS. Jafnvel án undirliggjandi illkynja meins geta einkenni LEMS verið þrálát og skert lífsgæði mikið en lífslíkur eru ekki skertar. Yfirleitt er byrjað með einkennameðferð meðan á uppvinnslu stendur og beðið með ónæmisstýrandi meðferðir þar til undirliggjandi krabbamein hefur verið nær útilokað. Þetta er gert af tveimur ástæðum, bein meðferð við krabbameininu getur haft nægilega góð áhrif á taugaeinkenni LEMS og eins er óljóst hvort og hversu mikil áhrif ónæmisbælandi meðferð hefur á framgang krabbameinsins og/eða nauðsynlega meðferð við því. Fyrsta einkennameðferðin sem notuð er hér á landi er kalíum-ganga hindrinn Amifampridine/Firdapse (3,4-diaminopyridine) sem er gefinn í töfluformi.13 Lyfið hámarkar losun acetýlkólíns úr fortaugamótunum og getur þannig lengt boðspennu (action potential). Lyfið er trappað upp og hafa þarf í huga að lyfið getur lækkað krampaþröskuld. Acetýlkólín-esterasa-hindrann Pyridostigmine (Mestinon) má gefa samhliða þessari meðferð þar sem lyfið eykur mögulega áhrif fyrrnefnda lyfsins auk þess sem aukaverkanir Mestinons draga úr munnþurrki. Ónæmisbælandi meðferð með sykursterum eða sterasparandi lyf eins og Azathioprine, Mycophenolate mofetil og Rituximab hafa öll sýnt árangur gegn LEMS ásamt inngripum eins og blóðvökvahreinsun (plasmaferesis) og ónæmisglóbúlínum (IvIg).14 Öll snýr þessi meðferð að því að draga úr skaðsemi sjálfsónæmismótefnanna. Að auki getur þurft að meðhöndla einkenni vegna áhrifa á ósjálfráða taugakerfið með viðeigandi lyfjum. Lyf sem hafa hamlandi áhrif á taugavöðvamót ber að varast og eins eru ýmis lyf þekkt fyrir að valda versnun á einkennum LEMS án þekktrar skýringar. Lista yfir þessi lyf má finna á viðurkenndum síðum.
Í umræddu tilfelli voru sterar viss frábending vegna sykursýkinnar og hófst því meðferð með Amifampridine auk IvIg eftir að búið var að útiloka illkynja mein eins og hægt var. Sjúklingur svaraði Amifampridine sæmilega en fór ekki að finna almennilegan mun á sér fyrr en eftir að meðferð hófst með IvIg og var sá munur strax ljós á fyrsta mánuði meðferðar. Verkir snarminnkuðu auk þess sem endurteknar klínískar læknisskoðanir og endurtekið ítarlegt mat sjúkraþjálfa staðfesti umtalsverðan mun á göngugetu. Vegna tíðra meðferða með IvIg (á 4-6 vikna fresti) var Rituximab sett inn samhliða þeirri meðferð nokkru síðar en það lyf er einstofna mótefni sem hemur ónæmissvörun með því að bindast CD20 viðtökum B-fruma. Markmiðið er að halda sjúkdómnum í skefjum með Rituximab eingöngu (lyfið er gefið á 6-12 mánaða fresti) og hefur það gefið góða raun erlendis. Eftirfylgd verður að mestu leyti klínísk en einnig er fyrirhugað að meta árangur meðferðar með nýjum taugaritum.
Atriði sem vert er að hafa í huga hjá LEMS-sjúklingum
Dæmigert er að einkenni versni við almenn veikindi svo sem hita og sýkingar. Ýmis lyf geta haft neikvæð áhrif á virkni taugavöðvamótanna og er því mikilvægt að forðast þau í meðferð LEMS-sjúklinga, er þar um sömu lyf að ræða og í vöðvaslensfári. Þetta eru algeng lyf eins og aminoglycosíð, beta-blokkerar og statín. Einnig er mikilvægt að hafa í huga að ýmis vöðvaslakandi svæfingarlyf geta valdið langvarandi vöðvaslappleika og ber því að forðast þau eða nota með mikilli varúð.15 Eldri tegundir skuggaefna voru varhugaverðar en nýrri tegundir virðast vera öruggar. Hér er tilvísun í gagnlega lista yfir lyf sem ber að forðast hjá þessum sjúklingahópi.16,17
Samantekt
LEMS er sjaldgæfur sjálfsónæmissjúkdómur sem getur verið snúinn í greiningu. Sjúkdómurinn getur fylgt illkynja krabbameinum (æxlishjákenni) en getur einnig greinst án undirliggjandi meins. Þrennan: 1. máttminnkun í stærri vöðvum neðri útlima/göngulagstruflanir, 2. minnkuð sinaviðbrögð (jafnvel engin) og 3. einkenni frá ósjálfráða taugakerfinu, ætti að vekja grun um LEMS. Einkennandi svörun fæst á tauga- /vöðvariti. Jákvæð mótefni í blóði hjálpa við greininguna en LEMS getur komið fram þrátt fyrir neikvæð mótefni og eins geta mótefnin verið til staðar án sjúkdómsins. Það má því segja að aðalgreiningartólið í þessum sjúkdómi séu taugalífeðlisfræðilegar rannsóknir og hið klíníska nef. Sjúkdómurinn getur haft mikil lífsgæðaskerðandi áhrif og meðferð haft mikið að segja. Gott er að þekkja til algengra lyfja sem ber að forðast hjá þessum sjúklingahópi.
Heimildir
| 1. Dourado E, Bottazzi F, Cardelli C, et al. Idiopathic inflammatory myopathies: one year in review 2022. Clin Exp Rheumatol 2023; 41: 199-231. https://doi.org/10.55563/clinexprheumatol/jof6qn PMid:36826800 |
||||
| 2. Galiero R, Caturano A, Vetrano E, et al. Peripheral Neuropathy in Diabetes Mellitus: Pathogenetic Mechanisms and Diagnostic Options. IJMS 2023; 24: 3554. https://doi.org/10.3390/ijms24043554 PMid:36834971 PMCid:PMC9967934 |
||||
| 3. London ZN. A Structured Approach to the Diagnosis of Peripheral Nervous System Disorders. CONTINUUM: Lifelong Learning in Neurol 2020; 26: 1130-60. https://doi.org/10.1212/CON.0000000000000922 PMid:33002996 |
||||
| 4. Zalewski NL, Lennon VA, Lachance DH, et al. P/Q- and N-type calcium-channel antibodies: Oncological, neurological, and serological accompaniments: Neuronal Calcium-Channel Abs. Muscle Nerve 2016; 54: 220-7. https://doi.org/10.1002/mus.25027 PMid:26789908 PMCid:PMC4940238 |
||||
| 5. Schoser B, Eymard B, Datt J, et al. Lambert-Eaton myasthenic syndrome (LEMS): a rare autoimmune presynaptic disorder often associated with cancer. J Neurol 2017; 264: 1854-63. https://doi.org/10.1007/s00415-017-8556-2 https://doi.org/10.1007/s00415-017-8541-9 PMid:28608304 |
||||
| 6. Muñiz-Castrillo S, Vogrig A, Honnorat J. Associations between HLA and autoimmune neurological diseases with autoantibodies. Autoimmun Highlights 2020; 11: 2. https://doi.org/10.1186/s13317-019-0124-6 PMid:32127039 PMCid:PMC7065322 |
||||
| 7. McGrogan A, Sneddon S, de Vries CS. The Incidence of Myasthenia Gravis: A Systematic Literature Review. Neuroepidemiol 2010; 34: 171-83. https://doi.org/10.1159/000279334 PMid:20130418 |
||||
| 8. Kesner VG, Oh SJ, Dimachkie MM, et al. Lambert-Eaton Myasthenic Syndrome. Neurologic Clin 2018; 36: 379-94. https://doi.org/10.1016/j.ncl.2018.01.008 PMid:29655456 PMCid:PMC6690495 |
||||
| 9. Ebright MJ, Li SH, Reynolds E, et al. Unintended consequences of Mayo paraneoplastic evaluations. Neurology 2018; 91: e2057-66. https://doi.org/10.1212/WNL.0000000000006577 PMid:30366974 PMCid:PMC6282240 |
||||
| 10. Titulaer MJ, Klooster R, Potman M, et al. SOX Antibodies in Small-Cell Lung Cancer and Lambert-Eaton Myasthenic Syndrome: Frequency and Relation With Survival. JCO 2009; 27: 4260-7. https://doi.org/10.1200/JCO.2008.20.6169 PMid:19667272 |
||||
| 11. Titulaer MJ, Maddison P, Sont JK, et al. Clinical Dutch-English Lambert-Eaton Myasthenic Syndrome (LEMS) Tumor Association Prediction Score Accurately Predicts Small-Cell Lung Cancer in the LEMS. JCO 2011; 29: 902-8. https://doi.org/10.1200/JCO.2010.32.0440 PMid:21245427 |
||||
| 12. Morren JA, Li Y. Myasthenia gravis: Frequently asked questions. CCJM 2023; 90: 103-13. https://doi.org/10.3949/ccjm.90a.22017 PMid:36724914 |
||||
| 13. Sanders DB, Juel VC, Harati Y, et al. 3,4-diaminopyridine base effectively treats the weakness of Lambert-Eaton myasthenia. Muscle Nerve 2018; 57: 561-8. https://doi.org/10.1002/mus.26052 PMid:29280483 PMCid:PMC5900968 |
||||
| 14. Weinberg DH. Lambert-Eaton myasthenic syndrome: Treatment and prognosis. medilib.ir/uptodate/show/5134 - september 2023. | ||||
| 15. Weingarten TN, Araka CN, Mogensen ME, et al. Lambert-Eaton myasthenic syndrome during anesthesia: a report of 37 patients. J Clin Anesthes 2014; 26: 648-53. https://doi.org/10.1016/j.jclinane.2014.09.009 PMid:25468580 |
||||
| 16. Cautionary drugs. Myasthenia Gravis Foundation of America. myasthenia.org/MG-Community/Cautionary-Drugs - september 2023. | ||||
| 17. Sanders DB, Wolfe GI, Benatar M, et al. International consensus guidance for management of myasthenia gravis: Executive summary. Neurol 2016; 87: 419-25. https://doi.org/10.1212/WNL.0000000000002790 PMid:27358333 PMCid:PMC4977114 |
||||