01. tbl. 108. árg. 2022
Fræðigrein
Aukin notkun á erfðaheilbrigðisþjónustu á Íslandi árin 2012-2017
Ágrip
INNGANGUR
Formleg erfðaráðgjafareining hefur verið starfrækt á Landspítala við Hringbraut frá árinu 2006. Samhliða hefur áhugi og þörf á erfðalæknisfræði í almennri heilbrigðisþjónustu aukist til muna. Í þessari grein er starfsemi og útkoma erfðarannsókna hjá erfða- og sameindalæknisfræðideild Landspítala á 5 ára tímabili (2012-2017) tekin saman. Sérstaklega var horft til fjölda einstaklinga, ástæðu komu, ástæðu erfðarannsókna án aðkomu erfðaráðgjafar Landspítala og eins var nýtni (heildarhlutfall rannsókna sem skila jákvæðri niðurstöðu) erfðarannsókna skoðuð.
AÐFERÐIR
Gögn um komur voru fengin upp úr sjúkraskrárkerfi erfðaráðgjafar, Shire og Sögu/Heilsugátt.
NIÐURSTAÐA
Fjöldi þeirra sem sóttu þjónustu erfðaráðgjafareiningarinnar jókst árlega allt tímabilið. Ástæður fyrir erfðaráðgjöf reyndust vera krabbameinstengdar í tveimur þriðju hlutum tilfella. Aðrir komu vegna fjölskyldulægra sjúkdóma sem eru algengir á Íslandi, ýmist sjúkdóma sem erfast ríkjandi (dæmi: vöðvaspennuvisnun og ofvaxtarhjartavöðvasjúkdómur) eða vegna víkjandi sjúkdóma (dæmi: mænuvöðvarýrnun og GM1-ganglio-síðkvilli). Algengast var að fólk færi í erfðarannsókn án aðkomu erfðaráðgjafar Landspítala vegna meðhöndlanlegra sjúkdóma, svo sem arfgengrar járnofhleðslu og bláæðasegatilhneigingar. Nýtni erfðarannsókna var metin fyrir a) leit að þekktum meinvaldandi breytingum, b) leit að meinvaldandi breytingum í stökum genum (eingenarannsóknir), c) fjölgenarannsóknir og d) tákn- og heilerfðamengisrannsóknir. Leit að þekktri breytingu skilaði jákvæðri niðurstöðu í 33% tilvika og leit í stöku geni í 46% tilvika. Nýtni fjölgenarannsókna vegna krabbameina var lægri (20%) samanborið við aðrar fjölgenarannsóknir (40%). Þá var nýtni tákn- og heilerfðamengisrannsókna 46%.
Greinin barst til blaðsins 17. maí 2021, samþykkt til birtingar 12. nóvember 2021.
Inngangur
Síðustu tvo áratugi hefur orðið bylting í erfðalæknisvísindum. Frá kapphlaupinu um raðgreiningu erfðamengis mannsins við upphaf aldarinnar hefur framþróun í raðgreiningartækni og erfðalæknisþjónustu verið hröð.1 Einnig hefur möguleiki á að geta haft áhrif á samsetningu erfðamengisins með líftækni orðið að veruleika.2 Samhliða hefur túlkun erfðaupplýsinga orðið sífellt flóknari.1 Erfðaráðgjöf hefur verið hluti af heilbrigðisþjónustu allt frá miðri seinustu öld.3 Hún er mikilvægur þáttur í því ferli sem sjúkdómsgreining og túlkun niðurstaðna úr erfðarannsóknum er, ásamt vísun í viðeigandi eftirlit og meðferð þegar það á við.4
Formleg erfðaráðgjafareining hefur verið starfrækt innan erfða- og sameindalæknisfræðideildar á Landspítala við Hringbraut frá árinu 2006. Fram að því höfðu ákveðnir læknar tekið að sér að veita erfðaráðgjöf, helst í tengslum við krabbamein og meðgöngu.4 Frá 2006 hafa nokkur þúsund einstaklingar leitað til einingarinnar. Á tímabilinu 2012-2017 voru starfandi á einingunni tveir deildarlæknar, einn erfðaráðgjafi, ritari og náttúrufræðingur. Nú (2021) starfa á einingunni þrír sérfræðingar í erfðalækningum í hlutastarfi, þrír erfðaráðgjafar í fullu starfi, deildarlæknir, kandídat, tveir hjúkrunarfræðingar, sálfræðingur og tveir ritarar.
Þrívegis hefur orðið skyndileg og mikil aukning á komum í erfðaráðgjöf í tengslum við fjölmiðlaumfjöllun eða einstakan atburð. Í fyrsta sinn þegar stjórnvöld í Færeyjum ákváðu að bjóða öllum Færeyingum rannsókn fyrir efnaskiptasjúkdómnum CTD (Carnitine transporter defect) sem er algengur í Færeyjum og að nokkru leyti á Íslandi vegna fjölda Færeyinga sem flust hafa til landsins.5 Í annað sinn árið 2013 þegar leikkonan Angelina Jolie skrifaði opið bréf í New York Times og sagði frá því að hún bæri meinvaldandi breytingu í BRCA1-geni.6 Að lokum varð nokkur aukning á komum í erfðaráðgjöf vorið 2018 í kjölfar þess að vefurinn arfgerd.is var opnaður hjá Íslenskri erfðagreiningu. Þar gat fólk leitað upplýsinga um hvort það bæri meinvaldandi breytinguna c.771_775del (betur þekkt sem 999del5) í BRCA2-geni.7
Eftir því sem höfundar vita best er þetta fyrsta samantekt á Íslandi á niðurstöðum erfðarannsókna sem gerðar hafa verið í tengslum við erfðaráðgjöf. Hún nær yfir 5 ára tímabil (2012-2017). Ein leið til að taka saman niðurstöður erfðarannsókna er að skoða nýtni (yield). Með nýtni erfðarannsókna er átt við það hlutfall rannsókna sem sýna jákvæða niðurstöðu á móti neikvæðum niðurstöðum og rannsóknum sem skila niðurstöðu með óþekkta klíníska þýðingu. Jákvæð niðurstaða þýðir að meinvaldandi erfðabrigði sem útskýrir sjúkdómsmynd einstaklings hefur fundist í erfðaefni hans. Samhliða var tekinn saman fjöldi þeirra sem fengu erfðaráðgjöf og þeirra sem fóru í erfðarannsókn án aðkomu erfðaráðgjafar Landspítala. Til viðbótar voru ástæður fyrir komu og niðurstöður rannsókna skráðar.
Aðferðir
Gögn um komur á árunum 2012-2017 í erfðaráðgjöf voru unnin upp úr sjúkraskrárkerfi ESD, Shire og Sögu/Heilsugátt. Shire var meginsjúkraskrárkerfi deildarinnar fram til 2016 en Saga/Heilsugátt hefur verið notuð í vaxandi mæli eftir það. Þá voru upplýsingar fengnar frá DNA-rannsóknarstofu ESD um sýni úr einstaklingum sem bárust á sama tímabili og þau samkeyrð til þess að fá yfirsýn yfir þá sem fóru í erfðarannsókn án erfðaráðgjafar hjá ESD. Einnig voru tíðnitölur yfir litninga- og örflögurannsóknir fengnar beint frá litningarannsóknarstofu ESD. Mismunandi var hvar erfðarannsóknirnar voru framkvæmdar, á DNA-rannsóknarstofu Landspítala, frumulíffræðideild spítalans eða á rannsóknarstofum erlendis. Einnig voru klínískar raðgreiningar gerðar hjá Íslenskri erfðagreiningu undir lok tímabilsins. Staðfesting og túlkun á niðurstöðum erfðarannsókna fóru alltaf fram á erfða- og sameindalæknisfræðideild Landspítala. Öll eftirvinnsla á gögnum fyrir rannsókn fór fram í Excel og eftirfylgniupplýsingar voru sóttar í sjúkraskrárkerfi Landspítala (Saga/Heilsugátt).
Niðurstöður
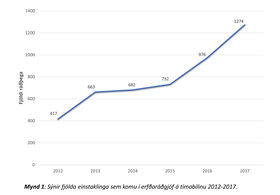
Úr Shire og Sögu fengust upplýsingar um 5063 einstaklinga sem skráðir voru í erfðaráðgjafahluta kerfanna á árunum 2012 til 2017. Ef ekki fannst færsla um erfðaráðgjöf var viðkomandi ekki talinn með. Alls 4744 einstaklingar á aldrinum 0-98 ára höfðu skráða komu í 4807 skipti á tímabilinu (mynd 1). Meðalaldur var 43 ár (miðgildi: 49 ár). Stöðug aukning á komum var yfir tímabilið (mynd 2), frá 417 komum árið 2012 í 1274 árið 2017. Gögn um fjölda símtala sem jafngiltu komu (símaráðgjöf) eru aðeins til frá árinu 2016 en þeim fjölgaði um ríflega helming, úr 575 í 1086 milli 2016 og 2017.
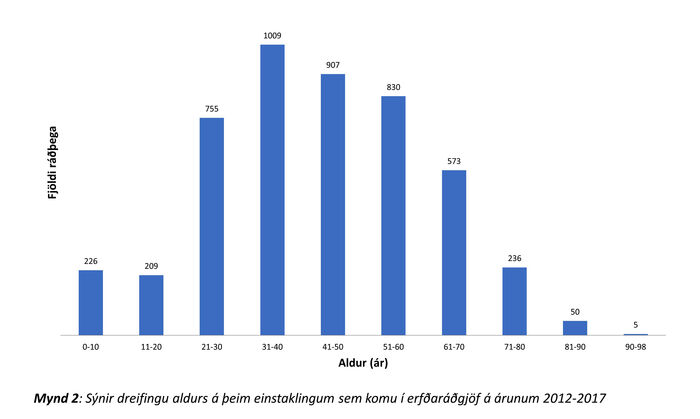 Mynd 1. Sýnir dreifingu aldurs þeirra sem komu í erfðaráðgjöf á árunum 2012-2017.
Mynd 1. Sýnir dreifingu aldurs þeirra sem komu í erfðaráðgjöf á árunum 2012-2017.
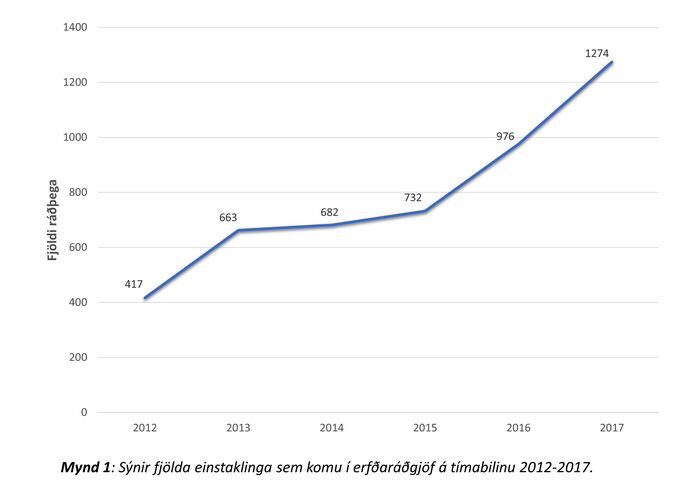 Mynd 2. Sýnir fjölda þeirra einstaklinga sem komu í erfðaráðgjöf á tímabilinu 2012-2017.
Mynd 2. Sýnir fjölda þeirra einstaklinga sem komu í erfðaráðgjöf á tímabilinu 2012-2017.
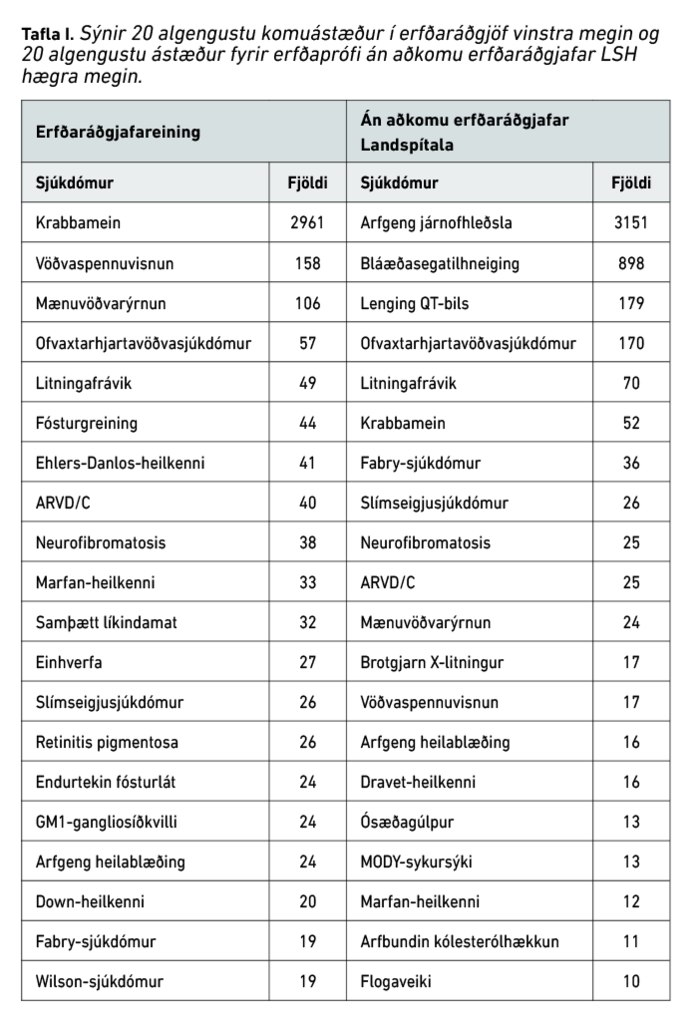
Helstu ástæður fyrir erfðaráðgjöf á þessu fimm ára tímabili voru krabbamein (n=2961, 62%). Á mynd 3 má sjá samsetningu annarra sjúkdóma en krabbameina (n=1846). Taugasjúkdómar voru algengastir (n=311, 17%), ásamt vöðvasjúkdómum (n=227, 12%) og hjarta- og æðasjúkdómum (n=226, 12%). Tafla I sýnir 20 algengustu ástæður fyrir komu í erfðaráðgjöf. Á eftir krabbameinum komu ýmsir sjúkdóma sem erfast ríkjandi. Af þeim má nefna til dæmis vöðvaspennuvisnun (myotonic dystrophy, n=158, 3%), ofvaxtarhjartavöðvasjúkdóm (hypertrophic cardiomyopathy, n=57, 1%), Marfan-heilkenni (n=33, 0,7%) og arfgenga heilablæðingu (n=24, 0,5%). Ráðgjöf vegna sjúkdóma sem erfast víkjandi og arfberapróf í tengslum við þá var einnig stór hluti erfðaráðgjafar. Af þeim sjúkdómum má nefna mænuvöðvarýrnun (spinal muscular atrophy; n=106, 2%) og GM1-ganglio-síðkvilla (n=24, 0,5%) sem dæmi. Erfðaráðgjöf vegna meðgöngutengdra vandamála var einnig algeng (tafla I) og einkum eftir niðurstöðu um auknar líkur á litningafráviki fósturs eftir samþætt líkindamat á fyrsta þriðjungi meðgöngu (n=32) og fósturgreiningu (n=44) (samtals n=76, 1,5%). Þá kom 1% vegna ýmissa annarra litningafrávika (n=49). Að lokum eru á listanum sjúkdómar sem oft er flókið að finna erfðaorsök fyrir, eins og einhverfa (n=27, 0,5%) og Ehlers-Danlos-heilkenni (n=41, 1%).
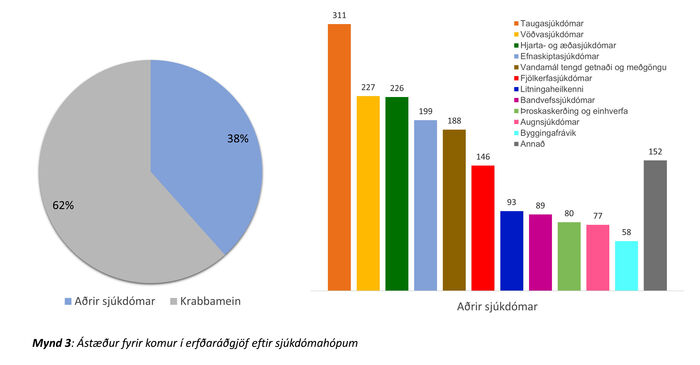 Mynd 3. Ástæður fyrir komur í erfðaráðgjöf eftir sjúkdómahópum.
Mynd 3. Ástæður fyrir komur í erfðaráðgjöf eftir sjúkdómahópum.
Gögn frá DNA-rannsóknarstofu ESD (tafla I) fyrir tímabilið sýna að fjöldi þeirra sem fóru í erfðarannsókn á Landspítala án skráðrar komu í erfðaráðgjöf (n=5503), er að stærstum hluta vegna tveggja sjúkdóma. Þeir eru arfgeng járnofhleðsla (haemochromatosis, n=3151, 57%) og bláæðasegatilhneiging (n=898, 16%). Sjúkdómar tengdir hjartarafleiðni eins og lenging QT-bils (Long QT syndrome, n=179, 3%) og ofvaxtarhjartavöðvasjúkdómur (n=170, 3%) voru einnig algengar ástæður fyrir erfðarannsóknum.
 Skoðaðir voru mismunandi flokkar erfðarannsókna sem framkvæmdar voru að undangenginni erfðaráðgjöf á Landspítala. Teknar voru saman niðurstöður eftir leit að þekktum meinvaldandi breytingum (target-testing), örflögugreiningum (array CGH), raðgreiningum (next generation sequencing, NGS) á stökum genum, fjölgenarannsóknir (gene panels) og tákn- og heilerfðamengisrannsóknir (whole exome sequencing, whole genome sequencing).
Skoðaðir voru mismunandi flokkar erfðarannsókna sem framkvæmdar voru að undangenginni erfðaráðgjöf á Landspítala. Teknar voru saman niðurstöður eftir leit að þekktum meinvaldandi breytingum (target-testing), örflögugreiningum (array CGH), raðgreiningum (next generation sequencing, NGS) á stökum genum, fjölgenarannsóknir (gene panels) og tákn- og heilerfðamengisrannsóknir (whole exome sequencing, whole genome sequencing).
Á tímabilinu voru framkvæmdar 2386 rannsóknir þar sem leitað var að þekktum meinvaldandi breytingum. Úr slíkum rannsóknum fékkst jákvæð niðurstaða í 33% tilfella (n=803). Neikvæðar niðurstöður voru 64% tilfella (n=1518). Niðurstöður úr 65 rannsóknum (3%) voru ekki aðgengilegar í þeim gagnagrunnum sem notaðir voru við rannsóknina. Algengast var að prófað væri fyrir landnemastökkbreytingum í BRCA1- og BRCA2-genum (n=1725, 72%). Raðgreiningar á stökum genum voru 181 yfir tímabilið. Þar af skiluðu 83 (46%) jákvæðri niðurstöðu og 98 skiluðu neikvæðri niðurstöðu (54%).
Á árunum 2014-2015 voru fjölgenarannsóknir teknar í notkun sem hluti af erfðauppvinnslu, mest vegna krabbameina en einnig vegna annarra sjúkdóma. Í kjölfarið voru tákn- og heilerfðamengisrannsóknir teknar í notkun. Á mynd 4 má sjá samantekt á niðurstöðum þeirra rannsókna. 491 fjölgenarannsókn var framkvæmd á tímabilinu, 378 (77%) vegna krabbameina og 113 (23%) vegna annarra sjúkdóma. Nýtni fjölgenarannsókna tengdra arf-gengum krabbameinum reyndist helmingi minni (20%) borið saman við aðrar fjölgenarannsóknir (40%) sem framkvæmdar voru yfir tímabilið. Nýtni tákn- og heilerfðamengisrannsókna var 46%. Gögn fengust um 88 slíkar rannsóknir, 53 (60%, nýtni = 40%) táknraðgreiningar og 35 (40%, nýtni = 52%) heilerfðamengisrannsóknir. Niðurstöður með óljósa klíníska þýðingu fengust í 56% tilfella í fjölgenarannsóknum vegna krabbameina, 23% tilfella hjá öðrum fjölgenarannsóknum og í 8% tilfella hjá tákn- og heilerfðamengisrannsóknum.
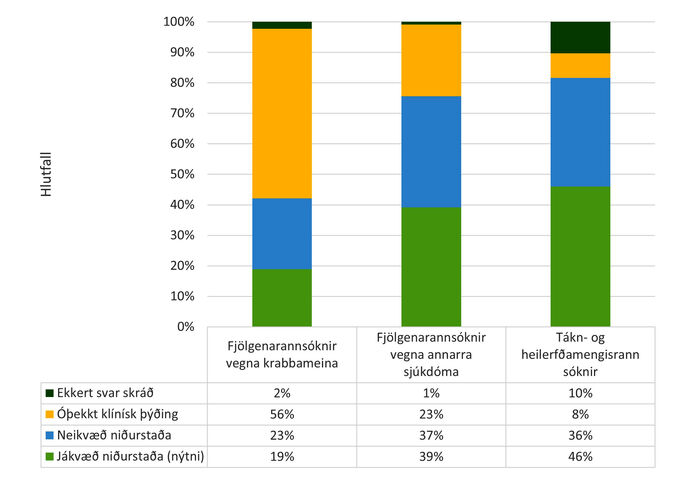 Mynd 4. Sýnir tölulegar upplýsingar um niðurstöður og nýtni fjölgenarannsókna vegna arfgengra krabbameina í samanburði við fjölgenarannsóknir vegna annarra sjúkdóma og tákn- og heilerfðamengisrannsókna.
Mynd 4. Sýnir tölulegar upplýsingar um niðurstöður og nýtni fjölgenarannsókna vegna arfgengra krabbameina í samanburði við fjölgenarannsóknir vegna annarra sjúkdóma og tákn- og heilerfðamengisrannsókna.
Samkvæmt gögnum frá litningarannsóknarstofu Landspítala fyrir tímabilið voru 475 örflögugreiningar gerðar. Í 34% tilfella var um að ræða eintakabreytingar (Copy number variations) á erfðaefni (n=161). Slíkar breytingar leiða oft til örbrottfalls- og örtvöföldunarheilkenna en 16 slík tilfelli greindust í gegnum erfðaráðgjöf Landspítala á tímabilinu.
Umræður
Vegna þeirra skilyrða sem sett voru í upphafi rannsóknar er ljóst að þau náðu ekki að öllu leyti yfir raunverulegan fjölda einstaklinga sem komu í erfðaráðgjöf á tímabilinu. Einnig má nefna að um afturskyggna rannsókn var að ræða og upplýsingar því aðeins jafn góðar og fyrirliggjandi gögn. Í sumum tilfellum vantaði færslur. Einnig var ekki ljóst að alltaf væru skráð nöfn þeirra ættingja sem fylgdu ráðþegum í viðtöl og höfðu ekki bein tengsl við sjúkdóm en gagn af erfðaráðgjöfinni engu að síður. Einnig endurspegla gögnin aðeins hluta þeirra sem fengu erfðaráðgjöf í gegnum síma.
Mikil aukning átti sér stað í erfðaráðgjöf á árunum 2012-2017. Mest varð aukningin milli 2012 og 2013 en þá fjölgaði komum um 59%. Þessi mikla aukning skýrist að hluta af þeim fjölda fólks sem leitaði sér erfðaráðgjafar eftir að leikkonan Angelina Jolie birti bréf í New York Times þar sem hún lýsti reynslu sinni af því að bera meinvaldandi breytingu í BRCA1-geni.6 Þá var aukningin minnst milli áranna 2013 og 2014, eða um 3%. Auknum fjölda koma fylgir aukin þörf á þjónustu og þeirri þörf hefur verið mætt, einkum með innleiðingu nýrra rannsókna og fjölgunar starfsfólks.
Þegar ástæður fyrir rannsókn voru skoðaðar kom í ljós að nokkur áherslumunur var vegna þeirra sem fóru í erfðaráðgjöf og erfðarannsókn í kjölfarið og þeirra sem fóru í erfðarannsókn án aðkomu erfðaráðgjafar ESD. Það kemur ekki á óvart að algengustu sjúkdómarnir sem sent var í rannsókn fyrir án aðkomu erfðaráðgjafar Landspítala eru í flestum tilvikum meðhöndlanlegir og um einstaklinga undir eftirliti sérfræðinga að ræða. Á það sérstaklega við í tilviki sjúkdóma eins og arfgengrar járnofhleðslu og bláæðasegatilhneigingar. Hafa ber í huga að erfðarannsóknir eru ein af mörgum greiningaraðferðum og ekki í öllum tilfellum sú besta. Athuga þarf að ekki eru allir sem mælast með of hátt ferritín í blóði arfhreinir fyrir stökkbreytingar sem valda arfgengri járnofhleðslu. Breytingarnar sem um ræðir eru algengar í samfélögum N-Evrópu og því ekki óalgengt að arfblendnir einstaklingar mælist með of hátt ferritín í blóði.8 Í grein Favoloro kemur fram að nýtni erfðarannsókna á stökkbreytingum tengdum bláæðasegatilhneigingu (F5: G1691A og F2: G20210A) sé í kringum 10% á árunum eftir 2010.9 Munur á tengslum þessara sjúkdóma við erfðaráðgjöf Landspítala gæti útskýrst með því að viðeigandi erfðapróf eru hluti af stærri uppvinnslu sjúklings hjá viðeigandi sérfræðingum.
Tíðni ákveðinna erfðaprófa er lægri hér á landi en annars staðar. Það helgast af algengi ákveðinna landnemabreytinga í íslensku þýði. Þannig er slímseigjusjúkdómur töluvert sjaldgæfari hér á landi en í Evrópu og vöðvaspennuvisnun, sem var algengasta ástæða fyrir erfðaprófi á eftir krabbameinum, er töluvert algengari.10,11 Mögulega mun það hlutfall breytast með auknum fjölda greininga og auknum fjölda innflytjenda á Íslandi.
Ástæður fyrir erfðaráðgjöf (að krabbameinum undanskildum) virtist vera nokkuð jafndreifðar með tilliti til sjúkdómahópa (mynd 3). Þetta er áhugavert í ljósi þess að deildin er lítil og þjónustar fjölbreyttan sjúklingahóp. Nýtni fjölgenarannsókna vegna krabbameina (n=396) var nokkuð lægri (20%) en vegna annarra sjúkdóma (40%). Einnig var munur á hversu oft niðurstaðan óþekkt klínísk þýðing fékkst. Í fjölgenarannsóknum vegna krabbameina var hlutfallið 56%, en 23% í fjölgenarannsóknum vegna annarra sjúkdóma.
Talsvert hefur verið skrifað um áhrif erfðabrigða með óþekkta klíníska þýðingu, bæði á greiningarferlið og fyrir sjúklinga.1 Erfðabrigði með óþekkta klíníska þýðingu geta oft flækt hvernig ráðþegi skilur niðurstöðu erfðarannsóknar og geta þau verið misskilin sem meinvaldandi.12 Erfðaráðgjöf Landspítala tekur á móti sjúklingum eftir tilvísun frá heilbrigðisstarfsfólki en einnig er sjálfsvísun í boði. Viðtöl fara fram ýmist í síma, myndsíma eða á göngudeild. Aðgengi að þjónustunni hefur jafnan verið gott og biðlistar stuttir. Í ljósi þess hve há nýtnin er fyrir ákveðna sjúkdómahópa má áætla að fleiri gætu átt erindi í erfðaráðgjöf. Kostir erfðaráðgjafar hafa verið vel skilgreindir og er því ljóst að hlutverk hennar innan almennar heilbrigðisþjónustu mun aukast.4,13 Greiningar í gegnum erfðaráðgjöf geta leitt til bættrar meðferðar fyrir ákveðna sjúklingahópa. Á rannsóknartímabilinu mætti til dæmis nefna sjúkdóma eins og Fabry-sjúkdóm og sum krabbameinsheilkenni. Í tilfelli Fabry-sjúkdóms var sértæk ensímuppbótarmeðferð (Enzyme Replacement Therapy) innleidd á tímabilinu.14,15 Fyrir krabbameinsheilkenni getur greining á erfðaþætti leitt til innleiðingar ákveðinna lyfja í krabbameinsmeðferð. Nærtækasta dæmið væri Olaparib sem nýtist við meðferð á eggjastokkakrabbameinum hjá arfberum að BRCA1/2-stökkbreytingum.16
Lágt nýtnihlutfall í fjölgenarannsóknum vegna krabbameina gæti orsakast af lágum þröskuldi fyrir framkvæmd slíkra rannsókna hér á Íslandi. ESD tók nýverið upp nýja hnitmiðaða fjölgenarannsókn, svokallaða TSHC-rannsókn (TruSight Hereditary Cancer Panel, fjölgenarannsókn fyrir arfgeng krabbamein) sem gerð er hér á landi. Sú rannsókn felur í sér raðgreiningu á 113 genum sem tengd hafa verið við arfgeng krabbamein. Jafnframt leitast DNA-rannsóknarstofa Landspítala við að meta breytingar með óþekkta klíníska þýðingu í rannsóknarniðurstöðum með tilliti til einkenna og/eða fjölskyldusögu. Nýleg grein Samadder tók til nýtni úr 80 gena erfðarannsókn sem gerð var hjá 2984 manns með krabbamein. Jákvæð niðurstaða fékkst í 13,3% tilfella og í 47,4% tilfella fundust breytingar með óljósa klíníska þýðingu.17 Nýtni fjölgenarannsókna vegna krabbameina var ívið hærri hér á landi á tímabilinu 2012-2017 (20%), en á sama tíma fékkst töluvert hærra hlutfall af breytingum með óljósa klíníska þýðingu (56%).
Nýtni tákn- og heilerfðamengisrannsókna yfir tímabilið er 46%. Þættir sem hafa áhrif á nýtni þeirra gæti verið takmarkaður fjöldi slíkra rannsókna (n=88), sem fyrst voru innleiddar undir lok tímabilsins. Hér gæti einnig verið um að ræða ákveðna uppsöfnun tilfella þar sem hópur með skýr einkenni erfðasjúkdóms en án greiningar hafi fyrst þá fengið aðgengi að slíkum rannsóknum. Ef niðurstöður erlendra rannsókna eru skoðaðar reynist nýtni tákn- og heilerfðamengisrannsókna almennt liggja á bilinu 25-50%.18-20 Útkoma þeirra veltur þó á ýmsu. Gerð sjúkdóms, uppvinnsla sjúklings og fjöldi rannsókna sem framkvæmdar voru áður en gerðar voru tákn- eða heilerfðamengisraðgreiningar, sem og hversu hár þröskuldur er til staðar að velja svo viðamikla og dýra rannsókn.18
Eftir því sem aðgengi að erfðarannsóknum eykst og kostnaður þeirra minnkar má gera ráð fyrir að þröskuldur fyrir erfðarannsókn lækki samhliða. Því má búast við með auknum fjölda rannsókna að nýtni erfðarannsókna lækki í framhaldinu. Samkvæmt verkferli erfðaráðgjafar Landspítala er hvert tilfelli metið með tilliti til þess hvort farið skal út í stærri rannsóknir eins og WGS/WES þegar aðrar erfðarannsóknir hafa ekki náð að útskýra einkenni sjúklings (skilað neikvæðum niðurstöðum). Í því samhengi hefur aðgengi að nýjum stærri erfðarannsóknum alltaf verið gott og almennt lágur þröskuldur fyrir áframhaldandi erfðauppvinnslu.
Lokaorð
Erfðaráðgjöf er í auknum mæli nýtt sem hluti af uppvinnslu einstaklinga í almennri heilbrigðisþjónustu. Tækniframförum og aukinni eftirspurn hefur verið mætt með innleiðingu nýrra rannsókna og fjölgun starfsfólks. Liður í því að bæta þjónustuna er að skoða og gera grein fyrir starfsemi einingarinnar. Þessari grein var ætlað að varpa ljósi á starfsemi yfir 5 ára tímabil. Áætlað er að endurtaka þessa rannsókn á 5 ára fresti en með því að birta tölulegar upplýsingar um starfsemina fæst regluleg yfirsýn yfir þjónustu erfðaráðgjafar Landspítala.
Heimildir
| 1. Horton RH, Lucassen AM. Recent developments in genetic/genomic medicine. Clin Sci 2019; 133: 697-708. https://doi.org/10.1042/CS20180436 PMid:30837331 PMCid:PMC6399103 |
||||
| 2. Perez Rojo F, Nyman RKM, Johnson AA, et al. CRISPR-Cas systems: Ushering in the new genome editing era. Bioengineered 2018; 9: 214-21. https://doi.org/10.1080/21655979.2018.1470720 PMid:29968520 PMCid:PMC6067892 |
||||
| 3. Resta RG. What have we been trying to do and have we been any good at it? A history of measuring the success of genetic counseling. Eur J Med Genet 2019; 62: 300-7. https://doi.org/10.1016/j.ejmg.2018.11.003 PMid:30414532 |
||||
| 4. Stefánsdóttir V, Arngrímsson R, Jónsson JJ. Iceland-Genetic Counseling Services. J Genet Counsel 2013; 22: 907-10. https://doi.org/10.1007/s10897-013-9640-0 PMid:23949570 |
||||
| 5. Lund AM, Joensen F, Hougaard DM, et al. Carnitine transporter and holocarboxylase synthetase deficiencies in The Faroe Islands. J Inherited Metabol Dis 2007; 30: 341-9. https://doi.org/10.1007/s10545-007-0527-9 PMid:17417720 |
||||
| 6. Jolie A. My Medical Choice. New York Times 14. mars 2013. | ||||
| 7. Stefánsdóttir V, Þórólfsdóttir EÞ, Högnason HB, et al. Web-based return of BRCA2 research results: One-year genetic counselling experience in Iceland. Eur J Hum Genet 2020; 28: 1656-61. https://doi.org/10.1038/s41431-020-0665-1 PMid:32523053 PMCid:PMC7784695 |
||||
| 8. Adams PC. Is DNA testing for hemochromatosis diagnosis reliable? Exp Rev Molecul Diagnost 2017; 17: 203-4. https://doi.org/10.1080/14737159.2017.1283221 PMid:28092202 |
||||
| 9. Favaloro EJ. Genetic Testing for Thrombophilia-Related Genes: Observations of Testing Patterns for Factor V Leiden (G1691A) and Prothrombin Gene "Mutation" (G20210A). Sem Thrombos Hemostas 2019; 45: 730-42. https://doi.org/10.1055/s-0039-1694772 PMid:31398733 |
||||
| 10. Bergsteinsson H, Baldursson O, Clausen M, et al. 466 Cystic Fibrosis in Iceland 1955-2005; incidence, survival and CFT mutations in the Icelandic population. J Cyst Fibr 2006; 5: S102. https://doi.org/10.1016/S1569-1993(06)80392-9 |
||||
| 11. Leifsdóttir G, Benedikz J, Jóhannesson G, et al. Spennuvisnun (Dystrophia Myotonica): almennt yfirlit og algengi á Íslandi. Læknablaðið 2005; 91: 829-34. | ||||
| 12. Clift K, Macklin S, Halverson C, et al. Patients' views on variants of uncertain significance across indications. J Comm Genet 2020; 11: 139-45. https://doi.org/10.1007/s12687-019-00434-7 PMid:31432391 PMCid:PMC7062975 |
||||
| 13. Patch C, Middleton A Genetic counselling in the era of genomic medicine. Br Med Bull 2018; 126: 27-36. https://doi.org/10.1093/bmb/ldy008 PMid:29617718 PMCid:PMC5998955 |
||||
| 14. Þórisdóttir AL. Bræðurnir fá lyf við Fabry sjúkdómnum. Morgunblaðið 2013; 13. mars: 12. | ||||
| 15. McCafferty EH, Scott LJ. Migalastat: A Review in Fabry Disease. Drugs 201; 79: 543-54. https://doi.org/10.1007/s40265-019-01090-4 PMid:30875019 PMCid:PMC6647464 |
||||
| 16. Ray-Coquard I, Pautier P, Pignata S, et al. Olaparib plus Bevacizumab as First-Line Maintenance in Ovarian Cancer. N Engl J Med 2019; 381: 241-28. https://doi.org/10.1056/NEJMoa1911361 PMid:31851799 |
||||
| 17. Samadder NJ, Riegert-Johnson D, Boardman L, et al. Comparison of Universal Genetic Testing vs Guideline-Directed Targeted Testing for Patients with Hereditary Cancer Syndrome. JAMA Oncol 2021; 7: 230. https://doi.org/10.1001/jamaoncol.2020.6252 PMid:33126242 PMCid:PMC7600058 |
||||
| 18. Sawyer SL, Hartley T, Dyment DA, et al. Utility of whole-exome sequencing for those near the end of the diagnostic odyssey: Time to address gaps in care. Clin Genet 2016; 89: 275-84. https://doi.org/10.1111/cge.12654 PMid:26283276 PMCid:PMC5053223 |
||||
| 19. Trujillano D, Bertoli-Avella AM, Kumar Kandaswamy K, et al. Clinical exome sequencing: Results from 2819 samples reflecting 1000 families. Eur J Hum Genet 2017; 25: 176-82. https://doi.org/10.1038/ejhg.2016.146 PMid:27848944 PMCid:PMC5255946 |
||||
| 20. Lionel AC, Costain G, Monfared N, et al. Improved diagnostic yield compared with targeted gene sequencing panels suggests a role for whole-genome sequencing as a first-tier genetic test. Genet Med 2018; 20: 435-43. https://doi.org/10.1038/gim.2017.119 PMid:28771251 PMCid:PMC5895460 |
||||