07/08. tbl. 104. árg. 2018
Umræða og fréttir
Skortur á tilkynningum um alvarlegar aukaverkanir lyfja til Lyfjastofnunar
Mikilvægt er að tilkynna allar alvarlegar aukaverkanir til Lyfjastofnunar eða til markaðsleyfishafa. Alvarlegar aukaverkanir teljast þær aukaverkanir sem leiða til dauða, sjúkrahúsvistar eða lengingar á sjúkrahúsvist, lífshættulegs ástands, fötlunar eða fósturskaða. Skráning slíkra tilkynninga í miðlægan gagnagrunn Lyfjastofnunar Evrópu (EMA), EudraVigilance, er mikilvæg því þær liggja meðal annars til grundvallar uppfærðri samantekt um eiginleika lyfsins (SmPC) í Sérlyfjaskrá, auk bættra öryggisupplýsinga og klínískra leiðbeininga.
Nýleg samantekt á fjölda og eðli aukaverkanatilkynninga á Íslandi fyrir árin 2013-2016 sýndi að fjöldi tilkynntra aukaverkana sem flokkast sem alvarlegar voru færri á Íslandi borið saman við hin Norðurlöndin.1 Þó er ekkert sem bendir til þess að alvarlegar aukaverkanir lyfja séu færri hér á landi en annars staðar. Hlutfall tilkynninga um alvarlegar aukaverkanir af heildarfjölda á hinum Norðurlöndunum var frá 38-64% á árunum 2013-2016 en sama hlutfall var um 10% hér á landi.1 Í kjölfar samantektarinnar hóf Lyfjastofnun samstarf við Landspítala en einstaklingar með alvarlegar aukaverkanir leita oft á móttökur sjúkrahúsa. Það eru bundnar vonir við að samstarfið leiði til fjölgunar tilkynninga um aukaverkun og þá sérstaklega tilkynninga um alvarlegar aukaverkanir. Þannig fást betri upplýsingar sem minnka áhættu og auka ávinning af notkun lyfja.
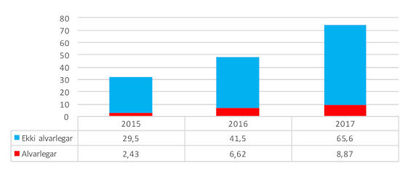
Mynd 1. Samanburður á fjölda og alvarleika tilkynntra aukaverkana
lyfja til Lyfja-stofnunar fyrir hverja 100.000 íbúa, eftir árum.
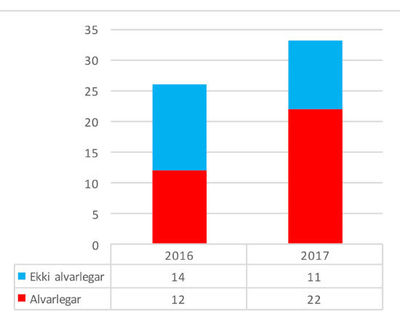
Mynd 2.Fjöldi og alvarleiki tilkynntra aukaverkana lyfja frá Landspítala
til Lyfjastofnunar eftir árum.
Niðurstöður
Heildarfjöldi aukaverkanatilkynninga lyfja
Aukning hefur verið á aukaverkanatilkynningum lyfja, þar með talið vegna alvarlegra aukaverkana, til Lyfjastofnunar frá árinu 2015 (mynd 1).2,3 Árið 2017 var heildarfjöldi tilkynninga 252, þar af 30 vegna alvarlegra aukaverkana.
Tilkynntar aukaverkanir eftir ATC-flokkun lyfja
Fjöldi tilkynntra aukaverkana, með tilliti til mismunandi ATC-flokka, var mestur í ATC-flokki N (tauga- og geðlyf), eða 45% af heildarfjölda aukaverkanatilkynninga árið 2017. Af þeim voru 75% þeirra tilkynninga vegna gruns um aukaverkun/vanverkun í tengslum við lyf úr flokki N06BA04 (methylphenidatum). Tilkynningar um alvarlegar aukaverkanir dreifðust nokkuð jafnt yfir ATC-flokka lyfja og var enginn einn lyfjaflokkur mest áberandi.
Tilkynntar aukaverkanir lyfja frá Landspítala
Á árinu 2017 bárust 33 tilkynningar um aukaverkanir lyfja til Lyfjastofnunar frá Landspítala og 22 af þeim lýstu alvarlegum aukaverkunum, (mynd 2),2 sem er 73% af heildarfjölda tilkynninga á alvarlegum aukaverkunum til Lyfjastofnunar.
Dæmi um tilkynntar aukaverkanir lyfja frá Íslandi sem hafa áhrif á lyfjaupplýsingar
Misoprostol: Á árunum 2015 og 2016 bárust 5 tilkynningar, þar af ein alvarleg, vegna gruns um aukaverkun í tengslum við notkun á Misodel í ATC-flokknum G (þvagfæralyf, kvensjúkdómalyf og kynhormónar) til Lyfjastofnunar. Sambærilegar tilkynningar bárust til EMA frá öðrum löndum sem leiddu til þess að algengi aukaverkana (óeðlilegir samdrættir í legi, óeðlilegar fæðingarhríðir sem hafa áhrif á fóstur, of mikil vöðvaspenna í legi) var aukið í SmPC og öryggisupplýsingar sendar til lækna.
Nivolumab: Á árinu 2017 bárust þrjár tilkynningar vegna gruns um heilabólgu (encephalitis) í tengslum við notkun á virka efninu nivolumabum í ATC-flokknum L (æxlishemjandi lyf og lyf til ónæmistemprunar) til Lyfjastofnunar. Í fyrstu tveimur tilfellanna leiddi aukaverkun til dauða sjúklings. Sambærileg einkenni hjá þriðja sjúklingnum leiddu til skjótrar uppvinnslu og meðferðar þannig að sjúklingur náði sér að fullu þrátt fyrir lífshættulegt ástand. Íslensku tilkynningarnar voru 30% allra tilkynninga sem bárust til EMA, lýstu breytingu á meðvitundarástandi og heilabólgu, og leiddu til þess að texti í SmPC var uppfærður.
Ályktun
Söfnun upplýsinga um aukaverkanir og úrvinnslu þeirra er mikilvægur hlekkur í neytendavernd sem hefur það að markmiði að bæta notkun og auka öryggi lyfja. Fjöldi aukaverkanatilkynninga þarf að vera um 100.000 íbúa og tilkynningar alvarlegra aukaverkana að minnsta kosti 35/100.000 íbúa árlega til þess að fjöldinn sé sambærilegur og á hinum Norðurlöndunum. Lyfjastofnun hefur sett sér það markmið að tilkynningum um alvarlegar aukaverkanir fjölgi um 50% árið 2018 miðað við árið 2017, eða úr 30 í 45 tilkynningar. Á fyrri hluta þessa árs hafa 11 tilkynningar vegna alvarlegra aukaverkana skilað sér til Lyfjastofnunar og þar af 7 frá Landspítala. Til þess að aukaverkanatilkynningum lyfja til Lyfjastofnunar fjölgi frá síðastliðnu ári er ljóst að mun fleiri tilkynningar þurfa að skila sér inn það sem eftir er árs. Aukaverkun er tilkynnt með því að fylla út vefeyðublað sem hægt er að nálgast á forsíðu Lyfjastofnunar, lyfjastofnun.is
Heimildir
| 1. Jónsdóttir SS, Ólafsdóttir S, Guðmundsdóttir H. Tilkynntar aukaverkanir lyfja á Íslandi á árunum 2013-2016. Samanburður við tilkynningar frá Norðurlöndum. Læknablaðið 2017; 103: 319-23. https://doi.org/10.17992/lbl.2017.0708.144 https://doi.org/10.17992/lbl.2017.07/08.144 |
|
| 2. Gagngrunnur Lyfjastofnunar. | |
| 3. Mannfjöldatölur frá Hagstofu Íslands, hagstofa.is - júní 2018. | |


