09. tbl. 94. árg. 2008
Fræðigrein
Árangur á notkun líftæknigerðs espaðs storkuþáttar VIIa við meiriháttar blæðingum í opnum hjartaskurðaðgerðum
The use of recombinant activated factor VIIa for major bleedings in open heart surgery
Ágrip
Inngangur: Rannsakaður var með aftursæjum hætti árangur meðhöndlunar lífshættulegra blæðinga í opnum hjartaaðgerðum á Landspítala með líftæknigerðum espuðum storkuþætti VII (recombinant factor VIIa, rFVIIa).
Efniviður og aðferðir: Frá júní 2003 til mars 2006 fengu 10 sjúklingar rFVIIa vegna meiriháttar blæðinga sem ekki tókst að stöðva með hefðbundinni meðferð í 11 hjartaskurðaðgerðum. Upplýsingar voru fengnar úr sjúkraskrám.
Niðurstöður: Meðalaldur var 66 ár (bil 36-82). Allir sjúklingarnir voru í NYHA-flokki III eða IV, þar af gengust þrír undir bráðaaðgerð. Algengustu aðgerðirnar voru ósæðarlokuskipti (n=5), með eða án kransæðahjáveitu. Tímalengd aðgerðanna var að meðaltali 673 mínútur (bil 475-932) og tími í hjarta- og lungnavél 287 mínútur (bil 198-615). Í 8 af 11 aðgerðum stöðvaðist blæðing skömmu eftir gjöf rFVIIa. Þrír sjúklingar þurftu þó enduraðgerð vegna blæðinga. Gjöf rauðkornaþykknis (p=0,002) og blóðvatns (p<0,02) minnkaði marktækt eftir gjöf rFVIIa og próþrombín-tími styttist (p<0,004). Fimm sjúklingar lifðu aðgerðina af en dánarorsakir hinna fimm voru óstöðvandi blæðing í aðgerð, segarek til lungna, hjartadrep, fjölkerfabilun og blóðstorkusótt.
Ályktun: rFVIIa er virkt lyf til að stöðva meiriháttar blæðingar í opnum hjartaaðgerðum, en blæðing stöðvaðist í 8 af 11 aðgerðum við gjöf lyfsins. Fimm sjúklingar af tíu lifðu aðgerðirnar af og útskrifuðust heim en hafa verður í huga að lyfið var einungis gefið þegar öll önnur meðferð hafði verið reynd til hlítar og sjúklingarnir hefðu annars dáið úr blæðingu. Í einu tilviki lést sjúklingur úr óstöðvandi blæðingu þrátt fyrir gjöf rFVIIa. Einn sjúklingur lést úr segareki til lungna og annar vegna bráðs hjartadreps, hvort tveggja dauðsföll sem gætu hafa tengst gjöf lyfsins.
Inngangur
Alvarlegar blæðingar eru algengir fylgikvillar opinna hjartaaðgerða (1). Oftast er um tiltölulega vægar blæðingar að ræða sem svara meðferð með prótamíni, tranexamic sýru, blóðvatns- og blóðflögugjöfum. Hjá hluta sjúklinga er þó um meiriháttar blæðingar að ræða, annaðhvort í aðgerðinni sjálfri þannig að ekki reynist unnt að loka sárinu, eða eftir aðgerðina. Því eru 4-8% þeirra teknir til enduraðgerðar vegna blæðingar (2). Hjá þessum sjúklingum er tíðni fylgikvilla verulega aukin og hluti þeirra lætur lífið af völdum blæðingarinnar eða afleiðingum hennar.

Líftæknigerður espaður storkuþáttur VIIa (recombinant activated coagulation factor VII, rFVIIa, NovoSeven®, Novo Nordisk A/S, Danmörku) var þróaður, sem lyf til meðferðar blæðinga hjá sjúklingum með deyrasýki og mótefni gegn meðfæddum skorti á storkuþætti VII (3, 4). Á seinni árum hefur notkun lyfsins farið vaxandi við óskráðum og lítt rannsökuðum ábendingum (5). Við lífeðlisfræðilegar kringumstæður stuðlar storkuþáttur VIIa að myndun þrombíns og þá með því að bindast vefjaþætti (tissue factor) í særðum æðavegg. Í kjölfar þess fylgir flókið samspil storkuþátta og blóðflagna sem á endanum leiðir til myndunar blóðflögukökks og fjölliðunar fíbríns á yfirborði blóðflagnanna (6). Í lyfjafræðilegri þéttni er hins vegar talið að rFVIIa stuðli að þrombínmyndun óháð vefjaþætti með ræsingu storkuþáttar X á yfirborði espaðra blóðflagna (7), en espaðar blóðflögur eru líkt og vefjaþáttur til staðar í særðum æðavegg (4). Segamyndun hefur verið lýst eftir notkun lyfsins en er sjaldséður fylgikvilli. Þetta á einkum við um eldri einstaklinga sem hafa aukna áhættu fyrir myndun sega (8). Frá árinu 1999 hefur rFVIIa verið notað í vaxandi mæli sem hinsta úrræði til að stöðva meiriháttar blæðingar í tengslum við slys og skurðaðgerðir hjá sjúklingum sem ekki hafa meðfæddan blæðingasjúkdóm (9). Fjölda sjúkratilfella hefur verið lýst þar sem talið er að gjöf rFVIIa hafi skipt sköpum við að stöðva blæðingar og þannig bjargað mannslífum. Í ljósi fjölbreytileika slíkra kringumstæðna er þó fátt um samanburðarrannsóknir (7) og því er erfitt að leggja mat árangur og einkum fylgikvilla meðferðar.
Á Landspítala hefur rFVIIa verið notaður frá árinu 2003 við meðferð meiriháttar blæðinga í opnum hjartaaðerðum og ætíð sem síðasta úrræði þegar önnur meðferð hefur ekki dugað til að stöðva blæðingar. Tilgangur þessarar rannsóknar var að kanna árangur notkunar lyfsins við opnar hjartaaðgerðir hér á landi.
Efniviður og aðferðir
Áður en rannsóknin hófst fengust öll tilskilin leyfi frá Persónuvernd og Vísindasiðanefnd Landspítala. Rannsóknin er aftursæ klínísk rannsókn á öllum þeim sjúklingum sem gengust undir hjartaskurðaðgerð og fengu rFVIIa á tímabilinu frá 1. júní 2003 til 1. mars 2006 á Landspítala. Sjúklingar voru fundnir með því að bera saman þrenns konar skrár á Landspítala; skrár blóðmeinafræðivaktar, gjörgæsludeildar og apóteks. Klínískar upplýsingar voru fengnar úr sjúkraskrám og aðgerðalýsingum, meðal annars aldur, kyn, New York Heart Association (NYHA) flokkun, tegund og lengd aðgerðar, blóðtap í aðgerð, magn blóðgjafar og hvaða storkuhemjandi lyfjum var beitt. Einnig voru skráðar niðurstöður storkuprófa fyrir og eftir gjöf rFVIIa og klínískt mat skurðlækna á árangri gjafar rFVIIa. Skráður var legutími á gjörgæslu og legudeild og kannað hverjir lifðu af meðferðina. Farið var í krufningaskýrslur þeirra sjúklinga sem létust.
Hjartaaðgerðirnar voru framkvæmdar með aðstoð hjarta- og lungnavélar þar sem beitt var vægri kælingu (33-34°C) og hjartað stöðvað með kalíumríkri blóðlausn (blood cardioplegia). Heparín var gefið út frá þyngd sjúklings og var ACT (activated clotting time) haldið yfir 400 sekúndum þegar sjúklingur var í hjarta- og lungnavél. Þegar hjarta- og lungnavélin var aftengd var gefið prótamín samkvæmt þyngd sjúklings. Ef upp kom alvarleg blæðing í aðgerð sem ekki átti sér augljósar orsakir (svo sem leka frá æðatengingum), var beitt storkuhvetjandi lyfjum eftir ástæðum (til dæmis tranexamic sýru og aprotiníni) og/eða gjöf blóðvatns, kuldabotnfalls (cryoperciptate), blóðflagna eða fibrínógens. Einungis var gripið til rFVIIa þegar önnur úrræði höfðu verið fullreynd og alltaf í samráði við bæði vakthafandi blóðmeinafræðing og svæfingalækni samkvæmt fyrirfram ákveðnum vinnureglum sjúkrahússins (sjá töflu I). Storkupróf, þar með talin ACT (activated clotting time), APTT (activated partial thromboplastin time) og PT (prothrombin time), voru mæld fyrir og eftir gjöf lyfsins.
Upplýsingar voru skráðar í forritið Excel og GraphPad Prism 4.0 tölfræðiforritið var notað til tölfræðiúrvinnslu. Gefin eru upp meðaltöl, bil auk miðgildis og tölfræðileg marktækni var reiknuð með Wilcoxon signed rank prófi fyrir paraðar niðurstöður (fyrir/eftir). Tölfræðileg marktækni miðaðist við p-gildi <0,05.
Niðurstöður
Tíu sjúklingar (sex karlar, fjórar konur), meðal-aldur 66 ár (bil 38-82 ár), fengu rFVIIa í 11 opnum hjartaaðgerðum. Sjö þeirra voru í NYHA flokki III og þrír í flokki IV. Þrjár aðgerðanna voru bráðaaðgerðir. Tveir sjúklingar tóku warfarín og klópídrógel fyrir aðgerð. Sjö sjúklingar fengu rFVIIa í fyrstu aðgerð, tveir í enduraðgerðum vegna blæðinga og einn í bæði upphaflegri aðgerð og enduraðgerð. Algengasta aðgerðin var ósæðarlokuskipti, með eða án kransæðahjáveitu (sjá töflu II). Í tíu aðgerðanna fengu sjúklingar einn skammt af rFVIIa og í einni þrjá skammta. Sá sem fékk þrjá skammta fékk jafnframt hæstu einstöku skammtana. Aðgerðartími var að meðaltali 673 mínútur (miðgildi 695, bil 475-932), tími í hjarta- og lungnavél 287 mínútur (miðgildi 265, bil 198-615) og tangartími 184 mínútur (miðgildi 147, bil 85-389). Meðaltími frá gjöf rFVIIa til loka aðgerðar var 132 mínútur (miðgildi 95, bil 30-330). Meðalskammtur lyfsins var 69 µg/kg (miðgildi 40, bil 40-160). Allir sjúklingarnir höfðu fyrir gjöf rVIIa fengið prótamín, plasma og blóðflögur, en fjórir sjúklingar fengu að auki tranexamic sýru, þrír aprótínin og þrír desmopressín. Fíbrínógen mældist að meðaltali 1,7 g/L (bil 0,2-3,8) en viðmiðunarmörk eru 1,5-4,0 g/L. Sjö sjúklingar fengu fíbrínógen fyrir eða skömmu eftir gjöf rVIIa, þar af höfðu tveir verið undir viðmiðunarmörkum.
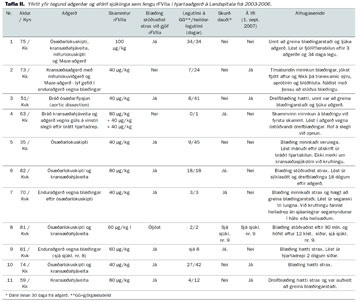
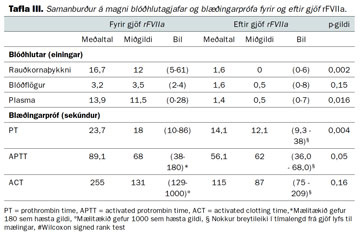
Í 10 aðgerðum af 11 náðist að stöðva blæðinguna, í 8 þeirra skömmu eftir gjöf rFVIIa. Í þeim þremur aðgerðum þar sem virkni lyfsins var lítil eða óviss hafði áður verið gefið fíbrínógen í öllum tilvikum. Nákvæm skráning á magni blæðingar fyrir og eftir gjöf rFVIIa reyndist ekki liggja fyrir í sjúkraskrám. Hins vegar dró marktækt úr gjöf rauðkornaþykknis og blóðvatns eftir gjöf rVIIA (tafla III). Einnig kom fram breyting til batnaðar á storkuprófum, einkum PT (tafla III). Nokkur munur er á tímalengd frá fyrstu mælingu storkuprófa til gjafar rVFIIa annars vegar og fram að næstu mælingu hins vegar. Í 9 af 11 aðgerðum hafði prótamín verið gefið áður en fyrsta mæligildi var fengið.
Þrír sjúklingar þurftu enduraðgerð vegna endurblæðingar, þar af einn tvær enduraðgerðir. Af samtals 10 sjúklingum sem fengu rFVIIa lifðu fimm aðgerðirnar af og útskrifuðust heim til sín, að meðaltali eftir 33 daga sjúkrahúslegu (miðgildi 41 dagur, bil 12-45). Heildarlegutími þessara sjúklinga og legutími á gjörgæslu er sýndur í töflu II. Af sjúklingunum fimm sem útskrifuðust lést einn mánuði eftir útskrift. Dánarorsökin var bráð hjartabilun hjá 35 ára karlmanni sem gengist hafði undir bráðaaðgerð þar sem skipt var um ósæðarloku vegna hjartaþelsbólgu (endocarditis). Hinir fjórir sjúklingarnir eru á lífi (1. september 2007), 18-44 mánuðum frá aðgerð. Einn þessara sjúklinga fékk dreifða blóðsega í fætur 10 dögum eftir aðgerð sem orsökuðu drep sem talið var að hefði stafað af blóðsegareki tengdri alvarlegri sýkingu og sýklasótt (septic embolism).
Fimm sjúklingar létust í sömu sjúkrahúslegu, einn í aðgerð, tveir tveimur dögum eftir aðgerð og einn eftir rúmar tvær vikur. Sá fimmti lést eftir 34 daga og fellur þannig ekki undir hina hefðbundnu skilgreiningu á skurðdauða sem telst vera innan 30 daga eftir aðgerð. Hjá sjúklingnum sem lést í aðgerð náðist ekki að stöðva blæðingu, en rof varð á gúl (aneurysma) á vinstri slegli í kjölfar bráðs hjartadreps. Annar sjúklingur lést skyndilega og óvænt á gjörgæslu tæpum tveimur sólarhringum eftir ósæðarlokuskiptaaðgerð. Við krufningu fannst blóðsegarek í lungnaslagæð og jafnframt drep í heila en ekki fannst blóðsegi í samsvarandi háls- eða heilaæðum. Hjá þriðja sjúklingnum voru hjartalínuritsbreytingar strax eftir aðgerð og lést hann úr hjartadrepi tveimur dögum eftir aðgerð. Fjórði sjúklingurinn lést fimm vikum eftir aðgerð vegna fjölkerfabilunar, sem sennilega mátti rekja til blæðingartruflana og lostástands í aðgerð og sá fimmti úr dreifðri blæðingu eftir þriggja vikna legu á gjörgæslu.
Umræður
Þessi rannsókn styður að rFVIIa sé áhrifaríkt lyf til að stöðva meiriháttar blæðingar við opnar hjartaaðgerðir. Hjá átta sjúklingum af 10 (eða í 8 af 11 aðgerðum) stöðvaðist blæðingin skömmu eftir gjöf lyfsins, en í einu tilviki var eftir á að hyggja ekki von til þess að blæðing stöðvaðist þar sem vinstri slegill var rofinn. Helmingur sjúklinganna lést eftir aðgerð en rétt er að hafa í huga að önnur úrræði til að stöðva blæðinguna voru þrotin og þessir sjúkingar hefðu því að öllum líkindum látist í aðgerð vegna blæðingarinnar. Það er því álit höfunda að meðferð með rFVIIa hafi bjargað nokkrum mannslífum við þessar skurðaðgerðir hér á landi. Einnig verður að hafa í huga að flestir sjúklinganna voru aldraðir, með langt genginn hjartasjúkdóm og aðgerðirnar því áhættusamar og flóknar.
Niðurstöðum okkar svipar að mörgu leyti til þeirra tæplega 400 tilfella sem lýst hefur verið erlendis og þar sem rFVIIa var notað við opnar hjartaaðgerðir (10-15). Dánarhlufall var þó heldur lægra í sumum þessara rannsókna (oft á bilinu 15-33%) (16-18). Þetta skýrist sennilega af því að sjúklingaefniviður í okkar rannsókn var óvenju þungur, til dæmis með tilliti til umfangs aðgerðanna og hás meðalaldurs. Sama getur átt við þegar borin er saman tíðni alvarlegra blóðsega en í erlendu rannsóknunum var hún að meðaltali 5,3% (bil 0-15%) (10-12). Í rannsókn okkar fengu þrír sjúklingar (30%) alvarlega blóðsega. Ein þeirra var sjötug kona sem lést úr lungnareki og blóðþurrð í heila aðeins tveimur dögum eftir aðgerð. Hún var þá komin úr öndunarvél og með bæði góða meðvitund og stöðug lífsmörk þegar hún lést skyndilega. Krufning sýndi blóðsegarek til lungna og blóðþurrð í heila þótt ekki væri hægt að sýna fram á blóðsegarek í tilsvarandi æð. Konan hafði einnig aðra áhættuþætti blóðsegamyndunar, svo sem gjöf annarra storkuhvetjandi lyfja, háan aldur, langa aðgerð og alvarlegan hjartasjúkdóm. Svipað á við um bæði sjúkling sem lést úr bráðu hjartadrepi með blóðsega í kransæð og þann sem greindist með blóðsegarek í báðum ganglimum 10 dögum eftir aðgerð. Í síðara tilvikinu var talið að rekið væri á grunni sýklasóttar og því erfitt að kenna um gjöf rFVIIa.
Lýst hefur verið áhyggjum af því að rFVIIa valdi dreifðri þrombínmyndun og stuðli þannig að blóðstorkusótt (diffuse intravascular coagulopathy, DIC) (4). Tveir sjúklingar í þessari rannsókn létust úr slíku ástandi. Annar þeirra hafði þróað slíkt ástand fyrir gjöf rFVIIa en hjá hinum kom það fram þremur vikum eftir gjöf lyfsins. Kringumstæður benda því ekki til orsakasambands.
Erfitt er að meta áhættuþætti blóðsegamyndunar í þessari rannsókn, enda er rannsóknin takmörkunum háð vegna smæðar sinnar og þeirrar staðreyndar að viðmiðunarhóp vantar. Auk þess eru aðgerðirnar mismunandi, meðferð fyrir gjöf lyfsins (til dæmis með storkuhvetjandi lyfjum) er ekki sambærileg í öllum tilvikum og magn blæðingar fyrir og eftir gjöf lyfsins er ekki skráð. Erlendar rannsóknir falla undir svipaða gagnrýni því sjúklingar eru fáir og viðmiðunarhóp er eingöngu að finna í helmingi tilfella (11-14, 19). Augljóst er að árangur, fylgikvillar og skammtastærðir rFVIIa meðferðar verða best greindir í stórum framsæjum rannsóknum þar sem sjúklingahópar eru sambærilegri. Slíkar rannsóknir skortir í dag og því kemur ekki á óvart að blæðing við skurðaðgerðir, bæði við opnar hjartaaðgerðir og aðrar skurðaðgerðir, er ekki viðurkennd ábending fyrir notkun rFVIIa. Hár kostnaður við notkun lyfsins hefur einnig verið til umræðu en 4,8 mg skammtur af rFVIIa kostar um 375.000 kr. (20) (september 2007). Meðferðin er því mjög dýr, ekki síst ef gefa þarf sama sjúklingi marga og háa skammta. Hafa verður þó í huga að endurteknar aðgerðir, löng gjörgæsludvöl og gjöf blóðhluta kostar einnig töluvert fé. Þannig kostar blóðvatnseining tæpar 9000 krónur, rauðkornaþykkni um 11.000 krónur og blóðflöguþykkni 41.000 krónur (21). Því er eðlilegt að spyrja hvort æskilegt sé að gefa lyfið fyrr við þær erfiðu aðstæður sem meiriháttar blæðingar eru, og þá með það að markmiði að minnka gjöf blóðhluta. Slíkt verður þó að telja vafasamt, að minnsta kosti miðað við þá takmörkuðu vitneskju sem liggur fyrir í dag um fylgikvilla meðferðar. Frekari rannsóknir á næstu árum geta þó vonandi svarað þessari spurningu.
Lokaorð
Virkjaður líftæknigerður storkuþáttur VIIa er mjög virkt lyf til að stöðva meiriháttar blæðingar við opnar hjartaaðgerðir. Þar sem gjöf lyfsins er oft síðasta meðferðarúrræði og sjúklingarnir eru flestir við aldur með langt genginn hjartasjúkdóm kemur ekki á óvart að dánarhlutfall sé hátt. Engu að síður er staðreynd að þessi meðferð hefur bjargað nokkrum mannslífum hér á landi. Reikna má með að notkun lyfsins aukist á komandi árum. Brýnt er að rannsaka betur fylgikvilla rFVIIa meðferðar áður en farið verður að nota lyfið í auknum mæli.
Þakkir
Þakkir fá læknarnir Magnús Karl Magnússon, Bjarni Torfason og Þórarinn Arnórsson fyrir klínískar upplýsingar og Gunnhildur Jóhannsdóttir fyrir aðstoð við öflun sjúkraskráa.
Heimildir
1. Hinds C. Current management of patients after cardiopulmonary bypass. Anaesthesia 1982; 37: 170-91.
2. Karthik S, Grayson AD, McCarron EE, Pullan DM, Desmond MJ. Reexploration for bleeding after coronary artery bypass surgery: risk factors, outcomes, and the effect of time delay. Ann Thorac Surg 2004; 78: 527-34.
3. FASS; sótt í sept. 2007 af www.fass.se/LIF/produktfakta/artikel_produkt.jsp
4. NovoNordisk A/S: Product Information. Sótt í sept 2007 af www.novonordisk.com/therapy_areas/haemostasis/hcp/product_info/novoseven/default.asp
5. Roberts H, Monroe D, White G. The use of recombinant factor VIIa in the treatment of bleeding disorders. Blood 2004; 104: 3858-64.
6. Hoffmann M, Monroe D. A cell-based model of hemostasis. Thromb Hemost 2001; 85: 958-65.
7. Hoffmann M, Monroe D, Oliver J. Platelet activity of high dose factor VIIa is independent of tissue factor. Br J Haematol 1997; 99: 542-7.
8. Dietrich W, Spannagl M. Caveat against the use of activates recombinant factor VII for intractable bleeding in cardiac surgery. Anasth Analg 2001; 94: 1369-71.
9. Franchini M, Zaffanello M, Veneri D. Recominant factor VII an update on its clinical use. Thromb Haemost 2005: 93; 1027-35.
10. Warren O, Mandal K, Hadjianastassiou V, et al. Recombinant Activated Factor VII in Cardiac Surgery: A Systematic Review. Ann Thorac Surg 2007; 83: 707-14.
11. Raivio P, Suojaranta-Ylinen R, Kuitunen A: Recombinant Factor VIIa in the Treatment of Postoperative Hemorrhage After Cardiac Surgery. Ann Thorac Surg 2005; 80: 3-5.
12. Al Douri M, Shafi T, Al Khudairi D, et al. Effect of the administration of recombinant activated factor VII (rFVIIa; NovoSeven) in the management of severe uncontrolled bleeding in patients undergoing heart valve replacement surgery. Blood Coagul Fibrinolysis; 2000 (suppl 1), S121-S127.
13. Filsoufi F, Castillo JG, Rahmanian PB, Scurlock C, Fischer G, Adams DH. Effective management of refractory postcardiotomy bleeding with the use of recombinant activated factor VII. Ann Thorac Surg 2006; 82: 1779-83.
14. McCall P, Story DA, Karapillai D. Audit of factor VIIa for bleeding resistant to conventional therapy following complex cardiac surgery. Can J Anaesth 2006; 53: 926-33.
15. Hyllner M, Houltz E, Jeppsson A. Recombinant activated factor VII in the management of life-threatening bleeding in cardiac surgery. Eur J Cardiothorac Surg 2005; 28: 254-8.
16. Karkouti K, Beattie W, Wijeysundera D, et al. Recombinant factor VIIa for intractable blood loss after cardiac surgery: a propensity score-matched case-control analysis. Transfusion 2005; 45: 26-34.
17. von Heymann C, Redlich U, Jain U, et al. Recombinant activated factor VII for refractory bleeding after cardiac surgery-a retrospective analysis of safety and efficacy. Crit Care Med 2005; 33: 2241-6.?
18. Romagnoli S, Bevilacqua S, Gelsomino S, et al. Small-dose recombinant activated factor VII (NovoSeven) in cardiac surgery. Anesth Analg 2006; 102: 1320-6.?
19. Karkouti K, Yau T, Riazi S, et al. Determinants of complications with recombinant factor VIIa for refractory blood loss in cardiac surgery. Can J Anaesth 2006; 53: 802-9.
20. Verðskrá Apóteks Landspítala, sótt í sept 2007 af svali.landspitali.is/lsh_ytri.nsf/htmlpages/index.html
21. Verðskrá Blóðbankans; sótt í sept 2007 af svali.landspitali.is/lsh_ytri.nsf/htmlpages/blodbankinn.html
