04. tbl. 94. árg. 2008
Fræðigrein
Ónæmi fyrir kínólónum hjá Gram neikvæðum stöfum á Íslandi og tengsl við sýklalyfjanotkun
Quinolone resistance in Gram negative rods in Iceland and association with antibiotic use
Ágrip
Tilgangur: Flúórókínólón eru bakteríudrepandi lyf og mikið notuð við meðhöndlun alvarlegra þvagfæra- og öndunarfærasýkinga. Kannanir sýna að ónæmi gegn flúórókínólónum eykst stöðugt bæði í Evrópu og Bandaríkjunum. Tilgangur rannsóknarinnar var að skoða ónæmi fyrir flúórókínólónum hjá algengustu Gram neikvæðu stöfunum ásamt tengslum þess við notkun flúóró-kínólóna síðastliðin átta ár.
Efniviður og aðferðir: Rannsóknin náði til allra stofna Escherichia coli, Klebsiella sp., Proteus sp. og Pseudomonas aeruginosa sem greindust sem líklegir sýkingarvaldar í innsendum sýnum á sýklafræðideild Landspítalans á tímabilinu 1.11.2006 til 31.1.2007. Næmispróf voru framkvæmd með skífuprófum og var næmi fyrir cíprófloxacíni prófað hjá öllum stofnunum. Gögn um tíðni ónæmis síðastliðin ár voru fengin úr skýrslum sýklafræðideildar, en að jafnaði var aðeins prófað fyrir cíprófloxacín næmi hjá inniliggjandi sjúklingum og þeim sem höfðu ónæmi fyrir tveimur eða fleiri lyfjaflokkum. Upplýsingar um sýklalyfjanotkun fengust frá sóttvarnalækni.
Niðurstöður: Af þeim 1861 stofni sem voru prófaðir á tímabilinu reyndust 104 vera flúóró-kínólón-ónæmir stofnar. Þar af voru 91 E. coli (87%), 8 Klebsiella sp. (8%) og 5 P. aeruginosa (5%). Enginn flúórókínólón-ónæmur Proteus sp. greindist. Marktæk jákvæð fylgni var á milli flúórókínólón-notkunar og tíðni ónæmra E. coli og Enterobacteriaceae stofna. Tíðni ónæmra E. coli stofna var 6% en marktækur munur var á tíðninni eftir aldurshópum (p>0,001). Einnig var marktækur munur á tíðni E. coli milli kynja en hún var 6% hjá konum en 11% hjá körlum (p=0,015). Hlutfall flúórókínólón ónæmra E. coli stofna var hæst á Landspítala og elliheimilum.
Ályktanir: Tíðni flúórókínólón-ónæmis er að auk-ast á Íslandi en er þó enn með því lægsta sem gerist í Evrópu. Tíðnin er hæst í eldri aldurshópum þar sem flúórókínólón-notkun er mest og marktæk fylgni er á milli notkunar og tíðni ónæmis hjá E. coli og Enterobacteriaceae. Niðurstöðurnar sýna mikilvægi þess að flúorókínólónin séu rétt notuð og að fylgst sé með notkun þeirra og ónæmi fyrir þeim. Draga þarf úr notkun flúórókínólóna til að hægja á útbreiðslu ónæmis.
Inngangur
Flúórókínólón eru bakteríudrepandi lyf sem hindra virkni DNA gyrasa og topoisomerasa IV ensíma sem í bakteríum stýra breytingum á byggingu DNA við eftirmyndun og umritun þess.
Með tilkomu flúórókínólóna, á níunda áratugnum, komu fram breiðvirk sýklalyf sem verkuðu bæði á Gram jákvæðar og Gram neikvæðar bakteríur sem og á innanfrumusýkla eins og Legionella pneumophila og Mycoplasma pneumoniae. Lyfin eru mikið notuð við meðhöndlun alvarlegra þvagfærasýkinga af völdum Escherichia coli og má einnig nota við meðhöndlun annarra sýkinga af völdum Enterobacteriaceae (1, 2). Cíprófloxacín er áhrifaríkt við meðhöndlun alvarlegra spítalasýkinga meðal annars af völdum Pseudomonas aeruginosa (3, 4).
Nýrri flúórókínólón, þar á meðal levófloxacín, gatifloxacín og moxifloxacín, hafa bætta virkni gegn Gram jákvæðum bakteríum, svo sem Streptococcus pneumoniae, þar á meðal penisillín-ónæmum stofnum og hefur notkun flúóró-kínólóna víða aukist vegna meðhöndlunar öndunarfærasýkinga (5-7).
Í ATC flokkunarskrá WHO eru nú 19 flúórókínólón en aðeins tvö þeirra eru á skrá hér á landi, cíprófloxacín og ófloxacín.
Stöðugri og umtalsverðri aukningu á tíðni flúórókínólónónæmis hefur verið lýst í Evrópu á síðustu fimm árum og svipaða sögu er að segja frá Bandaríkjunum (8-10). The European Antimicrobial Resistance Surveillance System (EARSS) heldur skrá yfir tíðni ónæmra stofna í ífarandi sýkingum (11). Í skýrslum EARSS má sjá að árið 2005 eru enn nokkur lönd sem hefur tekist að halda tíðni flúórókínólón ónæmra E. coli stofna við og undir 5% eins og Danmörk (5%), Eistland (5%), Ísland (3%) og Noregur (5%). Á sama tíma hefur fjöldi þeirra landa þar sem tíðnin er yfir 25% tvöfaldast á milli áranna 2004 og 2005 en þau eru sex talsins: Búlgaría (29%), Kýpur (29%), Spánn (28%), Ítalía (28%), Malta (30%) og Portúgal (29%). Af 28 löndum sem senda inn tölur sýndu 25 lönd greinilega aukningu og í 19 löndum var sú tilhneiging marktæk. Hraði þessarar ónæmismyndunar er sá mesti sem sést hefur frá því skráning hófst hjá EARSS (11).
Þar sem cíprófloxacínnæmi hefur venjulega eingöngu verið kannað á völdum Enterobacteriaceae stofnum, það er frá sjúklingum á sjúkrahúsum og þegar stofnarnir hafa verið ónæmir fyrir fleiri en tveimur sýklalyfjaflokkum, hefur skort á að gögn um raunverulega tíðni ónæmis gegn flúóró-kínólónum lægju fyrir. Því var ákveðið að skoða næmi fyrir cíprófloxacíni hjá algengustu tegundum Enterobacteriaceae og P. aeruginosa sem greindust á þriggja mánaða tímabili. Annað markmið með rannsókninni var að kanna tengsl ónæmis og notkunar flúórókínólóna.
Efniviður og aðferðir
Stofnar
Rannsóknin náði til allra stofna af ættkvíslunum Klebsiella og Proteus og tegundanna E. coli og P. aeruginosa sem greindust sem líklegir sýkingarvaldar í innsendum sýnum á sýklafræðideild Landspítala á tímabilinu 1.11.2006 til 31.1.2007.
Gagnasöfnun
Gögnum um ofangreinda stofna var safnað úr gagnagrunnskerfi sýklafræðideildar, GLIMS (MIPS, Gent, Belgíu), og var tölfræðihluta kerfisins beitt til þess. Teknar voru saman upplýsingar um fjölda og næmismynstur stofna, sendanda, tegund sýnis, kyn og aldur sjúklinga. Ekki var unnið með persónugreinanlegar upplýsingar. Endurteknar ræktanir hjá sama einstaklingi, innan eins mánaðar, með stofnum með sambærilegt næmi voru útilokaðar af tölvuforritinu og þeir taldir sem einn stofn.
Upplýsingar um tíðni ónæmis á árunum 1999 til 2006 voru fengnar úr skýrslum sýklafræðideildar Landspítala (12). Gögn um sölutölur og ávísanir flúórókínólónlyfja voru fengnar úr lyfjagagnagrunni sóttvarnalæknis.
Næmispróf
Næmispróf fyrir öllum umræddum sýklalyfjum voru gerð með skífuprófi skv. aðferð Kirby og Bauers og framkvæmd og túlkuð samkvæmt skilgreiningum og stöðlum Clinical Laboratory Standard Institute (13). Þeir staðlar héldust óbreyttir fyrir cíprófloxacín á rannsóknatímabilinu. Ónæmi fyrir cíprófloxacíni var álitin vísbending um ónæmi fyrir öllum flúórókínólónum.
Tölfræðileg úrvinnsla
Unnið var með gögnin í Excel (Microsoft Corporation, Redmond, USA) og tíðnitölur reiknaðar út í því forriti. Pearsons fylgnistuðull milli tíðni ónæmis og notkunar flúórókínólóna var reiknaður út í SPSS (SPSS Inc., Chicago, USA) ásamt könnun á marktækni munar á tíðni milli aldurshópa og kynja með kí-kvaðrat prófi.
Niðurstöður
Könnun á tíðni ónæmis
Á rannsóknartímabilinu greindust eftirfarandi stofnar: 1509 E. coli, 252 Klebsiella sp., 126 Proteus sp. og 118 P. aeruginosa. Eftir útilokun endurtekinna ræktana sátu eftir 1415 E. coli, 226 Klebsiella sp, 115 Proteus sp og 105 P. aeruginosa stofnar. Algengasta sýnið var þvagsýni en nánari skiptingu sýnaflokka má finna í töflu I. Miðgildi aldurs sjúklinga með ofangreinda stofna var 62 ár og 80% þeirra voru konur. Meðalaldur kvenna var 53,5 ár en karla 58,3 ár.

Alls greindust 104 flúórókínólón-ónæmir stofnar. Þar af voru 91 E. coli (87%), átta Klebsiella sp. (8%) og fimm P. aeruginosa (5%). Enginn flúóró-kínólón-ónæmur Proteus sp. greindist. Skiptingu ónæmra stofna eftir aldri og kyni má sjá í töflu II.

Tíðni ónæmra E. coli stofna var 3% í yngsta aldurshópnum, 5% í þeim næsta og 9% í þeim elsta. Munur á tíðni í aldurshópunum er tölfræðilega marktækur (p<0,001). Einnig er marktækur munur er á tíðni ónæmra E. coli stofna milli kynja, 6% hjá konum en 11% hjá körlum (p=0,015). Stofnar af öðrum tegundum en E. coli voru of fáir til að tölfræðileg úrvinnsla yrði marktæk.
Hlutfall flúórókínólón-ónæmra stofna eftir tegund heilbrigðisstofnunar sem sendir sýnið er sýnt í töflu III. Fyrir E. coli er hlutfall ónæmra stofna hæst á legudeildum Landspítala og elliheimilum. Læknastofur og móttökudeildir (bráðamóttökur) Landspítala hafa hæsta hlutfall ónæmra Klebsiella sp. og ónæmur P. aeruginosa er einnig algengastur á móttökudeildum Landspítala.


Mynd 1. Hlutfall stofna ónæmra fyrir sýklalyfjum.
(AMP=ampicillín, MEL=mecillínam, AMC=amoxicillín/klavúlansýra, CXM=cefúroxím, CAZ=ceftazidím, CN=gentamícín, W=trímetóprím, SXT=trímetóprím/súlfametoxazól, F=nítrófúrantoin, CIP=cíprófloxacín)
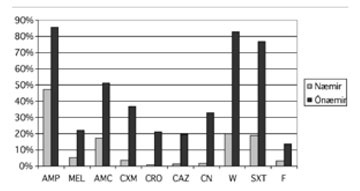
Mynd 2. Samanburður á hlutfalli ónæmis fyrir öðrum sýklalyfjum hjá flúórókínólón-næmum og -ónæmum E. coli.
(AMP=ampicillín, MEL=mecillínam , AMC=amoxicillín/klavúlansýra, CXM=cefúroxím, CAZ=ceftazidím, CN=gentamícín, W=trímetóprím, SXT=trímetóprím/súlfametoxazól, F=nítrófúrantoin, CIP=cíprófloxacín)
Næmi E. coli, Klebsiella sp. og Proteus sp. fyrir öðrum sýklalyfjum má sjá á mynd 1 og sundurliðun á tíðni ónæmis meðal flúórókínólón-ónæmra og næmra E. coli stofna má sjá á mynd 2. Í öllum tilfellum er ónæmi algengara meðal flúórókínólón-ónæmra stofna. Einn Klebsiella sp. stofn og 10 E. coli stofnar greindust einungis með næmi fyrir þremur eða færri af þeim sýklalyfjum sem næmi var prófað fyrir. Af fjölónæmum stofnum (ónæmir fyrir >3 sýklalyfjaflokkum) voru 88 E. coli , 27 Klebsiella sp., 12 Proteus sp. og einn P. aeruginosa.
Notkun flúórókínólóna og tengsl við tíðni ónæmis


Mynd 3. Hlutfall flúórókínólón-ónæmra E. coli og notkun flúórókínólóna 1998 til 2006.
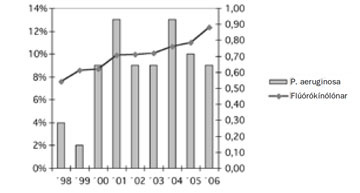
Mynd 4. Hlutfall flúórókínólón-ónæmra P. aeruginosa og notkun flúórókínólóna 1998 til 2006.
Í töflu IV og á myndum 3 og 4 má sjá gögn um notkun flúórókínólóna (ófloxacin, lómefloxacín, fleroxacín og cíprófloxacín) á Íslandi árin 1998 til 2006 ásamt tíðni ónæmis meðal E. coli, P. aeruginosa og Enterobacteriaceae (annarra en E. coli, ekki voru til sundurliðuð gögn eftir tegundum). Marktæk jákvæð fylgni er á milli flúórókínólón-notkunar og tíðni ónæmra E. coli og Enterobacteriaceae stofna. Þegar skoðaðar eru ávísanir á flúórókínólón eftir aldri kemur í ljós að notkunin er hvað mest hjá 50 ára og eldri sjá mynd 5.
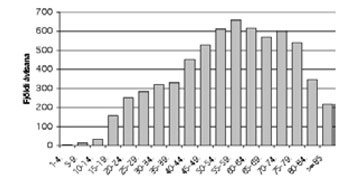
Mynd 5. Fjöldi ávísana á flúórókínólón eftir aldurshópum.
Umræður
Notkun flúórókínólóna hefur aukist um 63% á aðeins átta árum. Því miður virðist þessi aukning hafa haft afar slæm áhrif á sýklalyfjanæmi mikilvægra sýkingarvalda. Frá 1999 hefur tíðni ónæmra E. coli stofna, sem næmi var kannað hjá, farið úr 1% í 9%. Fyrir um 10 árum síðan var flúórókínólón ónæmi nánast óþekkt hjá E. coli á Íslandi. Tíðni ónæmra P. aeruginosa hefur frá 1998 farið úr 2% upp í 9%. Þótt hlutfall ónæmra stofna meðal allra E. coli stofna hafi verið 6% er tíðnin 50% hærri þegar litið er á stærsta sjúklingahópinn, það er 60 ára og eldri eða, 9% (p<0,001). Kemur það vel heim og saman við þá staðreynd að í þeim aldurshópi er notkun flúórókínólóna hvað mest en mun minni í yngri aldurhópum. Þessum niðurstöðum ber vel saman við rannsóknir sem hafa sýnt fram á sterk tengsl flúórókínólón-notkunar og tíðni ónæmis þar sem fer saman mikil notkun og há tíðni ónæmis (14, 15). Tíðni ónæmis er marktækt hærri hjá körlum en konum. Það kann að vera vegna þess að sýni frá sjúklingum með þvagfærasýkingar eru uppistaðan í efnivið rannsóknarinnar, en þær eru mun algengari hjá konum. Þeir karlar sem greinast með sýkingar eru almennt eldri og ef til vill veikari eða með undirliggjandi sjúkdóma sem auka líkur á því að sýkjast af ónæmum stofnum. Tíðni ónæmra E. coli stofna er hæst á Landspítala og á elliheimilum, en þar er þrýstingur frá sýklalyfjum líklega einna mestur ásamt því að þar eru veikustu einstaklingarnir.
Ætlunin var að kanna flúórókínólón-ónæmi innan Enterobacteriaceae ættkvíslarinnar, einkum hjá E. coli. Æskilegt hefði verið að hafa úrtakið stærra og að það næði yfir lengra tímabil. Með því hefði verið hægt að fá áreiðanlegri niðurstöður hjá öðrum tegundum innan ættkvíslarinnar. Þar sem við teljum rannsóknina hafa gefið áreiðanlegar upplýsingar um E. coli var ákveðið að leggja ekki í meiri kostnað og vinnu til að fá áreiðanlegri upplýsingar um aðrar tegundir. Hjá Klebsiella sp. var tíðni ónæmis 4% á heildina en stofnarnir eru fáir og niðurstöðurnar því ekki áreiðanlegar. Enginn flúórókínólón-ónæmur Proteus stofn fannst á rannsóknartímanum. Ónæmir Proteus stofnar hafa þó vissulega fundist hér en á tímabilinu maí 2006 til apríl 2007 voru sex af 312 (2%) greindum stofnum ónæmir fyrir flúórókínólónum.
Kínólón skiljast út í þvagi og berast með því út í umhverfið þar sem þau brotna afar hægt niður og því eru miklar líkur á uppsöfnun þeirra (16). Hvaða áhrif slík uppsöfnun hefur á umhverfisbakteríur er óljóst, en talsvert áhyggjuefni. Ónæmir P. aeruginosa stofnar virðast ekki tengjast neinni ákveðinni deild eða stofnun. Ónæmi hjá P. aeruginosa reyndist nokkuð lægra en tíðnitölur fyrir 2006 sýna. Stofnarnir eru hins vegar fáir og lítið þarf til að tíðnitölurnar breytist, einnig virðast vera meiri sveiflur í ónæmi hjá P. aeruginosa milli ára eins og sjá má af mynd 4. Auk þess má ætla að valþrýstingur frá sýklalyfjum sé annar á umhverfisstofna eins og Pseudomonas tegundir.
Rannsóknir sýna að flúórókínólón-notkun er áhættuþáttur fyrir myndun ónæmis þrátt fyrir að styrkur þeirra tengsla sé ef til vill minni en fyrstu rannsóknir gáfu til kynna (17-27). Val á viðmiðunarhópum í eldri rannsóknum hefur líklega ofmetið tengslin þar sem ljóst er að flúóró-kínólón-notkun dregur úr líkum á ræktun næmra stofna. Amínóglýkósíð og vankómýsín virðast í rannsóknum vera marktækir áhættuþættir fyrir myndun ónæmis (27, 28). Gæti það stafað af því að þessi lyf eru oft notuð sem fyrirbyggjandi breiðvirk meðferð hjá veikustu sjúklingunum. Þessi lyf gætu því einfaldlega verið merki um þessa mikið veiku sjúklinga sem oft eru meðhöndlaðir með mörgum sýklalyfjum og eru næmari fyrir sýkingum af völdum ónæmra baktería. Sama skýring gæti átt við aðra áhættuþætti eins kransæðasjúkdóm, galla í þvagfærum, dvöl á gjörgæsludeild eða langtímastofnun (27, 29-32). Önnur möguleg skýring á tengslum annarra sýklalyfja við myndun ónæmisins er samval, það er að baktería sem er ónæm gegn mörgum lyfjum (til dæmis amínóglýkósíðum og flúórókínólónum) getur valist úr vegna notkunar einhverra þessara lyfja. Það er einnig mögulegt að ákveðnar ónæmisgerðir miðli ónæmi gegn fleiri en einu sýklalyfi samanber útflæðispumpur. Í könnun á flúórókínólón-ónæmi í klínískum sýnum kom ónæmið aldrei fyrir eitt og sér (33). Í okkar rannsókn greindust einungis þrír E. coli stofnar eingöngu með ónæmi fyrir cíprófloxacíni og engin Klebsiella sp. Almennt er ónæmi fyrir öðrum sýklalyfjum algengara meðal flúórókínólón-ónæmra stofna en næmra eins og sést á mynd 2. Myndun ónæmis getur orðið í skrefum og verið háð snertingu við nokkur lyf (34). Þar sem sjúklingar á spítölum fá oft fleiri en eitt sýklalyf er erfitt að ákvarða hvaða lyf ber mesta ábyrgð á þróun ónæmis og kross-ónæmis. Í nýlegri grein Scneider-Lindner og félaga kemur fram að notkun kínólóna er sterkasti áhættuþátturinn fyrir methisillín ónæmum Staphylococcus aureus (MÓSA) utan sjúkrahúsa (35). Það virðist einkum vera þrennt sem hefur mest að segja um myndun sýklalyfjaónæmis og greiningu ónæmra stofna úr sýkingum. Það fyrsta er valþrýstingur frá notkun sýklalyfja. Annað er bakterían sjálf, eiginleikar hennar og hæfileikar til að mynda ónæmi og viðhalda því og í þriðja lagi er það sjúklingurinn sjálfur og næmi hans fyrir sýkingum.
Í nýlegri skýrslu um sýklalyfjanotkun og sýklalyfjaónæmi á Íslandi 2006 (36) eru settar fram upplýsingar um skiptingu þessarar notkunar eftir sérgreinum lækninga. Þar má sjá að notkun kínólóna er hvað mest hjá þvagfæralæknum. Ætla má að í mörgum tilvikum þvagfærasýkinga mætti nota sýklalyf með þrengra verkunarsvið og minni áhrif á eðlilegu örveruflóruna. Nægir að nefna lyfið mesillínam sem hefur hlutfallslega lítil áhrif á þarmaflóruna og er samkvæmt okkar niðurstöðum álíka oft virkt á E. coli og kínólónin. Það er auk þess þekkt að nokkuð er um að fólk fái með sér kínólón í ferðalög til sólarlanda og taki þau gagnrýnislaust og á rangan hátt við magaónotum og niðurgangi. Þannig virðist hægt að minnka talsvert notkun kínólóna án þess að það komi niður á sjúklingum.
Í grein í Læknablaðinu 1989 lýsti Karl G. Kristinsson áhyggjum sýklafræðinga og smitsjúkdómalækna af því að kínólón, þá nýskráð, yrðu ofnotuð hér á landi. Þar er eindregið mælt með að lyfin séu eingöngu notuð utan sjúkrahúsa að undangenginni ræktun og þá aðeins við meðhöndlun tiltekinna sýkinga, svo sem meðhöndlun fjölónæmra baktería, P. aeruginosa og hugsanlega Salmonella og lekanda (37). Því miður sýnir þessi rannsókn að þróunin hefur orðið önnur. Líklegt er að með því að draga úr notkun sýklalyfja megi hægja á eða snúa við þeirri þróun sem nú er í gangi. Það er því bæði fagleg og siðferðileg skylda lækna að draga úr ónauðsynlegri notkun kínólóna, enda sýnir þróunin annars staðar í heiminum að þessi mikilvægi sýklalyfjaflokkur kunni annars að tapast.
Mikilvægt er að fylgjast áfram vel með notkun flúórókínólóna til að tryggja viðeigandi notkun þar sem það er líklega besta ráðið sem tiltækt er til að sporna við frekari aukningu ónæmis.
Heimildir
1. Carson C, Naber KG. Role of fluoroquinolones in the treatment of serious bacterial urinary tract infections. Drugs 2004; 64: 1359-73.
2. Hooper DC. Clinical applications of quinolones. Biochim Biophys Acta 1998; 1400: 45-61.
3. Owens RC Jr, Ambrose PG. Clinical use of the fluoroquinolones. Med Clin North Am 2000; 84: 1447-69.
4. Peacock JE, Herrington DA, Wade JC, et al. Ciprofloxacin plus piperacillin compared with tobramycin plus piperacillin as empirical therapy in febrile neutropenic patients. A randomized, double-blind trial. Ann Intern Med 2002; 137: 77-87.
5. McCoy SI, Zell ER, Besser RE. Antimicrobial prescribing for otitis externa in children. Pediatr Infect Dis J 2004; 23: 181-3.
6. Scheld WM. Maintaining fluoroquinolone class efficacy: review of influencing factors. Emerg Infect Dis 2003; 9: 1-9.
7. Steinman MA, Gonzales R, Linder JA, Landefeld CS. Changing use of antibiotics in community-based outpatient practice, 1991-1999. Ann Intern Med 2003; 138: 525-33.
8. Gasink LB, Fishman NO, Weiner MG, Nachamkin I, Bilker WB, Lautenbach E. Fluoroquinolone-resistant Pseudomonas aeruginosa: assessment of risk factors and clinical impact. Am J Med 2006; 119: 526 e19-25.
9. Ray GT, Baxter R, DeLorenze GN. Hospital-level rates of fluoroquinolone use and the risk of hospital-acquired infection with ciprofloxacin-nonsusceptible Pseudomonas aeruginosa. Clin Infect Dis 2005; 41: 441-9.
10. Viray M, Linkin D, Maslow JN, et al. Longitudinal trends in antimicrobial susceptibilities across long-term-care facilities: emergence of fluoroquinolone resistance. Infect Control Hosp Epidemio 2005; 26: 56-62.
11. EARSS Annual Report 2005: The European Antimicrobial Resistance Surveillance System (EARSS); 2006.
12. Sýklafræðideild Landspítala. Sýklalyfjanæmi 1999-2006. www4.landspitali.is/lsh_ytri.nsf/pages/sykla_0056
13. Performance Standards for Antimicrobial Disk Susceptibility Tests; Approved Standard. Clinical and Laboratory Standards Institute document M2-A9 ninth ed: Clinical and Laboratory Standards Institute, 940 West Valley Road, Suite 1400, Wayne, Pennsylvania 19087-1898 USA; 2006.
14. Kahlmeter G. Prevalence and antimicrobial susceptibility of pathogens in uncomplicated cystitis in Europe. The ECO.SENS study. Int J Antimicrob Agents 2003; 22 Suppl 2: 49-52.
15. Goossens H, Ferech M, Vander Stichele R, Elseviers M. Outpatient antibiotic use in Europe and association with resistance: a cross-national database study. Lancet 2005; 365: 579-87.
16. Turiel E, Martin-Esteban A, Bordin G, Rodriguez AR. Stability of fluoroquinolone antibiotics in river water samples and in octadecyl silica solid-phase extraction cartridges. Anal Bioanal Chem 2004; 380: 123-8.
17. Carratala J, Fernandez-Sevilla A, Tubau F, Callis M, Gudiol F. Emergence of quinolone-resistant Escherichia coli bacteremia in neutropenic patients with cancer who have received prophylactic norfloxacin. Clin Infect Dis 1995; 20: 557-60; discussion 61-3.
18. Cheong HJ, Yoo CW, Sohn JW, Kim WJ, Kim MJ, Park SC. Bacteremia due to quinolone-resistant Escherichia coli in a teaching hospital in South Korea. Clin Infect Dis 2001; 33: 48-53.
19. Ena J, Amador C, Martinez C, Ortiz de la Tabla V. Risk factors for acquisition of urinary tract infections caused by ciprofloxacin resistant Escherichia coli. J Urol 1995; 153: 117-20.
20. Garau J, Xercavins M, Rodriguez-Carballeira M, et al. Emergence and dissemination of quinolone-resistant Escherichia coli in the community. Antimicrob Agents Chemother 1999; 43: 2736-41.
21. Gimber EA, Shields MD, Canawati HN, et al. Bacteriuria with Escherichia coli resistant to ciprofloxacin in patients with spinal-cord injury. Infect Control Hosp Epidemiol 1998; 19: 85-6.
22. McDonald LC, Chen FJ, Lo HJ, et al. Emergence of reduced susceptibility and resistance to fluoroquinolones in Escherichia coli in Taiwan and contributions of distinct selective pressures. Antimicrob Agents Chemother 2001; 45: 3084-91.
23. Ortiz J, Vila MC, Soriano G, et al. Infections caused by Escherichia coli resistant to norfloxacin in hospitalized cirrhotic patients. Hepatology 1999; 29: 1064-9.
24. Paterson DL, Mulazimoglu L, Casellas JM, et al. Epidemiology of ciprofloxacin resistance and its relationship to extended-spectrum beta-lactamase production in Klebsiella pneumoniae isolates causing bacteremia. Clin Infect Dis 2000; 30: 473-8.
25. Pena C, Albareda JM, Pallares R, Pujol M, Tubau F, Ariza J. Relationship between quinolone use and emergence of ciprofloxacin-resistant Escherichia coli in bloodstream infections. Antimicrob Agents Chemother 1995; 39: 520-4.
26. Lepelletier D, Caroff N, Reynaud A, Richet H. Escherichia coli: epidemiology and analysis of risk factors for infections caused by resistant strains. Clin Infect Dis 1999; 29: 548-52.
27. Bolon MK, Wright SB, Gold HS, Carmeli Y. The magnitude of the association between fluoroquinolone use and quinolone-resistant Escherichia coli and Klebsiella pneumoniae may be lower than previously reported. Antimicrob Agents Chemother 2004; 48: 1934-40.
28. Lautenbach E, Strom BL, Bilker WB, Patel JB, Edelstein PH, Fishman NO. Epidemiological investigation of fluoroquinolone resistance in infections due to extended-spectrum beta-lactamase-producing Escherichia coli and Klebsiella pneumoniae. Clin Infect Dis 2001; 33: 1288-94.
29. Lepelletier D, Caroff N, Riochet D, et al. Role of hospital stay and antibiotic use on Pseudomonas aeruginosa gastrointestinal colonization in hospitalized patients. Eur J Clin Microbiol Infect Dis 2006; 25: 600-3.
30. Huotari K, Tarkka E, Valtonen V, Kolho E. Incidence and risk factors for nosocomial infections caused by fluoroquinolone-resistant Escherichia coli. Eur J Clin Microbiol Infect Dis 2003; 22: 492-5.
31. Arslan H, Azap OK, Ergonul O, Timurkaynak F. Risk factors for ciprofloxacin resistance among Escherichia coli strains isolated from community-acquired urinary tract infections in Turkey. J Antimicrob Chemother 2005; 56: 914-8.
32. Hsu DI, Okamoto MP, Murthy R, Wong-Beringer A. Fluoroquinolone-resistant Pseudomonas aeruginosa: risk factors for acquisition and impact on outcomes. J Antimicrob Chemother 2005; 55: 535-41.
33. Sahm DF, Critchley IA, Kelly LJ, et al. Evaluation of current activities of fluoroquinolones against gram-negative bacilli using centralized in vitro testing and electronic surveillance. Antimicrob Agents Chemother 2001; 45: 267-74.
34. Harris A, Torres-Viera C, Venkataraman L, DeGirolami P, Samore M, Carmeli Y. Epidemiology and clinical outcomes of patients with multiresistant Pseudomonas aeruginosa. Clin Infect Dis 1999; 28: 1128-33.
35. Schneider-Lindner V, Delaney JA, Dial S, Dascal A, Suissa S. Antimicrobial Drugs and Community-acquired Methicillin-Resistant Staphylococcus aureus, United Kingdom. Emerg Infect Dis 2007; 13: 994-1000.
36. Sýklalyfjanotkun og sýklalyfjaónæmi á Íslandi 2006: Sóttvarnalæknir og nefnd um sýklalyfjanotkun og sýklalyfjaónæmi; 2007.
37. Kristinsson KG. Ný breiðrófs-sýklalyf. Læknablaðið 1989; 75: 141-7.
