02. tbl. 95. árg. 2009
Fræðigrein
Hlaupabóla hjá börnum á Íslandi - faraldsfræði og fylgikvillar
Varicella in Icelandic children - epidemiology and complications
Ágrip
Tilgangur: Hlaupabóla er algengur sjúkdómur og getur haft alvarlegar afleiðingar. Börn fá helst sjúkdóminn og mynda langvarandi mótefni. Bóluefni gegn hlaupabólu hefur lítið verið notað á Íslandi. Markmið rannsóknarinnar var að meta faraldsfræði hlaupabólu hjá íslenskum börnum og fylgikvilla hennar. Niðurstöður gætu meðal annars gagnast við ákvörðunartöku um bólusetningar gegn hlaupabólu á Íslandi.
Efniviður og aðferðir: Rannsóknin var aftur-virk, þversniðsrannsókn. Mæld voru mótefni gegn hlaupabólu í blóðvatnssýnum frá börnum <18 ára sem safnað hafði verið á árunum 2001-2002. Fylgikvillar voru kannaðir í sjúkraskrám barna sem lögð höfðu verið inn á barnadeildir í Reykjavík á 20 ára tímabili.
Niðurstöður: Fjöldi sýna var 280. Á fyrsta aldursári voru um 65% barna með mótefni gegn hlaupabólu en um 10% barna á aldrinum 1-2 ára. Fyrir 10 ára aldur voru nær öll börnin með mótefni, samanlagt voru 97,5% (78/80) barna >10 ára með mótefni.
Börn sem lögð voru inn vegna hlaupabólu eða fylgikvilla voru 58 eða 3,6 /100.000 börn á ári. Bakteríusýkingar voru algengasta ástæða innlagnar, einkum húðsýkingar en hnykilslingur, þurrkur og vannæring voru einnig algeng.
Ályktun: Flest börn á Íslandi fá hlaupabólu fyrir 10 ára aldur. Fylgikvillar geta verið alvarlegir. Mikilvægt er að þekkja sjúkdóminn, viðbrögð við honum og kanna hvort hefja eigi almenna bólusetningu gegn honum hér á landi.
Inngangur
Hlaupabóluveiran (VZV), veldur bæði hlaupabólu og ristli. Hlaupabóla er oftast tiltölulega mildur sjúkdómur en getur þó verið alvarleg. Bakteríusýkingar samhliða eða í kjölfar veirunnar geta verið hættulegar auk þess sem hlaupabólan getur valdið lungnabólgu, miðtaugakerfissýkingum og jafnvel dauða.1-3 Hlaupabólan getur einnig valdið alvarlegum fósturskaða og fósturláti, einkum ef mæður sýkjast í fyrsta sinn snemma á meðgöngunni.4, 5 Þá getur hlaupabóla móður við fæðingu reynst barninu háskalegur sjúkdómur.6
Hlaupabóluveiran smitast með úða- og snerti-smiti og er afar smitandi.7, 8 Berist hlaupabóla inn á heimili er talið að yfir 90% þeirra sem næmir eru smitist og berist hlaupabóla inn í skólastofu er talið að 10-35% veikist.9 Hlaupabóla gengur samt ekki í stórum faröldrum eins og margir aðrir barnasjúkdómar en árstíðabundnar sveiflur eru þekktar og greinast flest tilfelli um miðjan vetur og fram á vor.1, 3, 10 Ýmsar aðferðir til að greina veiruna eru tiltækar, svo sem mótefnamælingar, ræktanir og mögnunaraðferðir.
Algengast er að börn fái hlaupabólu á aldrinum 1-9 ára9, 11-14 og í flestum löndum hafa um 90% unglinga fengið hlaupabólu.15-17 Tilhneiging til að fá sjúkdóminn fyrr á ævinni hefur sést á undanförnum árum.14 Dánarhlutfall þeirra sem fá hlaupabólu (case fatality rate) er talið vera 2-4/100.000 í svokölluðum þróuðum löndum og er hæst meðal aldraðra og nýbura.3, 9, 18-21 Dánarhlutfall eldri barna sem fá hlaupabólu er lægra eða um 1/100.000.3, 9, 18, 19 Innlagnir á sjúkrahús vegna hlaupabólu eru um 2-6/100.0000 íbúa á ári1, 9, 18, 20, 22, 23 og eru flestar hjá börnum.14
Meðferð beinist að einkennum en þó ber að forðast asetýlsalicýl lyf vegna hugsanlegra tengsla við Reye syndrome.24 Meðferð gegn veirunni sjálfri er fyrst og fremst beitt hjá sjúklingum með ónæmisbresti og þarf að gefa snemma í sjúkdómsferlinu. Ónæmisaðgerðir gegn hlaupabólu eru mögulegar þar sem á markaði er virkt bóluefni.25, 26
Faraldsfræði hlaupabólu hjá börnum hér á landi er ekki þekkt enda er sjúkdómurinn ekki tilkynningaskyldur. Upplýsingar um faraldsfræði sjúkdómsins eru þó fróðlegar og gagnlegar, ekki síst í umræðu um hugsanlegar bólusetningar gegn hlaupabólu. Í þessari rannsókn verður faraldsfræðin metin eftir algengi mótefna hjá börnum á mismunandi aldri og alvarlegum fylgikvillum sýkingarinnar lýst.

Efniviður og aðferðir
Rannsóknin var afturvirk, þversniðsrannsókn. Rannsóknarhópurinn var valinn af handahófi úr blóðvatnssýnum frá börnum 18 ára og yngri sem höfðu borist til veirufræðideildar Landspítalans á árunum 2001-2002. Sýnin sem voru rannsökuð höfðu verið send inn til mælinga á mótefnum gegn ýmsum veirum öðrum en hlaupabólu.
Valin voru 20 sýni úr hverjum árgangi 0 til 10 ára og öðrum hverjum árgangi frá 10 til og með 18 ára. Yngsta aldurshópnum, 0-2 ára, var skipt eftir aldri í fjögur 6 mánaða tímabil. Notuð voru sýni sem send voru til greiningar á hinum ýmsu sjúkdómum, einkum öndunarfærasýkingum en ekki úr skimunum. Sleppt var sýnum þar sem hugsanleg ónæmisbæling eða hlaupabóla var nefnd á rannsóknarbeiðni. Til mótefnamælinga voru notuð enzyme linked immunoassay (ELISA) próf. Þau voru framkvæmd á hefðbundinn hátt á veirufræðideild Landspítala og niðurstöðurnar lesnar í ljósgleypnimæli með filter fyrir 492nm.
Einstaklingur taldist vera með mótefni ef ljósgleypni (optic density, OD) mældist yfir 0,2. Ljósgleypnigildið 0,2 var valið sem viðmiðunargildi (cut-off) eftir útreikninga með tilliti til þekktra jákvæðra og neikvæðra sýna og jafnframt var borið saman við gæðaeftirlitssýni frá stofnuninni Equalis í Uppsölum í Svíþjóð. Ef einstaklingar mældust með ljósgleypni um 0,2 var prófið endurtekið og ef gildin mældust enn nálægt 0,2 voru þau börn ekki tekin með í rannsóknina.
Til að finna fylgikvilla hlaupabólu voru sjúkraskrár athugaðar hjá börnum, 18 ára og yngri sem lögð höfðu verið inn á Barnaspítala Hringsins, barnadeild Landspítala Fossvogi (áður Sjúkrahús Reykjavíkur) og Landakot á tímabilinu 01.01.1983 til 31.12.2002 vegna hlaupabólu eða fylgikvilla tengdum henni.
Leitað var eftir greiningarnúmerum í ICD-9 og ICD-10; hlaupabóla, ristill, meðfædd hlaupabóla, drepmyndandi fellsbólga (necrotizing fasciitis), hnykilslingur (cerebellar ataxia; cerebellitis) og Reye heilkenni. Úr sjúkraskrám var safnað upplýsingum um sjúklingana og sjúkdómsferlið, þar með talið innlagnardag, útskriftardag, aldur við innlögn, kyn, ástæðu innlagnar, fylgikvilla og meðferð.
Nýgengi helstu fylgikvilla (fjöldi barna/100.000 börn) sem kröfðust innlagnar var reiknað miðað við meðalfjölda barna á aldrinum 0-18 ára eða meðalfjölda barna 0-10 ára á rannsóknartímabilinu.27
Tölfræðiútreikningar voru gerðir í SPSS en öryggisbil reiknað í EXCEL.
Fengið var leyfi hjá siðanefnd Landspítala og Persónuvernd fyrir rannsókninni.
Niðurstöður
Mótefnamælingar
Af 280 sýnum voru þrjú sýni útilokuð vegna gilda nálægt 0,2, af þeim voru tvö í aldurshópnum 0-1 árs og eitt í aldurshópnum 3-4 ára. Eitt sýni var útilokað vegna þess að það tilheyrði ekki réttum aldurshópi.
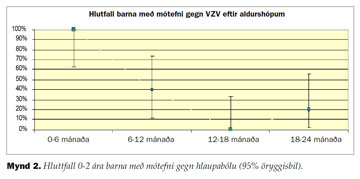
Hjá börnum á fyrsta aldursári voru um 65% með mótefni gegn hlaupabólu en einungis um 10% barna á aldrinum 1-2 ára voru með mælanleg mótefni. Fyrir 10 ára aldur voru nær öll börnin með mótefni gegn hlaupabólu (mynd 1). Samanlagt voru 97,5% (78/80) barna yfir 10 ára aldri með mótefni.
Þegar börn yngri en tveggja ára voru skoðuð sérstaklega sést að við fæðingu eru öll barnanna með mótefni, þetta hlutfall lækkar á fyrstu mánuðum ævinnar en rís að nýju eins og sjá má á mynd 2.
Fylgikvillar
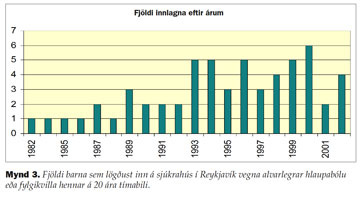
Eitt hundrað og fjórtán manns voru lagðir inn með greininguna hlaupabóla eða fylgikvillar hennar á rannsóknartímabilinu. Fimmtíu og sex voru útilokaðir úr rannsókninni vegna rangrar greiningar í sjúkraskrá eða hlaupabólan var ekki innlagnarástæðan og vandamálin ótengd henni. Þannig voru 58 einstaklingar lagðir inn vegna hlaupabólu eða fylgikvilla á rannsóknartímanum (mynd 3) eða 2,9 börn að meðaltali á ári. Fjöldi barna <18 ára var að meðaltali 81.588, innlagnir eru því 3,6/100.000 börn 18 ára og yngri á ári (tafla I). Af þessum 58 börnum voru 51 barn <10 ára, meðalfjöldi barna <10 ára var 47.488 á rannsóknartímabilinu. Innlagnir í þessum aldurshópi voru því 2,6 á ári eða 5,4/100.000 börn 10 ára og yngri á ári. Algengast var að börnin sem lögðust inn á sjúkrahús vegna hlaupabólu hefðu einn fylgikvilla eða 35 alls, en fimm höfðu tvo fylgikvilla. Fjórtán lögðust inn á sjúkrahús vegna hlaupabólu án annarra fylgikvilla og voru ástæðurnar oftast mikil ónæmisbæling, gjarnan í kjölfar ónæmisbælandi meðferðar eða hár hiti. Innlagnir virtust fleiri á seinni hluta tímabilsins en munurinn var ekki tölfræðilega marktækur (mynd 3). Árstíðabundinn munur sást einnig sem þó var ekki tölfræðilega marktækur en flestar innlagnirnar voru á tímabilinu frá nóvember til júní.
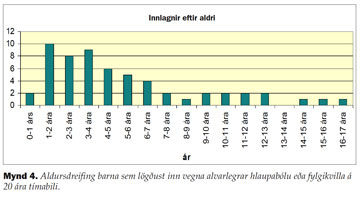
Aldursdreifing barnanna sýndi að flest þeirra sem lögðust inn voru á aldrinum 1-6 ára (mynd 4) og var meðalaldurinn 5,3 ár (miðgildi: 3,5 ár, spönn 0-16 ár). Drengir voru 55,2% innlagðra (32/58).
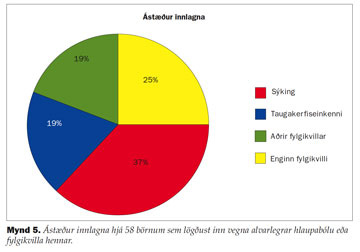
Bakteríusýkingar voru algengasta ástæða innlagnar (mynd 5). Innlögnum vegna bakteríusýkinga fjölgaði lítillega á tímabilinu, munurinn var ekki marktækur. Meðalaldur þeirra sem voru með bakteríusýkingar var 3,7 ár (miðaldur: 3,0 ár, spönn 1-9 ár). Meðalaldur þeirra sem höfðu einkenni frá taugakerfi (einkum hnykilslingur (cerebellar ataxia)) var 6,1 ár (miðaldur: 5 ár, spönn 2-12 ár) og meðalaldur þeirra sem höfðu aðra fylgikvilla var 3,4 ár (miðaldur: 1 ár, spönn 0-7 ár). Meðalaldur þeirra sem höfðu enga fylgikvilla var 5,2 ár (miðaldur: 9 ár, spönn 1-16 ár).
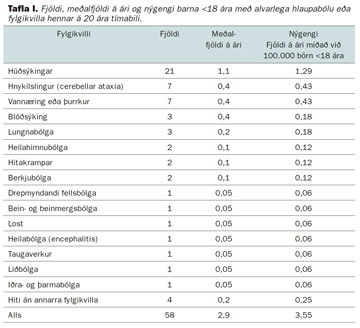
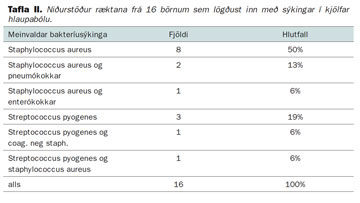
Húðsýkingar voru algengasti fylgikvilli þeirra sem lögðust inn á spítala og höfðu einn fylgikvilla, hnykilslingur var einnig algengt (tafla I). Frá 16 manns af 21 sem voru með húðsýkingar náðist að rækta bakteríur. Í flestum tilfellum var um staphylococcus aureus að ræða (tafla II).
Fimm sjúklingar höfðu tvo fylgikvilla, tveir þeirra voru með húðsýkingu og blóðsýkingu, einn með húðsýkingu og beinsýkingu, einn með húðsýkingu og heilahimnubólgu og loks einn með lungnabólgu og þurrk. Einn einstaklingur hafði þrjá fylgikvilla; iðra- og þarmabólgu (gastroenter-?itis), hitakrampa og þurrk. Einn einstaklingur hafði fjóra fylgikvilla; húðsýkingu, drepmyndandi fellsbólgu, lungnabólgu og lost.
Meðallengd innlagnar var 5,9 dagar (miðgildi: 5 dagar, spönn 0-25 dagar).
Engin tilfelli fundust með meðfædda hlaupabólu og Reye-heilkenni greindist ekki á tímabilinu. Enginn sjúklinganna lést.
Af innlögðum sjúklinum fengu allir utan einn sýklalyf, ýmist í æð eða um munn, 17 af 58 fengu veiruhemjandi lyf (acylovir). Einn sjúklingur þurfti öndunarvélaraðstoð.
Nýgengi innlagna á sjúkrahús vegna alvarlegrar hlaupabólu og fylgikvilla var 3,6/100.000 börn, 1,29/100.000 vegna húðsýkingar sem krefjast meðferðar á sjúkrahúsi, 0,8/100.000 vegna ýmissa einkenna frá taugakerfinu og er hnykilslingur algengast, 0,43/100.000 (tafla I).
Umræður
Rannsókn okkar sýnir að tæplega 70% barna á fyrsta ári mælast með mótefni gegn hlaupabólu sem líklega eru frá móður. Á öðru aldursári mælist einungis um 10% barna með mótefni en síðan eykst algengi mótefna með aldri og fyrir tíu ára aldur voru nánast öll börnin komin með mótefni.
Af þessu má ráða að á Íslandi sýkjast börn jafnt og þétt af hlaupabólu frá tveggja ári aldri og hafa flest sýkst fyrir 10 ára aldur. Svipaðar niðurstöður eru þekktar í mörgum samfélögum.9, 11-17 Þessar niðurstöður eru því sambærilegar þeim sem hafa fengist frá rannsóknum í öðrum tempruðum löndum14, 15, 17, 19 þó sýkingin virðist tiltölulega algengari hjá eldri börnum í heitum löndum.14, 15, 17 Þannig leiddi bandarísk rannsókn í ljós að 66% barna á aldrinum 4-5 ára, 82% barna á aldrinum 6-10 ára, 94% barna á aldrinum 11-19 ára og 96% fólks á aldrinum 20-29 ára höfðu mótefni gegn hlaupabólu (14) sem er harla líkt okkar niðurstöðum. Í Bretlandi, Þýskalandi, Belgíu og Sviss eru 92-95% barna komin með mótefni gegn hlaupabólu um 10 ára aldur.15, 17 Niðurstöður okkar benda til þess að nánast öll börn á þeim aldri hafi komist í snertingu við veiruna.
Í rannsókn okkar kemur fram að fjöldi innlagna vegna bakteríusýkinga virtist vaxa lítillega á tímabilinu. Erlendar rannsóknir sýna svipaðar niðurstöður en þar eru bakteríusýkingar yfirleitt algengasta innlagnarástæðan1, 10, 13, 28, 29 og fjöldi innlagna vegna þeirra virðist aukast.28, 29 Á rannsóknartímabilinu voru að meðaltali tæplega þrjú börn lögð inn á barnadeildir í Reykjavík árlega eða 3,6/100.000 börn. Flest voru börnin ung og fjöldi innlagna barna 10 ára og yngri var 5,4/100.000 börn í þessum aldurshópi. Mismunur milli ára og árstíðasveiflur voru óverulegar. Þetta eru svipaðar niðurstöður og fengist hafa úr rannsóknum gerðum í Bretlandi, Bandaríkjunum og Þýskalandi.1, 3, 9, 10, 18, 20, 22, 23 Það kemur á óvart að nýgengi sjúkrahúsinnlagna vegna hlaupabólu virðist fara vaxandi í ýmsum löndum.3 Ástæður þessa eru óljósar en mögulega eru hér tengsl við fleiri ónæmisbælda og fleiri aldraða í samfélaginu.
Hér á landi eru húðsýkingar af völdum baktería langalgengasti fylgikvilli hlaupabólu og í rúmum þriðjungi tilfella voru bakteríusýkingar innlagnarástæðan. Í börnum undir fjögurra ára aldri eru líkurnar á innlögn vegna húðsýkinga allt að 1:450 (28). Í rannsókn okkar var algengasti meinvaldur húðsýkinga staphylococcus aureus. Rannsóknir erlendis sýna hins vegar að streptókokkar ræktast jafnoft eða oftar hjá börnum sem eru lögð inn á spítala vegna sýkinga í kjölfar hlaupabólu.10, 30 Í flestum tilfellum er um netjubólgu (cellulitis) að ræða en kossageit, ígerðir, skarlatssótt og stafýlókokka „scalded skin syndrome“ eru þekkt.10, 29, 30 Ýmsar aðrar alvarlegar sýkingar eru þekktar í kjölfar hlaupabólu, svo sem drepmyndandi fellsbólga (necrotizing fasciitis), „varicella gangren-osa“, vöðvaígerð, blóðsýking og lost. 1,13, 22, 31 Þeir sem í rannsókn okkar greindust með streptókokka af hjúpgerð A voru allir með alvarlegar sýkingar, einn var með drepmyndandi fellsbólgu, annar með beinsýkingu, sá þriðji með blóðsýkingu og sá fjórði með ígerð á hálsi.
Í 19% tilfella voru taugakerfiseinkenni innlagnarástæðan vegna hlaupabólu. Algengasti fylgikvillinn í þeim hópi var hnykilslingur (cerebellitis, cerebellar ataxia) en því er lýst hjá 1/4000 einstaklingum í erlendum rannsóknum.13 Einnig greindust heilahimnubólga, hitakrampar, taugaverkir og heilabólga. Í svipuðum rannsóknum erlendis eru taugakerfiseinkenni oftast önnur algengasta innlagnarástæðan10, 28 eins og í okkar niðurstöðum.
Ekkert tilfelli af Reye-heilkenni greindist á tímabilinu sem mögulega skýrist af því að hér á landi er acetylsalicylsýra ekki notuð til að lækka hita í börnum.
Engin dauðsföll vegna hlaupabólu voru á rannsóknartímabilinu. Í Bretlandi og Wales er heildardánartíðni vegna hlaupabólu um 1:25.000.19 Í erlendum rannsóknum vekur athygli að flestir sem látast af hlaupabólu eru hraustir einstaklingar en ekki einstaklingar með ónæmisbælandi sjúkdóma.1, 3, 18, 22 Hins vegar geta einstaklingar með ónæmisbælandi sjúkdóma einnig fengið alvarlega fylgikvilla og því mikilvægt að hefja viðeigandi meðferð snemma. Meðferð við hlaupabólu hefur fram að þessu einkum beinst að einkennum sýkingarinnar. Hins vegar hafa blindaðar lyfleysurannsóknir sýnt fram á verulega gagnsemi acyclo-vir-meðferðar hjá börnum með hlaupabólu.32 Því má færa fyrir því viss rök að meðhöndla beri hlaupabólu oftar með veiruhamlandi lyfjum en gert hefur verið.
Nokkra athygli vekur að fjöldi einstaklinga var útilokaður úr rannsókninni vegna rangrar greiningar í sjúkraskrá. Þetta er umhugsunarefni. Þá voru margir sjúklingar útilokaðir þar sem hlaupabólan greindist í legunni en var ekki innlagnarástæðan og vandamálin ótengd henni.
Bóluefni gegn hlaupabólu sem inniheldur lifandi veiklaða veiru hefur verið á markaði í tæplega 20 ár. Heilbrigð börn svara slíkum ónæmisaðgerðum vel25, 26 og bólusetningin veitir vörn í 80-85% tilfella og vörn gegn alvarlegum hlaupabólusýkingum í um 95% tilfella.33, 34 Rannsóknir á virkni bóluefnisins gefa einnig til kynna að það veiti góða langtímavörn gegn sjúkdómnum.33-36 Í dag eru einnig á markaði samsett bóluefni sem innihalda bóluefni gegn hlaupabólu, mislingum, hettusótt og rauðum hundum (MMR), svokallað MMRV. Rannsóknir á þessum bóluefnum hafa sýnt mótefnasvörun hjá ríflega 98% einstaklinga sem fengið hafa tvær bólusetningar.35, 37 Bóluefnin eru örugg og aukaverkanir vægar og sambærilegar við MMR.35, 37 Í löndum þar sem ónæmisaðgerðir gegn hlaupabólu eru almennar hefur sjúkdómnum og fjölda alvarlegra fylgikvilla fækkað stórlega. Bólusetningin hefur einnig sýnt sig vera hagkvæm8, 38, 39 og þurfa íslensk heilbrigðisyfirvöld að kanna hagkvæmnina hér á landi.
Hlaupabóla getur haft alvarlegar afleiðingar. Rannsókn okkar gefur góða vísbendingu um faraldsfræði hlaupabólu á Íslandi og aukaverkanir sjúkdómsins hjá börnum. Mikilvægt er að þekkja sjúkdóminn, meðferðarmöguleika gegn hlaupabóluveirunni og fylgikvillum hennar og kanna hvort hefja eigi almenna bólusetningu gegn VZV sýkingum hér á landi.
Þakkir
Þakkir fær starfsfólk á veirurannsóknarstofunni í Ármúla og á skjalasafni Landspítala og ritarar á Barnaspítala Hringsins.
Heimildir
1. Bonhoeffer J, Baer G, Muehleisen B, et al. Prospective surveillance of hospitalisations associated with varicella-zoster virus infections in children and adolescents. Eur J Pediatr 2005; 164: 366-70.
2. Jaeggi A, Zurbruegg RP, Aebi C. Complications of varicella in a defined central European population. Arch Dis Child 1998; 79: 472-7.
3. Meyer PA, Seward JF, Jumaan AO, Wharton M. Varicella mortality: trends before vaccine licensure in the United States, 1970-1994. J Infect Dis 2000; 182: 383-90.
4. Enders G, Miller E, Cradock-Watson J, Bolley I, Ridehalgh M. Consequences of varicella and herpes zoster in pregnancy: prospective study of 1739 cases.[see comment]. Lancet 1994; 343: 1548-51.
5. Tan MP, Koren G. Chickenpox in pregnancy: revisited. Reprod Toxicol 2006; 21: 410-20.
6. Miller E, Cradock-Watson JE, Ridehalgh MK. Outcome in newborn babies given anti-varicella-zoster immunoglobulin after perinatal maternal infection with varicella-zoster virus. Lancet 1989; 2: 371-3.
7. Koropchak CM, Graham G, Palmer J, et al. Investigation of varicella-zoster virus infection by polymerase chain reaction in the immunocompetent host with acute varicella.[erratum appears in J Infect Dis 1992; 165:188]. J Infect Dis1991; 163: 1016-22.
8. Lieu TA, Cochi SL, Black SB, et al. Cost-effectiveness of a routine varicella vaccination program for US children.[see comment]. JAMA 1994; 271: 375-81.
9. Fairley CK, Miller E. Varicella-zoster virus epidemiology--a changing scene? J Infect Dis 1996;174 Suppl 3:S314-9.
10. Law B, MacDonald N, Halperin S, et al. The Immunization Monitoring Program Active (IMPACT) prospective five year study of Canadian children hospitalized for chickenpox or an associated complication. Pediatr Infect Dis J 2000; 9: 1053-9.
11. Finger R, Hughes JP, Meade BJ, Pelletier AR, Palmer CT. Age-specific incidence of chickenpox. Public Health Reports 1994; 109: 750-5.
12. Gabutti G, Penna C, Rossi M, et al. The seroepidemiology of varicella in Italy. Epidemiol Infect 2001; 126: 433-40.
13. Guess HA, Broughton DD, Melton LJ, 3rd, Kurland LT. Population-based studies of varicella complications. Pediatr 1986; 78: 723-7.
14. Wharton M. The epidemiology of varicella-zoster virus infections. Infect Dis Clin N Amer 1996; 10: 571-81.
15. Heininger U, Braun-Fahrlander C, Desgrandchamps D, et al. Seroprevalence of varicella-zoster virus immunoglobulin G antibodies in Swiss adolescents and risk factor analysis for seronegativity. Pediatr Infect Dis J 2001; 20: 775-8.
16. Kudesia G, Partridge S, Farrington CP, Soltanpoor N. Changes in age related seroprevalence of antibody to varicella zoster virus: impact on vaccine strategy. J Clin Pathol 2002; 55: 154-5.
17. Wutzler P, Farber I, Wagenpfeil S, Bisanz H, Tischer A. Seroprevalence of varicella-zoster virus in the German population. Vaccine 2001; 20: 121-4.
18. Boelle PY, Hanslik T. Varicella in non-immune persons: incidence, hospitalization and mortality rates. Epidemiol Infect 2002; 129: 599-606.
19. Brisson M, Edmunds WJ, Law B, et al. Epidemiology of varicella zoster virus infection in Canada and the United Kingdom. Epidemiol Infect 2001; 127: 305-14.
20. Chant KG, Sullivan EA, Burgess MA, et al. Varicella-zoster virus infection in Australia.[erratum appears in Aust N Z J Public Health 1998; 22: 630]. Aust N Z J Public Health 1998; 22: 413-8.
21. Rawson H, Crampin A, Noah N. Deaths from chickenpox in England and Wales 1995-7: analysis of routine mortality data.[see comment]. BMJ 2001; 323: 1091-3.
22. Galil K, Brown C, Lin F, Seward J. Hospitalizations for varicella in the United States, 1988 to 1999. Pediatr Infect Dis J 2002; 21: 931-5.
23. Ratner AJ. Varicella-related hospitalizations in the vaccine era. Pediatr Infect Dis J 2002; 21: 927-31.
24. Starko KM, Ray CG, Dominguez LB, Stromberg WL, Woodall DF. Reye?s syndrome and salicylate use. Pediatr 1980; 66: 859-64.
25. Kuter B, Matthews H, Shinefield H, et al. Ten year follow-up of healthy children who received one or two injections of varicella vaccine. Pediatr Infect Dis J 2004; 23: 132-7.
26. Shehab Z, Brunell PA. Enzyme-linked immunosorbent assay for susceptibility to varicella. J Infect Dis 1983; 148: 472-6.
27. www.hagstofan.is. Mannfjöldi, yfirlit. /ágúst, 2008.
28. Choo PW, Donahue JG, Manson JE, Platt R. The epidemiology of varicella and its complications. J Infect Dis 1995; 172: 706-12.
29. Jackson MA, Burry VF, Olson LC. Complications of varicella requiring hospitalization in previously healthy children. Pediatr Infect Dis J 1992; 11: 441-5.
30. Ziebold C, von Kries R, Lang R, Weigl J, Schmitt HJ. Severe complications of varicella in previously healthy children in Germany: a 1-year survey.[erratum appears in Pediatr 2004; 113: 1470]. Pediatr 2001; 108: E79.
31. Tyrrell GJ, Lovgren M, Kress B, Grimsrud K. Varicella-associated invasive group A streptococcal disease in Alberta, Canada--2000-2002. Clin Infect Dis 2005; 40: 1055-7.
32. Balfour HH, Jr. Acyclovir for childhood chickenpox. No reason not to treat. BMJ 1995; 310: 109-10.
33. Miron D, Lavi I, Kitov R, Hendler A. Vaccine effectiveness and severity of varicella among previously vaccinated children during outbreaks in day-care centers with low vaccination coverage. Pediatr Infect Dis J 2005; 24: 233-6.
34. Sheffer R, Segal D, Rahamani S, et al. Effectiveness of the Oka/GSK attenuated varicella vaccine for the prevention of chickenpox in clinical practice in Israel. Pediatr Infect Dis J 2005; 24: 434-7.
35. Shinefield H, Black S, Digilio L, et al. Evaluation of a quadrivalent measles, mumps, rubella and varicella vaccine in healthy children. Pediatr Infect Dis J 2005; 24: 665-9.
36. Weibel RE, Neff BJ, Kuter BJ, et al. Live attenuated varicella virus vaccine. Efficacy trial in healthy children. N Engl J Med 1984; 310: 1409-15.
37. Knuf M, Habermehl P, Zepp F, et al. Immunogenicity and safety of two doses of tetravalent measles-mumps-rubella-varicella vaccine in healthy children. Pediatr Infect Dis J 2006; 25: 12-8.
38. Coudeville L, Paree F, Lebrun T, Sailly J. The value of varicella vaccination in healthy children: cost-benefit analysis of the situation in France. Vaccine 1999; 17: 142-51.
39. Law B, Fitzsimon C, Ford-Jones L, McCormick J, Riviere M. Cost of chickenpox in Canada: part II. Cost of complicated cases and total economic impact. The Immunization Monitoring Program-Active (IMPACT). Pediatr 1999; 104: 7-14.