11. tbl. 94. árg. 2008
Fræðigrein
Broddþensluheilkenni - sjúkratilfelli og yfirlit
Ágrip
Broddþensluheilkenni einkennist af bráðri skerðingu á samdrætti vinstri slegils þar sem broddur og miðhluti hans þenjast út, en kröftugur samdráttur er í grunnhluta. Heilkennið er mun algengara hjá konum. Líkamlegt eða andlegt álag getur verið orsakavaldur. Einkenni og teikn sjúklings líkjast bráðu kransæðaheilkenni með brjóstverk, breytingum á hjartalínuriti og hækkun á hjartaensímum. Ekki finnast marktækar þrengingar í kransæðum. Heilkennið er afturkræft. Lýst er þremur tilfellum af broddþenslu sem voru greind á hjartadeild Landspítala á 10 dögum í desember 2007.
Inngangur
Apical Ballooning Syndrome, sem við höfum kosið að nefna broddþensluheilkenni (BÞH) á íslensku, er hjartasjúkdómur sem nýlega hefur verið lýst í alþjóðlegum fræðum. Í þessari grein er lýst fyrstu þremur tilfellum broddþensluheilkennis á Íslandi. Heilkennið einkennist af bráðri afturkræfri truflun á samdrætti í miðhluta og broddi vinstri slegils og öflugum samdrætti í grunnhluta hans sem leiðir til útþenslu brodds í slagbili. Hreyfitruflunin nær oft yfir meira svæði en næringarsvæði einnar kransæðar. Samdráttartruflunin gengur til baka á fáeinum dögum til vikum (1, 2). Einkenni og teikn sjúklinganna benda til bráðs kransæðasjúkdóms en ekki finnast marktækar þrengingar við kransæðamyndatöku sem útskýra einkenni þeirra (3, 4). BÞH hefur gengið undir ýmsum nöfnum, svo sem álagshjartavöðvakvilli eða Takotsubo hjartavöðva-kvilli (tafla I). Því var fyrst lýst árin 1990 og 1991 og var nefnt eftir hinni japönsku kolkrabbagildru Takotsubo, en útlit slegilsins í slagbili þykir minna á hana (mynd 1, mynd 2) (4).
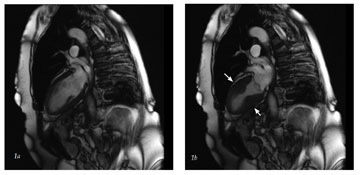
Mynd 1. Myndir teknar með segulómun í gegnum lengdarás vinstri slegils og vinstri gáttar. Mynd 1a og 1b eru frá tilfelli 2 og sýna eðlilega þykknun á vegg vinstri slegilsins í grunnhluta hjartans (basis) (hægra megin við örvar) en nánast engan samdrátt í broddi hjartans (apex) (vinstra megin við örvar). Mynd 1a sýnir hjartað í lok hlébils og 1b í lok slagbils.
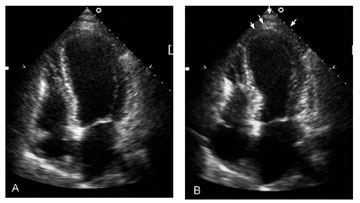
Mynd 2. Hjartaómun af vinstri slegli hjá einstaklingi með broddþensluheilkenni í lok hlébils (A) og í lok slagbils (B) þar sem broddsvæðið sýnir dæmigerða útbungun (örvar). Hjartaómunin er af sjúkratilfelli 3.
Sjúkratilfelli
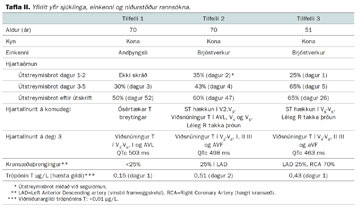
Fyrsta tilfelli er 69 ára gömul kona sem var lögð inn á skurðdeild Landspítala vegna garnastíflu (mechanic ileus) og fór í opna kviðarholsaðgerð. Hún var með nokkurra ára sögu um háþrýsting og kæfisvefn. Hún hafði 36 ára reykingasögu auk ættarsögu um kransæðasjúkdóm. Hún fékk sarpabólgu (diverticulitis) ellefu mánuðum fyrir núverandi innlögn sem var meðhöndluð með sýklalyfjum. Fimm dögum eftir aðgerðina var grunur um sýkingu í skurðsári, CRP mældist verulega hækkað (216 mg/L). Sex dögum eftir aðgerð kvartaði hún við hjúkrunarfræðing á skurðdeild um ógleði, mæði, svita og andþyngsli. Hjartsláttur var 115-120 slög/mínútu með sínus hraðtakti á hjartalínuriti, blóðþrýstingur var 135/95 og súrefnismettun 96%. Trópónín (TNT) mældist vægt hækkað, 0,15 µg/L. Tekin var tölvusneiðmynd af lungum sem sýndi stækkað hjarta en ekki sáust blóðtappar í lungnaslagæðum. Einnig sást hnútur í skjaldkirtli. Hún var flutt á hjartadeild og fékk hefðbundna meðferð við bráðu kransæðaheilkenni og hjartabilun. Hjartaómun á deildinni sýndi engan samdrátt (akinesis) í broddi vinstri slegils. Um nóttina fékk hún endurtekna brjóstverki og tvisvar sáust runur af sleglahraðtakti (ventricular tachycardy). Næsta dag var TNT lækkandi og á hjartalínuriti sáust viðsnúnir T takkar í V3-V6, I og AVL, léleg R takka þróun og lengt QT bil (tafla II). Kransæðamyndataka sýndi breytingar í höfuðstofni, vinstri framveggskvísl og hliðargreinum hennar sem allar voru undir 25%. Hjartaómun á þriðja degi sýndi engan samdrátt í öllum mið- og broddhluta vinstri slegils en góðan samdrátt í grunnhluta hans. Útstreymisbrot (ejec-tion fraction) vinstri slegils á þriðja degi mældist 30%. Hún útskrifaðist við ágæta líðan eftir fjögurra daga legu á hjartadeild.
Hjartaómun 52 dögum síðar sýndi góðan samdrátt á öllum svæðum hjartans og 50% útstreymisbrot. Við eftirlit þremur mánuðum eftir útskrift sáust engin merki um offramleiðslu kortisóls, aldósteróns, skjaldkirtilshormóna eða vaxtarhormóna. Ómstýrð ástunga á hnút í vinstra skjaldkirtilsblaði eftir útskrift sýndi góðkynja frumur.
Annað tilfelli er 69 ára gömul kona sem leitaði á bráðamóttöku vegna þyngsla fyrir brjósti og verkja í brjósthrygg. Hún var með langa sögu um iktsýki og beinþynningu og hafði greinst með brjóstakrabbamein fyrir 9 árum. Hún hafði einnig sögu um hnút í skjaldkirtli sem var fjarlægður fyrir 25 árum. Til staðar var ættarsaga um kransæðasjúkdóm en ekki saga um aðra áhættuþætti kransæðasjúkdóma. Hún hafði verið undir miklu andlegu álagi allt árið vegna fjölskyldumála. Við komu var blóðþrýstingur 139/70 og hjartsláttur 87 slög/mínútu. Mettun var 99% á 5L súrefnis. Við hlustun heyrðist fjórði hjartatónn og brak neðan til í báðum lungum. Á hjartalínuriti við komu sáust háir T-takkar í V2-V5, viðsnúinn T takki í aVL og léleg R takka þróun. TNT var undir 0,01 µg/L. Hjartalínurit sem var tekið klukkutíma síðar sýndi 1mm ST hækkanir í V2 og V3 (tafla II). Rit tekið þremur klukkutímum síðar sýndi auk þess viðsnúna T takka í AVL, V4 og V5 og aVL. Hún fékk hefðbundna meðhöndlun við bráðu kransæðaheilkenni. Gerð var bráð kransæðamyndataka sem sýndi 25% þrengsli í vinstri framveggskvísl og vægar veggbreytingar í öðrum æðum. Hjartaómun á þræðingarborðinu sýndi samdráttarskerðingu (hypokinesis) í mið- og broddhluta vinstri slegils og 25% útstreymisbrot. Á öðrum degi voru viðsnúnir T takkar í V2- V6 og leiðslum I, II, III og aVF. TNT fór í 0,51 µg/L. Hjartaómun sýndi engan samdrátt í öllum broddhluta hjartans, skertan samdrátt í öllum miðhluta hjartans og 35% útstreymisbrot. Segulómun af hjarta var gerð á fjórða degi sem staðfesti skertan samdrátt í framvegg og broddi hjartans, 43% útstreymisbrot (mynd 1). Hún var útskrifuð eftir sjö daga legu.
Hjartaómskoðun 47 dögum eftir útskrift sýndi 60% útstreymisbrot og eðlilegan samdrátt vinstri slegils. Við eftirlit þremur mánuðum síðar sáust engin merki um offramleiðslu kortisóls, aldó-steróns, eða vaxtarhormóna og skjaldkirtilspróf voru innan eðlilegra marka.
Þriðja tilfelli er 51 árs gömul kona sem leitaði á bráðamóttöku vegna nokkurra klukkustunda sögu um brjóstverk. Hún var með háan blóðþrýsting og langa reykingasögu en ekki aðra áhættuþætti kransæðasjúkdóma. Þrjátíu árum áður hafði hún gengist undir legbrottnám og einu og hálfu ári áður greindust hjá henni nýrnahettuæxli í báðum nýrnahettum. Hún var rannsökuð ítarlega með tilliti til offramleiðslu hormóna en ekki fundust merki um litfíklaæxli (pheochromocytoma), aldósterónheilkenni (hyperaldosteronisma) eða offramleiðslu á kortisóli. Vegna stærðar hnútsins í hægri nýrnahettu var gert nýrnahettubrottnám í kviðarholsspeglun ári eftir að hann greindist. Mánuði síðar hafði hún lést um 13 kg og blóðþrýstingur lækkað. Hún fékk kortisól-skort eftir aðgerðina og þurfti stuttan kúr af barksterum í minnkandi skömmtum. Það var því klínískur grunur um að hún hafi verið með offramleiðslu kortisóls fyrir aðgerð.
Konan hafði verið undir miklu andlegu álagi undanfarna mánuði og fengið brjóstverk af og til við áreynslu. Við komu var blóðþrýstingur 108/69 og hjartsláttur 89 slög/mínútu. Súrefnismettun var 95% á 2L og öndunartíðni var 12/mínútu. Við lungnahlustun heyrðist vægt brak en annars var líkamsskoðun eðlileg. Hjartalínurit við komu sýndi vægar ST hækkanir í V5 og V6 en sex tímum síðar voru þau einn mm (mynd 3). TNT við komu var <0,01µg/L en fór eftir 6 tíma í 0,43ug/L. Hjartaómun á komudegi sýndi engan samdrátt í öllum mið- og broddhluta vinstri slegils en eðlilegan samdrátt í grunnhluta. Útstreymisbrot var 25%. Bráð kransæðamyndataka sýndi vægar breytingar í vinstri framveggskvísl og 70% þrengsli í hægri kransæð. Ekki var talið að þessar breytingar skýrðu skerta slegilsstarfsemi eða einkenni hennar og var því ekki gerð kransæðavíkkun. Einkenni voru hugsanlega talin tengd hjartavöðvabólgu. CRP var hins vegar lágt, 8 mg/l, og ekki sáust önnur bólgueinkenni. Daginn eftir komu voru T-takkar viðsnúnir í V4-V6, II, III og aVF (tafla II). Hún fékk hefðbundna lyfjameðferð við bráðu kransæðaheilkenni.
Fimm dögum eftir innlögn sýndi hjartaómun eðlilegan samdrátt vinstri slegils með 65% útstreymisbroti. Þó að þrenging í hægri kransæð væri ekki talin orsaka einkenni hennar var hún markvert þrengd og því var gerð kransæðavíkkun sex dögum eftir komu.
Segulómun af höfði var gerð til uppvinnslu á nýrnahettuæxlunum. Þar kom í ljós fyrirferð í vinstri hluta heiladinguls. Vegna þessa var aftur hafin rannsókn á hvort um offramleiðslu hormóna væri að ræða en ítarlegar rannsónir leiddu það ekki í ljós (4).
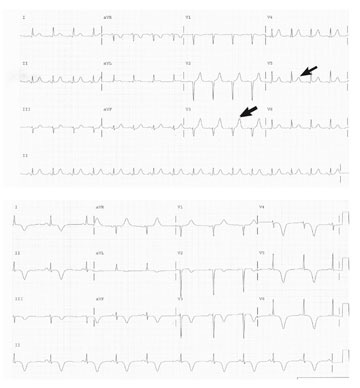
Mynd 3. Myndir 3a og 3b sýna hjartalínurit frá þriðja tilfelli sem er dæmigert fyrir broddþensluheilkenni. Á komudegi sjást ST hækkanir í V5, V6 og aVL, léleg þróun R takka. Á þriðja degi sýnir rit djúpa viðsnúna T takka í flestum leiðslum, QTc er lengt 463ms.
Umræða
Einkenni og teikn: Umræddir þrír einstaklingar eru þeir fyrstu sem lýst hefur verið hér á landi með BÞH. Algengustu einkenni BÞH er hvíldarbrjóstverkur auk mæði og yfirliða. Flestir sjúklingar eru með eðlileg lífsmörk en sumir sjúklinganna eru í losti við komu (1, 4, 5). Í flestum tilfellum er saga um líkamlegt eða andlegt álag skömmu áður en einkenni koma fram, til dæmis andlát ættingja, fjölskylduerjur, slys eða meiriháttar aðgerð (2, 4).
Flestir sjúklingar með BÞH hafa breytingar á hjartalínuriti á fyrsta degi, ýmist ST-lækkanir, ST-hækkanir eða viðsnúna T-takka og R-takka þróun er léleg. Á innan við 48 klukkustundum er QT-bilið yfirleitt lengt og dæmigert er að djúpar viðsnúnar T-bylgjur sjáist. Breytingar á hjartalínuriti eru oftast meiri en samrýmast hækkun á hjartaensímum (4, 6, 7). Öll okkar tilfelli höfðu einhverjar ST-breytingar á fyrsta degi og lélega R-þróun og hjá öllum þróast viðsnúnar T-bylgjur (mynd 3 og tafla II).
Sjúklingar með BÞH hafa lélegan samdrátt í broddi og miðhluta vinstri slegils sem lagast umtalsvert á nokkrum dögum og alveg á nokkrum vikum. Kröftugur samdráttur er í grunnhluta slegilsins (2). Útstreymisbrot við komu er oftast um 20%, um 45% eftir þrjá til sjö daga og samdráttur er yfirleitt orðinn eðlilegur á tveimur til fjórum vikum (6). Þetta er í samræmi við hjartaómanir hjá okkar tilfellum.
Engin ein skilgreining hefur verið samþykkt fyrir BÞH. Samkvæmt flestum skilgreiningum er talað um tímabundna truflun á samdrætti vinstri slegils, ásamt nýjum breytingum á hjartalínuriti og/eða hækkun á hjartaensímum. Kransæðamyndatöku þarf að gera til að útiloka bráðan kransæðasjúkdóm en samkvæmt mörgum skilgreiningum er krafist að allar kransæðar séu með ómarkverðar þrengingar, innan við 25-50% (1, 7-9). Samkvæmt sumum skilgreiningum er leyfð þrenging á kransæð. Er þá miðað við að þrengingar í kransæðum útskýri ekki línuritsbreytingar eða samdráttarskerðingu slegilsins þar sem skerðingin nái út fyrir dreifingarsvæði kransæðarinnar (10).
Öll okkar tilfelli höfðu einkenni bráðs kransæðaheilkennis. Konurnar höfðu vægar hækkanir á hjartaensímum, nýjar ST-breytingar og tímabundna samdráttarskerðingu á vinstri slegli. Þriðja tilfellið var með marktæka þrengingu á hægri kransæð en hins vegar var hún með einkennandi útlit fyrir BÞH á hjartaómun, hún var með ST-hækkanir í V5 og V6 og hún þróaði djúpar T-bylgjur í öllum leiðslum á hjartalínuriti. Þrenging í hægri kransæð getur tæplega útskýrt þessi teikn. Hjartaómun eftir fimm daga sýndi eðlilegan slegil og var þá ekki búið að gera víkkun á hægri kransæð.
Faraldsfræði: Í 80% tilfella eru sjúklingar með BÞH konur, oftast eldri en fimmtugar (1, 4). Öll okkar tilfelli voru konur og tvær af þremur voru komnar í tíðahvörf. Ekki er vitað um algengi BÞH í almennu þýði. Í japönskum rannsóknum er heilkennið um 1,2-2,2% allra innlagna vegna bráðrar kransæðastíflu (11-13) og í rannsókn frá Minnesota í Bandaríkjunum var BÞH talið vera orsök 2,2% allra hjartaáfalla með ST-hækkun (14). Í ítalskri rannsókn var BÞH greiningin hjá 4% af fólki sem var grunað um brátt kransæðaheilkenni (15). Í þessari grein er fjallað um þrjú sjúkratilfelli sem voru greind á innan við mánuði. Þessi fjöldi sjúklinga gefur ekki til kynna tíðni heilkennisins hér á landi enda var ekki farið yfir greiningar á ákveðnu tímabili. Ekki er um að ræða afturvirka rannsókn heldur sjúkratilfelli.
Meingerð BÞH er ekki þekkt en nokkrar tilgátur hafa verið settar fram. Offramleiðsla katekólamína er ein þeirra. Katekólamín geta haft bein áhrif á hjartavöðvafrumu með offramleiðslu kalsíums gegnum beta viðtaka og þau geta verið uppspretta súrefnisradikala. Katekólamín geta valdið kransæðaherpingi og truflun á æðaþeli. Sýnt hefur verið fram á aukið magn katekólamína og nevrópeptíða hjá einstaklingum með BÞH. Þekkt er að sjúkdómar sem hafa áhrif á magn katekólamína geta valdið tímabundinni truflun á starfsemi vinstri slegils, til dæmis litfíklaæxli og neðanskúmblæðing (subar-achnoidal haemorrhage). Í meinafræðirannsóknum hafa katekólamín verið tengd herslidrepi (contraction band necrosis), líkt og sjást í hjartavöðvafrumum hjá einstaklingum með neðan-skúmblæðingar og litfíklaæxli (2, 6, 16, 17).
Samdráttartruflunin verður á mið- og brodd-hluta slegilsins hjá einstaklingum með BÞH en í grunnhluta slegilsins er venjulega góður samdráttur. Rannsóknir sýna að broddhluti vinstri slegilsins svarar sterkar sympatískri örvun. Hjartavöðvinn þynnist á broddsvæði og broddurinn tapar auðveldlega teygjanleika eftir þenslu og hann er á mörkum næringarsvæðis kransæðanna (4, 6).
Konur eru í miklum meirihluta sjúklinga með BÞH. Kynhormón hafa áhrif á sympatíska taugahormónaöxulinn og stjórn æðaherpings kransæða (vasoreactivity) en þau áhrif eru ekki vel skilgreind (6). Í tilraunum með estrógengjöf hefur verið sýnt fram á að þau minnka framleiðslu streituhormóna, minnka áhrif katekólamína og virkni verður minni í sympatíska taugakerfinu eftir estrógengjöf (18-20).
Í tilfelli þrjú var sterkur grunur um offramleiðslu kortisóls. Ekki hefur verið sýnt fram á tengsl milli of hás styrks kortisóls og BÞH en til eru rannsóknir sem sýna að sykursterar geta aukið svar hjartavöðvafrumna við sympatískri örvun (21).
Hnútur fannst í skjaldkirtli hjá tilfelli eitt og tilfelli tvö var með sögu um hnút í skjaldkirtli, en hvorugt þeirra var með hækkun á skjaldkirtilshormónum. Ekki hefur verið sýnt fram á að ofvirkni skjaldkirtils tengist BÞH en vitað er að ofseyting skjaldkirtilshormóna eykur sympatíska virkni (22).
Meðferð: Þar sem í upphafi er ekki hægt að greina á milli bráðs kransæðaheilkennis og BÞH skal fyrst meðhöndla líkt og um hið fyrrnefnda sé að ræða. Rétt er að gera kransæðamyndatöku til að útiloka alvarlegan kransæðasjúkdóm (3). Eftir að kransæðamyndatöku til greiningar er lokið er mælt með stuðningsmeðferð með Beta blokker, ACE-hemlum, salicýlsýru og, ef þörf krefur, þvagræsilyfjum. Fylgjast þarf með sjúklingum vegna hættu á hjartsláttartruflunum, hjartabilun og öðrum fylgikvillum (2, 3). Sjúklingar með BÞH geta hjartabilast vegna samdráttarskerðingar í slegli og þurft adrenvirk og dópamínvirk lyf eða hjálpardælu í ósæð (intra aortic balloon pump). Vegna minnkaðs samdráttarkrafts í miðhluta slegilsins og broddi og öflugs samdráttar í grunnhluta hans hjá sjúklingum með BÞH getur myndast mótstaða í sleglinum og starfræn útflæðishindrun. Mikilvægt er að athuga með hjartaómun eða vinstri slegilsmynd í þræðingu hvort útflæðishindrun sé til staðar hjá sjúklingum með BÞH og lágan blóðþrýsting. Sjúklinga með útflæðishindrun ætti ekki að meðhöndla með adrenvirkum lyfjum því þau geta gert flæðishindrunina verri. Betablokkar eru notaðir varlega til að minnka samdrátt í grunnhluta slegilsins og stundum eru α-1 agonistar, eins og noradrenalin, notaðir til að auka mótstöðu í slagæðakerfinu (3, 8, 23).
Fylgikvillar: Hjartabilun er einn helsti fylgikvilli BÞH og þróast hjá fimmtungi sjúklinga (23, 24). Aðrir alvarlegir fylgikvillar BÞH eru hjartsláttartruflanir, alvarlegur míturlokuleki og hjartavöðvarof (25). Gáttaflökt/tif sést oft og í þeim tilvikum ætti að huga að blóðþynningarmeðferð. Hins vegar er sleglatif og sleglaflökt sjaldgæfur fylgikvilli (4).
Horfur þeirra sem fá BÞH eru góðar. Í nokkrum stórum rannsóknum á heilkenninu hefur komið fram að nánast allir sjúklingar ná sér að fullu innan fjögurra til átta vikna (1, 4). Endurkoma heilkennisins er fátíð eða um 3-11% og dánartíðni er ekki hærri en hjá almennu þýði. Hærri dánartíðni sást hjá þeim sjúklingum sem höfðu undirliggjandi sjúkdóm eða fengu heilkennið upp úr alvarlegu slysi eða sjúkdómi (24, 26).
Samantekt: BÞH er áður óþekktur sjúkdómur hér á landi. Hann veldur einkennum sem líkjast bráðu kransæðaheilkenni og einkennist af tímabundinni samdráttarskerðingu í vinstri slegli sem skýrist ekki af fyrirliggjandi kransæðaþrengslum. Horfur sjúklinga eru góðar. Þar sem sjúkdómurinn greinist aðallega hjá konum er mikilvægt að læknar hafi hann í huga hjá konum með einkenni bráðs kransæðaheilkennis.
Þakkir
Eftirfarandi fá kærar þakkir fyrir aðstoð: Gizur Gottskálksson, Axel Sigurðsson, lækna- og hjúkrunarritarar á hjarta- og skurðdeild.
Heimildir
1. Sharkey SW, Lesser JR, Zenovich AG, et al. Acute and reversible cardiomyopathy provoked by stress in women from the United States. Circulation 2005; 111: 472-9.
2. Tarkin JM, Khetyar M, Kaski JC. Management of Tako-tsubo Syndrome. Cardiovasc Drugs Ther 2008; 22: 71-7.
3. Bybee KA, Kara T, Prasad A, et al. Systematic review: transient left ventricular apical ballooning: a syndrome that mimics ST-segment elevation myocardial infarction. Ann Intern Med 2004; 141: 858-65.
4. Tsuchihashi K, Ueshima K, Uchida T, et al. Transient left ventricular apical ballooning without coronary artery stenosis: a novel heart syndrome mimicking acute myocardial infarction. Angina Pectoris-Myocardial Infarction Investigations in Japan. J Am Coll Cardiol 2001; 38: 11-8.
5. Prasad A, Lerman A, Rihal CS. Apical ballooning syndrome (Tako-Tsubo or stress cardiomyopathy): a mimic of acute myocardial infarction. Am Heart J 2008; 155: 408-17.
6. Wittstein IS, Thiemann DR, Lima JA, et al. Neurohumoral features of myocardial stunning due to sudden emotional stress. N Engl J Med 2005; 352: 539-48.
7. Abe Y, Kondo M, Matsuoka R, Araki M, Dohyama K, Tanio H. Assessment of clinical features in transient left ventricular apical ballooning. J Am Coll Cardiol 2003; 41: 737-42.
8. Prasad A. Apical ballooning syndrome: an important differential diagnosis of acute myocardial infarction. Circulation 2007; 115: e56-9.
9. Haghi D, Fluechter S, Suselbeck T, Kaden JJ, Borggrefe M, Papavassiliu T. Cardiovascular magnetic resonance findings in typical versus atypical forms of the acute apical ballooning syndrome (Takotsubo cardiomyopathy). Int J Cardiol 2007; 120: 205-11.
10. Lee YP, Poh KK, Lee CH, et al. Diverse clinical spectrum of stress-induced cardiomyopathy. Int J Cardiol 2008 (in print).
11. Matsuoka K, Okubo S, Fujii E, et al. Evaluation of the arrhythmogenecity of stress-induced ?Takotsubo cardiomyopathy? from the time course of the 12-lead surface electrocardiogram. Am J Cardiol 2003; 92: 230-3.
12. Dote K, Sato H, Tateishi H, Uchida T, Ishihara M. [Myocardial stunning due to simultaneous multivessel coronary spasms: a review of 5 cases]. J Cardiol 1991; 21: 203-14.
13. Ito K, Sugihara H, Katoh S, Azuma A, Nakagawa M. Assessment of Takotsubo (ampulla) cardiomyopathy using 99mTc-tetrofosmin myocardial SPECT--comparison with acute coronary syndrome. Ann Nucl Med 2003; 17: 115-22.
14. Bybee KA, Prasad A, Barsness GW, et al. Clinical characteristics and thrombolysis in myocardial infarction frame counts in women with transient left ventricular apical ballooning syndrome. Am J Cardiol 2004; 94: 343-6.
15. Spedicato L, Zanuttini D, Nucifora G, et al. Transient left ventricular apical ballooning syndrome: a 4-year experience. J Cardiovasc Med (Hagerstown) 2008; 9: 916-21.
16. Kurisu S, Sato H, Kawagoe T, et al. Tako-tsubo-like left ventricular dysfunction with ST-segment elevation: a novel cardiac syndrome mimicking acute myocardial infarction. Am Heart J 2002; 143: 448-55.
17. Singal PK, Kapur N, Dhillon KS, Beamish RE, Dhalla NS. Role of free radicals in catecholamine-induced cardiomyopathy. Can J Physiol Pharmacol 1982; 60: 1390-7.
18. Ueyama T. Emotional stress-induced Tako-tsubo cardiomyopathy: animal model and molecular mechanism. Ann N Y Acad Sci 2004; 1018: 437-44.
19. Komesaroff PA, Esler MD, Sudhir K. Estrogen supplementation attenuates glucocorticoid and catecholamine responses to mental stress in perimenopausal women. J Clin Endocrinol Metab 1999; 84: 606-10.
20. Ueyama T, Ishikura F, Matsuda A, et al. Chronic estrogen supplementation following ovariectomy improves the emotional stress-induced cardiovascular responses by indirect action on the nervous system and by direct action on the heart. Circ J 2007; 71: 565-73.
21. Lister K, Autelitano DJ, Jenkins A, Hannan RD, Sheppard KE. Cross talk between corticosteroids and alpha-adrenergic signalling augments cardiomyocyte hypertrophy: a possible role for SGK1. Cardiovasc Res 2006; 70: 555-65.
22. Burggraaf J, Tulen JH, Lalezari S, Schoemaker RC, De Meyer PH, Meinders AE, et al. Sympathovagal imbalance in hyperthyroidism. Am J Physiol Endocrinol Metab 2001; 281: E190-5.
23. Villareal RP, Achari A, Wilansky S, Wilson JM. Anteroapical stunning and left ventricular outflow tract obstruction. Mayo Clin Proc 2001; 76: 79-83.
24. Gianni M, Dentali F, Grandi AM, Sumner G, Hiralal R, Lonn E. Apical ballooning syndrome or takotsubo cardiomyopathy: a systematic review. Eur Heart J 2006; 27: 1523-9.
25. Ishida T, Yasu T, Arao K, Kawakami M, Saito M. Images in cardiovascular medicine. Bedside diagnosis of cardiac rupture by contrast echocardiography. Circulation 2005 Dec; 112: e354-5.
26. Elesber AA, Prasad A, Lennon RJ, Wright RS, Lerman A, Rihal CS. Four-year recurrence rate and prognosis of the apical ballooning syndrome. J Am Coll Cardiol 2007; 50: 448-52.
Barst: 2. maí 2008, - samþykkt til birtingar: 6. október 2008.
