10. tbl. 94. árg. 2008
Fræðigrein
Miðbrúar- og utanbrúarafmýling í kjölfar leiðréttingar svæsinnar blóðnatríumlækkunar
Sjúkratilfelli og yfirlitsgrein
Ágrip
Við greinum frá 43 ára gamalli konu sem fékk osmósuafmýlingarheilkenni (osmotic demyelination syndrome) í kjölfar leiðréttingar sérlega svæsinnar blóðnatríumlækkunar sem álitin var af langvinnum toga. Styrkur natríums í sermi var aðeins 91 mmól/l við komu á sjúkrahús. Stefnt var að hægfara leiðréttingu natríumlækkunarinnar og var markmiðið að hraði leiðréttingar yrði ekki meiri en 12 mmól/l á sólarhring. Það tókst fyrstu tvo daga meðferðar en á þriðja degi hækkaði natríumstyrkurinn um 13 mmól/l. Á 11. degi reyndist konan komin með merki um sýndarmænukylfulömun (pseudobulbar palsy) ásamt stjarfaferlömun (spastic quadriparesis) og staðfesti segulómmyndun miðbrúar- og utanbrúarafmýlingarskemmdir. Konan fékk almenna stuðningsmeðferð og náði smám saman fullum bata. Fjallað er um meinalífeðlisfræði osmósuafmýlingarheilkennis og meðferð blóðnatríumlækkunar. Við mælum með að hraði leiðréttingar langvinnrar blóðnatríumlækkunar sé ekki umfram 8 mmól/l á sólarhring.
Inngangur
Osmósuafmýlingarheilkenni (osmotic demyel-ination syndrome) er fátíður fylgikvilli meðferðar blóðnatríumlækkunar sem getur leitt til óafturkræfra heilaskemmda eða dauða. Afmýlingarskemmdir eru yfirleitt staðsettar í brú heilastofnsins (central pontine myelinolysis) en einnig finnast þær utan brúarinnar (extrapontine myelinolysis) í um 10% tilfella (1). Klíníska myndin getur verið breytileg eftir því hve umfangsmiklar afmýlingarskemmdirnar eru, allt frá skjálfta og þvoglumæli, yfir í sýndarkylfulömun (pseudobulbar palsy), stjarfaferlömun (spastic quadriparesis) og meðvitundarskerðingu (2, 3). Algengasta orsök osmósuafmýlingarheilkennis er hröð leiðrétting langvinnrar blóðnatríumlækkunar sem myndast á meira en 48 klukkustundum, samkvæmt skilgreiningu er öðlast hefur sess (4, 5). Blóðnatríumlækkun telst því bráð ef hún myndast á innan við 48 klukkustundum. Þessi aðgreining milli bráðrar og langvinnrar blóðnatríumlækkunar grundvallast á þekkingu á aðlögun heilans og hefur þýðingu fyrir ákvörðun meðferðar. Ýmsir aðrir kvillar eru taldir geta aukið hættuna á myndun afmýlingarskemmda, meðal annars áfengissýki, vannæringarástand, kalíumskortur og lifrarbilun (6-8). Rýni í fjölda sjúkratilfella fyrir tveimur áratugum sýndi fram á að hættan á osmósuafmýlingarheilkenni í kjölfar leiðréttingar langvinnrar blóðnatríumlækkunar eykst verulega þegar hraði leiðréttingar er umfram 12 mmól/l á sólarhring og því hefur verið mælt með að hraðanum sé haldið undir því marki (9, 10). Hins vegar verður að bregðast skjótt við þegar blóðnatríumlækkun er bráð því þá er oft um að ræða svæsinn heilabjúg er leitt getur til heilaskemmda eða dauða (11). Í slíkum tilfellum eru yfirleitt alvarleg einkenni frá miðtaugakerfi, svo sem flog, rugl eða meðvitundarleysi. Oft er óljóst hvort lækkun natríum er af bráðum eða langvinnum toga og því getur meðferðin verið mjög vandasöm.
Greint er frá nýlegu sjúkratilfelli þar sem osmósuafmýlingarheilkenni kom fyrir þrátt fyrir að reynt væri að fara varlega við leiðréttingu sérlega svæsinnar blóðnatríumlækkunar.
Sjúkratilfelli
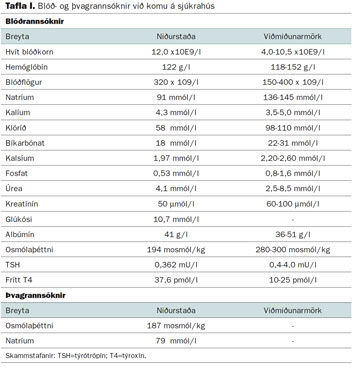
Fjörutíu og þriggja ára gömul kona var flutt á bráðamóttöku Landspítala vegna vaxandi slappleika og sljóleika um einnar viku skeið. Hún hafði einnig kastað upp í nokkur skipti. Saga var um háþrýsting sem var meðhöndlaður með atenólóli og samsetningu hýdróklórtíazíðs og amílóríðs (Hýdramíl míte). Auk þess lagði hún sig fram við að halda saltinntöku hóflegri og neytti jafnframt vatns í ríkulegum mæli. Heilsufarssaga hennar var að öðru leyti ómarkverð; hún hafði aldrei legið á sjúkrahúsi. Þá hafði hún aldrei reykt og neytti ekki áfengis. Við komu var konan sljó en gat svarað einföldum spurningum og hún var áttuð á persónu, stað og stund. Hún var þvoglumælt en skoðun taugakerfis var að öðru leyti eðlileg. Hún var hitalaus. Blóðþrýstingur mældist 133/81 og púls 70 slög á mínútu útafliggjandi; svipuð gildi fengust í sitjandi stöðu. Vökvaástand var metið eðlilegt. Niðurstöður blóð- og þvagrannsókna við komu eru sýndar í töflu I. Natríumstyrkur í sermi (S-natríum) var aðeins 91 mmól/l og S-osmólaþéttni 194 mosmól/kg. Einnig voru öndunarlýting og væg lækkun kalsíums og fosfats fyrir hendi. Natríumstyrkur í þvagi var 79 mmól/l og osmólaþéttni 187 mosmól/kg. Röntgenmynd af brjóstholi var eðlileg. Mynd 1. Hraði leiðréttingar natríumstyrks í sermi fyrstu níu daga meðferðar.

Mynd 1. Hraði leiðréttingar natríumstyrks í sermi fyrstu níu daga meðferðar.
Konan var því með afar svæsna blóðnatríumlækkun með einkennum frá miðtaugakerfi sem voru þó tiltölulega væg í ljósi þess hve natríumstyrkurinn var lágur og þótti það benda til að natríumlækkunin væri langvinn. Hýdróklórtíazíð var talið vera líkleg orsök ásamt mikilli vatnsdrykkju. Hún var lögð inn á sjúkrahúsið til meðferðar og var stefnt að því að hraði leiðréttingar S-natríums yrði alls ekki meiri en 12 mmól/l á sólarhring. Konan fékk í fyrstu 0,9% natríumklóríð með hraðanum 100 ml á klukkustund og fúrósemíð 40 mg, hvort tveggja í æð, auk þess sem inntaka hýdróklórtíazíðs/amílóríðs var stöðvuð. Náið var fylgst með konunni og var S-natríum mælt á tveggja til fjögurra klukkustunda fresti fyrsta sólarhringinn en eftir það dró úr tíðni mælinga. Þróun natríumstyrksins er sýnd á mynd 1. Þremur klukkustundum eftir komu hafði S-natríum hækkað í 94 mmól/l og var vökvagjöf í æð þá hætt og vökvainntaka takmörkuð við 800 ml á dag. Sólarhring eftir komu hafði S-natríum hækkað í 100 mmól/l. Á ný var 0,9% natríumklóríð gefið í æð með hraðanum 150 ml á klukkustund auk þess að fúrósemíð var gefið í tvígang. Eftir tvo sólarhringa var S-natríum komið í 106 mmól/l og í 119 mmól/l eftir þrjá sólarhringa. Samhliða hækkun S-natríums fór meðvitundarástand batnandi og þvoglumæli hvarf. Þvagútskilnaður var stöðugur á bilinu 650-1000 ml á sólarhring og vökvajafnvægi var jákvætt fyrstu fjóra daga sjúkrahúslegunnar. Daginn eftir komu reyndist S-kalíum hafa lækkað niður í 2,8 mmól/l en með ríkulegri kalíumuppbót var kalíumstyrkurinn kominn í eðlilegt horf innan tveggja daga. Einnig fékk konan uppbótarmeðferð vegna lækkunar S-kalsíums og S-fosfats og leiðréttust þessar raskanir á nokkrum dögum. Þá var S-glúkósi lítillega hækkaður við komu en mældist eftir það innan eðlilegra marka. Á fjórða degi fékk konan alflog í þrígang og reyndist S-natríum þá 121 mmól/l. Í kjölfarið bar á vaxandi sljóleika. Ekkert markvert fannst við tölvusneiðmyndun á heila og heldur ekki við segulómmyndun sem framkvæmd var fjórum dögum síðar (mynd 2). Á 11. degi var konan orðin ófær um að tjá sig og fylgdi illa fyrirmælum. S-natríum var þá orðið eðlilegt. Næstu daga versnaði ástand konunnar enn frekar með mikilli meðvitundarskerðingu, sundurvísun augnhreyfinga, taltruflun, kyngingartregðu og stjarfaferlömun. Lífleg sinaviðbrögð voru í báðum líkamshelmingum, hægt var að framkalla vöðvakippi (clonus) í hægri fótlegg og jákvætt iljarviðbragð var þeim megin. Mænustunga leiddi í ljós eðlilegan mænuvökva. Heilarit sýndi útbreidda hægbylgjuvirkni og samrýmdist það dreifðum heilakvilla (encephalopathy). Segulómmyndun leiddi í ljós samhverfar segulskærar breytingar miðsvæðis í brú, rófukjörnum (caudate nucleus) og djúphnoðum (basal ganglia) heilans er þóttu dæmigerðar fyrir miðbrúar- og utanbrúarafmýlingu (mynd 2). Konan fékk almenna stuðningsmeðferð og í kjölfarið langvarandi endurhæfingarmeðferð og komst smám saman á bataveg. Hún var útskrifuð af sjúkrahúsinu fjórum mánuðum eftir komu og hafði þá náð nær fullum bata. a. T2-mynd tekin á áttunda degi innlagnar sýnir engar sjúklegar breytingar. b. T2-mynd tekin á 15. degi innlagnar sýnir samhverfar skærar breytingar miðsvæðis í brú (ör) og eru þær dæmigerðar fyrir miðbrúarafmýlingu (central pontine myelinolysis). c. FLAIR*-mynd tekin á áttunda degi innlagnar var í fyrstu álitin eðlileg en við nánari rýni má sjá vægar segulskærar breytingar í rófukjarna (caudate nucleus) beggja vegna (örvar). d. FLAIR*-mynd tekin á 15. degi innlagnar sýnir samhverfar segulskærar breytingar í rófukjörnum og djúphnoðum heilans (basal ganglia) (örvar) sem samrýmast utanbrúarafmýlingu (extrapontine myelinolysis). *FLAIR: Fluid Attenuated Inversion Recovery.
Umræða
Tilfelli það sem hér er greint frá sýnir glögglega hve hættan á afmýlingarskemmdum er mikil þegar svæsin, langvinn blóðnatríumlækkun er leiðrétt. Stefnt var að hægfara leiðréttingu natríumstyrksins og má segja að vel hafi tekist í upphafi meðferðar því S-natríum hækkaði aðeins um 9 mmól/l á fyrsta sólarhring og samtals um 15 mmól/l fyrstu tvo sólarhringa meðferðar. Á þriðja sólarhring hækkaði S-natríum hins vegar um 13 mmól/l sem verður að teljast óhóflegt. Daginn eftir versnaði ástand konunnar skyndilega og í kjölfarið varð klíníska myndin dæmigerð fyrir miðbrúarafmýlingu. Hugsanlegt er að hægari leiðrétting natríumstyrksins hefði komið í veg fyrir þennan alvarlega fylgikvilla. Hættan á osmósuafmýlingu í þessu tilfelli var að líkindum sérlega mikil í ljósi þess hve blóðnatríumlækkunin var svæsin en natríumstyrkurinn var með þeim lægstu sem um getur.
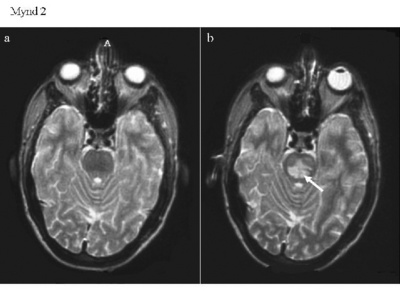
a. T2-mynd tekin á áttunda degi innlagnar sýnir engar sjúklegar breytingar.
b. T2-mynd tekin á 15. degi innlagnar sýnir samhverfar skærar breytingar miðsvæðis í brú (ör) og eru þær dæmigerðar fyrir miðbrúarafmýlingu (central pontine myelinolysis).
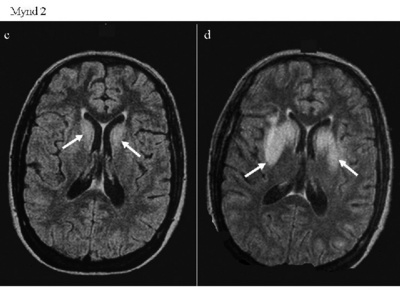
c. FLAIR*-mynd tekin á áttunda degi innlagnar var í fyrstu álitin eðlileg en við nánari rýni má sjá vægar segulskærar breytingar í rófukjarna (caudate nucleus) beggja vegna (örvar).
d. FLAIR*-mynd tekin á 15. degi innlagnar sýnir samhverfar segulskærar breytingar í rófukjörnum og djúphnoðum heilans (basal ganglia) (örvar) sem samrýmast utanbrúarafmýlingu (extrapontine myelinolysis).
*FLAIR: Fluid Attenuated Inversion Recovery.
Miðbrúarafmýlingu var fyrst lýst af Adams og Victor árið 1950 (12) er þeir greindu frá hratt versnandi ferlömun og sýndarmænukylfulömun í ungum manni sem hafði lagst inn á spítala 10 dögum áður vegna áfengisfráhvarfs. Krufning nokkrum dögum síðar sýndi fram á stóra, samhverfa mýliseyðingu (demyelination) sem náði yfir stærsta hluta brúar heilastofnsins en athygli vakti þyrming sjálfra taugafrumnanna. Er fyrstu tilfellunum var lýst var S-natríum ekki mælt reglulega í klínísku starfi. Árið 1976 var ljósi varpað á tengsl miðbrúarafmýlingar við leiðréttingu blóðnatríumlækkunar (13). Dýratilraunir hafa sýnt sams konar klíníska mynd og afmýlingarskemmdir við hraða leiðréttingu blóðnatríumlækkunar og styðja því þátt hennar í meinmyndun sjúkdómsins (14, 15). Lagt hefur verið til að nota heitið osmósuafmýlingarheilkenni fremur en miðbrúar- og utanbrúarafmýling því það þykir lýsa betur meinalífeðlisfræði þessa kvilla og tengslum hans við meðferð blóðnatríumlækkunar (9). Nýgengi osmósuafmýlingarheilkennis hefur ekki verið vel skilgreint en ljóst er að það er umtalsvert eftir leiðréttingu svæsinnar blóðnatríumlækkunar af langvinnum toga með hliðsjón af þeim fjölda tilfella sem greint hefur verið frá. Osmósuafmýlingar-heilkenni leggst jafnt á bæði kyn og er að því leyti frábrugðið heilaskemmdum af völdum bráðrar blóðnatríumlækkunar sem eru algengastar meðal kvenna fyrir tíðahvörf (16).
Þrátt fyrir umfangsmiklar rannsóknir hefur gengið erfiðlega að skilgreina hversu hraða leiðréttingu blóðnatríumlækkunar heilinn þolir. Rannsóknir Sterns og samstarfsmanna (9, 17) hafa leitt í ljós verulega aukna hættu á osmósuafmýlingu ef natríumstyrkurinn er hækkaður um meira en 12 mmól/l á 24 klukkustundum eða 18 mmól/l á 48 klukkustundum en hins vegar litla hættu ef leiðrétting natríumstyrksins er hægari en sem þessu nemur. Þó hefur stöku tilfellum verið lýst þar sem hækkun S-natríums var 9-10 mmól/l á 24 klukkustundum (2, 9, 17). Vinna Sterns og félaga (17) sýndi einnig að þeir sem höfðu haft blóðnatríumlækkun lengur en 48 klukkustundir áður en meðferð hófst voru líklegri til að fá osmósuafmýlingarheilkenni en þeir sem höfðu haft röskunina í skemmri tíma. Rannsóknir á tilraunadýrum með svæsna, langvinna blóðnatríumlækkun hafa sýnt að afmýlingarskemmdir koma fram þegar S-natríum er leiðrétt hraðar en sem nemur 13-16 mmól/l á sólarhring (14, 15, 18, 19). Á hinn bóginn myndast slíkar skemmdir ekki ef blóðnatríumlækkun er leiðrétt hægar eða látin óáreitt og sama er að segja ef blóðnatríumlækkunin er framkölluð á innan við sólarhring. Tímalengd blóðnatríumlækkunar og hraði leiðréttingar virðast því ráða mestu um myndun heilaskemmda í kjölfar meðferðar langvinnrar blóðnatríumlækkunar.
Ekki er vitað með vissu hvernig leiðrétting blóðnatríumlækkunar leiðir til afmýlingarskemmda en talið er líklegt að það tengist óhóflegri vökvaþurrð heilafrumna sem myndast er natríumstyrkurinn er hækkur hratt í kjölfar aðlögunar að svæsinni lækkun hans. Blóðnatríumlækkun veldur auknu flæði vatns inn í frumur sem tútna út og eru klínísk áhrif þess að mestu bundin við heilann því ósveigjanleiki höfuðkúpunnar takmarkar útþenslu hans. Heilabjúgur sem veldur meiri en 10% rúmmálsaukningu leiðir til dauða vegna haulunar (20). Heilinn hefur þó mikla aðlögunarhæfni gegn blóðnatríumlækkun og spornar við myndun alvarlegs heilabjúgs með því að losa sig við uppleyst efni. Þetta ferli er hraðvirkt og hefst innan fárra mínútna með auknu flæði natríumríks millivefsvökva um sérstök göng yfir í heila- og mænuvökva fyrir tilstilli hækkaðs vökvaþrýstings (21). Losun kalíumjóna úr heilafrumum hefst tveimur til þremur klukkustundum síðar (18, 21). Eftir það tekur við losun smárra lífrænna efna sem er mun hægvirkari (22). Þessi lífrænu efni sem kallast osmólýtar eru meðal annars mýóinósitól og amínósýrurnar glútamín og taurín. Aðlögunarbreytingarnar hafa þau áhrif að vatnsinnihald heilans er komið í eðlilegt horf innan 48 klukkustunda og helst stöðugt eftir það. Sjúklingar með langvinna blóðnatríumlækkun hafa því oft mjög væg eða engin klínísk einkenni þrátt fyrir afar lágan natríumstyrk. Hins vegar virðist aðlögunin gera heilann viðkvæman fyrir álagi sem fylgir leiðréttingu natríumlækkunarinnar. Natríum- og kalíuminnihald heilans kemst í eðlilegt horf á nokkrum klukkustundum við leiðréttingu blóðnatríumlækkunar en flutningur lífrænna osmólýta inn í frumurnar og nýmyndun osmólýta tekur lengri tíma eða allt að fimm til sjö daga (23, 24). Ef hraði leiðréttingar er meiri en hraði endurupptöku lífrænna osmólýta í heilafrumurnar, skreppa þær saman og afmýlingarskemmdir geta myndast (25, 26). Rannsóknir á tilraunadýrum hafa sýnt sundrun blóð- og heilaþröskuldar og að komplímentþættir, sem hafa eiturhrif á fáhyrnur (oligodendrocytes), og mögulega önnur efni með eiturhrif á taugavef, komast inn í heilann eftir skjóta leiðréttingu blóðnatríumlækkunar (27). Einnig hafa komið fram vísbendingar um að osmósuáverki sem fylgir hraðri leiðréttingu S-natríums hrindi af stað stýrðum frumudauða meðal mýlismyndandi frumna (28). Framtíðarrannsóknir munu beinast að því að finna þætti sem útsetja sjúklinga fyrir osmósuafmýlingu við leiðréttingu blóðnatríumlækkunar og að skilgreina ferli er leiða til mýlisskemmda.
Einkenni osmósuafmýlingar koma yfirleitt ekki fram fyrr en nokkrum dögum eftir leiðréttingu blóðnatríumlækkunar eins og var reyndin hjá okkar sjúklingi. Hin dæmigerða klíníska mynd, sýndarmænukylfulömun og stjarfaferlömun, speglar skemmdir í barkar- og mænubrautum (corticospinal tracts) og barkar- og heilastofnsbrautum (corticobulbar tracts) í brú (2). Einnig er meðvitundarskerðing algeng og sumir sjúklingar lenda í svokölluðu innilokunarástandi (locked-in state) þar sem skynjun er óskert en tjáning mjög heft og getur nær eingöngu farið fram með lóðréttum augnhreyfingum og því að depla augunum. Flog geta komið fyrir en eru fátíð (2, 29) og eru miklu fremur afleiðing bráðrar blóðnatríumlækkunar. Flogin hjá okkar sjúklingi tengdust þó án efa leiðréttingu natríumstyrksins þar sem hann var kominn upp í 121 mmól/l þegar þau áttu sér stað og hafði því hækkað um 30 mmól/l eða um 33%. Hjá mörgum sjúklingum með osmósuafmýlingarheilkenni eru einkenni og teikn lítil eða engin og líklega uppgötvast sjúkdómurinn því aðeins hjá minnihluta sjúklinga. Greiningu osmósuafmýlingar hefur þó fleygt fram með tilkomu tölvusneiðmyndunar (30) og segulómmyndunar (31). Segulómmyndun er kjörrannsókn því hún sýnir vel hina dæmigerðu fiðrildisskemmd í brú heilans (32). Tímasetning segulómmyndunar er mikilvæg því rannsóknin getur verið eðlileg við upphaf einkenna og í sumum tilvikum greinast skemmdir ekki fyrr en eftir eina til tvær vikur (33). Í tilviki sjúklingsins sem hér er fjallað um voru segulómmyndir af heila sem teknar voru á áttunda degi innlagnar metnar eðlilegar en við nánari rýni má greina vægar segulskærar breytingar í rófukjarna beggja vegna. Svokölluð flæðisegulómmyndun (diffusion-weighted magnetic resonance imaging) kann að vera næmari en hefðbundin segulómmyndun við greiningu afmýlingarskemmda (34) og hefði hugsanlega leitt til uppgötvunar osmósuafmýlingar strax á áttunda degi en sú tækni var ekki fyrir hendi á Landspítala á þessum tíma. Ráðlegt er að framkvæma segulómmyndun sem fyrst ef einkenni vekja grun um osmósuafmýlingarheilkenni en þótt sjúklegar breytingar greinist ekki útilokar það ekki afmýlingarskemmdir og getur því verið ástæða til að endurtaka rannsóknina eftir eina eða tvær vikur. Ekki er völ á sértækri meðferð við osmósuafmýlingarheilkenni og því eingöngu um að ræða almenna stuðningsmeðferð. Útkoman er breytileg og fer eftir alvarleika. Rannsókn (8) sem gerð var fyrir rúmum áratug sýndi að meðal 34 sjúklinga með osmósuafmýlingarheilkenni létust tveir, og af þeim 32 sem lifðu náði þriðjungur fullum bata, þriðjungur hlaut varanlega fötlun en gat lifað sjálfstæðu lífi og þriðjungur þurfti vistun á hjúkrunarstofnun. Líklega hefur stuðningsmeðferð batnað auk þess sem vægari tilfelli greinast í auknum mæli. Flestir sjúklingar sem lifa af eru líklegir til að þurfa langvarandi og umfangsmikla endurhæfingarmeðferð eins og var raunin hjá okkar sjúklingi.
Í ljósi þess hve afleiðingar afmýlingarskemmda geta verið alvarlegar er afar brýnt að ávallt sé leitast við að fyrirbyggja myndun þeirra með því að fara varlega við meðferð blóðnatríumlækkunar. Þó verður ætíð að bregðast skjótt við ef natríumlækkunin er bráð og einkenni eru alvarleg vegna hættu á heilaskaða og jafnvel dauða af völdum heilabjúgs (35). Þessi sjónarmið stangast að vissu leyti á og því getur svæsin blóðnatríumlækkun verið afar erfið viðureignar (36). Meðferðina þarf að sníða að þörfum sérhvers sjúklings. Í flestum tilfellum er tímalengd blóðnatríumlækkunar óþekkt og því verður að byggja á alvarleika einkenna. Klínískar aðstæður geta hjálpað því bráð blóðnatríumlækkun sést einkum meðal sjúklinga á sjúkrahúsi, einkum eftir skurðaðgerðir (16). Einnig hjá sjúklingum með alvarlegar geðraskanir sem drekka vatn óhóflega (17) og hjá einstaklingum sem hafa þreytt maraþonhlaup (37). Í slíkum tilfellum eru einkenni yfirleitt alvarleg, til dæmis flog eða alvarleg meðvitundarskerðing, og er þá lífsnauðsynlegt að leiðrétta natríumstyrkinn tafarlaust. Mælt hefur verið með að hækka natríumstyrkinn um 3-7 mmól/l á fáeinum klukkustundum og draga síðan verulega úr leiðréttingarhraðanum (38). Þessi nálgun byggist á líf- eðlisfræðilegri þekkingu sem gefur til kynna að fremur lítilfjörleg hækkun S-natríums, eða um það bil 5%, nægi til að minnka heilabjúg verulega (20). Flestir eru á því að best sé að nota 3% natríumklóríð (513 mmól/l) við meðferð svæsinnar bráðrar blóðnatríumlækkunar og gefa 1-2 ml/kg á klukkustund sem ætti að hækka S-natríum um 1-2 mmól/l á klukkustund (2, 17, 36, 38, 39). Sé ástand sjúklings sérlega alvarlegt má gefa 4-5 ml/kg á 1-2 klukkustundum. Einnig getur verið gagnlegt að gefa fúrósemíð samhliða því það eykur útskilnað vatns og hækkar S-natríum um 2-4 mmól/l á klukkustund. Ef engin batamerki koma fram er ráðlegt að halda áfram hraðri leiðréttingu natríumstyrksins þrátt fyrir hættu á osmósuafmýlingu. Loks er hægt að nota úrea til að leiðrétta bráða blóðnatríumlækkun. Úrea framkallar osmósuþvagaukningu og eykur þannig útskilnað vatns og minnkar jafnframt útskilnað natríums um nýru (40). Lengi hefur verið þekkt að osmósuafmýling er mjög fátíð hjá sjúklingum í blóðskilun þrátt fyrir að hröð leiðrétting blóðnatríumlækkunar sé algeng og bendir það til að þvageitrun hafi verndandi áhrif. Dýratilraunir hafa einnig gefið til kynna verndandi áhrif þvageitrunar (41, 42). Hugsanlegt er því að úrea verndi heilann gegn afleiðingum hraðrar leiðréttingar blóðnatríumlækkunar. Rannsóknir hafa sýnt að úrea flæðir mun hægar inn í heilafrumur en aðrar frumur og að það flýti endurheimt lífrænna osmólýta (43, 44). Úrea er hægt að gefa um munn eða í æð, 30-60 g á dag, og ætti það að hækka S-natríum um 5 mmól/l á dag. Nýrnabilun og lifrarbilun eru frábendingar gegn notkun þess.
Langvinn blóðnatríumlækkun sést einkum hjá sjúklingum utan spítala og eru tíazíð þvag- ræsilyf ein algengasta orsökin. Í flestum tilvikum er tímalengd blóðnatríumlækkunarinnar óþekkt. Langvinna blóðnatríumlækkun án teljandi einkenna er almennt mælt með að leiðrétta rólega með því að beita einvörðungu takmörkun á inntöku vatns (38) og byggist sú nálgun á lífeðlisfræðilegri þekkingu á aðlögun heilans auk reynslu af meðferð fjölmargra sjúklinga sem greint hefur verið frá. Sterns (17) hefur mælt með því að hraði leiðréttingar sé minni en 12 mmól/l á sólarhring og 18 mmól/l tvo fyrstu sólarhringa meðferðar. Aðrir hafa viljað setja hámarkið við 10 mmól/l á sólarhring (45) og enn aðrir við 8 mmól/l á sólarhring (38, 46). Það ríkir því ekkert samkomulag í þessu efni. Raunar hefur lengi verið deilt um hve mikla þýðingu hraði leiðréttingar langvinnrar blóðnatríumlækkunar hefur fyrir myndun afmýlingarskemmda og því verið haldið fram að hægfara leiðrétting auki hættu á heilaskemmdum af völdum natríumlækkunarinnar sjálfrar (47). Þessu erum við ósammála og styðjum þá skoðun að hætta á heilaskemmdum af völdum blóðnatríumlækkunar sé óveruleg nema þegar hún er bráð. Við teljum að ávallt skuli leiðrétta langvinna blóðnatríumlækkun eins rólega og kostur er og stefna að því að hækkun natríumstyrksins sé ekki meiri en 8 mmól/l á sólarhring. Það er þó óvíst að alfarið sé hægt að koma í veg fyrir osmósuafmýlingarheilkenni með því að halda hraða leiðréttingar natríumstyrksins undir ákveðnu marki.
Gjöf 0,9% natríumklóríðs er varasöm hjá flestum sjúklingum með langvinna blóðnatríumlækkun. Ef orsökin er óviðeigandi seyting vasópressíns (syndrome of inappropriate antidiuresis) getur gjöf saltvatns leitt til frekari natríumlækkunar því natríum í innrennslisvökvanum er jafnóðum skilið út í þéttu þvagi. Á hinn bóginn ef saltskortur á hlutdeild í orsök blóðnatríumlækkunar getur saltvatn valdið skjótri leiðréttingu S-natríums vegna bælingar á seytingu vasópressíns. Gjöf 0,9% natríumklóríðs á eingöngu rétt á sér ef verulegur skortur utanfrumuvökvarúmmáls er fyrir hendi.
Sjúklingurinn sem hér er fjallað um var með sérlega svæsna langvinna blóðnatríumlækkun og var natríumstyrkurinn með þeim lægstu sem greint hefur verið frá. Því kann að hafa verið óvarlegt að miða við 12 mmól/l á sólarhring sem hámarkshraða leiðréttingar S-natríum þar sem hlutfallsleg hækkun natríumstyrksins er þá meiri en almennt hefur verið reyndin í þeim tilfellum sem framangreindar ráðleggingar byggja á. Þá kann gjöf 0,9% natríumklóríðs og fúrósemíðs að hafa átt þátt í að hraði leiðréttingar var óhóflegur á þriðja sólarhring með- ferðar. En jafnvel þótt mjög varlega sé farið getur reynst erfitt að halda hraða leiðréttingar S-natríums innan þeirra marka sem stefnt er að, einkum vegna skyndilegrar aukningar á vatnsríkum þvagútskilnaði er leitt getur til skjótrar leiðréttingar natríumstyrksins. Þetta getur gerst hjá sjúklingum sem skyndilega hætta óhóflegri vatnsdrykkju eða þegar skerðing á vatnsútskilnaði um nýru er lagfærð, til dæmis við upprætingu skorts á utanfrumuvökva eða annarra þátta sem trufla þynningarhæfni nýrna. Ef þvagútskilnaður eykst skyndilega má reyna að sporna við hækkun S-natríums með því að gefa 5% glúkósalausn í æð eða hamla útskilnaði vatns með gjöf vasópressínhliðstæðunnar desmópressíns (38). Enn fremur voru mælingar á S-natríum ekki nægilega tíðar eftir fyrsta sólarhring meðferðar. Náin vöktun er afar mikilvæg meðan natríumlækkun er leiðrétt. Auk tíðra mælinga á S-natríum, gjarnan með eins til tveggja klukkustunda millibili (39), þarf að fylgjast stöðugt með þvagútskilnaði fyrstu sólarhringana svo hægt sé að grípa inn í ef vatnsrík þvagaukning á sér stað. Loks er mikilvægt að leiðrétta blóðkalíumlækkun þótt ósannað sé að það hafi áhrif á myndun osmósuafmýlingar.
Sjúkratilfelli það sem hér er greint frá sýnir hve meðferð blóðnatríumlækkunar getur verið vandasöm. Það er hugsanlegt að hægari leiðrétting natríumstyrksins hefði nægt til að fyrirbyggja eða minnka sköddunina sem konan varð fyrir. Með hliðsjón af þessu tilfelli og þeirri þekkingu sem hér hefur verið reifuð mælum við með að við leiðréttingu svæsinnar langvinnrar blóðnatríumlækkunar sé hækkun S-natríums ekki umfram 8 mmól/l á sólarhring.
Þakkir
Höfundar þakka Ólafi Kjartanssyni, yfirlækni myndgreiningar á Landspítala, og Þórdísi E. Ágústsdóttur, ljósmyndara á Landspítala, fyrir aðstoð við frágang segulómmynda.
Heimildir
1. Wright DG, Laureno R, Victor M. Pontine and extrapontine myelinolysis. Brain 1979; 102: 361-85.
2. Karp BI, Laureno R. Pontine and extrapontine myelinolysis: a neurologic disorder following rapid correction of hyponatremia. Medicine (Baltimore) 1993; 72: 359-73.
3. Martin RJ. Central pontine and extrapontine myelinolysis: the osmotic demyelination syndromes. J Neurol Neurosurg Psychiatry 2004; 75 Suppl 3: iii22-8.
4. Sterns RH. The management of symptomatic hyponatremia. Semin Nephrol 1990;10 503-14.
5. Soupart A, Decaux G. Therapeutic recommendations for management of severe hyponatremia: current concepts on pathogenesis and prevention of neurologic complications. Clin Nephrol 1996; 46: 149-69.
6. Norenberg MD, Leslie KO, Robertson AS. Association between rise in serum sodium and central pontine myelinolysis. Ann Neurol 1982; 11: 128-35.
7. Lohr JW. Osmotic demyelination syndrome following correction of hyponatremia: association with hypokalemia. Am J Med 1994; 96: 408-13.
8. Menger H, Jorg J. Outcome of central pontine and extrapontine myelinolysis (n = 44). J Neurol 1999; 246: 700-5.
9. Sterns RH, Riggs JE, Schochet SS, Jr. Osmotic demyelination syndrome following correction of hyponatremia. N Engl J Med 1986; 314: 1535-42.
10. Cluitmans FH, Meinders AE. Management of severe hyponatremia: rapid or slow correction? Am J Med 1990; 88: 161-6.
11. Arieff AI. Hyponatremia, convulsions, respiratory arrest, and permanent brain damage after elective surgery in healthy women. N Engl J Med 1986; 314: 1529-35.
12. Adams RD, Victor M, Mancall EL. Central pontine myelinolysis: a hitherto undescribed disease occurring in alcoholic and malnourished patients. AMA Arch Neurol Psychiatry 1959; 81: 154-72.
13. Tomlinson BE, Pierides AM, Bradley WG. Central pontine myelinolysis. Two cases with associated electrolyte disturbance. Q J Med 1976; 45: 373-86.
14. Kleinschmidt-DeMasters BK, Norenberg MD. Rapid correction of hyponatremia causes demyelination: relation to central pontine myelinolysis. Science 1981; 211: 1068-70.
15. Laureno R. Central pontine myelinolysis following rapid correction of hyponatremia. Ann Neurol 1983; 13: 232-42.
16. Ayus JC, Wheeler JM, Arieff AI. Postoperative hyponatremic encephalopathy in menstruant women. Ann Intern Med 1992; 117: 891-7.
17. Sterns RH, Cappuccio JD, Silver SM, Cohen EP. Neurologic sequelae after treatment of severe hyponatremia: a multicenter perspective. J Am Soc Nephrol 1994; 4: 1522-30.
18. Sterns RH, Thomas DJ, Herndon RM. Brain dehydration and neurologic deterioration after rapid correction of hyponatremia. Kidney Int 1989; 35: 69-75.
19. Verbalis JG, Martinez AJ. Neurological and neuropathological sequelae of correction of chronic hyponatremia. Kidney Int 1991; 39: 1274-82.
20. Sterns RH. The treatment of hyponatremia: first, do no harm. Am J Med 1990; 88: 557-60.
21. Melton JE, Patlak CS, Pettigrew KD, Cserr HF. Volume regulatory loss of Na, Cl, and K from rat brain during acute hyponatremia. Am J Physiol 1987; 252(4 Pt 2): F661-9.
22. Videen JS, Michaelis T, Pinto P, Ross BD. Human cerebral osmolytes during chronic hyponatremia. A proton magnetic resonance spectroscopy study. J Clin Invest 1995; 95: 788-93.
23. Verbalis JG, Gullans SR. Hyponatremia causes large sustained reductions in brain content of multiple organic osmolytes in rats. Brain Res 1991; 567: 274-82.
24. Lien YH, Shapiro JI, Chan L. Study of brain electrolytes and organic osmolytes during correction of chronic hyponatremia. Implications for the pathogenesis of central pontine myelinolysis. J Clin Invest 1991; 88: 303-9.
25. McManus ML, Churchwell KB, Strange K. Regulation of cell volume in health and disease. N Engl J Med 1995; 333: 1260-6.
26. Strange K. Regulation of solute and water balance and cell volume in the central nervous system. J Am Soc Nephrol 1992; 3: 12-27.
27. Baker EA, Tian Y, Adler S, Verbalis JG. Blood-brain barrier disruption and complement activation in the brain following rapid correction of chronic hyponatremia. Exp Neurol 2000; 165: 221-30.
28. DeLuca GC, Nagy Z, Esiri MM, Davey P. Evidence for a role for apoptosis in central pontine myelinolysis. Acta Neuropathol 2002; 103: 590-8.
29. Ellis SJ. Severe hyponatraemia: complications and treatment. Q J Med 1995; 88: 905-9.
30. Rosenbloom S, Buchholz D, Kumar AJ, Kaplan RA, Moses H, 3rd, Rosenbaum AE. Evolution of central pontine myelinolysis on CT. AJNR Am J Neuroradiol 1984; 5: 110-2.
31. Thompson AJ, Brown MM, Swash M, Thakkar C, Scholtz C. Autopsy validation of MRI in central pontine myelinolysis. Neuroradiology 1988; 30: 175-7.
32. Chua GC, Sitoh YY, Lim CC, Chua HC, Ng PY. MRI findings in osmotic myelinolysis. Clin Radiol 2002; 57: 800-6.
33. Kumar SR, Mone AP, Gray LC, Troost BT. Central pontine myelinolysis: delayed changes on neuroimaging. J Neuroimaging 2000; 10: 169-72.
34. Ruzek KA, Campeau NG, Miller GM. Early diagnosis of central pontine myelinolysis with diffusion-weighted imaging. AJNR Am J Neuroradiol 2004; 25: 210-3.
35. Arieff AI, Llach F, Massry SG. Neurological manifestations and morbidity of hyponatremia: correlation with brain water and electrolytes. Medicine (Baltimore) 1976; 55: 121-9.
36. Berl T. Treating hyponatremia: damned if we do and damned if we don?t. Kidney Int 1990; 37: 1006-18.
37. Almond CS, Shin AY, Fortescue EB, et al. Hyponatremia among runners in the Boston Marathon. N Engl J Med 2005; 352: 1550-6.
38. Adrogue HJ, Madias NE. Hyponatremia. N Engl J Med 2000; 342: 1581-9.
39. Decaux G, Soupart A. Treatment of symptomatic hyponatremia. Am J Med Sci 2003; 326: 25-30.
40. Decaux G, Unger J, Brimioulle S, Mockel J. Hyponatremia in the syndrome of inappropriate secretion of antidiuretic hormone. Rapid correction with urea, sodium chloride, and water restriction therapy. Jama 1982; 247: 471-4.
41. Van Reeth O, Decaux G. Rapid correction of hyponatraemia with urea may protect against brain damage in rats. Clin Sci (Lond) 1989; 77: 351-5.
42. Soupart A, Stenuit A, Perier O, Decaux G. Limits of brain tolerance to daily increments in serum sodium in chronically hyponatraemic rats treated with hypertonic saline or urea: advantages of urea. Clin Sci (Lond) 1991; 80: 77-84.
43. Trachtman H, Futterweit S, Tonidandel W, Gullans SR. The role of organic osmolytes in the cerebral cell volume regulatory response to acute and chronic renal failure. J Am Soc Nephrol 1993; 3: 1913-9.
44 Soupart A, Silver S, Schrooeder B, Sterns R, Decaux G. Rapid (24-hour) reaccumulation of brain organic osmolytes (particularly myo-inositol) in azotemic rats after correction of chronic hyponatremia. J Am Soc Nephrol 2002;13: 1433-41.
45. Laureno R, Karp BI. Myelinolysis after correction of hyponatremia. Ann Intern Med 1997; 126: 57-62.
46. Oh MS, Kim HJ, Carroll HJ. Recommendations for treatment of symptomatic hyponatremia. Nephron 1995; 70: 143-50.
47. Moritz ML, Ayus JC. The pathophysiology and treatment of hyponatraemic encephalopathy: an update. Nephrol Dial Transplant 2003; 18: 2486-91.
