04. tbl. 94. árg. 2008
Fræðigrein
Lungnakrabbamein - Yfirlitsgrein
Ágrip
Lungnakrabbamein er annað algengasta krabbameinið á Íslandi og það krabbamein sem dregur flesta Íslendinga til dauða. Orsökina má yfirleitt rekja beint til reykinga en erfðaþættir koma einnig við sögu. Einkenni lungnakrabbameins eru oft almenns eðlis. Sjúklingar greinast því oft seint og um 70% þeirra eru með meinvörp við greiningu. Skurðaðgerð í læknandi tilgangi kemur aðeins til greina í um þriðjungi tilfella en annars er beitt krabbameinslyfjum og/eða geislameðferð. Á síðustu árum hafa orðið framfarir í greiningu og meðferð lungnakrabbameins. Nýjungar í myndgreiningu auðvelda rannsóknir og stigun æxlanna og meðferð hefur því orðið markvissari. Margt bendir til þess að skimun með lágskammta tölvusneiðmyndum geti bætt horfur og lækkað dánartíðni. Nýjar tegundir krabbameinslyfja hafa bætt líðan og lengt líf sumra sjúklinga með útbreitt lungnakrabbamein. Þá er í vaxandi mæli farið að gefa krabbameinslyfjameðferð í tengslum við skurðaðgerðir, aðallega til að minnka líkur á því að krabbameinið nái að dreifa sér. Loks hafa nýjungar í skurðlækningum gert kleift að fjarlægja æxli sem áður voru talin óskurðtæk. Í þessari yfirlitsgrein eru helstu nýjungar í greiningu og meðferð lungnakrabbameins reifaðar. Byggt er á nýjustu þekkingu og heimildum en greinin er skrifuð með lækna úr sem flestum sérgreinum í huga.
Faraldsfræði
Lungnakrabbamein er annað algengsta krabbamein hjá báðum kynjum á Íslandi, á eftir blöðruhálskirtilkrabbameinum hjá körlum og brjóstakrabbameinum hjá konum. Hér á landi greinast um það bil 125 manns á ári samkvæmt Krabbameinsskrá Krabbameinsfélags Íslands (1). Alls létust 123 einstaklingar árið 2006 vegna krabbameina í lungum en það eru fleiri en samanlagður fjöldi þeirra sem létust úr brjóstakrabbameini, blöðruhálskirtilkrabbameini og ristilkrabbameini það árið (2).
Hér á landi hefur tíðni lungnakrabbameins aukist hratt meðal karla allt frá frá upphafi skráningar árið 1955, þangað til í kringum 1980 en þá dró úr aukningunni (mynd 1). Aldursstaðlað nýgengi (alþjóðlegur staðall) hækkaði úr 10,9 og fór hæst upp í í 36,6/100.000 íbúa á tímabilinu 1990-1994, en eftir það hefur nýgengi lækkað og er nú 31,3 fyrir hverja 100.000 íbúa (3). Tilsvarandi aldursstaðlað nýgengi meðal kvenna hefur hækkað frá því að skráning hófst úr 5,4 í 33/100.000 íbúa þegar tíðnin var hæst, en hefur lækkað eftir það og er nú 29,4 fyrir hverja 100.000 íbúa (mynd 1). Nýgengi lungnakrabbameins meðal kvenna á Íslandi er með því hæsta í heiminum og aðeins stallsystur þeirra í Bandaríkjunum eru með hærra nýgengi. Ennfremur er kynjahlutfall lungnakrabbameinssjúklinga á Íslandi óvenjulega jafnt (4) og er skýringin talin vera hröð og almenn útbreiðsla reykinga meðal íslenskra kvenna um og upp úr seinni heimsstyrjöld.
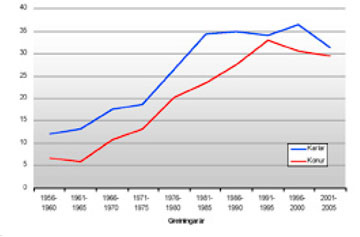
Mynd 1. Árlegt aldursstaðlað nýgengi lungnakrabbameins fyrir bæði kyn á Íslandi (alþjóðlegur aldursstaðall).
Ef tekið er mið af þróun nýgengis lungnakrabbameins og reykingavenjum Íslendinga mun nýgengi lungnakrabbameins halda áfram að lækka hjá bæði körlum og konum, en búist er við að lækkunin hjá konum verði áfram hægari. Því getur farið svo að lungnakrabbamein verði algengara meðal kvenna en karla í framtíðinni.
Áhættuþættir
Reykingar eru veigamesta orsök lungnakrabbameins og eru taldar valda um 90% tilfella. Tengslin eru sterkust við flöguþekjukrabbamein og smáfrumukrabbamein, en heldur veikari fyrir kirtilmyndandi krabbamein þar sem 80-85% eru talin af völdum reykinga (5, 6). Í íslenskri rannsókn á 105 sjúklingum höfðu 93% reykt að meðaltali 20 sígarettur á dag en 7% höfðu aldrei reykt (7). Reykmengun í umhverfi (óbeinar reykingar) eykur áhættu á lungnakrabbameini hjá reyklausum (8) og hafa meiri áhrif á börn og unglinga en fullorðna (9). Ýmis eiturefni í umhverfi og á vinnustað geta einnig aukið áhættuna verulega, svo sem asbest, radon og fleiri slík efni.
Með reykbindindi minnkar áhætta á lungna-krabbameini í 15 ár eftir að reykingum er hætt úr allt að þrítugfaldri áhættu í um tvöfalda áhættu (10, 11). Vegna mikils fjölda fyrrverandi reykingamanna eru álíka mörg tilfelli lungnakrabbameins nú greind meðal fyrrverandi reykingamanna og þeirra sem enn reykja (12). Svo virðist sem hátt hlutfall grænmetis og ávaxta í fæðu geti lækkað áhættu á lungnakrabbameini (13), en það hefur þó ekki verið sannað í framvirkum samanburðarrannsóknum (14).
Þó svo að um 90% lungnakrabbameins sé af völdum reykinga fá aðeins um 16% reykingamanna lungnakrabbamein (11) sem bendir til þess að einstaklingar séu misnæmir fyrir krabbameinsvaldandi áhrifum tóbaksreyks. Þeir reykingamenn sem fá teppusjúkdóm hafa margfalt hærri tíðni lungnakrabbameins og virðist hættan aukast í réttu hlutfalli við loftvegateppu (15, 16). Því hefur verið sett fram sú kenning að sameiginlegur undirliggjandi áhættuþáttur sé til staðar, líklega byggður á arfgengi (17, 18).
Nýleg rannsókn á Íslandi sem byggð var á gögnum úr krabbameinsskrá KÍ og ættfræðigrunni Íslenskrar erfðagreiningar hefur staðfest meira en tvöfalda áhættu hjá nákomnum ættingjum lungnakrabbameinssjúklinga. Einnig sást marktækt aukin áhætta hjá fjarskyldari ættingjum sem ýtir stoðum undir erfðaþátt, enda sameiginleg umhverfisáhrif síður til staðar hjá þeim, en nákomnum ættingjum (19). Í nýlegri rannsókn á 52 bandarískum fjölskyldum fannst í fyrsta sinn svæði í erfðamengi manna, á litningi 6q23-25, sem hafði marktæka fylgni við krabbamein í lungum og efri loftvegum (20). Óhætt er að fullyrða að framfarir í erfðarannsóknum hafi opnað nýjar leiðir til þess að rannsaka áhættuþætti krabbameina og annarra algengra sjúkdóma. Mikilvægir þættir við mat á áhættu eru reykingasaga, teppa við öndunarmælingu og fjölskyldusaga og gætu þeir aðstoðað við val sjúklinga vegna skimunar og virkrar reykbindindismeðferðar.
Einkenni
Yfir 90% sjúklinga sem greinast með lungnakrabbamein hafa einkenni sjúkdómsins við greiningu (21). Aðeins 5-10% sjúklinga greinast fyrir tilviljun vegna myndrannsókna á brjóstholi (22). Einkenni vegna lungnakrabbameina má rekja til frumæxlis, dreifingar innan brjósthols, fjarmeinvarpa eða hjáeinkenna æxlis (paraneoplastic syndromes). Helstu einkenni eru sýnd í töflu I. Flestir sjúklingar með lungnakrabbamein hafa fleiri en eitt einkenni við greiningu, bæði einkenni frá öndunarvegum og almenn einkenni.

Hósti er algengasta fyrsta einkenni lungnakrabbameins (23, 24). Andnauð, brjóstverkur og blóðhósti koma næst í röðinni hvað algengi varðar (25). Blóðhóstinn er yfirleitt vægur, brjóstverkur kemur fyrir hjá allt að helmingi sjúklinga og þyngdartap hjá allt að 68% sjúklinga (22). Önghljóð verða þegar æxli þrengja meginberkjur en æxli sem þrengir marktækt að barka getur valdið soghljóði (stridor). Hæsi stafar hins vegar yfirleitt af þrýstingi á raddbandataugar, oftar vinstra megin vegna legu n. laryngeus recurrens þar. Þegar æxli í lungum þrýstir á efri holæð getur myndast holæðar heilkenni (superior vena cava syndrome) og sést það oftast hjá sjúklingum með smáfrumukrabbamein (22). Pancoast heilkenni stafar af ífarandi vexti úr lungnatoppi í rif og nálægar taugar (plexus brachialis), Horners heilkenni stafar hins vegar af ífarandi vexti í nálægt taugahnoð (ganglion stellatum) (26). Einkenni vegna fjarmeinvarpa eru fyrsta einkenni um lungnakrabbamein hjá um einum þriðja sjúklinga (22, 23). Eitlastækkanir á hálsi koma fyrir hjá 15-30% sjúklinga og verkir í beinum vegna beinmeinvarpa koma fyrir hjá allt að fimmtungi sjúklinga við greiningu (23). Meinvörp í nýrnahettum eru til staðar hjá 15% sjúklinga við greiningu og í heila hjá 10% (23). Síðarnefndu meinvörpin valda höfuðverk en einnig geta sést flog, taugaeinkenni og persónuleikabreytingar. Lifrarmeinvörp geta valdið verkjum, gulu og jafnvel lifrarbilun.
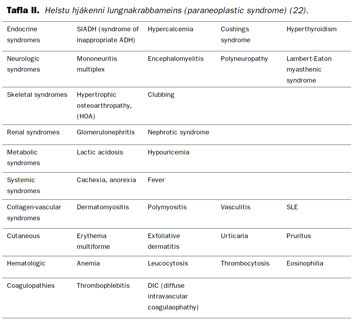
Hjákenni krabbameins (paraneoplastic syndrome) er safnheiti yfir ýmis heilkenni sem hægt er að rekja til krabbameina en tengjast ekki staðsetningu æxlis eða meinvörpum. Þau geta verið fyrsta einkenni lungnakrabbameins en eru oft fylgifiskar útbreidds sjúkdóms. Hjákenni lungnakrabbameins koma fyrir hjá um 10-20% sjúklinga (23) og eru þau helstu sýnd í töflu II. Algengast eru hormónatengd einkenni, hækkun á kalsíum í sermi, offramleiðsla þvagstemmuvaka (syndrome of inappropriate ADH, SIADH), og Cushings heilkenni. Klumbufingur (clubbing) (mynd 2) koma fyrir hjá allt að 30% sjúklinga, eru algengari hjá konum (40%) en körlum (19%) og hjá sjúklingum með lungnakrabbamein sem er ekki smáfrumukrabbamein (27).
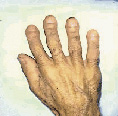
Mynd 2. Klumbufingur (ör) hjá karlmanni með smáfrumukrabbamein í lunga.

Af öðrum hjákennum má nefna beinliðkvilla (hypertrophic osteoarthropathy, HOA) en þá fá sjúklingar verki í liði og nýmyndun beins á sér stað á útlimabeinum. Taugaeinkenni eru margvísleg og koma nær eingöngu fyrir hjá sjúklingum með smáfrumukrabbamein (22).
Meinafræði
Illkynja lungnaæxli skiptast í fjóra meginflokka skilgreinda við smásjárskoðun, nánar tiltekið smáfrumukrabbamein (small cell carcinoma, SCLC), flöguþekjukrabbamein (squamous cell carcinoma, SCC), kirtilmyndandi krabbamein (adenocarcinoma, AC) og stórfrumukrabbamein (large cell carcinoma, LCC) (28). Að minnsta kosti 95% allra illkynja lungnaæxla falla í einhvern þessara fjögurra flokka (29). Önnur sjaldgæfari lungnakrabbamein eru sýnd í töflu III, þeirra á meðal krabbalíki (carcinoid) og bronchioloalveolar lungnakrabbamein sem eru undirflokkur kirtilmyndandi krabbameina. Smáfrumukrabbamein sem eru 13-20% lungnakrabbameins (30) skera sig frá hinum flokkunum, sem þannig eru oft nefnd með safnheitinu lungnakrabbamein sem ekki eru smáfrumukrabbamein (non-small cell carcinoma, NSCLC). Ástæða skiptingarinnar er rakin til þeirrar staðreyndar að smáfrumukrabbamein hefur aðra lífhegðan og horfur en hinir flokkarnir þrír og er oftast útbreitt við fyrstu greiningu (31). Smáfrumukrabbamein (mynd 3a) er skilgreint sem æxli án smásærrar mynsturmyndunar. Flatarmál æxlisfrumna er um það bil tvöfalt meira en flatarmál eitilfrumna, æxlisfrumur eru umfrymissnauðar, kjarnakorn þeirra eru lítt áberandi og frumudeilingar margar. Smásæ greiningarskilmerki flöguþekjukrabbameins (mynd 3b) eru millifrumubrýr og/eða hornefnismyndun, síðartalið innan fruma eða milli þeirra. Greiningarskilmerki kirtilmyndandi krabbameins (mynd 3c) er kirtilmyndun og/eða slímmyndun, síðartalið innan fruma eða utan. Stórfrumukrabbamein (mynd 3d) er að nokkru leyti afgangsstærð, það er æxli af ekki-smáfrumugerð sem ekki uppfylla smásæ skilmerki flöguþekju- eða kirtilkrabbameins.
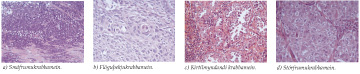
Mynd 3. Fjórar helstu vefjagerðir lungnakrabbameins. a) Smáfrumukrabbamein. Þéttar breiður smárra æxlisfrumna vaxa án mynsturs. Kjarnalitarefni er þétt, einsleitt og kjarnakorn sjást naumast eða ekki. b) Flöguþekjukrabbamein. Æxlisfrumur mynda hornefni og tengjast millifrumubrúm. c) Kirtilmyndandi krabbamein. Stórar æxlisfrumur með áberandi kjarnakorn mynda kirtilholrými. d) Stórfrumukrabbamein. Stórar æxlisfrumur vaxa í breiðum án sérhæfingar í átt til flögu- eða kirtilþekju.
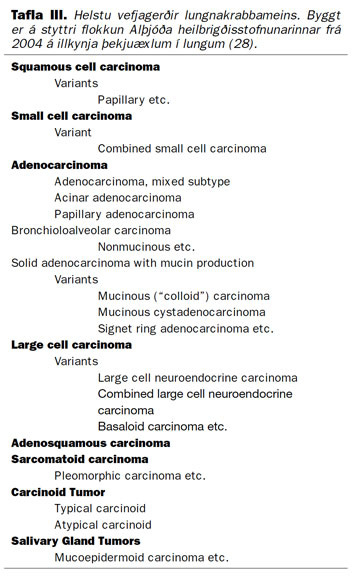
Á Vesturlöndum hefur orðið umtalsverð breyting á innbyrðis hlutföllum æxlisflokkanna fjögurra frá því í lok áttunda áratugs 20. aldar. Þannig hefur fjöldi kirtilmyndandi krabbameins hér á landi aukist að því marki að það er nú algengasta vefjagerðin meðal kvenna (47%) og karla (37%). Hlutfall flöguþekjukrabbameins (karlar 32%, konur 25%), og þó sérstaklega smáfrumu-krabbameins (karlar 18%, konur 14%), hefur að sama skapi lækkað á þessu tímabili (30). Þessi innbyrðis hliðrun hefur einnig orðið hér á landi (3). Þótt ósannað sé með öllu hefur skýringa verið leitað í breyttum reykingavenjum, til dæmis dýpri innöndun með tilkomu síuvindlinga og breyttu innihaldi þessarar vindlingategundar með tilliti til krabbameinsvaldandi efna, sérlega nitrósamína (32). Að auki hefur lengi hefur verið vitað að orsakatengsl reykinga eru sterkust við smáfrumukrabbamein en veikust við kirtilmyndandi krabba-mein, og má vænta þess að fjöldi kirtilmyndandi krabbameins vaxi miðað við smáfrumukrabbamein þegar heildarnýgengi lungnakrabbameins fer lækkandi.
Myndgreining
Þegar grunur vaknar um lungnakrabbamein á lungnamynd er ástæða til nánari skoðunar með tölvusneiðmyndarannsókn (TS), bæði til greiningar og stigunar. Oftast sést afmörkuð staðbundin þétting á lungnamynd (mynd 4), en einnig getur æxlið valdið lokun á berkjugreinum með samfalli eða þéttingu á aðlægum hluta lunga. Lungnabólga sem erfiðlega gengur að meðhöndla eða íferðir sem ekki vilja hverfa ættu því að vekja grun um lungnakrabbamein.
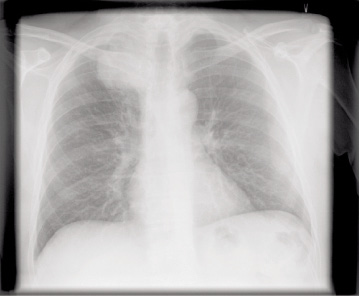
Mynd 4. Lungnamynd sem sýnir þéttingu efst í hægra lunga sem reyndist eftir sýnatöku vera lungnakrabbamein.
Hluti lungnakrabbameins (5-10%) greinist við myndrannsóknir hjá einkennalausum sjúklingum (22) og er þá oftast um stakan hnút að ræða. Útlit hnúta á TS getur gefið vísbendingu um hvers eðlis þeir eru, til dæmis benda óreglulegar og tenntar brúnir til lungnakrabbameins og þeir sem eru stærri en 10 mm í þvermál (mynd 5).
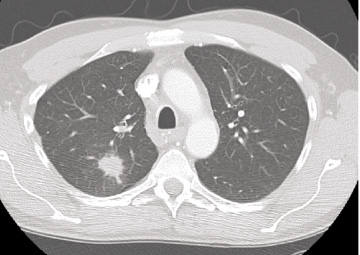
Mynd 5. Tölvuneiðmyndir af hægra lunga sem sýnir fyrirferð með óreglulegar og tenntar brúnir sem við sýnatöku reyndist lungnakrabbamein.
Óbreytt stærð í tvö ár er talið merki um að hnúturinn sé góðkynja (33) og kalkanir benda sömuleiðis frekar til góðkynja hnúta þótt á þessu séu undantekningar. Stakir hnútar geta verið meinvörp frá illkynja æxlum annars staðar (33). Jáeindaskann (JS) (positron emisson tomography, PET) og jáeindasneiðmyndir (JSS)(PET/CT) eru gagnlegar rannsóknir til þess að meta hvort stakur hnútur sé ill- eða góðkynja og er oftast notast við merkiefni sem inniheldur 18F-fluorodeoxyglucose (sjá mynd 6). JS er ekki áreiðanlegt til að meta hnúta undir 1 cm á stærð, en fyrir stærri hnúta er rannsóknin áreiðanleg (34). Nokkuð er um falskt jákvæða hnúta á JS en yfirleitt er talið óhætt að fylgja eftir hnútum sem ekki lýsa upp við þessa rannsókn. Næmi rannsóknarinnar til að greina ?illkynja hnúta er samkvæmt nýlegum rannsókn-um 90-100% og sértækni 69-95% (34).
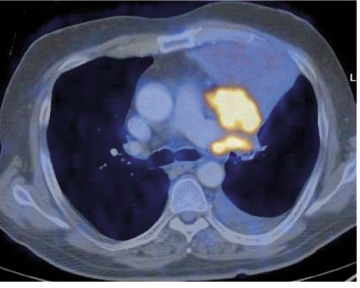
Mynd 6. Jáeindasneiðmynd af sjúklingi sem var með samfall efst í vinstra lunga á lungnamynd. Skannið sýnir greinilega að orsök samfallsins er æxli miðlægt í efra blaði vinstra lungans.
Þegar grunur vaknar um lungnakrabbamein er nauðsynlegt að staðfesta greininguna með frumu- og/eða vefjasýni. Yfirleitt er reynt að fá vefjasýni með berkjuspeglun, sérstaklega ef um miðlæg æxli er að ræða. Þegar æxli er staðsett utar í lunganu er hægt að gera ástungu í gegnum húð og er hún gerð með aðstoð myndgreiningarrannsókna, oftast TS. Helstu fylgikvillar eru loftbrjóst, eða í um 13-40% tilvika (35, 36), en flest þessara loftbrjósta eru lítil og þarfnast engrar sértækrar meðferðar, svo sem brjóstholskera (35). Alvarlegar blæðingar eru ?einnig sjaldgæfar. Hjá sjúklingum með fjarmeinvörp er stundum hentugast að fá vefjasýni frá meinvarpi og staðfesta þannig greiningu.
Skimun
Árangur af meðferð lungnakrabbameins er ennþá takmarkaður og eru fimm ára lífshorfur aðeins um 15% með bestu greiningar- og meðferðarúrræðum (37). Ástæðan er sú að um 70% tilfella greinast eftir að sjúkdómurinn er orðinn útbreiddur og því ekki unnt að beita læknandi skurðaðgerð. Þótt æxli greinist á skurðtæku stigi fá allt að 60% þessara sjúklinga meinvörp síðar og eru fimm ára lífshorfur þessa hóps um 40% (38). Þetta þýðir að meinvörp hafa verið til staðar í byrjun við greiningu frumæxlisins. Í áratugi hefur verið talið að bættur árangur í meðferð lungnakrabbameins væri fólginn í greiningu meinsins á byrjunarstigi (39). Rannsóknir á áhættuhópum sem gerðar voru með lungnamyndum og frumurannsóknum á hráka sýndu þó ekki fram á lægri dánartíðni borið saman við hefðbundið eftirlit (40, 41). Frumurannsókn á hráka er því ekki talin gagnleg rannsókn til að greina lungnakrabbamein (42).
Með tilkomu tölvusneiðmynda er unnt að finna mun smærri hnúta í lungum en hægt var með lungnamynd. Fyrstu stóru skimunarrannsóknirnar voru gerðar í Japan og sýndu að með lágskammta TS var unnt að greina 80% hnúta á stigi I samanborið við 20% án skimunar (43), en á því stigi eru langbestar líkur á lækningu með skurðaðgerð. Í kjölfarið fylgdu stórar rannsóknir bæði í Bandaríkjunum og Evrópu en nýlega voru birtar niðurstöður úr einni þeirra (44). Í þessari rannsókn var einkennalaus áhættuhópur skimaður með lágskammta tölvusneiðmyndum og grunsamlegir hnútar rannsakaðir frekar, meðal annars með endurteknum sneiðmyndum, fínnálarástungum og JS. Af 31.567 einstaklingum sem skimaðir voru fannst lungnakrabbamein hjá 484, eða 1,5%. Af þessum hópi voru 412 með sjúkdóm á stigi I, eða 85%, og voru 10 ára lífshorfur þeirra sem fóru í skurðaðgerð 92% en heildar 10 ára lífshorfur þeirra sem greindust með lungnakrabbamein í skimunarhópnum voru 80% (44).
Bandaríska krabbameinsstofnunin og fleiri alþjóðasamtök hafa enn ekki mælt með skimun þótt sterkar vísbendingar séu um gagnsemi hennar (45). Þar ræður sennilega mestu reynsla af eldri rannsóknum en þær sýndu aukinn fjölda tilfella á lægri stigum án þess að dánartíðni eða að hlutfall sjúklinga með meinvörp lækkaði (40, 41). Slembirannsóknir eru hins vegar hafnar bæði vestanhafs og austan og niðurstaðna að vænta á næstu árum.
Stigun
Stigun lungnakrabbameins ræðst af vefjagerð. Við smáfrumukrabbamein er um tvö stig að ræða, takmarkaðan (limited disease) og útbreiddan sjúkdóm (extensive disease) (31). Í takmörkuðum sjúkdómi er krabbameinið bundið við lungað og brjósthol æxlismegin, auk miðmætiseitla og eitla ofan við viðbein er fellur í eitt geislasvæði. Útbreiddur sjúkdómur er þó mun algengari en þar eru fjarmeinvörp oftast til staðar, til dæmis í beinmerg, lifur, heila og lungum (46). Stigun er mikilvægasti forspárþáttur lífshorfa hjá þessum sjúklingum, en almennt líkamlegt ástand sjúklings og aðrir þættir eins og hækkun á LDH í sermi hafa þar einnig áhrif (47). Einnig hafa rannsóknir sýnt að konur svari betur meðferð en karlar og hafi því betri lífshorfur (48).
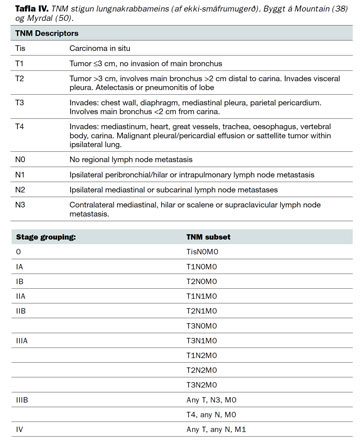
Lungnakrabbamein af ekki-smáfrumugerð er stigað samkvæmt TNM-stigunarkerfi Alþjóða heilbrigðisstofnunarinnar (38). Lagt er mat á stærð (T) æxlisins, útbreiðslu þess í eitla (N) og önnur líffæri (M). Í töflu IV eru sýndir fjórir stigunarflokkar TNM-kerfisins. Þessar upplýsingar eru síðan notaðar til að spá fyrir um horfur sjúklinga og ákvarða meðferð. Stigun er jafnframt sterkasti forspárþáttur lífshorfa fyrir þessa sjúklinga (49).
Tafla V sýnir fimm ára lífshorfur eftir TNM-stigum (38, 49). Aðrir mikilvægir forspárþættir eru stærð æxlisins (38, 51, 52), frumugerð (53), innvöxtur í æðar og sogæðar (54), en einnig aldur og ýmis klínísk atriði, svo sem almennt ástand sjúklings, þyngdartap og starfsgeta (55).
Rannsóknir til greiningar og stigunar
Nákvæm greining er nauðsynleg til þess að unnt sé að taka ákvörðun um viðeigandi meðferð. Greiningar-stigunarrannsóknir eru fjölmargar og eru þær helstu sýndar í flæðiriti á mynd 7.
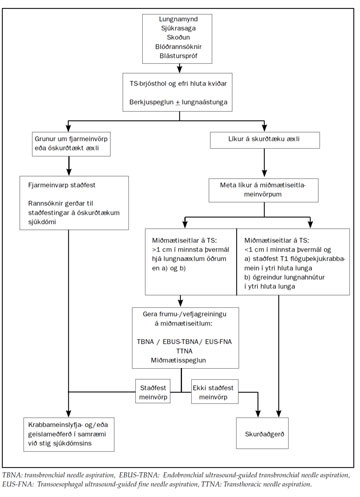
Mynd 7. Flæðirit yfir uppvinnslu sjúklinga með lungnakrabbamein (án jáeindaskanna).
Þessum rannsóknum má skipta í tvennt, myndrannsóknir (sjá áður) og rannsóknir til vefja- og/eða frumugreiningar en þær krefjast yfirleitt inngrips. TS af brjóstholi og efri hluta kviðar er grunnrannsókn stigunar og er oft gerð um leið og rannsókn sem framkvæmd er til þess að staðfesta að æxli sé til staðar. Næmi TS við mat á ífarandi vexti í miðmæti er talið 40-84% og sértækni 57-94% (56). Í völdum tilvikum getur segulómum einnig verið hjálpleg til að meta frekar ífarandi vöxt í miðmæti og frá lungnatoppum (Pancoast æxli) (mynd 8) (57).
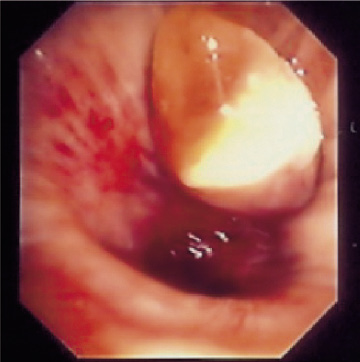
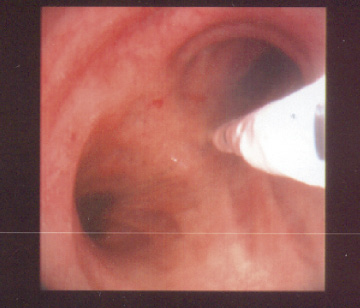
Mynd 9. Mynd tekin við berkjuspeglun sem sýnir lungnakrabbamein í vinstri meginberkju.
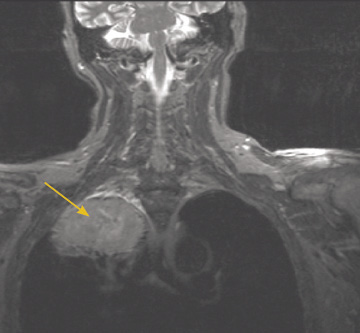
Mynd 8. Segulómun af brjóstholi sem sýnir Pancoast æxli (ör) í hægra lunga.
Berkjuspeglun er mikilvæg rannsókn, bæði til greiningar og stigunar (mynd 9). Oftast eru tekin vefjasýni beint úr æxlinu eða frumusýni með bursta- og/eða skoli, sérstaklega við miðlæg æxli en þá er næmi berkjuspeglunar til greiningar allt að 88%, en aðeins 33% ef æxlin eru lítil (<2 cm) og utar í lunganu (58). Hjá síðarnefnda hópnum finnast þó breytingar í berkjuslímhúð í allt að 10% tilfella (59). Því er mælt með að gera berkju-speglun á flestum sjúklingum sem greinast með lungnakrabbamein, óháð staðsetningu æxlisins.
Þegar æxli liggja utan stærri berkjugreina getur verið erfitt að komast að þeim með hefðbundinni berkjuspeglun. Kemur þá til greina að stinga nál í gegnum berkjuna (transbronchial needle aspiration, TBNA) (mynd 10) þar sem staðsetning fyrirferðar er áætluð með hjálp tölvusneiðmynda (60). Nýlega er farið að notast við segulmiðun (electromagnetic navigation) (61), útfjólublátt ljós (ultraviolet light) eða ómtækni (62) til að auka greiningarhæfni þessara rannsóknar (61, 62).
Mynd 10. Nálarstunga á miðmætiseitli í gegnum berkju við berkjuspeglun (transbronchial needle aspiration).
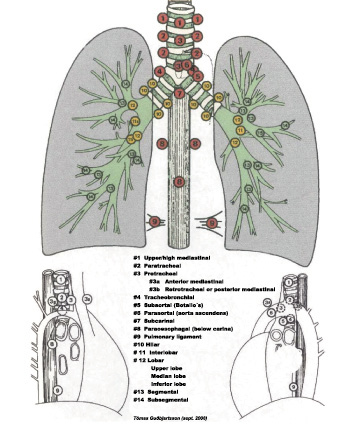
Mynd 11. Kort af helstu eitilsvæðum í miðmæti, byggt á Naruke (63).
Rannsóknir á útbreiðslu sjúkdómsins í miðmæt-iseitla eru sérlega mikilvægar og frekari meðferð er undir niðurstöðum þessara rannsókna komin. Eitilstöðvum í miðmæti er skipt upp í svæði og þær númeraðar til hægðarauka (mynd 11).
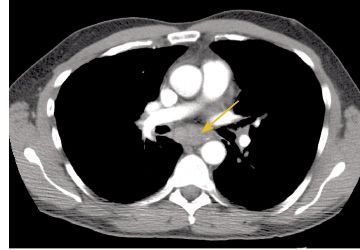
Mynd 12. TS af brjóstholi sem sýnir stækkaða eitla í miðmæti (ör) sem við miðmætisspeglun reyndust vera meinvörp frá lungnakrabbameini í vinstra lunga.
Með TS eru eitlar í miðmæti og stærð þeirra metin (mynd 12). Hefðbundið viðmið er að líta á eitla sem eru minni en 1 cm í þvermál sem góðkynja (64). Litlir eitlar geta þó borið í sér smásæ meinvörp í allt að 20% tilfella (65) og sömuleiðis getur stækkun stafað af bólgubreytingum. Nákvæmni þessa stærðarmats er því lítil og í nýlegri samantekt á fjölda rannsókna var næmi TS einungis 57% og sértæki 82% (66). Á síðustu árum hefur fjöldi rannsókna staðfest betra næmi og sértæki JS samanborið við TS. Næmi JS er yfirleitt á bilinu 79-85% og sértækni 89-92% (67). Er talið að JS geti fækkað óþarfa skurðaðgerðum um allt að fimmtung (68). Þótt neikvætt forspárgildi JS sé mjög hátt verður að telja ólíklegt að JS/JSS tæknin komi algjörlega í stað miðmætisspeglunar (67).
Nálarstunga í gegnum berkju hefur reynst örugg aðferð til að ná vefjasýni úr miðmætiseitlum, sérstaklega eitlum sem liggja nálægt stærri loftvegum. Í nýlegri rannsókn reyndist næmi þessarar rannsóknar til greiningar á miðmætismeinvörpum vera 79% (66). Sýnataka með aðstoð ómunar við vélinda- og berkjuspeglun (esophageal ultrasound, EUS, endobronchial ultrasound, EBUS) er nýleg aðferð þar sem tekin eru sýni úr miðmætiseitlum með nál sem stungið er í gegnum vélinda eða berkju með aðstoð ómstýringar. Ástunga í gegnum vélinda kemur sérstaklega til greina við eitlastækkanir í neðri hluta miðmætis (eitlastöðvar 8 og 9) sem ekki er hægt að ná til með berkju- eða miðmæt-isspeglun (69). Sértækni ómstýrðu berkju- og vélindarannsóknanna er allt að 100%, næmi á bilinu 88-92%(69, 70) og tíðni fylgikvilla lág (71). Þessar ástungur eru einfaldar í framkvæmd og eru því kjöraðferð til að staðfesta útbreiddan sjúkdóm í miðmætiseitlum. Þar sem neikvætt forspárgildi þeirra er lágt er oft þörf á frekari rannsóknum, til dæmis miðmætisspeglun.
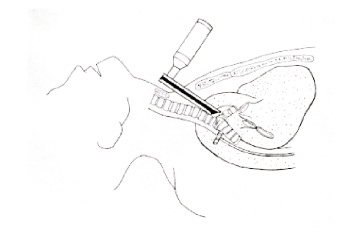
Mynd 13. Miðmætisspeglun.
Nákvæmasta stigun á eitlum í miðmæti er miðmætisspeglun (mynd 13), þar sem tekin eru sýni úr bæði N2-eitlum (sömu megin í miðmætinu og æxlið), og N3-eitlum (gagnstæðu megin) (sjá mynd 11). Hægt er að ná til eftirfarandi svæða við miðmætisspeglun; mót barka og hæ./vi. meginberkju (svæði 4), hliðlægt við og framan barka (svæði 2 og 3) og undir barkarkili (subcarinalt, svæði 7). Hins vegar næst ekki í lungnaeitla (svæði 10 og 11) né heldur eitla á mótum ósæðar og lungnaslagæðar (svæði 5). Ef eitlar á svæði 5 eru stækkaðir á TS, kemur til greina að taka úr þeim sýni með brjóstholsspeglun (72). Eitlar á svæði 4, gagnstæðu megin við æxlið (N3 eitlar), hafa þó mesta þýðingu við miðmætisspeglun, því reynist þeir jákvæðir er um stig IIIB að ræða. Í slík- um tilvikum eru horfur lakar og ekki mælt með skurðaðgerð (73, 74).
Næmi miðmætisspeglunar í greiningu eitilmeinvarpa er 90% og sértæki 100% (75, 76), en það er umtalsvert hærra en aðrar stigunarrannsóknir, þar með taldar TS, segulómun, JS/JSS og vélinda/berkju-fínnálarástunga (EBUS/EUS) (64, 75). Þannig hafa rannsóknir sýnt að smásæ eitilmeinvörp geta verið til staðar hjá 5-20% sjúklinga með miðmætiseitla undir 1 cm á TS (64, 65). Færa má rök fyrir því að miðmætisspeglun eigi að framkvæma í nánast öllum tilfellum lungnakrabbameins þegar ekki er hægt að notast við JS við stigunina (64, 75).
Miðmætisspeglun er hægt að framkvæma í sömu aðgerð/svæfingu og þegar æxlið í lunganu er fjarlægt. Eitilsýni eru þá send í frystiskurð og svar fæst oftast innan hálftíma. Reynist eitlar innihalda meinvörp er yfirleitt horfið frá frekari aðgerð. Helstu fylgikvillar miðmætisspeglunar eru blæðingar (2-4%), sýkingar (<1%) og skaði á vinstri raddbandataug (<2%) (77). Dánartíðni er þó lág við miðmætisspeglun, eða undir 0,1% (77).
Leit að meinvörpum er mikilvægur hluti af stigun. TS rannsókn af heila er gerð ef einkenni benda til slíkra meinvarpa og hjá sjúklingum á stigi IIIA og IIIB (78). Fyrir utan bein eru lifur og nýrnahettur (mynd 14) líklegustu staðir fyrir meinvörp. Fyrirferðir í nýrnahettum eru algeng-ar (10-20% sjúklinga) og eru þetta oft góðkynja fyrirferðir (78). Nánari skoðun á stækkuðum ?nýrnahettum er því stundum nauðsynleg og geta TS og segulómun oft sagt til um hvort um góð-kynja fyrirferð sé að ræða. Nýlega hefur verið sýnt fram á gagnsemi JS við leit að fjarmeinvörpum (79). Sértæki og nákvæmni JS við mat á meinvörpum í beinum er talið betra en við beinaskann, en næmi er sennilega heldur síðra (80). Beinaskann er þó kjörrannsókn þar sem JS er ekki fyrir hendi (78). Brjóstholsspeglun getur komið til greina þar sem sterkur grunur leikur á meinvörpum í fleiðru, til dæmis ef smásjárskoðun á fleiðruvökva er neikvæð og æxli ekki sjáanleg á TS (78).
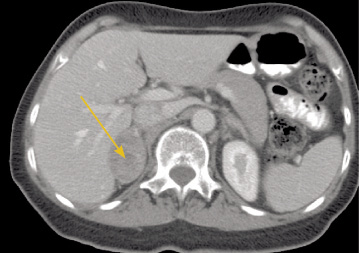
Mynd 14. Tölvusneiðmynd af kvið sem sýnir meinvarp í hægri nýrnahettu (ör).
Skurðmeðferð
Skurðaðgerð er helsta meðferðin til lækninga á lungnakrabbameinum og á einungis við þegar fjarmeinvörp eru ekki til staðar, það er hjá sjúklingum á stigi I og II og í völdum tilvikum á stigi IIIA (81, 82). Talið er að aðeins 10-15% allra sjúklinga með lungnakrabbamein læknist með skurðaðgerð (83) en meirihluti sjúklinga er ekki rannsakaður með tilliti til skurðaðgerðar vegna fjarmeinvarpa eða ífarandi vaxtar í miðmæti (T4-æxli). Í Evrópu hefur hlutfall sjúklinga með lungnakrabbamein sem gengst undir skurðaðgerð verið í kringum 10-20% (84). Á síðustu árum hefur þetta hlutfall hækkað og nálgast óðum 25-30%, líkt og þekkist í Bandaríkjunum (85).
Hefðbundin skurðaðgerð við lungnakrabbameini er blaðnám þar sem lungnalappinn er fjarlægður í heild sinni ásamt eitlum í kring (82). Í sömu aðgerð er reynt að fjarlægja eða taka sýni úr miðmætiseitlum, það er miðmætiseitlum sömu megin og lungnaæxlið (eitilsvæði 4, 10, 11 og stundum 5, 7 og 9) (86, 87). Þetta er gert til stigunar og eykur óverulega fylgikvilla við aðgerð (87).
Fleygskurður (wedge resection) og geiraskurður (segmentectomy) eru síðri kostir en blaðnám við lungnakrabbameini (81, 82). Ástæðan er þrefalt hærri tíðni endurtekins krabbameins eftir fyrrnefndu aðgerðirnar (88). Skýringuna á þessu er sennilega að finna í eitlum miðsvæðis í lungnalappanum (N1-eitlar) en þeir eru fjarlægðir við blaðnám og geta í allt að 15% tilfella innihaldið meinvörp (75, 82). Fleygskurður kemur hins vegar til greina hjá sjúklingum sem ekki þola blaðnám, til dæmis ef lungnastarfsemi er verulega skert (82). Þegar æxlin eru staðsett miðsvæðis í lunganu eða æxlið teygir sig á milli blaða getur þurft að fjarlægja allt lungað, eða hjá 10-15% sjúklinga (89). Lungnabrottnám (pulmectomy) er stór aðgerð og sjúklingar eru lengur að jafna sig en eftir blaðnám (89). Samanborið við blaðnám eru fylgikvillar fátíðari eftir fleygskurð og um það bil helmingi algengari eftir lungnabrottnám (89, 90). Sama á við um skurðdauða (dánir <30 daga frá aðgerð) sem er yfirleitt á bilinu 1,2-4% eftir blaðnám og 3,2-12% eftir lungnabrottnám (90). Erma-blaðnám (sleeve-lobectomy) er í völdum tilvikum hægt að framkvæma við miðlæg æxli í efri blöðum lungna og komast þannig hjá lungnabrottnámi (91). Þá er auk hefðbundins blaðnáms fjarlægður bútur úr meginberkju og berkjuendarnir saumaðir saman.
Fleygskurð, blað- og jafnvel lungnabrottnám er hægt að framkvæma með brjóstholssjá (video-assisted thoracic surgery, VATS) (92). Fjöldi rannsókna hefur sýnt minni skurði/ör og sjúklingar eru fljótari að jafna sig en eftir hefðbundna opna aðgerð (82, 92, 93). Þessar rannsóknir eru þó fæstar slembaðar og val á sjúklingum sennilega skekkt (selection bias) (94). Einnig þykja brjóstholssjáraðgerðirnar tæknilega flóknar, þær eru töluvert dýrari en opin aðgerð og sýnataka úr miðmæt-iseitlum síðri en við opna aðgerð (94). Opin aðgerð stendur því enn fyrir sínu (82).
Þegar lungnakrabbamein er vaxið í brjóstvegg er hægt að fjarlægja í sömu aðgerð, æxlið í lunganu og hluta af brjóstveggnum, helst í einu lagi (mynd 15). Þetta á einnig við um æxli sem vaxin eru út í þind eða gollurshús (mynd 16). Gatið í brjóstveggnum er þá þakið að innanverðu með bót úr gerviefni, oftast Goretex®. Stundum er beitt geislameðferð fyrir eða eftir aðgerð, þó ekki hafi tekist að sýna fram á að slík meðferð bæti lífshorfur sjúklinganna (95). Ef tekst að fjarlægja allt æxlið og eitlar eru án meinvarpa eru fimm ára lífshorfur á bilinu 18-61% (95-97). Sjúklingar með skurðtæk Pancoast-æxli fá yfirleitt bæði geisla- og krabbameinslyfjameðferð fyrir aðgerð, enda sannað að slíkt bæti lífshorfur þeirra (95).
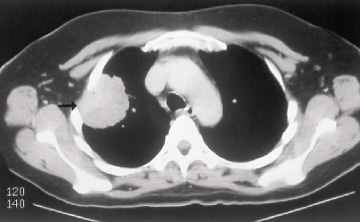
Mynd 15. Tölvusneiðmynd af brjóstholi sjúklings með lungnakrabbamein af flöguþekjugerð sem vaxið er út í hægri hluta brjóstveggjar (T3-æxli). Með skurðaðgerð var fjarlægður hluti af brjóstveggnum auk efri lungnalappa.
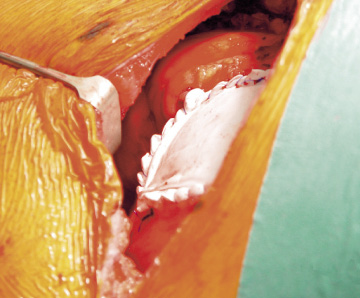
Mynd 16. Gati í þind lokað með Goretex®-bót. Um var að ræða lungnakrabbamein sem óx inn í þindina og þurfti því að fjarlægja hluta af þindinni. Sams konar bót má nota til að loka götum í gollurshúsi og brjóstvegg.
Ef lungnakrabbamein er vaxið inn í miðmæti (T4-æxli) getur í einstaka tilfellum komið til greina að fjarlægja æxlin með skurðaðgerð (95). Er þá yfirleitt gefin geisla- og krabbameinslyfjameðferð fyrir aðgerð. Með þessu er hægt að minnka æxlin, jafnvel æxli sem fyrir meðferðina voru talin óskurðtæk (down-staging) (mynd 17). Ekki er þó mælt með skurðaðgerð hjá þessum sjúklingum ef meinvörp eru til staðar í N2- miðmætiseitlum (95). Reynist miðmætiseitlar hins vegar án meinvarpa eru fimm ára lífshorfur eftir skurðaðgerð í kringum 25-30% (95).

Mynd 17 a, b. Tölvusneiðmyndir 64 ára karlmanns með flöguþekjukrabbamein (ör) sem vaxið var inn í miðmæti (T4 æxli) (mynd 17a). Fyrst var gerð miðmætisspeglun sem var eðlileg. Í kjölfarið fékk hann geislameðferð á miðmæti, samtals 44 Gy. Við þetta minnkaði æxlið (mynd 17b). Fjórum mánuðum síðar var gerð skurðaðgerð þar sem lungað var fjarlægt ásamt eitlum hægra megin í miðmæti og hluta af gollurshúsi. Við vefjaskoðun reyndust skurðbrúnir hreinar og engin merki um eitilmeinvörp. Hann fékk krabbameinslyfjameðferð eftir aðgerð og er við góða heilsu í dag, rúmum tveimur árum frá aðgerð.
Allt að 30% sjúklinga sem greinast með lungnakrabbamein eru með meinvörp í miðmætiseitlum. Þriðjungur þeirra er með eitilmeinvörp í miðmæti sömu megin og lungnaæxlið (N2-eitlar) og eru því á stigi IIIA (38). Langflestir hinna eru með eitilmeinvörp í N3 eitlum, og eru því á stigi IIIB þar sem ekki er mælt með skurðaðgerð (98, 99). Hjá sjúklingum á stigi IIIA getur komið til greina að gera aðgerð, sérstaklega ef um lítil og smásæ eitilmeinvörp er að ræða í einni eitilstöð eingöngu (98). Horfur er bestar hjá sjúklingum undir sextugu en allt að þriðjungur þessara sjúklinga getur náð að lifa í fimm ár frá aðgerð (100, 101). Á síðustu árum hefur verið venja að beita geisla- og krabbameinslyfjameðferð fyrir slíka aðgerð enda þótt ekki hafi verið sýnt fram á ótvíræðan árangur slíkrar meðferðar.
Skurðaðgerð kemur yfirleitt ekki til greina hjá sjúklingum með fjarmeinvörp (99). Þó eru á þessu einstaka undantekningar, einkum ef um er að ræða unga einstaklinga með stakt meinvarp í heila eða nýrnahettu (102). Meinvarpið er þá fjarlægt fyrst og síðan æxlið í lunganu. Að öðru leyti byggist meðferð þessara sjúklinga á krabbameinslyfjameðferð og/eða geislum og er sú meðferð óháð því hver vefjagerðin er að frátöldu smáfrumukrabbameini.
Skurðaðgerð á sjaldan við hjá sjúklingum með smáfrumukrabbamein, enda langflestir þeirra með útbreiddan sjúkdóm (31). Ef um staðbundinn sjúkdóm er að ræða getur blaðnám eða fleygskurður komið til greina og eru lífshorfur á bilinu 13-44% (103).
Geislameðferð
Geislameðferð er bæði hægt að beita í læknandi og líknandi tilgangi. Læknandi meðferð kemur til greina hjá sjúklingum sem ekki er treyst í aðgerð eða sem hluti af viðbótarmeðferð fyrir og/eða eftir skurðaðgerð (49). Líknandi meðferð er hins vegar beitt þegar lækningu verður ekki komið við en þörf er á meðferð við einkennum. Hér er fjallað um geislameðferð smáfrumukrabbameins og lungnakrabbameina af ekki-smáfrumugerð í sitt hvoru lagi.
Lungnakrabbamein af ekki-smáfrumugerð
Óskurðtæka sjúklinga á stigi I og II er hægt að meðhöndla með geislameðferð einvörðungu þar sem lækning er höfð að markmiði. Ekki liggja fyrir slembaðar rannsóknir en lífshorfur sjúklinga sem fá geislameðferð í lækningaskyni virðast betri en sjúklinga sem enga meðferð fá (104).
Geislameðferð fyrir skurðaðgerð getur komið til greina í völdum tilvikum en slík meðferð er fyrst og fremst talin eiga við innan ramma klínískra rannsókna (98). Almennt gildir því um "óskurðtæk" æxli á stigum IIIA og sérstaklega á stigi IIIB að geislameðferð fyrir aðgerð bæti ekki lífshorfur sjúklinga (105). Sama á við um skurðtæk æxli, en geislameðferð fyrir aðgerð virðist hvorki bæta lífshorfur né heldur bæta staðbundinn árangur (98). Krabbameinslyfja- og geislameðferð gefin samhliða fyrir aðgerð á skurðtækum æxlum bætir heldur ekki lífshorfur (105).
Hefðbundin aðferð við geislameðferð óskurðtækra lungnakrabbameina er að gefa meðferð einu sinni á dag fimm daga vikunnar, að heildarskammti um 60 Gy í 2 Gy skömmtum (49). Meðferðarsvæðið er æxlið sjálft ásamt þeim eitlum sem sterkur grunur er um að innihaldi meinvörp (106). Rannsóknir á áhrifum þess að gefa geislameðferð tvisvar sinnum eða jafnvel oftar á dag (hyperfractionated treatment) við sjúkdómi á stigi III benda sumar til betri lífshorfa en þessi meðferð er þó að öllum líkindum ekki betri en samhliða lyfja- og geislameðferð (105).
Sýnt hefur verið fram á betri árangur með því að gefa samhliða krabbameinslyfja- og geislameðferð en geislameðferð eingöngu (107). Ljóst er að tíðni snemmkominna aukaverkana geislameðferðar, á borð við vélindabólgu og geislalungnabólgu, er marktækt hærri en við geislameðferð eingöngu. Af þessu leiðir að einungis þeir sjúklingar sem eru í góðu líkamlegu ástandi geta gengist undir samhliða meðferð (108).
Geislameðferð hefur löngum verið beitt eftir skurðaðgerð, sérstaklega í tilfellum þar sem æxli greinist í skurðbrúnum eða eitilmeinvörp finnast í miðmæti við aðgerð. Niðurstöður rannsókna á gildi geislameðferðar einnar sér eða samhliða krabbameinslyfjameðferð hjá þessum hópi sjúklinga benda til þess að slík meðferð bæti ekki marktækt lífshorfur (109). Hjá sjúklingum með hreinar skurðbrúnir á stigi I og II virðist viðbótar geislameðferð jafnvel geta gert lífshorfur verri (109). Viðbótargeislameðferð á svæði í miðmæti þar sem eitilmeinvörp hafa verið fjarlægð eða annars staðar innan brjósthols virðist heldur ekki bæta lífshorfur, enda þó ekki sé fullljóst hvort slík meðferð geti átt við í N2-sjúkdómi og þá samhliða krabbameinslyfjameðferð fyrir skurðaðgerð (110).
Smáfrumukrabbamein
Venja er að meðhöndla smáfrumukrabbamein sem bundið er við annan helming brjósthols í læknandi skyni með bæði krabbameinslyfjum og geislameðferð (31). Talið er að árangur og þar með taldar lífshorfur, séu betri ef þessar meðferðir eru gefnar samhliða (111). Mælt er með að gefa verndandi geislameðferð gegn heilavef hjá sjúklingum með staðbundinn sjúkdóm, en það bætir lifun þeirra ef fullkomin svörun hefur orðið við undangenginni krabbameinslyfja- og geislameðferð (31).
Krabbameinslyfjameðferð
Á síðastliðnum árum hafa orðið töluverðar framfarir í krabbameinslyfjameðferð við lungnakrabbameini. Ný lyf eru komin til sögunnar, ábendingar fyrir notkun eldri lyfja hafa breyst og í vaxandi mæli er farið að nota krabbameinslyf eftir skurðaðgerðir sem viðbótarmeðferð (adjuvant). Umfjöllun um krabbameinslyfjameðferð er hér skipt eftir vefjagerð og fjallað um smáfrumukrabbamein og lungnakrabbamein af ekki-smáfrumugerð í sitt hvoru lagi.
Smáfrumukrabbamein
Meðferð smáfrumukrabbameina fer eftir stigi sjúkdómsins, hvort um staðbundinn sjúkdóm er að ræða eða útbreiddan. Hjá fyrrnefndu sjúklingunum er gefin samhliða meðferð krabbameinslyfja, yfirleitt cisplatin og etoposid í æð á þriggja vikna fresti auk geislameðferðar (31). Best er að hefja geislameðferð snemma í ferlinu en það bætir lífshorfur þessara sjúklinga um allt að 36% (31). Smáfrumukrabbamein svarar yfirleitt mjög vel meðferð, eða í allt að 80% tilfella (112). Hins vegar er algengt að sjúklingar fái endurtekið krabbamein og aðeins 15-20% þessara sjúklinga eru á lífi án krabbameins fimm árum frá greiningu (112).
Sjúklingar með útbreitt smáfrumukrabbamein eru yfirleitt meðhöndlaðir með krabbameinslyfjum eingöngu, oftast lyfjablöndur með tveimur lyfjum þar sem annað lyfjanna er platinumlyf. Tæplega 20% sjúklinga svara þessari meðferð að fullu. Flestir þeirra fá þó endurtekið krabbamein innan eins árs og er þá oftast gefin sama meðferð að nýju. Þetta á þó ekki við ef sjúkdómurinn tekur sig upp innan sex mánaða frá lokum meðferðar, en þá eru gefin önnur lyf eins og paclitaxel, topotecan eða irinotecan sem 20-30% sjúklinganna svara (113). Horfur þessara sjúklinga eru slæmar, til dæmis eru lífshorfur sjúklinga með útbreitt smáfrumukrabbamein að meðaltali 7-9 mánuðir og einungis 2% sjúklinga eru á lífi eftir fimm ár (114).
Lungnakrabbamein af ekki-smáfrumugerð (tafla VI)

Það hefur lengi verið þekkt að stór hluti sjúklinga sem gengst undir skurðaðgerð vegna sjúkdóms á stigi I, II og III, greinist aftur með sjúkdóminn, eða um 40% á stigi I, 61% sjúklinga á stigi II og 74% á stigi III (115). Á síðustu árum hafa verið gerðar stórar slembaðar fjölsetra rannsóknir þar sem kannaður er árangur lyfjameðferðar eftir skurðaðgerð hjá sjúklingum með sjúkdóm á stigi IB-IIIA (116-118). Tvær þessara rannsókna náðu til samtals 1322 sjúklinga og var sjúklingunum skipt í tvennt þar sem annar hópurinn fékk lyfjameðferð eftir skurðaðgerð en hinn ekki. Niðurstöður sýndu að sjúklingar á stigi II og IIIA sem fengu lyfjameðferð greindust síður með sjúkdóminn að nýju og lífshorfur voru betri (116, 118). Hjá þessum sjúklingahópi er því mælt með krabbameinslyfjameðferð eftir skurðaðgerð (82). Með krabbameinslyfjameðferð er hægt að fækka tíðni endurkomu krabbameinsins í 51% hjá sjúklingum á stigi II og í 61% á stigi III (115). Ekki hefur tekist að sýna fram á sambærilegan árangur fyrir sjúklinga á stigi I og þeir því meðhöndlaðir með skurðaðgerð eða geislameðferð eingöngu (82).
Krabbameinslyfjameðferðinni fylgja aukaverkanir og gagnast því aðeins sjúklingum sem eru vel á sig komnir líkamlega og þjást ekki af öðrum alvarlegum sjúkdómum. Einnig er mikilvægt að sjúklingar séu fljótir að jafna sig eftir skurðaðgerð því æskilegt er að meðferð geti hafist innan tveggja mánaða. (115). Helstu aukaverkanir eru ógleði, þreyta, slappleiki og bæling á starfsemi beinmergs (116, 118). Þá geta platinumlyf, einna helst cisplatin, valdið truflun á starfsemi nýrna og þarf því að huga vel að vökvajafnvægi sjúklinga á meðan meðferð stendur.
Hjá sjúklingum með óskurðtækan sjúkdóm á stigi III (IIIA/B) sem eru vel á sig komnir líkamlega er mælt með samtvinnaðri meðferð krabbameinslyfja og geislameðferðar, en samhliða meðferð gefur betri árangur en hvor meðferð gefin í sínu lagi (119, 120).
Sjúklingar með útbreitt lungnakrabbamein (á stigi IV) eru taldir ólæknandi og tilgangur meðferðar fyrst og fremst að halda aftur af einkennum sjúkdómsins. Meðferð á þessu stigi er einstaklingsbundin og taka verður tillit til fjölmargra þátta, svo sem kvartana sjúklings, annarra sjúkdóma og almenns líkamlegs ástands. Nýlegar rannsóknir hafa sýnt fram á bættar lífshorfur eftir lyfjameðferð þar sem tvö lyf eru gefin saman og annað þeirra er lyf úr flokki platinumlyfja (121). Þá hefur lyf sem hemur nýmyndun æða í æxlum, bevacizumab, einnig verið rannsakað hjá sjúklingum með langt gengið lungnakrabbamein og bætt lífshorfur þeirra marktækt. Þetta lyf á hins vegar ekki að gefa sjúklingum með aukna blæðingartilhneigingu þar sem meðferðin getur valdið alvarlegum blæðingum (122). Ef sjúkdómur tekur sig upp að nýju er oft gripið til annarra lyfja. Á undanförnum árum hafa komið á markað nokkur ný lyf sem hægt er að nota í slíkum tilvikum. Þar má nefna docetaxel og pemetrexet sem er skylt lyfinu methotrexate og hefur áhrif á umbrot fólínsýru (123). Gefitinib og erlotinib eru í flokki nýrra lyfja sem ráðast gegn vaxtarviðtökum á yfirborði krabbameinsfruma (epidermal growth factor receptor). Þessi lyf eru merk viðbót við eldri lyf og aukaverkanir litlar. Þau nýtast þó aðeins þröngum hópi sjúklinga (124). Í framtíðinni er hugsanlegt að sameindalíffræðileg og vefjafræðileg próf á æxlisvef geti verið leiðbeinandi í því að finna þá sjúklinga sem svara þessum lyfjum best (125).
Horfur
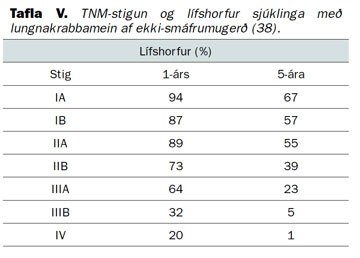
Lífshorfur sjúklinga með lungnakrabbamein ráðast af fjölda þátta, svo sem aldri sjúklings og almennu líkamlegu ástandi. Það sem mestu máli skiptir eru útbreiðsla (stig) sjúkdómsins og hvort um smáfrumukrabbamein er að ræða eða ekki (49). Sjúklingar með smáfrumukrabbamein hafa umtalsvert lakari horfur en sjúklingar með lungnakrabbamein af ekki-smáfrumugerð. Þetta á sérstaklega við um þá sem hafa útbreitt smáfrumukrabbamein en lífshorfur þeirra eru oftast í kringum 10 mánuðir, samanborið við 16-22 mánuðir fyrir staðbundið smáfrumukrabbamein (31). Fimm ára lífshorfur fyrir aðrar vefjagerðir má sjá í töflu V.
Lokaorð
Lungnakrabbamein er stórt heilbrigðisvandamál hér á landi, líkt og annars staðar í heiminum. Tveir þriðju sjúklinga greinast enn með útbreiddan sjúkdóm sem skýrir af hverju lungnakrabbamein leggur fleiri að velli en önnur krabbamein. Á síðasta áratug hafa orðið framfarir í greiningu og meðferð lungnakrabbameins.
Tíðni reykinga hefur farið minnkandi hér á landi undanfarna áratugi og standa vonir til að það skili sér í lækkandi tíðni lungnakrabbameins. Forvarnir og hjálp til reykleysis eru því afgerandi varðandi árangur í baráttu við lungnakrabbamein. Þá gæti skimun með tölvusneiðmyndatækni bætt árangur verulega en beðið er eftir frekari rannsóknum.
Á undanförnum árum hefur verið lögð áhersla á samvinnu mismunandi sérgreina í meðferð sjúklinga með lungnakrabbamein. Á Landspítala er starfandi hópur sérfræðinga sem eru lungnalæknar, krabbameinslæknar, meinafræðingar, rönt-genlæknar og skurðlæknar. Vikulega eru haldnir fundir þar sem ný tilfelli eru rædd og ákveðið um meðferð.
Þakkir
Þakkir fá Gunnhildur Jóhannsdóttir skrifstofustjóri á Skurðdeild Landspítala fyrir aðstoð við gerð mynda og Laufey Tryggvadóttir framkvæmdastjóri Krabbameinsskrár KÍ fyrir faraldsfræðilegar upplýsingar.
Heimildir
1. www.krabbameinsskra.is
2. www.hagstofa.is
3. Jonasson J, (ed.) TL. Krabbamein á Íslandi. Krabbameinsskrá Krabbameinsfélags Íslands 50 ára. Reykjavík: Krabbameinsfélagið; 2004.
4. Ferlay J, F B, Pisani P, Parkin D. GLOBOCAN 2002: Cancer incidence, mortality and prevalence worldwide. In: IARC CancerBase No. 5 version 2.0. Lyon: IARCPress; 2004 www-dep.iarc.fr/
5. Miller YE, Franklin WA. Molecular events in lung carcinogenesis. Hematol Oncol Clin North Am 1997; 11: 215-34.
6. Wynder EL, Graham EA. Landmark article May 27, 1950: Tobacco Smoking as a possible etiologic factor in bronchiogenic carcinoma. A study of six hundred and eighty-four proved cases. By Ernest L. Wynder and Evarts A. Graham. Jama 1985; 253: 2986-94.
7. Sigurðsson A, Ísaksson HJ, Kristjánsson K, Jónsson S. Þáttur reykinga í myndun lungnakrabbameins á Íslandi. Rannsóknarráðstefna 4. árs læknanema (ágrip). 2001.
8. Tobacco smoke and involuntary smoking. IARC Monogr Eval Carcinog Risks Hum 2004; 83: 1-1438.
9. Janerich DT, Thompson WD, Varela LR, et al. Lung cancer and exposure to tobacco smoke in the household. N Engl J Med 1990; 323: 632-6.
10. Anthonisen NR, Skeans MA, Wise RA, Manfreda J, Kanner RE, Connett JE. The effects of a smoking cessation intervention on 14.5-year mortality: a randomized clinical trial. Ann Intern Med 2005; 142: 233-9.
11. Doll R, Peto R, Boreham J, Sutherland I. Mortality in relation to smoking: 50 years? observations on male British doctors. BMJ 2004; 328: 1519.
12. Tong L, Spitz MR, Fueger JJ, Amos CA. Lung carcinoma in former smokers. Cancer 1996; 78: 1004-10.
13. Skuladottir H, Tjoenneland A, Overvad K, Stripp C, Olsen JH. Does high intake of fruit and vegetables improve lung cancer survival - Lung Cancer 2006; 51: 267-73.
14. Feskanich D, Ziegler RG, Michaud DS, et al. Prospective study of fruit and vegetable consumption and risk of lung cancer among men and women. J Natl Cancer Inst 2000; 92: 1812-23.
15. Skillrud DM, Offord KP, Miller RD. Higher risk of lung cancer in chronic obstructive pulmonary disease. A prospective, matched, controlled study. Ann Intern Med 1986; 105: 503-7.
16. Tockman MS, Anthonisen NR, Wright EC, Donithan MG. Airways obstruction and the risk for lung cancer. Ann Intern Med 1987; 106: 512-8.
17. Petty TL. Are COPD and lung cancer two manifestations of the same disease - Chest 2005; 128: 1895-7.
18. Schwartz AG, Ruckdeschel JC. Familial lung cancer: genetic susceptibility and relationship to chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2006; 173: 16-22.
19. Jónsson S, Þorsteinsdóttir U, Guðbjartsson DF, et al. Familial risk of lung carcinoma in the Icelandic population. Jama 2004; 292: 2977-83.
20. Bailey-Wilson JE, Amos CI, Pinney SM, et al. A major lung cancer susceptibility locus maps to chromosome 6q23-25. Am J Hum Genet 2004; 75: 460-74.
21. Beckles MA, Spiro SG, Colice GL, Rudd RM. Initial evaluation of the patient with lung cancer: symptoms, signs, laboratory tests, and paraneoplastic syndromes. Chest 2003; 123(1 Suppl): 97S-104S.
22. Spiro SG, Gould MK, Colice GL. Initial evaluation of the patient with lung cancer: symptoms, signs, laboratory tests, and paraneoplastic syndromes: ACCP evidenced-based clinical practice guidelines (2nd edition). Chest 2007; 132(3 Suppl): 149S-160S.
23. Pretreatment evaluation of non-small-cell lung cancer. The American Thoracic Society and The European Respiratory Society. Am J Respir Crit Care Med 1997; 156: 320-32.
24. Koyi H, Hillerdal G, Branden E. A prospective study of a total material of lung cancer from a county in Sweden 1997-1999: gender, symptoms, type, stage, and smoking habits. Lung Cancer 2002; 36: 9-14.
25. Buccheri G, Ferrigno D. Lung cancer: clinical presentation and specialist referral time. Eur Respir J 2004; 24: 898-904.
26. Arcasoy SM, Jett JR. Superior pulmonary sulcus tumors and Pancoast's syndrome. N Engl J Med 1997; 337: 1370-6.
27. Sridhar KS, Lobo CF, Altman RD. Digital clubbing and lung cancer. Chest 1998; 114: 1535-7.
28. Travis W, Muller-Hermelink H-K, CC H. Pathology and genetics of tumors of the lung, pleura, thymus and heart. Lyon: IARC Press; 2004.
29. Riquet M, Foucault C, Berna P, Assouad J, Dujon A, Danel C. Prognostic value of histology in resected lung cancer with emphasis on the relevance of the adenocarcinoma subtyping. Ann Thorac Surg 2006; 81: 1988-95.
30. Wahbah M, Boroumand N, Castro C, El-Zeky F, Eltorky M. Changing trends in the distribution of the histologic types of lung cancer: a review of 4,439 cases. Ann Diagn Pathol 2007; 11: 89-96.
31. Simon GR, Turrisi A. Management of small cell lung cancer: ACCP evidence-based clinical practice guidelines (2nd edition). Chest 2007; 132 (3 Suppl):324S-339S.
32. Ginsberg MS. Epidemiology of lung cancer. Semin Roentgenol 2005; 40: 83-9.
33. Jeong YJ, Yi CA, Lee KS. Solitary pulmonary nodules: detection, characterization, and guidance for further diagnostic workup and treatment. AJR Am J Roentgenol 2007; 188: 57-68.
34. Ginsberg MS, Grewal RK, Heelan RT. Lung cancer. Radiol Clin North Am 2007; 45: 21-43.
35. Guðmundsdóttir A, Reynisson K, Guðmundsson G. Lungnaástungur með hjálp tölvusneiðmynda á Landspítala. Ábendingar, fylgikvillar og útkoma. Læknablaðið 2005; 91: 917-21.
36. Kinoshita F, Kato T, Sugiura K, et al. CT-guided trans-?thoracic needle biopsy using a puncture site-down positioning technique. AJR Am J Roentgenol 2006; 187: 926-32.
37. Jemal A, Siegel R, Ward E, Murray T, Xu J, Thun MJ. Cancer statistics, 2007. CA Cancer J Clin 2007; 57: 43-66.
38. Mountain CF. Revisions in the International System for Staging Lung Cancer. Chest 1997; 111: 1710-7.
39. Hirsch FR, Franklin WA, Gazdar AF, Bunn PA, Jr. Early detection of lung cancer: clinical perspectives of recent advances in biology and radiology. Clin Cancer Res 2001; 7: 5-22.
40. Fontana RS. The Mayo Lung Project: a perspective. Cancer 2000; 89 (11 Suppl): 2352-5.
41. Tockman MS. Survival and mortality from lung cancer in a screened population: The Johns Hopkins Study. Chest 1986; 89: 324S-325S.
42. Schwartz AM, Henson DE. Diagnostic surgical pathology in lung cancer: ACCP evidence-based clinical practice guidelines (2nd edition). Chest 2007; 132(3 Suppl): 78S-93S.
43. Kaneko M, Kusumoto M, Kobayashi T, et al. Computed tomography screening for lung carcinoma in Japan. Cancer 2000; 89(11 Suppl): 2485-8.
44. Henschke CI, Yankelevitz DF, Libby DM, Pasmantier MW, Smith JP, Miettinen OS. Survival of patients with stage I lung cancer detected on CT screening. N Engl J Med 2006; 355: 1763-71.
45. Mulshine JL, Sullivan DC. Clinical practice. Lung cancer screening. N Engl J Med 2005; 352: 2714-20.
46. Elliott JA, Osterlind K, Hirsch FR, Hansen HH. Metastatic patterns in small-cell lung cancer: correlation of autopsy findings with clinical parameters in 537 patients. J Clin Oncol 1987; 5: 246-54.
47. Lassen U, Osterlind K, Hansen M, Dombernowsky P, Bergman B, Hansen HH. Long-term survival in small-cell lung cancer: posttreatment characteristics in patients surviving 5 to 18+ years--an analysis of 1,714 consecutive patients. J Clin Oncol 1995; 13: 1215-20.
48. Singh S, Parulekar W, Murray N, Feld R, Evans WK, Tu D, et al. Influence of sex on toxicity and treatment outcome in small-cell lung cancer. J Clin Oncol 2005;23(4):850-6.
49. Spira A, Ettinger DS. Multidisciplinary management of lung cancer. N Engl J Med 2004;350(4):379-92.
50. Myrdal G. Lung cancer. Epidemiological an clinical studies with special reference to surgical treatment. Uppsala: Uppsala University; 2003.
51. Mery CM, Pappas AN, Burt BM, et al. Diameter of non-small cell lung cancer correlates with long-term survival: implications for T stage. Chest 2005; 128: 3255-60.
52. Naruke T, Goya T, Tsuchiya R, Suemasu K. Prognosis and survival in resected lung carcinoma based on the new international staging system. J Thorac Cardiovasc Surg 1988; 96: 440-7.
53. Gail MH, Eagan RT, Feld R, et al. Prognostic factors in patients with resected stage I non-small cell lung cancer. A report from the Lung Cancer Study Group. Cancer 1984; 54: 1802-13.
54. Kwiatkowski DJ, Harpole DH, Jr., Godleski J, et al. Molecular pathologic substaging in 244 stage I non-small-cell lung cancer patients: clinical implications. J Clin Oncol 1998; 16: 2468-77.
55. Pater JL, Loeb M. Nonanatomic prognostic factors in carcinoma of the lung: a multivariate analysis. Cancer 1982; 50: 326-31.
56. Munden RF, Swisher SS, Stevens CW, Stewart DJ. Imaging of the patient with non-small cell lung cancer. Radiology 2005; 237: 803-18.
57. Heelan RT, Demas BE, Caravelli JF, et al. Superior sulcus tumors: CT and MR imaging. Radiology 1989; 170(3 Pt 1): 637-41.
58. Schreiber G, McCrory DC. Performance characteristics of different modalities for diagnosis of suspected lung cancer: summary of published evidence. Chest 2003; 123(1 Suppl): 115S-128S.
59. Chhajed PN, Bernasconi M, Gambazzi F, et al. Combining bronchoscopy and positron emission tomography for the diagnosis of the small pulmonary nodule < or = 3 cm. Chest 2005; 128: 3558-64.
60. Laroche C, Fairbairn I, Moss H, et al. Role of computed tomographic scanning of the thorax prior to bronchoscopy in the investigation of suspected lung cancer. Thorax 2000; 55: 359-63.
61. Makris D, Scherpereel A, Leroy S, et al. Electromagnetic navigation diagnostic bronchoscopy for small peripheral lung lesions. Eur Respir J 2007; 29: 1187-92.
62. Kurimoto N, Miyazawa T, Okimasa S, et al. Endobronchial ultrasonography using a guide sheath increases the ability to diagnose peripheral pulmonary lesions endoscopically. Chest 2004; 126: 959-65.
63. Naruke T, Tsuchiya R, Kondo H, Nakayama H, Asamura H. Lymph node sampling in lung cancer: how should it be done? Eur J Cardiothorac Surg 1999; 16 Suppl 1: S17-24.
64. De Leyn P, Lardinois D, Van Schil PE, et al. ESTS guidelines for preoperative lymph node staging for non-small cell lung cancer. Eur J Cardiothorac Surg 2007; 32: 1-8.
65. De Leyn P, Vansteenkiste J, Cuypers P, et al. Role of cervical mediastinoscopy in staging of non-small cell lung cancer without enlarged mediastinal lymph nodes on CT scan. Eur J Cardiothorac Surg 1997; 12: 706-12.
66. Toloza EM, Harpole L, McCrory DC. Noninvasive staging of non-small cell lung cancer: a review of the current evidence. Chest 2003; 123(1 Suppl): 137S-146S.
67. Devaraj A, Cook GJ, Hansell DM. PET/CT in non-small cell lung cancer staging-promises and problems. Clin Radiol 2007; 62: 97-108.
68. van Tinteren H, Hoekstra OS, Smit EF, et al. Effectiveness of positron emission tomography in the preoperative assessment of patients with suspected non-small-cell lung cancer: the PLUS multicentre randomised trial. Lancet 2002; 359: 1388-93.
69. Annema JT, Versteegh MI, Veselic M, Voigt P, Rabe KF. Endoscopic ultrasound-guided fine-needle aspiration in the diagnosis and staging of lung cancer and its impact on surgical staging. J Clin Oncol 2005; 23: 8357-61.
70. Yasufuku K, Nakajima T, Motoori K, et al. Comparison of endobronchial ultrasound, positron emission tomography, and CT for lymph node staging of lung cancer. Chest 2006; 130: 710-8.
71. Rintoul RC, Skwarski KM, Murchison JT, Hill A, Walker WS, Penman ID. Endoscopic and endobronchial ultrasound real-time fine-needle aspiration for staging of the mediastinum in lung cancer. Chest 2004; 126: 2020-2.
72. Cerfolio RJ, Bryant AS, Eloubeidi MA. Accessing the aortopulmonary window (#5) and the paraaortic (#6) lymph nodes in patients with non-small cell lung cancer. Ann Thorac Surg 2007; 84: 940-5.
73. Detterbeck FC, DeCamp MM, Jr., Kohman LJ, Silvestri GA. Lung cancer. Invasive staging: the guidelines. Chest 2003; 123(1 Suppl): 167S-175S.
74. Cerfolio RJ, Bryant AS. Distribution and likelihood of lymph node metastasis based on the lobar location of nonsmall-cell lung cancer. Ann Thorac Surg 2006; 81: 1969-73; discussion 1973.
75. Detterbeck FC, Jantz MA, Wallace M, Vansteenkiste J, Silvestri GA. Invasive mediastinal staging of lung cancer: ACCP evidence-based clinical practice guidelines (2nd edition). Chest 2007; 132(3 Suppl): 202S-220S.
76. Toloza EM, Harpole L, Detterbeck F, McCrory DC. Invasive staging of non-small cell lung cancer: a review of the current evidence. Chest 2003; 123(1 Suppl): 157S-166S.
77. Park BJ, Flores R, Downey RJ, Bains MS, Rusch VW. Management of major hemorrhage during mediastinoscopy. J Thorac Cardiovasc Surg 2003; 126: 726-31.
78. Silvestri GA, Gould MK, Margolis ML, et al. Noninvasive staging of non-small cell lung cancer: ACCP evidenced-based clinical practice guidelines (2nd edition). Chest 2007; 132(3 Suppl): 178S-201S.
79. Fischer BM, Mortensen J. The future in diagnosis and staging of lung cancer: positron emission tomography. Respiration 2006; 73: 267-76.
80. Gayed I, Vu T, Johnson M, Macapinlac H, Podoloff D. Comparison of bone and 2-deoxy-2-[18F]fluoro-D-glucose positron emission tomography in the evaluation of bony metastases in lung cancer. Mol Imaging Biol 2003; 5: 26-31.
81. Reif MS, Socinski MA, Rivera MP. Evidence-based medicine in the treatment of non-small-cell lung cancer. Clin Chest Med 2000; 21: 107-20, ix.
82. Scott WJ, Howington J, Feigenberg S, Movsas B, Pisters K. Treatment of non-small cell lung cancer stage I and stage II: ACCP evidence-based clinical practice guidelines (2nd edition). Chest 2007; 132(3 Suppl): 234S-242S.
83. Nesbitt JC, Putnam JB, Jr., Walsh GL, Roth JA, Mountain CF. Survival in early-stage non-small cell lung cancer. Ann Thorac Surg 1995; 60(2): 466-72.
84. Damhuis RA, Schutte PR. Resection rates and postoperative mortality in 7,899 patients with lung cancer. Eur Respir J 1996; 9: 7-10.
85. Laroche C, Wells F, Coulden R, et al. Improving surgical resection rate in lung cancer. Thorax 1998; 53: 445-9.
86. Kim ES, Bosquee L. The importance of accurate lymph node staging in early and locally advanced non-small cell lung cancer: an update on available techniques. J Thorac Oncol 2007; 2 Suppl 2: S59-67.
87. Whitson BA, Groth SS, Maddaus MA. Surgical assessment and intraoperative management of mediastinal lymph nodes in non-small cell lung cancer. Ann Thorac Surg 2007; 84: 1059-65.
88. Ginsberg RJ, Rubinstein LV. Randomized trial of lobectomy versus limited resection for T1 N0 non-small cell lung cancer. Lung Cancer Study Group. Ann Thorac Surg 1995; 60: 615-22; discussion 622-3.
89. Guðbjartsson T, Gyllsted E, Pikwer A, Jonsson P. Early Surgical Results Following Pneumonectomy for Non-Small Cell Lungcancer are not Affected by Preoperative Radio- and Chemotherapy. Ann Thorac Surg (in press) 2007.
90. Myrdal G. Lung cancer. Epidemiological and clinical studies with special reference to surgical treatment (Dissertation). Uppsala: Uppsala University; 2003.
91. Deslauriers J, Gregoire J, Jacques LF, Piraux M, Guojin L, Lacasse Y. Sleeve lobectomy versus pneumonectomy for lung cancer: a comparative analysis of survival and sites or recurrences. Ann Thorac Surg 2004; 77: 1152-6; discussion 1156.
92. McKenna RJ, Jr. Surgical management of primary lung cancer. Semin Oncol 2007; 34: 250-5.
93. McKenna RJ, Jr., Mahtabifard A, Pickens A, Kusuanco D, Fuller CB. Fast-tracking after video-assisted thoracoscopic surgery lobectomy, segmentectomy, and pneumonectomy. Ann Thorac Surg 2007; 84: 1663-7; discussion 1667-8.
94. West D, Rashid S, Dunning J. Does video-assisted thora-coscopic lobectomy produce equal cancer clearance compared to open lobectomy for non-small cell carcinoma of the lung? Interact Cardiovasc Thorac Surg 2007; 6: 110-6.
95. Shen KR, Meyers BF, Larner JM, Jones DR. Special treatment issues in lung cancer: ACCP evidence-based clinical practice guidelines (2nd edition). Chest 2007; 132(3 Suppl): 290S-305S.
96. Chapelier A, Fadel E, Macchiarini P, et al. Factors affecting long-term survival after en-bloc resection of lung cancer invading the chest wall. Eur J Cardiothorac Surg 2000; 18(5): 513-8.
97. Downey RJ, Martini N, Rusch VW, Bains MS, Korst RJ, Ginsberg RJ. Extent of chest wall invasion and survival in patients with lung cancer. Ann Thorac Surg 1999; 68: 188-93.
98. Robinson LA, Ruckdeschel JC, Wagner H, Jr., Stevens CW. Treatment of non-small cell lung cancer-stage IIIA: ACCP evidence-based clinical practice guidelines (2nd edition). Chest 2007; 132(3 Suppl): 243S-265S.
99. Socinski MA, Crowell R, Hensing TE, et al. Treatment of non-small cell lung cancer, stage IV: ACCP evidence-based clinical practice guidelines (2nd edition). Chest 2007; 132(3 Suppl):277S-289S.
100. Depierre A, Milleron B, Moro-Sibilot D, et al. Preoperative chemotherapy followed by surgery compared with primary surgery in resectable stage I (except T1N0), II, and IIIa non-small-cell lung cancer. J Clin Oncol 2002; 20: 247-53.
101. Roth JA, Atkinson EN, Fossella F, et al. Long-term follow-up of patients enrolled in a randomized trial comparing perioperative chemotherapy and surgery with surgery alone in resectable stage IIIA non-small-cell lung cancer. Lung Cancer 1998; 21:1-6.
102. Schuchert MJ, Luketich JD. Solitary sites of metastatic disease in non-small cell lung cancer. Curr Treat Options Oncol 2003; 4: 65-79.
103. Asamura H, Ginsberg RJ. Treatment of smal cell lung cancer: Surgery. London: Martin Dunitz; 2000.
104. Rowell NP, Williams CJ. Radical radiotherapy for stage I/II non-small cell lung cancer in patients not sufficiently fit for or declining surgery (medically inoperable): a systematic review. Thorax 2001; 56: 628-38.
105. Sirzen F, Kjellen E, Sorenson S, Cavallin-Stahl E. A systematic overview of radiation therapy effects in non-small cell lung cancer. Acta Oncol 2003; 42: 493-515.
106. Emami B, Mirkovic N, Scott C, et al. The impact of regional nodal radiotherapy (dose/volume) on regional progression and survival in unresectable non-small cell lung cancer: an analysis of RTOG data. Lung Cancer 2003; 41: 207-14.
107. Komaki R, Sause WT, Byhardt RW, et al. Non-small cell lung cancer, nonsurgical, aggressive therapy. American College of Radiology. ACR Appropriateness Criteria. Radiology 2000; 215 Suppl: 1319-30.
108. Gravolin M, Rowell K, de Groot J. Interventions to support the decision-making process for older people facing the possibility of long-term residential care. Cochrane Database Syst Rev 2007(3): CD005213.
109. Postoperative radiotherapy for non-small cell lung cancer. PORT Meta-analysis Trialists Group. Cochrane Database Syst Rev 2000(2): CD002142.
110. Bogart JA, Aronowitz JN. Localized non-small cell lung cancer: adjuvant radiotherapy in the era of effective systemic therapy. Clin Cancer Res 2005; 11(13 Pt 2): 5004s-5010s.
111. Stupp R, Monnerat C, Turrisi AT, 3rd, Perry MC, Leyvraz S. Small cell lung cancer: state of the art and future perspectives. Lung Cancer 2004; 45: 105-17.
112. Janne PA, Freidlin B, Saxman S, et al. Twenty-five years of clinical research for patients with limited-stage small cell lung carcinoma in North America. Cancer 2002; 95: 1528-38.
113. Samson DJ, Seidenfeld J, Simon GR, et al. Evidence for management of small cell lung cancer: ACCP evidence-based clinical practice guidelines (2nd edition). Chest 2007; 132(3 Suppl): 314S-323S.
114. Chute JP, Chen T, Feigal E, Simon R, Johnson BE. Twenty years of phase III trials for patients with extensive-stage small-cell lung cancer: perceptible progress. J Clin Oncol 1999; 17: 1794-801.
115. Pisters KM, Le Chevalier T. Adjuvant chemotherapy in completely resected non-small-cell lung cancer. J Clin Oncol 2005; 23: 3270-8.
116. Douillard JY, Rosell R, De Lena M, et al. Adjuvant vinorelbine plus cisplatin versus observation in patients with completely resected stage IB-IIIA non-small-cell lung cancer (Adjuvant Navelbine International Trialist Association [ANITA]): a randomised controlled trial. Lancet Oncol 2006; 7: 719-27.
117. Pignin J, Tibodet H, Scagliotti G, et al. Lung adjuvant cisplatin evaluation (LACE): A pooled analysis of five randomized clinical trials including 4584 patients. J Clin Oncol 2006(June 20): 7008.
118. Winton T, Livingston R, Johnson D, et al. Vinorelbine plus cisplatin vs. observation in resected non-small-cell lung cancer. N Engl J Med 2005; 352: 2589-97.
119. Farray D, Mirkovic N, Albain KS. Multimodality therapy for stage III non-small-cell lung cancer. J Clin Oncol 2005; 23: 3257-69.
120. Jett JR, Schild SE, Keith RL, Kesler KA. Treatment of non-small cell lung cancer, stage IIIB: ACCP evidence-based clinical practice guidelines (2nd edition). Chest 2007; 132(3 Suppl): 266S-276S.
121. Wakelee H, Belani CP. Optimizing first-line treatment options for patients with advanced NSCLC. Oncologist 2005; 10 Suppl 3: 1-10.
122. Sandler A. Bevacizumab in non small cell lung cancer. Clin Cancer Res 2007; 13(15 Pt 2): s4613-6.
123. Hanna N, Shepherd FA, Fossella FV, et al. Randomized phase III trial of pemetrexed versus docetaxel in patients with non-small-cell lung cancer previously treated with chemotherapy. J Clin Oncol 2004; 22: 1589-97.
124. Shepherd FA, Rodrigues Pereira J, et al. Erlotinib in previously treated non-small-cell lung cancer. N Engl J Med 2005; 353: 123-32.
125. Hirsch FR, Varella-Garcia M, Cappuzzo F, et al. Combination of EGFR gene copy number and protein expression predicts outcome for advanced non-small-cell lung cancer patients treated with gefitinib. Ann Oncol 2007; 18: 752-60.
