09. tbl 93. árg. 2007
Fræðigrein
Óvenjuleg pneumocystis lungnabólga - tilfelli og yfirlitsgrein
An Unusal Case of Pneumocystis Pneumonia-Case report and review Læknablaðið 2007; 93: 607-13
Ágrip
Sextíu og þriggja ára kona leitar á Landspítala vegna hita, höfuðverks og vaxandi mæði. Saga er um sóraliðagigt og notkun metótrexats í skammtinum 10 mg/viku þess vegna. Einnig er saga um verulega áfengisneyslu. Við komu reynist hún með öndunarbilun og með brak yfir neðanverðum lungum. Í blóði sést hækkun á bólgumiðlum, eðlileg hvítfrumutalning en lækkun á eitilfrumum. Á TS-mynd af lungum sjást hélubreytingar. Í berkjuspeglun er tekið sýni sem leiðir í ljós sveppinn P. jiroveci, sem veldur eingöngu sýkingu hjá ónæmisbældum. Eftir ítarlegar rannsóknir var ályktun meðferðaraðila að ónæmisbæling hennar væri vegna metótrexats, etanóls og liðagigtar.
Í þessari grein er farið yfir tilfelli pneumocystis lungnabólgu og einnig farið yfir smitleiðir P. jiroveci og hýsilvarnir gegn sveppnum. Auk þess er sagt frá teiknum og einkennum sýkingarinnar, rannsóknum til greiningar og meðferð. Þar sem í þessu tilfelli virðist sem metótrexat og etanól hafi átt ríkan þátt í ónæmisbælingunni er fjallað um víðtæk áhrif þessara tveggja efna á ónæmiskerfið.
Tilfelli
Sextíu og þriggja ára gömul kona leitaði á Landspítala vegna fimm daga sögu um hita, allt að 39°C, höfuðverk og vaxandi mæði. Hún kvaðst ekki hafa verið með hósta, uppgang eða takverk en lýsti margra ára sögu um sóraliðagigt. Einnig hafði hún fengið krabbamein í brjóst sem var meðhöndlað með skurðaðgerð og geislameðferð fyrir átta árum og talið læknað. Hún reykti ekki en drakk 3-4 lítra af bjór og eitthvað af sterku víni daglega.
Lyf við komu voru Atenólól®, Arthrotec®, Cozaar Comp®, Cipralex®, Korzem-R®, Phenergan® og 10 mg á viku af Methotrexate®.
Við skoðun var blóðþrýstingur 161/76 og púls 89, hiti 37,7°C og súrefnismettun 91% á andrúmslofti. Andþyngsli voru greinileg, öndunartíðni 25/mín. Hjartahlustun var eðlileg en við lungnahlustun var brak yfir neðri lungnablöðum báðum megin. Blóðprufur sýndu eðlilega hvítfrumutalningu, (4,9 x109/L) með eitilfrumufæð (0,6 x109/L, eðlileg gildi 1,1-4,0), eðlilegt hemóglóbín og blóðflögur, vægt aukið kreatínín (108 µmól/L), CRP 70 mg/L (eðl <10), sökk 103 mm/klst (eðl <23) og væga hækkun á lifrarprófum sem var talin stafa af áfengisneyslu. Niðurstöður slagæðarblóðsýnis samrýmdust ,,hypoxískri" öndunarbilun. Sýrustig var 7,50 (vægt hækkað), PO2 var 61 mmHg (lækkað), PCO2 var 30mmHg (vægt lækkað) og bíkarbónat var 25mmól/L (eðlilegt). Röntgenmynd af lungum sýndi fremur grófgerð lungu en einnig íferðargrunsamlega breytingu í ofanverðu hægra lunga. Á tölvusneiðmynd sást héla (ground glass) í báðum lungum, mest ofan til (sjá mynd 1).
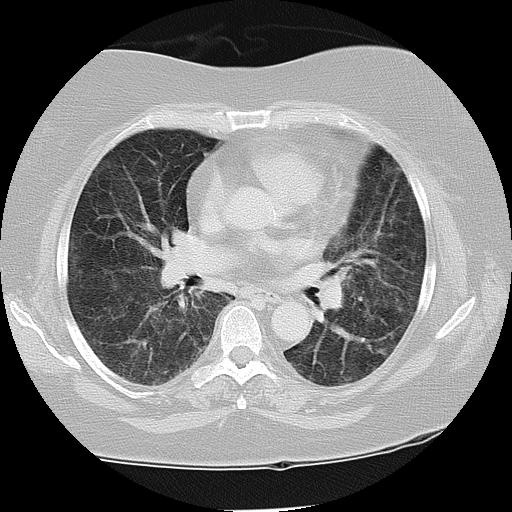
Mynd 1. Tölvusneiðmynd af lungum sjúklings, tekin stuttu eftir komu á Landspítala. Í báðum lungum eru hélubreytingar, greinilegastar aftan til í lungunum.
Sjúklingurinn var lagður inn til nánari greiningar á lungnabólgu af óþekktum toga. Leit að helstu lungnabólgubakteríum og öndunarfæraveirum var neikvæð. Berklarækt og Mantoux húðpróf voru neikvæð. Berkjuspeglun var gerð og berkjuskolsýni og vefjasýni úr berkju tekin. Í báðum sýnagerðum fannst Pneumocystis jiroveci (áður carinii).
Þar sem P. jiroveci sýkir almennt ekki einstaklinga með heilbrigt ónæmiskerfi var leitað að ónæmisbresti. Rafdráttur blóðpróteina var innan eðlilegra marka og mótefni gegn alnæmisveiru og lifrarbólguveirum fundust ekki. Af gigtarprófum var RF (IgG undirflokkur) jákvæður en ANA, ENA og ANCA neikvæð. Athygli vakti að frumuflæðisjártalning á eitilfrumum sýndi fækkun á öllum stofnum eitilfrumna, með hlutfallslega minni fækkun B- en T-frumna. CD4+ T-frumur voru 372 x106/L (eðl. 600-1200), CD8+ T-frumur voru 92 x106/L (eðl. 300-800) og B-frumur voru 84 x106/L (eðl. 100-400).
Meðferð var hafin við P. jiroveci lungnabólgu með trimetoprim og sulfamethoxazole, 480 mg í æð þrisvar sinnum á dag, auk 30 mg prednisólons um munn. Svörun var góð, með minnkandi mæði og hita og umtalsvert betri líðan. Sjúklingurinn útskrifaðist á trimetoprim-sulfamethoxazole töflum 15 dögum eftir komu á spítalann.
Pneumocystis lungnabólga (PCP), er fremur sjaldgæf sýking sem greinist helst hjá HIV-sýktum en einnig hjá einstaklingum með vissar tegundir krabbameins og/eða ónæmisbælingu. Í þessari grein verður fjallað um P. jiroveci og samverkandi þætti í myndun PCP, aðra en HIV og krabbamein, með áherslu á metótrexat og áfengi.
Pneumocystis lungnabólga
Pneumocystis hefur nýlega verið sett í ríki með sveppum og P. carinii gefið nýtt nafn P. jiroveci, en Pneumocystis var lengi talið frumdýr. Enn er margt á huldu um uppruna P. jiroveci sýkinga og um samskipti P. jiroveci og hýsils og ástæðu þess að hann sýkir nær eingöngu ónæmisbælda, en PCP var sjaldgæfur sjúkdómur fyrir tíma HIV-faraldursins (1). Blóðrannsóknir hafa sýnt að líklegast hefur meginþorri fólks komist í tæri við P. jiroveci fyrir fjögurra ára aldur og faraldsfræðilegar rannsóknir benda til þess að sýkillinn sé loftborinn og að smit milli manna sé mögulegt (2, 3).
Eftir innöndun P. jiroveci festist sýkillinn á alveolar-þekjufrumu af gerð 1 og veldur skaða á lungnablöðrum staðbundið, með tjáningu bólguhvetjandi efna svo sem "major surface antigen"(4). Þetta veldur aðkomu flestra frumutegunda ónæmiskerfisins, fyrst ósértækra átfrumna og síðan eitilfrumna en makrófagar miðla líklega endanlegri hreinsun P. jiroveci. Músatilraunir sýna að T-eitilfrumugerðirnar CD4+ og CD8+ eru báðar mikilvægar í sjúkdómsganginum. CD4+ frumur hemja vöxt og viðgang P. jiroveci, aðallega með Th1-eitilfrumusvörun (5,6) og teljast aðalvarnarfruman gegn PCP, en CD8+ frumur geta bæði varið og skaðað, í samræmi við frumudrepandi eiginleika þeirra (4). Hámarksstyrkur T-eitilfrumna í lungum verður líklega 2-3 vikum eftir P. jiroveci smit (7). Frekari rannsóknir hafa sýnt að vörn gegn P. jiroveci er kvikt jafnvægi sértækra og ósértækra varnarþátta þar sem lítið má útaf bregða áður en ónæmiskerfið fer að skaða lungnavef og klínísk mynd PCP kemur fram. Þeir hópar sem helst eru í hættu á að fá PCP eru sem fyrr segir HIV-sýktir með verulega fækkun á CD4+ frumum og einnig einstaklingar með T-eitilfrumuskerðingu af öðrum orsökum svo sem bráða-eitilfrumuhvítblæði eða eftir notkun barkstera.
Klínísk einkenni PCP eru ekki sértæk en þrenningin hiti, mæði og þurr hósti er til staðar í meira en helmingi tilfella. Einnig má oftast sjá minnkaða súrefnismettun og/eða hækkun á laktat dehydrogenasa í blóði. Einkenni eru iðulega hægt vaxandi í allmarga daga, og geta líkst astma, en sumir hafa hraðan sjúkdómsgang. Teikn við skoðun eru einnig ósértæk og eru helst þurrt brak í lungum við hlustun, auk hita og almenns slappleika. Einstaka sinnum veldur PCP loftbrjósti. Án meðferðar er PCP iðulega banvænn sjúkdómur sem veldur dauða helst með öndunarbilun. Dæmi eru um dreifingu P. jiroveci utan lungna, með dreifðum sjúkdómi í kjölfarið (1, 8). Dánartíðni PCP á spítala var í einni bandarískri samantekt metin 13,2% meðal HIV-sýktra og 40,6% meðal HIV-ósýktra (9). Þessi athyglisverði munur gæti stafað af verulega bættri meðferð HIV-sýktra eftir að vitund óx um hættuna á PCP hjá þeim sjúklingahópi.
Greining PCP byggir fyrst og fremst á grun rannsakanda þar sem P. jiroveci ræktast ekki, hvorki úr hráka né blóði og einkenni og myndgreining eru ósértæk. Á lungnamynd sjást oft dreifðar íferðir með eða án staðbundinna íferða en blöðrumyndun sést sjaldan. Þriðjungur hefur eðlilega lungnamynd við komu á spítala. Tölvusneiðmynd er sértækari og sýnir betur bólgubreytingar í lungnavefnum. Helstu lífeðlisfræðilegar breytingar eru: lækkun á súrefnismettun í blóði, lungnarýmd (Vital Capacity) minnkar, alveolar-arterial (A-a) mismunur eykst, og loftskiptageta (Dilutation of CO) minnkar.
Lokagreining PCP byggir á sérlitun P. jiroveci úr lungnaslími eða lungnavef. Helstu sérlitanir sem beitt er eru metenamín-silfurlitun og ónæmisfræðileg-flúrskinslitun, ýmist önnur hvor eða báðar, og er síðarnefnda sérlitunin talin næmari (10). Lungnaslím er ýmist fengið með hráka (sputum) eða með berkjuskoli. Næmi silfurlitunar var í einni rannsókn á HIV-smituðum, 55% í hrákasýni, 79% í berkjuskolvökva og 90% í sýni úr lungnavef (11) en þessar tölur eru nokkuð mismunandi milli rannsókna þó almennt virðist berkjuskol eða sýni úr lungnavef vera næmara til greiningar P. jiroveci en hrákasýni (12).
HIV-sýktir hafa meira af P. jiroveci í lungunum við sýkingu heldur en þeir sem ekki hafa HIV og er sérlitun fyrir P. jiroveci í berkjuskolvökva >95% næm rannsókn hjá HIV-sýktum en hlutfallið er lægra hjá HIV-ósýktum. Það er því mælt með að vefjasýni sé tekið úr HIV-ósýktum þar sem grunur er um PCP en berkjuskolvökvi er neikvæður (12, 13). Vert er að minnast á nýja rannsóknaraðferð sem er í þróun og gengur út á blóðmælingar beta-D glucans sem er upprunnið í vegg P. jiroveci. Nýlegar japanskar rannsóknir hafa sýnt gagnsemi þessara mælinga, bæði í frumgreiningu PCP og til að meta meðferðarsvörun (14, 15).
Kjörmeðferð PCP er trimetoprim-sulfamethoxazole, gefið í æð eða um munn. Í 20-50% tilfella dugir sú lyfjablanda ekki til, og er slíkur meðferðarbrestur (treatment failure) oftast vegna ofnæmis eða lyfjaaukaverkana, auk þess sem þekkt ofnæmi fyrir lyfinu kemur oft í veg fyrir ávísun þess í upphafi (16, 17, 18). HIV-sýktum virðist hættara við aukaverkunum trimetoprim-sulfamethoxazole en öðrum hópum (19).
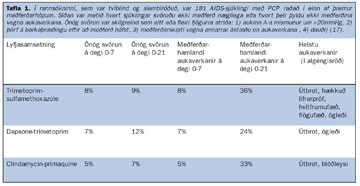
Aðrir meðferðarmöguleikar eru clindamycin og primaquine saman, um munn eða í æð eða dapsone og trimetoprim saman. Þessar þrjár lyfjasamsetningar eru taldar nokkuð sambærilegar með tilliti til árangurs en allar gjarnar á myndun aukaverkana. Í töflu I má sjá niðurstöðu rannsóknar á gjöf þessara þriggja lyfjasamsetninga hjá AIDS-sjúklingum með PCP.
Pentamidine í æð er annar valkostur í meðferð PCP og hefur annars konar aukaverkanir en ofannefndar samsetningar, til dæmis skaða á nýrum, háan blóðþrýsting og lágan blóðsykur. Ein rannsókn sýndi þó minni og hægari virkni gagnvart PCP, miðað við trimetoprim-sulfamethoxazole en lyfið er þó almennt talinn annar valkostur í alvarlegri Pneumocystis sýkingu (18). Atovaquone er ekki eins virkt og trimetoprim-sulfamethoxazole en einnig með minni aukaverkanir. HIV-sýktir með PCP þurfa almennt þriggja vikna sýklalyfjameðferð en fyrir aðra sjúklingahópa er miðað við tvær vikur (19).
Trimetoprim-sulfamethoxazole er einnig fyrsta val sem forvarnarlyf gegn PCP. Stærsti áhættuhópurinn eru HIV sýktir með CD4+ talningu <200x106/L eða með önnur AIDS-skilgreinandi veikindi svo sem Candida sýkingu í munni (20). Trimetoprim-sulfamethoxazole veldur meðferðartakmarkandi aukaverkunum hjá 30-40% sjúklinga á forvarnarskömmtum en hugsanlega má lækka það hlutfall með því að hefja meðferðina hægt (21, 22). Innandað pentamidine, dapsone-töflur eða atovaquone-töflur eru aðrir valkostir (23).
Ábendingar fyrir lyfjaforvörn gegn PCP fyrir aðra hópa ónæmisbældra eru ekki eins skýrar. Í grein frá 2003 er stungið uppá að þrír sjúklingahópar fái forvörn gegn PCP. Fyrsti hópurinn er ofannefndur HIV-hópur, annar hópurinn eru sjúklingar í lyfjameðferð við bráða-eitilfrumuhvítblæði (ALL) eða non-Hodgkins eitlakrabbameini og sá þriðji eru sjúklingar sem nota 20 mg eða meira af prednisólon í meira en tvær vikur samfleytt (22, 24). Barksterar eru sjálfstæður áhættuþáttur fyrir PCP og tengslin milli þeirra hafa verið þekkt í allmörg ár (25, 26).
Hugsanlegt er að nota megi CD4+ eitilfrumutalningu sem vísbendingu um hættu á PCP hjá ónæmisbældum sem ekki hafa HIV, líkt og gert er hjá HIV sýktum (22, 27).
Auk sýklalyfja hefur gagnsemi barkstera hjá HIV-sýktum með PCP og súrefnisþrýsting undir 70mmHg verið sönnuð (28). Gagnsemi barkstera hjá HIV-ósýktum er ekki eins skýr en rannsóknir þess efnis eru fáar (29, 30). Gagnsemin byggist á bólgueyðandi áhrifum barkstera, þar sem deyjandi sýklar geta aukið bólgusvar í lungum og þar með öndunarbilunareinkenni. Oft er þörf á öndunarstuðningi, sérstaklega á fyrstu dögunum, og búast má við að öndunarbilun versni á fyrstu dögum eftir upphaf sýklalyfjameðferðar (1, 9).
Metótrexat og Pneumocystis
Metótrexat er lyf sem bælir díhýdrófólat redúktasa í frumum og bælir þar með myndun púrína og pýrimidína, byggingareininga DNA og RNA. Þetta veldur ójafnvægi í DNA-efnaskiptum og ýtir frumum oft í sjálfsstýrðan frumudauða. Metótrexat í lágum skömmtum er talið bæla púrín umfram pýrimidín (31). Metótrexat hefur áhrif á allar frumur en mest áhrif á þær frumugerðir sem skipta sér oft, svo sem æxlisfrumur, beinmergsfrumur og slímhúðarþekjufrumur. Þetta skýrir bæði verkun og hliðarverkanir lyfsins, en metótrexat er helst notað gegn krabbameini, svo sem hvítblæði eða eitilfrumukrabbameini og einnig gegn sjálfsofnæmissjúkdómum svo sem liðagigt. Helstu hliðarverkanir aðrar en beinmergs- og ónæmisbæling eru: lifrarskemmdir, sár í meltingarvegi (mucositis, stomatitis), millivefsbólga lungna (interstitial pneumonitis) og frjósemisskerðing (32). Eituráhrif metótrexats eru tengd bæði meðferðarlengd og heildarmagni lyfsins (33).
Áhrifin á beinmerg eru mismikil á mismunandi frumulínur og almennt er talað um metótrexat sem T-eitilfrumubælandi lyf en rannsóknir hafa sýnt að virkni þess er fjölþætt þegar kemur að ónæmisbælingu. Áhrifin virðast að einhverju leyti vera vegna frumudauða T-eitilfrumna (34) en einnig hefur verið sýnt fram á bælingu á virkjun T-eitilfrumna og bælingu á tjáningu millifrumutengja T-frumna, svo sem ICAM-1 (35). Þessi bæling T-frumna kemur að miklu gagni við meðferð sjúkdóma svo sem liðagigtar og sóra en getur einnig lagt grunn að hliðarverkunum svo sem sýkingum (36).
Þar sem ónæmisfræðileg vörn gegn P. jiroveci er að miklu leyti háð T-frumum þá er einstaklingum á metótrexati hætt við Pneumocystis lungnabólgu. Greint hefur verið frá allnokkrum slíkum tilfellum en þau eiga það flest sammerkt að metótrexat-skammturinn er yfir 15 mg á viku, sjúklingurinn hefur liðagigt eða annan sjálfsónæmisjúkdóm, og í flestum tilfellunum tekur sjúklingurinn barkstera daglega (37, 38, 39, 40). Einnig eru dæmi um einstaklinga sem eingöngu tóku metótrexat, og höfðu ekki aðra þekkta ónæmisbælingu, en þá voru skammtarnir hærri, um og yfir 35 mg á viku, (41) eða aðrir flækjandi þættir til staðar svo sem nýrnabilun (sem tefur útskilnað metótrexats) eða notkun salílyfja (NSAID) (19). Höfundum er ekki kunnugt um vinnureglur varðandi forvarnarsýklalyf gegn PCP hjá sjúklingum á háskammta metótrexati. Slíkri meðferð er helst beitt gegn krabbameinum og því oft um víðtæka ónæmisbælingu að ræða.
Milliverkun salílyfja og metótrexats er vel þekkt, en nákvæmur verkunarmáti þeirrar milliverkunar er óþekktur. Kenningar eru um að salílyf annað hvort minnki útskilnað metótrexats um nýrun, ýti metótrexati burt af burðarpróteinum og auki þar með blóðstyrk frjáls metótrexats eða trufli umbrot metótrexats í lifur, en mögulega er um blöndu allra þessara verkunarmáta að ræða (42).
Nokkuð algengt er að eitilfrumufæð sjáist í blóði PCP sjúkra sem tekið hafa metótrexat, samanber beinmergsbælandi áhrif metótrexats, en það er þó alls ekki alltaf til staðar (29).
Tímalengd metótrexat meðferðar er mjög mismunandi í þeim tilfellum PCP sem lýst hefur verið en dæmi eru um að PCP hafi greinst innan við mánuð frá upphafi meðferðar þó að oftast sé meðferðartíminn allnokkrir mánuðir (43).
Í grein Duncan og félaga (44) er að finna fjórar áhugaverðar athugasemdir varðandi samspil metótrexats og PCP:
1. Hætta á PCP ætti að vera skráð sem alvarleg aukaverkun lágskammta metótrexatmeðferðar.
2. Samhliða barksteranotkun getur aukið hættuna á PCP.
3. Jafnvel væg öndunarfæraeinkenni hjá sjúklingi á lágskammta metótrexatmeðferð ætti að meta með tilliti til möguleika á PCP.
4. Eðlileg hvítfrumutalning útilokar ekki möguleikann á tækifærissýkingu svo sem PCP.
Hvað varðar fyrsta atriðið þá skal þess getið að komin er málsgrein um áhættu á myndun PCP í lyfjatexta metótrexat taflna í Sérlyfjaskrá Lyfjastofnunar Íslands (32).
Áfengismisnotkun og Pneumocystis
Lyfið metótrexat er vel þekkt að ónæmisbælandi áhrifum sínum, enda markaðssett sem slíkt, en hið sama verður ekki sagt um etanól, þó ónæmisfræðileg áhrif þess séu töluverð. Áhrif etanóls á lífverur hafa verið rannsökuð ítarlega, allt frá áhrifum á frumdýr og frumur í rækt til stórra hópa fólks í lýðfræðilegum rannsóknum. Einn angi þeirra rannsókna eru áhrif skammrar og langvinnrar neyslu áfengis á ónæmiskerfi manna og annarra spendýra.
Lýðfræðilegar rannsóknir hafa sýnt að sýkingar eru algengasta orsök dauða hjá áfengissjúklingum. Vannæring, vítamínskortur, lifrarskemmdir og bágar félagsaðstæður eiga hlut í skýringunni en einnig ónæmisbælandi áhrif etanóls (45,46). Allmargar rannsóknir eru til þar að lútandi, til dæmis hefur verið sýnt fram á fækkun neutrófíla í blóði (47), rýrnun milta og hóstarkirtils, (40, 42) skerðingu reticuloendothelial-kerfisins (RES), (48) skerðingu sýnifrumna (antigen presenting cells) svo sem makrófaga (49) og síðast en ekki síst, áhrif á eitilfrumur.
Rottutilraunir hafa sýnt að myndun innanfrumuboðefnisins mikilvæga cyclic-AMP í eitilfrumum er skert í réttu hlutfalli við magn etanóls í blóði, þar sem etanól hemur myndun þess beint með fleiri en einum hætti (50). Slík röskun á innanfrumuboðkerfi getur haft gríðarleg áhrif á alla virkni frumu, allt frá genatjáningu til frumuskiptinga og á líklega einhvern þátt í þeim fjölþættu breytingum sem verða á eitilfrumum áfengissjúklinga. Rottutilraunir hafa einnig sýnt heildarfækkun eitilfrumna í milta eftir langvinna áfengisgjöf; B-frumum og CD4+ T-frumum fækkar en fjöldi CD8+ frumna breytist ekki (40). Rannsókn á músum frá 1998 sýndi minnkaða færslu eitilfrumna í lungu músa í tengslum við langvinna áfengisgjöf. Mýsnar voru smitaðar með P. jiroveci og helmingur þeirra síðan alinn á alkóhólblöndu og reyndist sá hópur hafa mun færri CD4+ og CD8+ frumur í lungunum en viðmið þremur vikum eftir smit (7).
Áfengissjúklingar sem leggjast á spítala vegna áfengislifrarbólgu hafa færri T-eitilfrumur í blóði (51) en viðmið og 6,7% þeirra hafa CD4+ gildi undir 300/µl (52) en ljóst er að vannæring á þar einnig hlut að máli. In vitro rannsóknir á mannafrumum hafa sýnt hemjandi áhrif etanóls á myndun IL-2 og vaxtarhvetjandi (mitogenic) frumuboðefni í T-eitilfrumum (53). Tilraun, þar sem rottum var skammtað etanólfæði sem olli fíkn, sýndi fram á verulega minnkaða svörun T- og B-eitilfrumna við vaxtarhvetjandi frumuboðefnum og olli það marktækri eitilfrumufæð sem lagaðist fjótlega er etanólneyslu lauk þótt eitilfrumuvirknin væri skert lengur (42).
Sýnt hefur verið fram á tengsl milli etanóls og P. jiroveci lungnabólgu í músum, en höfundar hafa ekki fundið heimildir þar sem etanól er talið beinn áhrifavaldur í myndun Pneumocystis sýkingar í mönnum og einungis fáar þar sem etanól er talið hluti orsakarinnar (54,55). Árið 1998 var birt rannsókn þar sem mýs fengu etanólfæði og P. jiroveci var síðan komið fyrir í öndunarvegi. Fjórum vikum seinna voru 2/3 músanna með PCP á fremur vægu stigi, en engin músanna í viðmiðunarhópnum, sem ekki fékk áfengisfæði. Mýs sem gerðar voru CD4+ eitilfrumusnauðar fengu svæsna sýkingu hvort sem þær voru á áfengisfæði eða ekki sem undirstrikar enn á ný mikilvægi CD4+ frumna í P. jiroveci ónæmissvörun. Í sömu rannsókn var sýnt fram á tengsl milli etanóls og minnkaðrar framleiðslu CD4+ frumna á IFN-y, sem virkjar makrófaga og tengist Th1-boðleiðinni (6). Nýlegar rannsóknir hafa haldið fram þeim möguleika að langvarandi áfengisneysla ýti ónæmissvari T-frumna frá Th1-boðleiðinni (frumubundið svar) að Th2-boðleiðinni (vessabundið svar) (56).
Auk áhrifa á eitilfrumur hefur etanól áhrif á TNFa-myndun lungna-makrófaga sem svar við lípópólýsakkaríði (LPS), en TNFa er eitt grunnboðefna ósértæka ónæmissvarsins. Etanól bælir einnig nituroxíð (NO) og súrefnisróttæklinginn O2-. Bæling þessara þriggja efna myndi að líkindum hafa veruleg áhrif á ósértækt ónæmissvar lungnavefs gegn bakteríum og ef til vill öðrum sýklum (57).
Enn fleiri áhrif etanóls á sértækt og ósértækt ónæmissvar hafa verið greind, meðal annars bæling á frumuáti makrófaga (58) og myndun NF?B í makrófögum (59), bæling á aðdráttarboðefnum (chemoattractants) sem verka á neutrófíla (60) og bæling á viðloðun neutrófíla við æðaþel (61) auk bælingar á drápvirkni neutrófíla gagnvart bakteríum (62). Þá eru ótalin áhrif lifrarskemmda og/eða lifrarbilunar á ónæmiskerfið í heild. Af framansögðu er ljóst að áfengissjúklingar eru markvert ónæmisbældir og virðast umfram annað vera viðkvæmir fyrir lungnasýkingum.
Umræða
Í tilfellinu sem kynnt er hér fékk HIV-neikvæð kona lífshættulega P. jiroveci lungnabólgu, sýkingu sem eingöngu leggst á ónæmisbælda. Hún neytti verulegs magns áfengis daglega og tók metótrexat, í skammtinum 10 mg á viku, sem telst lágskammtameðferð. Einnig notaði hún Arthrotec®. , sem er í flokki NSAID-lyfja, sem geta aukið áhrif metótrexats. Hún hafði einnig sögu um sóraliðagigt, sem líkt og gigtsjúkdómar almennt, tengist bælingu og breytingu ónæmissvarsins og hefur verið tengd við myndun sýkinga, svo sem PCP (63). Hún hafði ekki aðrar þekktar orsakir ónæmisbælingar og ekki var grunur um endurvakningu brjóstakrabbameins, né önnur krabbamein. Athyglisvert er að hún var með fækkun eitilfrumna í blóði og við deilitalningu var fækkun mest á T-frumum. Eitilfrumufæð er mjög vel þekkt í sjúklingum með PCP en er fremur talin orsök en afleiðing sýkingarinnar (29).
Það er álit höfunda að orsök eitilfrumufæðarinnar og P. jiroveci sýkingarinnar í þessu tilfelli hafi verið sambland af áhrifum etanóls, metótrexats og sóraliðagigtar. Þar sem metótrexat skammturinn var lágur og sóraliðagigtin ekki á háu stigi, virðist okkur etanólið óvenju sterkur áhættuþáttur í þessu tilfelli.
Mikilvægt er að hafa P. jiroveci lungnabólgu ávallt í huga sem mögulega mismunagreiningu hjá fólki á ónæmisbælandi meðferð, svo sem metótrexati og barksterum og þeirra sem eru ónæmisbældir vegna sjúkdóma svo sem alnæmis, krabbameins, gigtsjúkdóms eða áfengissýki. Einnig þurfa læknar að hafa í huga hvort einstaklingur sem tilheyrir ofannefndum hópum þurfi forvarnarmeðferð gegn PCP, í lengri eða skemmri tíma.
Að síðustu er rétt að geta þess að áfengissýki er skráð frábending fyrir metótrexatmeðferð (32), og nauðsynlegt er að læknar spyrji alla þá sem hefja slíka meðferð ítarlega um áfengisnotkun.
Þakkir
Þakkir fær starfsfólk röntgendeildar Landspítala við Hringbraut fyrir aðstoð við afritun myndgagna, til notkunar í þessari grein.
Heimildir
1 Wilkin A, Feinberg J. Pneumocystis carinii pneumonia: a clinical review. Am Fam Physician 1999; 60: 1699-708, 1713-4
2 Morris A, Beard CB, Huang L. Update on the epidemiology and transmission of Pneumocystis carinii. Microbes Infect. 2002; 4: 95-103.
3 Lundgren B, Elvin K, Rothman LP, Ljungstrom I, Lidman C, Lundgren JD. Transmission of Pneumocystis carinii from patients to hospital staff. Thorax. 1997; 52: 422-4.
4 Benfield TL. Clinical and experimental studies on inflammatory mediators during AIDS-associated Pneumocystis carinii pneumonia Dan Med Bull 2003; 50: 161-76
5 Hanano R, Kaufmann SH. Pneumocystis carinii and the immune response in disease. Trends Microbiol 1998 Feb; 6: 71-5
6 Shellito JE. Alcohol and host defense against pulmonary infection with Pneumocystis carinii.?Alcohol Clin Exp Res 1998; 22 (5 Suppl):208S-211S.
7 Shellito JE, Olariu R. Alcohol decreases T-lymphocyte migration into lung tissue in response to Pneumocystis carinii and depletes T-lymphocyte numbers in the spleens of mice. Alcohol Clin Exp Res. 1998; 22: 658-63.
8 Barry SM, Johnson MA. Pneumocystis carinii pneumonia: a review of current issues in diagnosis and management. HIV Med 200; 2: 123-32.
9 Mansharamani NG, Garland R, Delaney D, Koziel H. Management and outcome patterns for adult Pneumocystis carinii pneumonia, 1985 to 1995: comparison of HIV-associated cases to other immunocompromised states. Chest 2000 Sep;118(3):704-11
10 Procop GW, Haddad S, Quinn J, Wilson ML, Henshaw NG, Reller LB et al. Detection of Pneumocystis jiroveci in respiratory specimens by four staining methods. J Clin Microbiol 2004 Jul;42(7):3333-5.
11 Pitchenik AE, Ganjei P, Torres A, Evans DA, Rubin E, Baier H. Sputum examination for the diagnosis of Pneumocystis carinii pneumonia in the acquired immunodeficiency syndrome. Am Rev Respir Dis 1986 Feb;133(2):226-9.
12 Huang L, Hecht FM, Stansell JD, Montanti R, Hadley WK, Hopewell PC. Suspected Pneumocystis carinii pneumonia with a negative induced sputum examination. Is early bronchoscopy useful? Am J Respir Crit Care Med. 1995 Jun;151(6):1866-71.
13 Limper AH, Offord KP, Smith TF, Martin WJ 2nd. Pneumocystis carinii pneumonia. Differences in lung parasite number and inflammation in patients with and without AIDS. Am Rev Respir Dis. 1989 Nov;140(5):1204-9.
14 Kawagishi N, Miyagi S, Satoh K, Akamatsu Y, Sekiguchi S, Satomi S. Usefulness of beta-D: glucan in diagnosing Pneumocystis carinii pneumonia and monitoring its treatment in a living-donor liver-transplant recipient. J Hepatobiliary Pancreat Surg. 2007;14(3):308-11.
15 Tasaka S, Hasegawa N, Kobayashi S, Yamada W, Nishimura T, Takeuchi T, et al. Serum indicators for the diagnosis of pneumocystis pneumonia. Chest. 2007 Apr;131(4):1173-80.
16 Colby C, McAfee S, Sackstein R, Finkelstein D, Fishman J, Spitzer T. A prospective randomized trial comparing the toxicity and safety of atovaquone with trimethoprim/sulfamethoxazole as Pneumocystis carinii pneumonia prophylaxis following autologous peripheral blood stem cell transplantation. Bone Marrow Transplant. 1999 Oct;24(8):897-902.
17 Safrin S, Finkelstein DM, Feinberg J, Frame P, Simpson G, Wu A et al. Comparison of three regimens for treatment of mild to moderate Pneumocystis carinii pneumonia in patients with AIDS. A double-blind, randomized, trial of oral trimethoprim-sulfamethoxazole, dapsone-trimethoprim, and clindamycin-primaquine. ACTG 108 Study Group. Ann Intern Med. 1996 May 1;124(9):792-802.
18 Sattler FR, Cowan R, Nielsen DM, Ruskin J. Trimethoprim-sulfamethoxazole compared with pentamidine for treatment of Pneumocystis carinii pneumonia in the acquired immunodeficiency syndrome. A prospective, noncrossover study. Ann Intern Med. 1988 Aug 15;109(4):280-7.
19 Kovacs JA, Hiemenz JW, Macher AM, Stover D, Murray HW, Shelhamer J et al. Pneumocystis carinii Pneumonia: A Comparison Between Patients with the Acquired Immodeficiency Syndrome and Patients with Other Immunodeficiencies. Ann Intern Med. 1984 May;100(5):663-71.
20 2002 USPHS/IDSA guidelines for the prevention of opportunistic infection in persons infected with human immunodeficiency virus: US Public Health Service (USPHS) and Infectious Diseases Society of America (IDSA). Vefsíða: http://www.aidsinfo.nih.gov/guidelines/
21 Leoung GS, Stanford JF, Giordano MF, Stein A, Torres RA, Giffen CA et al. Trimethoprim-sulfamethoxazole (TMP-SMZ) dose escalation versus direct rechallenge for Pneumocystis Carinii pneumonia prophylaxis in human immunodeficiency virus-infected patients with previous adverse reaction to TMP-SMZ. J Infect Dis. 2001 Oct 15;184(8):992-7.
22 Mathew BS, Grossman SA. Pneumocystis carinii pneumonia prophylaxis in HIV negative patients with primary CNS lymphoma.Cancer Treat Rev. 2003 Apr;29(2):105-19
23 Warnock AC, Rimland D. Comparison of trimethoprim-sulfamethoxazole, dapsone, and pentamidine in the prophylaxis of Pneumocystis carinii pneumonia. Pharmacotherapy. 1996 Nov-Dec;16(6):1030-8.
24 Slivka A, Wen PY, Shea WM, Loeffler JS. Pneumocystis carinii pneumonia during steroid taper in patients with primary brain tumors. Am J Med. 1993 Feb;94(2):216-9.
25 Walzer PD, Powell RD Jr, Yoneda K, Rutledge ME, Milder JE. Growth characteristics and pathogenesis of experimental Pneumocystis carinii pneumonia. Infect Immun. 1980 Mar;27(3):928-37.
26 Walzer PD, LaBine M, Redington TJ, Cushion MT. Lymphocyte changes during chronic administration of and withdrawal from corticosteroids: relation to Pneumocystis carinii pneumonia. J Immunol. 1984 Nov;133(5):2502-8.
27 Mansharamani NG, Balachandran D, Vernovsky I, Garland R, Koziel H. Peripheral blood CD4 + T-lymphocyte counts during Pneumocystis carinii pneumonia in immunocompromised patients without HIV infection. Chest. 2000 Sep;118(3):712-20.
28 Briel M, Bucher HC, Boscacci R, Furrer H. Adjunctive corticosteroids for Pneumocystis jiroveci pneumonia in patients with HIV-infection. Cochrane Database Syst Rev. 2006 Jul 19;3:CD006150.
29 Pareja JG, Garland R, Koziel H.Use of adjunctive corticosteroids in severe adult non-HIV Pneumocystis carinii pneumonia. Chest. 1998 May;113(5):1215-24.
30 Delclaux C, Zahar JR, Amraoui G, Leleu G, Lebargy F, Brochard L, et al. Corticosteroids as adjunctive therapy for severe Pneumocystis carinii pneumonia in non-human immunodeficiency virus-infected patients: retrospective study of 31 patients. Clin Infect Dis. 1999 Sep;29(3):670-2.
31 Kremer JM. Methotrexate and leflunomide: biochemical basis for combination therapy in the treatment of rheumatoid arthritis. Semin Arthritis Rheum. 1999 Aug;29(1):14-26.
32 Sérlyfjaskrá Lyfjastofnunar Íslands. Vefsíða: http://www.lyfjastofnun.is /júlí 2007
33 Goldie JH, Price LA, Harrap KR. Methotrexate toxicity: correlation with duration of administration, plasma levels, dose and excretion pattern. Eur J Cancer 1972; 8: 409-14.
34 Genestier L, Paillot R, Fournel S, Ferraro C, Miossec P, Revillard JP. Immunosuppressive properties of methotrexate: apoptosis and clonal deletion of activated peripheral T cells. J Clin Invest 1998 15; 102: 322-8.
35 Johnston A, Gudjonsson JE, Sigmundsdottir H, Ludviksson BR, Valdimarsson H. The anti-inflammatory action of methotrexate is not mediated by lymphocyte apoptosis, but by the suppression of activation and adhesion molecules. Clin Immunol 2005; 114: 154-63.
36 Weinblatt ME, Maier AL, Fraser PA, Coblyn JS. Longterm prospective study of methotrexate in rheumatoid arthritis: conclusion after 132 months of therapy. J Rheumatol. 1998; 25: 238-42.
37 Krebs S, Gibbons RB. Low-dose methotrexate as a risk factor for Pneumocystis carinii pneumonia. Mil Med. 1996 Jan;161(1):58-60.
38 Kaneko Y, Suwa A, Ikeda Y, Hirakata M. Pneumocystis jiroveci pneumonia associated with low-dose methotrexate treatment for rheumatoid arthritis: report of two cases and review of the literature. Mod Rheumatol. 2006;16(1):36-8.
39 Marinosa M, Soler A, Nogues X, Pedro-Botet J. Pulmonary coinfection by Pneumocystis carinii and Aspegillus fumigatus in a seronegative arthritis patient treated with low-dose methotrexate. Clin Rheumatol. 2004 Dec;23(6):555-6.
40 Roblot F, Godet C, Le Moal G, Garo B, Faouzi Souala M, Dary M, et al. Analysis of underlying diseases and prognosis factors associated with Pneumocystis carinii pneumonia in immunocompromised HIV-negative patients. Eur J Clin Microbiol Infect Dis. 2002 Jul;21(7):523-31
41 Barbier C, Arnaout L, Schmit C, Aucouturier JS, Ricome JL, Loubieres Y. Respiratory failure due to Pneumocystis carinii following methotrexate therapy for gestational trophoblastic disease. BJOG. 2005 Mar;112(3):382-3
42 Frenia ML, Long KS. Methotrexate and nonsteroidal antiinflammatory drug interactions. Ann Pharmacother. 1992 Feb;26(2):234-7
43 Hilliquin P, Renoux M, Perrot S, Puechal X, Menkes CJ. Occurrence of pulmonary complications during methotrexate therapy in rheumatoid arthritis. Br J Rheumatol. 1996 May;35(5):441-5.
44 Duncan KO, Imaeda S, Milstone LM. Pneumocystis carinii pneumonia complicating methotrexate treatment of pityriasis rubra pilaris. J Am Acad Dermatol. 1998 Aug;39(2 Pt 1):276-8.
45 Helm RM, Wheeler G, Burks AW, Hakkak R, Badger TM. Flow cytometric analysis of lymphocytes from rats following chronic ethanol treatment. Alcohol. 1996 Sep-Oct;13(5):467-71.
46 Jerrells TR, Marietta CA, Bone G, Weight FF, Eckardt MJ. Ethanol-associated immunosuppression. Adv Biochem Psychopharmacol. 1988;44:173-85.
47 Jerrells TR, Marietta CA, Eckardt MJ, Majchrowicz E, Weight FF. Effects of ethanol administration on parameters of immunocompetency in rats. J Leukoc Biol. 1986 May;39(5):499-510.
48 Ali MV, Nolan JP. Alcohol induced depression of reticuloendothelial function in the rat. J Lab Clin Med. 1967 Aug;70(2):295-301.
49 Szabo G. Consequences of alcohol consumption on host defence. Alcohol Alcohol. 1999 Nov-Dec;34(6):830-41.
50 Pauly T, Dahmen N, Szegedi A, Wetzel H, Bol GF, Ferdinand K et al. Blood ethanol levels and adenylyl cyclase activity in lymphocytes of alcoholic patients. Biol Psychiatry. 1999 Feb 15;45(4):489-93.
51 Roselle GA, Mendenhall CL, Grossman CJ, Weesner RE. Lymphocyte subset alterations in patients with alcoholic hepatitis. J Clin Lab Immunol. 1988 Aug;26(4):169-73.
52 Roselle GA, Mendenhall CL, Chedid A, Moritz TE, Gartside P. Alcohol modulation of immune function: clinical and experimental data. Alcohol Clin Exp Res. 1995 Jun;19(3):551-4.
53 Chiappelli F, Kung M, Lee P, Pham L, Manfrini E, Villanueva P. Alcohol modulation of human normal T-cell activation, maturation, and migration. Alcohol Clin Exp Res. 1995 Jun;19(3):539-44.
54 Ichai P, Azoulay D, Feray C, Saliba F, Antoun F, Roche B, et al. Pneumocystis carinii and cytomegalovirus pneumonia after corticosteroid therapy in acute severe alcoholic hepatitis: 2 case reports. Gastroenterol Clin Biol. 2002 May;26(5):532-4.
55 Riebold D, Hennig A, Loebermann M, Schareck W, Reisinger EC. Pneumocystis pneumonia in an alcoholic patient with prolonged mechanical ventilation. Eur J Clin Microbiol Infect Dis. 2005 Apr;24(4):294-6.
56 Latif O, Peterson JD, Waltenbaugh C. Alcohol-mediated polarization of type 1 and type 2 immune responses. Front Biosci. 2002 Aug 1;7:a135-47.
57 D?Souza NB, Nelson S, Summer WR, Deaciuc IV. Alcohol modulates alveolar macrophage tumor necrosis factor-alpha, superoxide anion, and nitric oxide secretion in the rat. Alcohol Clin Exp Res. 1996 Feb;20(1):156-63.
58 Bagasra O, Howeedy A, Kajdacsy-Balla A. Macrophage function in chronic experimental alcoholism. I. Modulation of surface receptors and phagocytosis. Immunology. 1988 Nov;65(3):405-9.
59 Mandrekar P, Dolganiuc A, Bellerose G, Kodys K, Romics L, Nizamani R, et al. Acute alcohol inhibits the induction of nuclear regulatory factor kappa B activation through CD14/toll-like receptor 4, interleukin-1, and tumor necrosis factor receptors: a common mechanism independent of inhibitory kappa B alpha degradation? Alcohol Clin Exp Res. 2002 Nov;26(11):1609-14.
60 MacGregor RR, Gluckman SJ, Senior JR. Granulocyte function and levels of immunoglobulins and complement in patients admitted for withdrawal from alcohol. J Infect Dis. 1978 Dec;138(6):747-55.
61 Zhang P, Bagby GJ, Xie M, Stoltz DA, Summer WR, Nelson S. Acute ethanol intoxication inhibits neutrophil beta2-integrin expression in rats during endotoxemia. Alcohol Clin Exp Res. 1998 Feb;22(1):135-41.
62 Tamura DY, Moore EE, Partrick DA, Johnson JL, Offner PJ, Harbeck RJ, et al. Clinically relevant concentrations of ethanol attenuate primed neutrophil bactericidal activity. J Trauma. 1998 Feb;44(2):320-4.
63 Iikuni N, Kitahama M, Ohta S, Okamoto H, Kamatani N, Nishinarita M. Evaluation of Pneumocystis pneumonia infection risk factors in patients with connective tissue disease. Mod Rheumatol. 2006;16(5):282-8.
