04. tbl 93. árg. 2007
Fræðigrein
Nýrnafrumukrabbamein á Íslandi
- yfirlitsgrein
Ágrip
Nýrnafrumukrabbamein er langalgengasta illkynja æxlið í nýrum og nýgengi þess er vaxandi víðast hvar í heiminum. Á síðustu tveimur áratugum hefur þekking á nýrnafrumukrabbameini aukist verulega, ekki síst skilningur á erfða- og ónæmisfræði sjúkdómsins. Engu að síður er lítið vitað um orsakir og áhættuþætti samanborið við mörg önnur krabbamein. Þetta á ekki síst við um tengsl erfða við nýrnafrumukrabbamein. Sjúkdómurinn getur verið nánast einkennalaus og margir greinast með langt genginn sjúkdóm, þar sem langtímahorfur eru mun lakari en þegar um staðbundið krabbamein er að ræða. Á Íslandi er nýrnafrumukrabbamein óvenjualgengt og nýgengi er með því hæsta sem þekkist. Árlega greinast í kringum 30 tilfelli og má gera ráð fyrir að tæplega helmingur sjúklinganna látist úr sjúkdómnum.
Hér er farið yfir einkenni þessa margslungna sjúkdóms og getið helstu rannsókna. Sérstök áhersla er lögð á nýrnafrumukrabbamein á Íslandi og íslenskar rannsóknir kynntar.
Inngangur
Af illkynja æxlum í nýrum er nýrnafrumukrabbamein (renal cell carcinoma*, adenocarcinoma renis) það langalgengasta, eða um 86% samkvæmt íslenskum rannsóknum (1-3). Nýrnaskjóðuæxli (transitional cell cancer of the pelvis) eru næstalgengust (8%) (4) en hlutfall Wilmsæxla, sem langoftast greinast í ungum börnum, er einungis 1,5% (5). Önnur illkynja æxli í nýrum, eins og sarkmein og eitilkrabbamein, eru enn sjaldgæfari.
Nýrnafrumukrabbamein er þekkt fyrir margbreytilega hegðun og einkenni eru lúmsk. Þetta tefur oft greiningu og meðferð. Nýgengi sjúkdómsins hefur aukist á heimsvísu og jafnframt hefur þekkingu á sjúkdómnum fleygt fram, ekki síst innan erfða- og sameindalíffræði. Margt bendir til þess að lífshorfur sjúklinga með nýrnafrumukrabbamein muni batna í náinni framtíð. Meðferð með ónæmishvetjandi lyfjum er í örri þróun en þessi lyf geta nýst sjúklingum með útbreitt nýrnafrumukrabbamein. Einnig hafa orðið framfarir á sviði skurðlækninga og gjörgæslu sem leitt hefur til betri árangurs af skurðmeðferð. Mest áhrif á lífshorfur hópsins í heild hefur þó sennilega aukinn fjöldi nýrnafrumukrabbameina sem greinast fyrir tilviljun. Þessa þróun má aðallega rekja til aukinna myndrannsókna á kviði, einkum ómskoðana og tölvusneiðmyndatöku. Þar sem tilviljanagreindu æxlin reynast oftast á lægri stigum eru horfur þessara sjúklinga betri.
Íslenskar rannsóknir á nýrnafrumukrabbameini
Árið 1981 birtist fyrsta stóra rannsóknin á nýrnafrumukrabbameini á Íslandi. Það var meinafræðilega úttekt á nýrnakrabbameinum greindum 1955-1974 (6). Frá 1992 hefur birst á annan tug vísindagreina um nýrna- og nýrnafrumukrabbamein á Íslandi sem höfundar þessarar greinar hafa komið að (1, 2, 4, 5, 7-15). Rannsóknirnar hafa birst jafnt í erlendum og íslenskum vísindaritum. Sammerkt öllum rannsóknunum er að þær ná til þjóðarinnar allrar. Því er um einstakan sjúklingaefnivið að ræða. Í sumum rannsóknanna er um að ræða tilfelli sem greindust aftur til ársins 1955 (11) þegar Krabbameinsskrá KÍ var stofnuð, samtals yfir 1200 tilfelli greind fram á daginn í dag. Flestar greinanna styðjast þó við tilfelli sem greindust á 30 ára tímabili, frá 1971 til 2000 (9, 10, 12). Ítarlegar klínískar og meinafræðilegar upplýsingar liggja því fyrir um tæplega 700 sjúklinga. Aðaláhersla hefur verið lögð á faraldsfræði sjúkdómsins hér á landi (1, 12), en einnig á klíníska hegðun hans og árangur skurðaðgerða (2, 8, 9, 12, 15). Tilviljanagreind nýrnafrumukrabbamein hafa verið skoðuð sérstaklega og áhrif þeirra á horfur sjúklingahópsins í heild (8, 12). Auk þess hefur verið lagt mat á áhættuþætti lífshorfa, bæði klíníska en ekki síður meinafræðilega (2, 8, 9). Loks hefur verið könnuð fjölskyldulægni sjúkdómsins hér á landi (11). Leit að meingeni sjúkdómsins stendur yfir í samstarfi við Íslenska erfðagreiningu og nýlega er hafin á Landspítala umfangsmikil rannsókn á próteintjáningu (proteomics) nýrnafrumukrabbameinsæxla. Einnig er fyrirhugað að kanna umhverfis- og áhættuþætti sjúkdómsins hér á landi í samvinnu við Hjartavernd.
Nýgengi og faraldsfræði
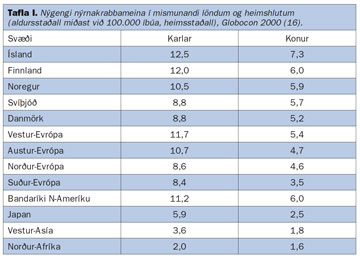
Af óþekktum ástæðum er nýgengi nýrnakrabbameins á Íslandi með því hæsta sem gerist í heiminum (3, 16) og skýrist það fyrst og fremst af hárri tíðni nýrnafrumukrabbameins. Á tímabilinu 1998-2002 var nýgengi krabbameina í nýrum hjá íslenskum körlum 14,7/100.000 en 7,4/100.000 hjá konum (3). Árlega greinast hér á landi um 30 manns með nýrnafrumukrabbamein og gera má ráð fyrir að í kringum 14 deyi úr sjúkdómnum á ári hverju (3). Nýrnafrumukrabbamein eru rúm 3% allra greindra krabbameina á Íslandi og er það svipað hlutfall og í nágrannalöndum okkar (yfirleitt í kringum 2-3%) (3, 8, 16). Á árunum 1998-2002 voru krabbamein í nýrum í 6. sæti hjá körlum og 12. sæti hjá konum yfir algengustu nýgreind krabbamein hérlendis (3).
Í töflu I sést nýgengi nýrnakrabbameins á hinum Norðurlöndunum og annars staðar í heiminum (16).
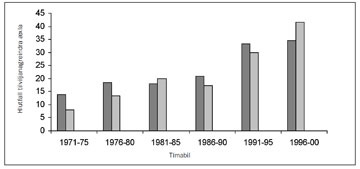
Þegar borið er saman nýgengi nýrnafrumukrabbameins á heimsvísu er mikilvægt að hafa í huga að nýrnaskjóðuæxli (transitional cell cancer of the renal pelvis) eru iðulega talin með í nýgengis- og dánartölum. Mikill munur er á nýgengi eftir löndum og heimshlutum. Þannig reynist nýgengi hærra í Mið-Evrópu, Norður-Ameríku og á Norðurlöndunum, borið saman við Suður-Evrópu og Asíu (16). Nýgengi er almennt talsvert hærra á Vesturlöndum en í þróunarlöndum. Hugsanlegar skýringar eru mismunandi fæðuvenjur, félagslegir og hagfræðilegir þættir. Munur milli einstakra landa skýrist þó einnig af mismunandi skráningu krabbameina og mismunandi tíðni krufninga (16). Víðast hvar hefur orðið talsverð aukning á greiningu sjúkdómsins á síðasta áratug. Þetta á einnig við hér á landi en reyndar aðeins hjá körlum (mynd 1) (12). Svipuð þróun hefur átt sér stað í Finnlandi (18) en í Bandaríkjunum hefur orðið aukning hjá báðum kynjum og í nánast öllum aldurshópum og kynþáttum (19). Á Vesturlöndum hefur hækkað nýgengi aðallega verið rakið til vaxandi fjölda tilviljanagreininga sem skýrist af aukningu í myndrannsóknum á kviðarholi (17, 19).
Nýrnafrumukrabbamein er fyrst og fremst sjúkdómur eldra fólks en meðalaldur við greiningu er 67 ár á Íslandi (1, 12, 20) sem er svipað og erlendis (21). Fáir greinast undir fertugu, eða um 5% sjúklinga (22). Sjúkdómurinn er algengari hjá körlum og greinast þrír karlar fyrir hverjar tvær konur (1, 212) sem er sambærilegt við nágrannalönd okkar (21).

Mynd 1. Aldursstaðlað nýgengi (heimsstaðall) í lifandi körlum og konum á Íslandi, greindum 1971-2000) (17).
Orsakir
Lítið er vitað um orsakir og áhættuþætti sjúkdómsins samanborið við mörg önnur krabbamein (23). Þetta á ekki síst við um tengsl erfða við nýrnafrumukrabbamein.
Umhverfisþættir
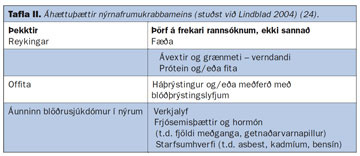
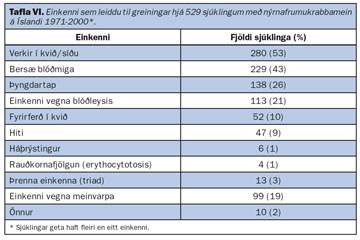
Einungis fáeinir umhverfisþættir teljast hafa sterkt orsakasamband við nýrnafrumukrabbamein (23). Reykingar og offita eru þar efst á blaði (24) (tafla II). Tengsl reykinga við sjúkdóminn eru nokkuð sterk og er um magnáhrif að ræða, því meira sem reykt er þeim mun meiri er áhættan (24, 25). Að sama skapi minnkar áhættan þegar reykingum er hætt sem ýtir stoðum undir orsakasamband (25). Yfir 20 rannsóknir hafa einnig sýnt fram á að hár líkamsþyngdarstuðull (BMI) sé áhættuþáttur (24). Óljóst er hvað veldur aukinni hættu hjá offitusjúklingum en aukin estrogenframleiðsla er talin hafa áhrif (26). Áunninn blöðrusjúkdómur í nýrum (acquired cystic kidney disease) sem er algeng orsök lokastigs nýrnabilunar er einnig þekktur áhættuþáttur. Sjúklingar með þennan sjúkdóm þurfa oft blóðskilun um lengri tíma, en sýnt hefur verið fram á umtalsvert aukna áhættu á nýrnafrumukrabbameini hjá sjúklingum í blóðskilun, eða allt að 40-100-falda áhættu (27). Aðrir áhættuþættir eru verr skilgreindir (tafla II), svo sem sykursýki, háþrýstingur, atvinna, lyfjanotkun (þar með talin notkun hormóna) og áfengisneysla (24, 28).
Erfðir
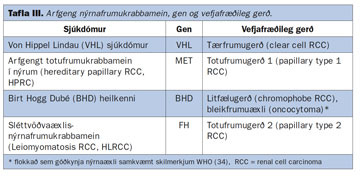
Til er arfgeng gerð nýrnafrumukrabbameins, líkt og fyrir krabbamein í ristli, brjóstum og blöðruhálskirtli (29). Slíkt erfðamynstur er þó sjaldgæft fyrirbæri og er sennilega ekki til staðar nema í 1-3% tilfella (29). Erfðamynstur er því ekki til staðar eða óþekkt (sporadic) (11, 29) í langflestum tilvikum. Þáttur erfða í tilurð sjúkdómsins hefur verið mikið rannsakaður á síðustu árum og arfgengum sjúkdómum eða heilkennum verið lýst þar sem nýrnafrumukrabbamein er einkennandi (29). Þeir helstu eru sýndir í töflu III. Af þeim er von Hippel-Lindau (VHL) sjúkdómur þekktastur. VHL-sjúkdómur er sjaldgæfur (nýgengi 1/36.000 fæðingar) arfgengur ríkjandi sjúkdómur sem einkennist af æðaæxli í nethimnu (retinal angioma), æðakímfrumuæxli (hemangioblastoma) í heila og hjá 60% sjúklinga greinast nýrnafrumukrabbamein (31). Oftast er þá um að ræða nýrnafrumukrabbamein af tærfrumugerð. Margir sjúklinganna eru undir fertugu og greinast með æxli í báðum nýrum (32). Árið 1993 fannst æxlisbælandi gen (tumor supressor gene) í þessum sjúklingum (VHL-gen). Sýnt hefur verið fram á að stökkbreyttur hluti gensins erfist sem óvirk samsæta (allele) og veldur þannig æxlisvexti, þar á meðal nýrnafrumukrabbameini. Nýlegar rannsóknir hafa leitt í ljós að galli í VHL-geninu sé undirrót allt að 60% af stökum tilvikum af tærfrumukrabbameini í nýrum (sporadic RCC) (33).
Í rannsóknum okkar á nýrnafrumukrabbameini á Íslandi var farið yfir sjúkraskrár allra sjúklinga sem greinst hafa með nýrnafrumukrabbamein á Íslandi frá 1955. Aðeins ein VHL-ætt fannst með vissu en tveir einstaklingar í þessari ætt hafa greinst með nýrnafrumukrabbamein. (Runólfur Pálsson, persónulegar upplýsingar.)
Aðrir sjaldgæfari erfðasjúkdómar sem tengjast nýrnafrumukrabbameini eru fjölskyldulægt totukrabbamein (hereditary papillary RCC, HPRCC) (35) og Birt Hogg Dubé-heilkenni (36).
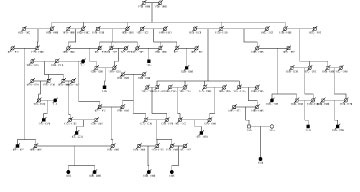
Mynd 2. Fjölskyldutré af stórri íslenskri fjölskyldu. Sýndir eru 17 einstaklingar með nýrnafrumukrabbamein (svartir hringir og kassar). Af þessum 17 einstaklingum er hægt að rekja 12 til sameiginlegs forföður. Þessi ættlægni sjúkdómsins getur samrýmst meingeni með lága sýnd (penetrance).
Til að kanna ættlægni sjúkdómsins á Íslandi var stuðst við íslenskan ættfræðigrunn (Íslendingabók) og hann borinn saman við afkóðaðar kennitölur sjúklinga. Rannsóknin náði til allra sem greindust með nýrnafrumukrabbamein hér á landi frá árunum 1950 til 2000, samtals 1078 sjúklinga (11). Niðurstöður okkar benda sterklega til þess að erfðaþáttur sé til staðar í þorra tilfella (sem ekki eru talin „ættlæg“) og þá sem kímlínu-stökkbreytingar (germline mutations). Bæði tókst að sýna fram á ættlægni í náskyldum ættingjum (foreldrar/börn/systkini) en einnig þeim fjarskyldari. Makar reyndust hins vegar ekki hafa marktækt aukna áhættu, sem styður að um áhrif erfða sé að ræða frekar en sameiginlega umhverfisþætti (11). Ennfremur var sýnt fram á að sjúklingar með nýrnafrumukrabbamein voru marktækt skyldari en samanburðarhópur. Alls reyndust 58% sjúklinganna koma frá fjölskyldum þar sem tvö eða fleiri tilfelli af nýrnafrumukrabbameini höfðu greinst og 26% sjúklinga frá fjölskyldum með þrjú eða fleiri tilfelli (tenging innan fimm meiósa). Ekki hefur tekist að sýna fram á jafnskýr tengsl erfða við nýrnafrumukrabbamein í öðrum rannsóknum og hefur þessi grein vakið töluverða athygli erlendis og oft verið vísað til hennar.
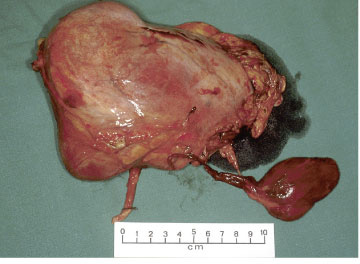
Mynd 3a. Stórt nýrnafrumukrabbamein í hægra nýra sem fjarlægt var með skurðaðgerð. Nýrað er undirlagt krabbameini og erfitt að sjá mörk æxlis og eðlilegs nýrnavefs. Neðst til hægri sést lítið fylgiæxli (satellite tumor) sem óx inn í neðri holæð sjúklingsins en slíkur vöxtur er dæmigerður fyrir nýrnafrumukrabbamein.
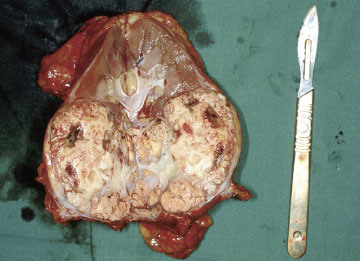
Mynd 3b. Nýra með nýrnafrumukrabbameini. Nýrað hefur verið skorið í tvennt að endilöngu. Efst sést eðlilegur nýrnavefur en annars er nýrað að mestu undirlagt af æxlisvexti.
Meingerð og vefjafræði
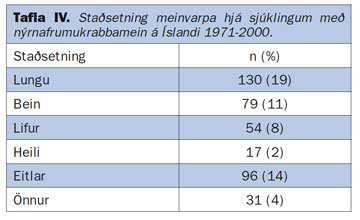
Nýrnafrumukrabbamein eru æðarík æxli. Þau vaxa ýmist ífarandi í gegnum nýrnahýðið (capsula renis), út í fituna umhverfis nýrað og þaðan í nálæg líffæri, eða þá út í bláæðar nýrans og þaðan í neðri holæð (vena cava inferior) (mynd 3a og 3b). Vöxtur út í nýrnabláæð sést í um 20% tilvika en sjaldgæfara er að æxlin teygi sig langt inn í holæð eða alla leið upp í hægri hjartagátt (37, 38). Ekki er óalgengt að nýrnafrumukrabbamein meinverpist, annaðhvort til eitla í nálægð nýrans eða til annarra líffæra (39). Algengustu meinvörpin í íslenskum sjúklingum eru sýnd í töflu IV. Á mynd 4 sést meinvarp í heila 60 ára sjúklings (7).
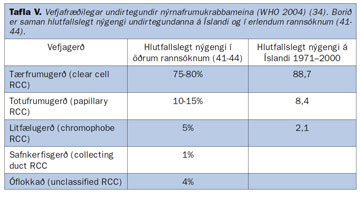
Áður fyrr var litið á nýrnafrumukrabbamein sem eina vefjagerð (adenocarcinoma renis) með mismunandi útlitsleg sérkenni. Síðan hafa nokkrar undirtegundir nýrnafrumukrabbameina verið skilgreindar sem allar hafa mismunandi útlit, vefja-gerð og klíníska hegðun (tafla V) (40-44).
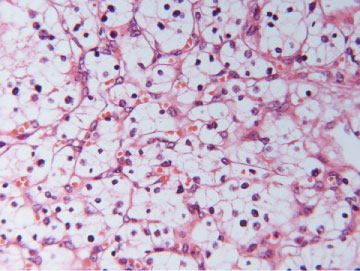
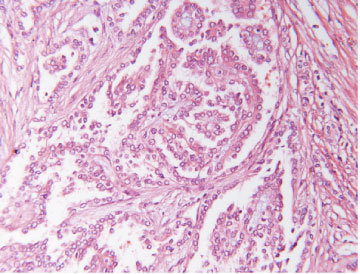
Fyrir flestar þessara vefjagerða hefur verið lýst ákveðinni erfðafræðilegri meingerð og tengslum við sérstök meingen (sjá töflu III) (45). Til dæmis hefur VHL-genið verið tengt við tærfrumuafbrigði, en þessi æxli eru talin eiga uppruna sinn í ofanverðum hluta bugupípla nýrna (proximal convolutet tubules) (46). Totufrumuafbrigði er hins vegar talið upprunnið í fjarhluta bugpípla og er oft tengt þrístæðu á litningum 7 og 17 (47). Litfæluafbrigði (chromophobe RCC) er talið tengj-?ast vöntun á Y-litningi og litningi 1 ásamt uppruna í millifrumum nýrna (intercalated cells) (48). Nýtt flokkunarkerfi sem byggir á þessum vefjagerðum var kynnt til sögunnar 1996 (40) og nokkrum árum síðar tók Alþjóða heilbrigðisstofnunin (WHO) upp mjög sambærilega flokkun (34). Mynd 5 sýnir þrjár algengustu vefjagerðirnar og helstu sérkenni þeirra við smásjárskoðun.
Hér á landi hafa öll nýrnafrumukrabbamein frá árinu 1971 verið endurflokkuð samkvæmt skilmerkjum WHO, samtals 629 æxli (9). Í töflu V sést hlutfallslegt nýgengi vefjagerðanna samanborið við erlendar rannsóknir. Líkt og erlendis reyndist tærfrumukrabbamein langalgengast en næst komu totufrumu- og litfæluafbrigði. Ekki reyndist munur á stærð æxlanna eftir vefjagerð eða aldri sjúklinganna. Æxlin voru að meðaltali 7,4 cm við greiningu og þótt tilviljanagreindu æxlin hafi reynst minni (5,1 cm) voru þau af sömu vefjagerð og æxlin sem greindust hjá sjúklingum með einkenni (7,4 cm). Hins vegar reyndust tærfrumuæxlin oftar vera af hærri gráðu (gráða III og IV) og stigun (stig III og IV) en æxli af hinum vefjagerðunum (sjá síðar).
Bleikfrumuæxli (oncocytoma) voru áður (fyrir 1997) flokkuð með illkynja nýrnaæxlum en eru nú flokkuð með góðkynja nýrnaæxlum (sama á við um ?metanephric adenoma?) (34, 49). Þessi æxli eru oftast 3-7% af nýrnafrumukrabbameinum og eru talin eiga uppruna sinn í millifrumum nýrnanna. Flóknar litningabreytingar eru iðulega til staðar (50, 51). Bleikfrumuæxli eru rauðleit, vel afmörkuð og stök en geta greinst í báðum nýrum (mynd 6). Þau vaxa oftast hægt og meinvörp eru nánast óþekkt (17, 50). Einkennandi er rauðleitt (sýrusækið) umfrymi sem skýrist af miklum fjölda orkukorna (mitochondria) í því. Erfitt getur verið að greina bleikfrumuæxli frá nýrnafrumukrabbameini (sjá mynd 5) (45, 52). Meðferð þeirra er því oft hliðstæð því þegar um krabbamein er að ræða, það er að segja skurðaðgerð (sjá síðar).
A)
B)
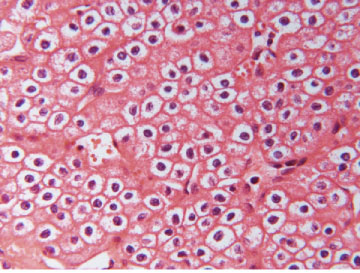
Mynd 5 A) Tærfrumugerð einkennist af frumum með tæru eða rauðleitu umfrymi (H&E-litun). Einkennandi er að útlitið er ólíkt á mismunandi stöðum í sama æxli. Algengst er þó að æxlisfrumurnar myndi samfelldar breiður, klasa, bjálka eða litlar blöðrur. Svæði með totuútlit er stundum einnig til staðar. B) Nýrnafrumukrabbamein af totufrumugerð (papillary RCC) einkennist af totumyndunum þar sem toturnar eru gerðar af bandvefsstilkum sem klæddir eru æxlisfrumum. Sjaldgæfara er að æxlið eða hluti þess hafi píplumyndanir og í sumum æxlum er totum svo þétt skipað að erfitt er að greina þær sem slíkar. C) Æxli af litfælugerð (chromophobe RCC) eru samsett af tveimur frumugerðum; stórum fjölflata frumum með gegnsætt umfrymi og minni frumum með kornóttu rauðleitu umfrymi (H&E-litun). Báðar þessar frumugerðir hafa áberandi frumuhimnu. Kjarnastærð og lögun er breytileg og tær baugur (halo) umhverfis kjarnann er algengur. Vaxtarmynstrið er oftast samfellt en stundum píplumyndandi.
Á myndinni er ekki sýnt fjórða afbrigði nýrnafrumukrabbameins, krabbamein útgengið frá safngöngum (collecting duct RCC). Þessi æxli vaxa oft með píplumynstri eða totum, stoðvefir eru áberandi og kjarnagráða yfirleitt há. Óflokkað nýrnafrumukrabbamein (unclassified RCC) er misleitur hópur æxla sem ekki er hægt að setja í ofannefnda undirflokka. Sarkmeinslíkar breytingar (sarcomatoid) geta sést í öllum undirflokkum en eru algengastar í tærfrumugerð.
Í íslenskri rannsókn, sem náði til allra tilfella sem greindust á 30 ára tímabili (samtals 45 tilfelli eða tæp 6% nýrnafrumukrabbameina), greindist tæpur þriðjungur (31%) æxlanna fyrir tilviljun og 21% við krufningu. Aðeins einn sjúklingur (2%) hafði bleikfrumuæxli í báðum nýrum og enginn sjúklinganna reyndist hafa eitil- eða fjarmeinvörp. Þetta er í samræmi við erlendar rannsóknir (50, 52, 53) og rökstyður núverandi flokkun þessara æxla með góðkynja æxlum í nýrum. Þó er rétt að geta þess að þrjú æxlanna (7%) uxu ífarandi út í fituvef umhverfis nýrað og hjá 4% sjúklinganna fannst nýrnafrumukrabbamein í sama nýra og bleikfrumuæxlið. Sum þessara æxla virðast því geta sýnt af sér klíníska hegðun sem frekar samræmist illkynja æxlum.
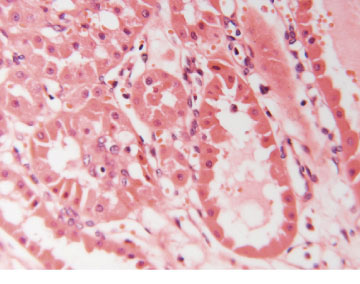
Mynd 6. Smásjármynd af dæmigerðu bleikfrumuæxli (oncocytoma). Umfrymi frumnanna er áberandi rauðleitt.
Einkenni
Nýrnafrumukrabbamein eru þekkt fyrir að geta valdið mjög fjölbreyttum einkennum. Helstu einkenni eru sýnd í töflu VI og er vísað til íslenskra rannsókna (8, 12). Sambærilegri tíðni einkenna er lýst í erlendum rannsóknum (28, 54). Algengustu einkennin eru verkir eða fyrirferð í síðu eða kvið og bersæ blóðmiga. Svokölluð þrenna einkenna (triad), það er verkir í kvið/síðu, blóðmiga og fyrirferð, sást einungis hjá tæpum 3% íslensku sjúklinganna. Þetta er mun lægra en áður var talið og heldur lægra en í nýlegum erlendum rannsóknum þar sem hlutfallið er í kringum 5-10% (55). Hins vegar verður að hafa í huga að bæði íslensku rannsóknirnar og þær erlendu er aftursæjar, en slíkar rannsóknir eru ekki jafn áreiðanlegar og þær framsýnu þegar kemur að því að rannsaka einkenni sjúkdóma.
Nýrnafrumukrabbamein geta einnig verið alveg einkennalaus eða valdið óljósum og almennum einkennum, svo sem þreytu, þyngdartapi og blóðleysi (56). Þetta veldur því að margir greinast með langt genginn sjúkdóm (39). Til dæmis höfðu um 40% þeirra sem greinast hér á landi verið með einkenni lengur en þrjá mánuði (1, 12) og tæpur þriðjungur þeirra greinist með útbreiddan sjúkdóm (stig IV) (8, 9). Til samanburðar greindust 17% sjúklinganna innan viku og þriðjungur innan mánaðar frá upphafi einkenna (17). Þessir sjúklingar reyndust oftar hafa bersæja blóðmigu og/eða bráða kviðverki.
Tilviljanagreind nýrnafrumukrabbamein
Með tilviljanagreiningu er átt við mein (til dæmis krabbamein) sem greinast fyrir tilviljun við rannsóknir sem gerðar eru vegna sjúkdóma eða einkenna sem ekki er hægt að rekja til viðkomandi meins. Hér er hins vegar ekki átt við æxli sem greinast fyrir tilviljun við krufningu. Slík æxli teljast til svokallaðra krufningagreininga. Alls greindust 17% nýrnafrumukrabbameina með þeim hætti á tímabilinu 1955-1999 og er búist við að sú tala lækki vegna fækkunar krufninga (57). Tilviljanagreiningu nýrnafrumukrabbameina má langoftast rekja til myndrannsókna á kviði, sérstaklega tölvuneiðmynda og ómskoðana sem framkvæmdar eru vegna gruns um sjúkdóma í gallvegum og lifur (8, 12). Einkennalausir sjúklingar sem greinast með smásæja blóðmigu eða hækkað sökk við heilsueftirlit eru oftast taldir með í þessum hópi. Rétt er þó að geta þess að skilgreining á tilviljangreiningu er nokkuð flöktandi eftir rannsóknum og hefur því áhrif á hlutfallslegan fjölda tilviljanagreindra æxla í þeim (17). Með aukinni notkun myndgreiningarannsókna á undanförnum árum hefur hlutfall tilviljanagreindra aukist hratt (19, 58). Þessi þróun hefur sést glögglega hér á landi með auknum myndrannsóknum á kviði (mynd 7) sem leitt hefur af sér aukinn fjölda tilviljanagreindra nýrnafrumukrabbameina (mynd 8). Á síðustu árum greinast allt að 40% nýrnafrumkrabbameina hér á landi fyrir tilviljun og langflest þessara æxla finnast við ómskoðun eða tölvusneiðmyndatöku af kviðarholi (12, 17). Svipuð þróun hefur orðið erlendis þar sem hlutfall tilviljanagreindra æxla er yfirleitt á bilinu 30-50% (59-61) en svo virðist sem hlutfall tölvusneiðmynda sé vaxandi á kostnað annarra myndrannsókna (17).

Mynd 7. Fjöldi myndgreiningarannsókna á kvið og nýrum á Íslandi 1986-2004. Tölur yfir fjölda rannsókna byggja á skýrslum frá Landspítala, Fjórðungssjúkrahúsinu á Akureyri og röntgendeild Domus Medica (Ólafur Kjartansson, persónulegar upplýsingar). IVP = nýrnamynd (intravenous urography), CT = tölvusneiðmyndataka (computed tomography), US = ómskoðun (ultrasound).
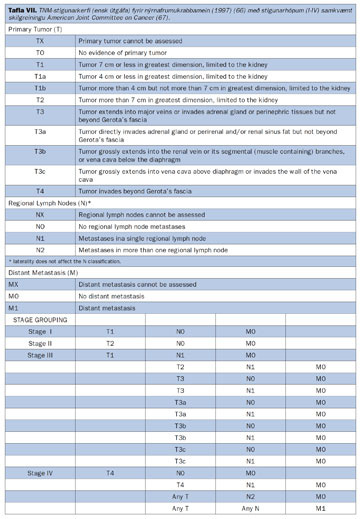
Með stigun krabbameina er átt við kortlagningu á útbreiðslu þeirra. Stigun er langmikilvægasti forspárþáttur hvað varðar lífshorfur sjúklinga með nýrnafrumukrabbamein (62-64). Hefur meðal annars verið sýnt fram á mikilvægi hennar í íslenskum rannsóknum (8, 9). Tvö stigunarkerfi hafa mest verið notuð hér á landi; stigunarkerfi Robsons (65) (sjá mynd 9) og TNM stigunarkerfið (tafla VII) (66 67).
Kostur fyrrnefnda kerfisins er hversu einfalt það er. Það er hins vegar takmarkað hvað varðar sjúklinga á stigi III þar sem ekki er gerður munur á æxlisvexti í eitlum, sem hefur í för með sér slæmar horfur, og æxlisvexti í nýrnabláæð, sem stundum er hægt að fjarlægja með aðgerð (37 38). TNM-kerfið þykir því fullkomnara að þessu leyti og er í dag algjörlega ráðandi.
Af 708 íslenskum sjúklingum greindum með nýrnafrumukrabbamein á árunum 1971-2000 voru 629 tilfelli staðfest með vefjagreiningu (hinir sjúklingarnir voru ?klínískt? greindir) (9). Mynd 10 sýnir TNM-stigun þessara sjúklinga en flestir greindust á stigi I (30%) og IV (32%). Þegar á rannsóknartímabilið leið fjölgaði sjúklingum á stigi I og að sama skapi fækkaði sjúklingum á stigi IV. Þetta skýrist af aukningu í tilviljanagreiningu en á tímabilinu 1996-2000 greindust 37% æxlanna fyrir tilviljun og hlutfall æxla á stigi I voru 46% og 25% á stigi IV (12).
Með gráðun (grading) er átt við útlit frumanna (í ljóssmásjá) sem mynda æxlið. Gráðun getur sagt til um ágengni (agressiveness) frumanna og tilhneigingu til meinvarpa. Þetta er mikilvægur forspárþáttur lífshorfa enda þótt stigun vegi mun þyngra (9). Margar rannsóknir hafa sýnt að gráðun er sjálfstæður forspárþáttur lífshorfa (68-70), meðal annars áðurnefnd íslensk rannsókn (9). Mörg kerfi til gráðunar hafa verið notuð en þekktast er kerfi Fuhrmans (70) sem byggir á fjórum flokkum og stuðst var við í íslensku rannsókninni (mynd 11).
Mynd 8. Hlutfall tilviljanagreindra nýrnafrumukrabbameina. Sýnd er tíðni karla (dökkgráar súlur) og kvenna (ljósgráar súlur) á fimm ára tímabilum frá 1971-2000 (12).
Æxlisvísar
Fjölmargir æxlisvísar (biomolecular markers) hafa verið rannsakaðir fyrir nýrnafrumukrabbamein, þar á meðal AgNOR, PCNA, Ki67, p53 og CD44 svo einhverjir séu nefndir (71). Sennilega eru þó mælingar á DNA-magni æxlisfrumnanna (DNA-ploidy) best rannsakaðar en líkt og fyrir hina æxlisvísana ber rannsóknum ekki saman um klínískt gildi þeirra (72). Enn sem komið er er enginn æxlisvísir í klínískri notkun í nýrnafrumukrabbameini sem hægt er að nota við greiningu eða eftirlit. Ekki hefur heldur verið lýst sértækum æxlisvísi fyrir þetta krabbamein.
Uppvinnsla
Í dag er tölvusneiðmynd mikilvægasta myndgreiningin á æxlum í nýrum og við stigun nýrnafrumukrabbameins (73). Í sumum tilvikum getur ómskoðun gefið upplýsingar umfram tölvusneiðmynd, sérstaklega ef um er að ræða æxlisvöxt í æðar. Ómskoðanir og nýrnamynd, sem áður voru mikilvægustu greiningartækin við fyrirferð í nýrum, eru þó síðri en tölvusneiðmyndir við greiningu á smáum æxlum (74). Segulómskoðun (MRI) getur verið mikilvæg viðbótarrannsókn þegar um er að ræða óljósa fyrirferð á tölvusneiðmynd og greinir vel innvöxt í æðar (75). Að auki getur segulómskoðun átt við þegar um er að ræða frábendingu fyrir notkun skuggaefnis (75).
Fyrir skurðaðgerð er yfirleitt tekin rönt-?genmynd af lungum, tölvusneiðmynd eða ómskoðun af lifur ásamt venjubundnum blóðrannsóknum, þar á meðal lifrarpróf. Beinaskönnun, tölvusneiðmynd af heila, segulómskoðun og aðrar rannsóknir eru gerðar eftir þörfum og þá yfirleitt út frá einkennum sjúklings.
Skimun á nýrnafrumukrabbameini með tölvusneiðmyndum eða þvagrannsóknum (blóð í þvagi) er ekki talin svara kostnaði (17). Ræður þar mestu tiltölulega lág tíðni nýrnafrumukrabbameins. Slík skimum þykir því ekki koma til greina nema þá helst í fjölskyldum þar sem nýrnafrumukrabbamein gengur í erfðir (23).
Mismunagreiningar
Með hliðsjón af margvíslegum einkennum nýrnafrumukrabbameins er ljóst að listi yfir mismunagreiningar er langur. Fyrirferð í nýra getur verið góðkynja æxli, þar sem blöðrur (cystae) eru langalgengastar, bleikfrumuæxli, kirtilæxli (adeonoma) eða æðavöðvafituæxli (angiomyolipoma). Einnig eru dæmi um að meinvörp hreiðri um sig í nýrum og sömuleiðis getur eitilkrabbamein (lymphoma) og sarkmein (sarcoma) greinst í nýrum. Í sumum tilvikum getur útlit á ómskoðun eða tölvusneiðmynd gefið vísbendingu um suma af þessum sjúkdómum, til dæmis þegar um blöðrur er að ræða.
Meðferð
Meðferð ræðst af því hvort sjúkdómurinn er staðbundinn eða ekki og má skipta henni í meðferð til lækninga (curative) og til líknar (palliative). Eina læknandi meðferðin er að fjarlægja meinið með skurðaðgerð. Íslenskar rannsóknir á meðferð sjúklinga með nýrnafrumukrabbamein hafa aðallega beinst að árangri skurðaðgerða og þá fyrst og fremst nýrnabrottnáms. Einnig eru hafnar hér á landi rannsóknir á árangri skurðaðgerða þar sem meinvörp nýrnafrumukrabbameins í lungum eru fjarlægð. Hvað varðar aðra meðferð er hér að neðan aðallega vísað til erlendra rannsókna.
Skurðaðgerðir
Nýrnabrottnám (radical nephrectomy) er oftast framkvæmt með skurði undir rifjaboga eða í gegnum miðlínuskurð. Nýrað er fjarlægt ásamt fitunni umhverfis og Gerotasfelli. Umdeilt er hvort alltaf eigi að fjarlægja eitla kringum nýrað og nýrnahettur (76). Brottnám eitla getur veitt upplýsingar til stigunar sjúkdómsins en lækningagildi þess er umdeilt (77). Hins vegar eru eitlar fjarlægðir ef þeir reynast stækkaðir eða harðir við þreifingu í aðgerð. Nýrnahettur sömu megin og æxlið eru oftast fjarlægðar og alltaf ef æxlið liggur nálægt eða grunur er um meinvörp í þeim. Nýjar rannsóknir benda hins vegar til þess að óhætt sé að skilja eftir nýrnahettur ef um er að ræða tiltölulega lítil æxli (<5 cm) í neðri hluta nýrans (78). Um 5-9% sjúklinga með nýrnafrumukrabbamein hafa æxlisvöxt í neðri holæð (v. cava inf.). Ef engin meinvörp eru til staðar getur verið ávinningur af því fjarlægja þennan æxlissega við sömu aðgerð (79).
Nýrnabrottnám er viðamikil aðgerð með fylgikvilla á við aðrar stórar kviðarholsaðgerðir. Á Íslandi voru framkvæmd 575 nýrnabrottnám vegna nýrnafrumukrabbameins á árunum 1971-2000, á 8 sjúkrahúsum og af 32 skurðlæknum. Skurðdauði (operative mortality), það er dauðsföll innan 30 daga frá aðgerð, var 2,8% (15) sem er sambærilegt við erlendar tölur (80, 81). Í öllum tilvikum (n = 16) reyndust dauðsföll beint tengd aðgerðinni en algengustu orsakirnar voru blæðingar í og eftir aðgerð (31%) og sýkingar (25%).
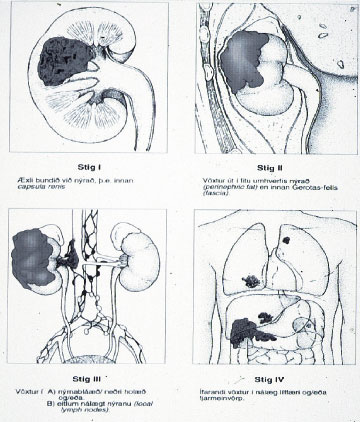
Mynd 9. Stigun nýrnafrumukrabbameins samkvæmt stigunarkerfi Robsons (65.)
Hlutabrottnám á nýra (partial nephrectomy) er aðgerð sem upphaflega var framkvæmd í sjúklingum með stakt nýra eða æxli í báðum nýrum, eða sjúklingum í alvarlegri nýrnabilun (82). Nú er hlutabrottnám á nýra að auki viðurkennd meðferð þegar æxli eru <4 cm að stærð (83). Vegna vaxandi fjölda lítilla tilviljanagreindra æxla hefur þessum aðgerðum fjölgað verulega, sérstaklega í Bandaríkjunum. Á síðustu árum hefur hlutabrottnám verið framkvæmt hér á landi (84) en þorri aðgerða við nýrnafrumukrabbameini er enn framkvæmdur með brottnámi alls nýrans. Sýnt hefur verið fram á að horfur sjúklinga sem gangast undir hlutabrottnám á nýra eru svipaðar og þeirra sem hafa æxli af sömu stærð og gangast undir heildarbrottnám á nýra (83, 85, 86). Hins vegar er meiri hætta á staðbundinni endurkomu sjúkdómsins eða í um 3-6% tilfella (87).
Nýrnabrottnám með kviðsjárspeglun (laparoscopic nephrectomy) var fyrst lýst árið 1991 og hefur sums staðar erlendis náð fótfestu sem aðgerð við nýrnafrumukrabbameini (86). Hægt er að fjarlægja allt nýrað eða hluta þess með kviðsjártækni. Þetta eru þó tæknilega töluvert flóknar aðgerðir. Kostir speglunaraðgerðanna eru minni verkir eftir aðgerð og styttri legutími og endurhæfing (88). Á hinn bóginn er ekki ljóst hver langtímaárangur þessara aðgerða er, til dæmis liggja ekki fyrir áreiðanlegar upplýsingar um tíðni endurtekins krabbameins og langtíma lífshorfur (86). Aðgerð með kviðsjártækni hefur því ekki leyst af hólmi hefðbundið nýrnabrottnám. Á Íslandi hefur nýrnabrottnám verið framkvæmt með kviðsjárspeglun og í vaxandi mæli á allra síðustu árum.
Nýrnabrottnám hjá sjúklingum með meinvörp getur komið til greina hjá völdum hópi sjúklinga. Engu að síður gildir í flestum tilvikum sú regla að sjúklingar með fjarmeinvörp hafi ekki bættar horfur sé nýrað fjarlægt. Sjúklingar með alvarlega blóðmigu og/eða kviðverki, sem ekki svara annarri meðferð, geta þurft slíka aðgerð. Blóðmigu er þó oftast hægt að hemja með því að stífla blóðflæði í nýrnaslagæð (embolisation). Í þessu sambandi er mikilvægt að hafa í huga að fylgikvillar eru algengari hjá þessum hópi sjúklinga samanborið við þá sem eru með staðbundinn sjúkdóm (81). Tilhneigingu í þessa átt mátti sjá í íslenskri rannsókn, en 20% nýrnabrottnámsaðgerða á Íslandi á tímabilinu 1971-2000 voru framkvæmdar í líknandi tilgangi (15). Líknandi aðgerð er því auðveldara að réttlæta hjá yngri sjúklingum og þeim sem ekki þjást af hjarta- og æðasjúkdómum eða öðrum sjúkdómum sem auka áhættu við aðgerð (89). Á síðustu árum hafa komið fram rannsóknir sem gefa til kynna að sjúklingar með meinvörp svari betur lyfjameðferð (til dæmis α-interferoni) eftir nýrnabrottnám heldur en þegar lyfjameðferð er veitt eingöngu (90, 91). Aðgerðin felst þá í því að minnka æxlisvef (cytoreductive) fyrir lyfjameðferðina. Þessi meðferð er ekki hættulaus og sumir sjúklingar þola hana illa. Því er mikilvægt að vanda vel val á sjúklingum (89).
Skurðaðgerðir á meinvörpum nýrnafrumkrabbameins koma til greina í völdum tilvikum (86 89). Þetta á sérstaklega við um yngri sjúklinga með stök meinvörp þar sem langur tími hefur liðið frá nýrnabrottnámi þar til meinvarpið greinist (86 89). Nýlegar rannsóknir virðast benda til þess að slíkar aðgerðir, sérstaklega á stökum meinvörpum í lunga en jafnvel einnig í heila og lifur, geti bætt lífshorfur sjúklinga. Hefur verið lýst allt að 30% fimm ára lífshorfum í fjölda rannsókna (86 89) sem er umtalsvert betri árangur en fyrir aðra sjúklinga á stigi IV þar sem tveggja ára lífshorfur eru undir 20% (91). Rétt er þó að hafa í huga að um mjög valinn hóp sjúklinga er að ræða og í mörgum þessara rannsókna vantar ítarlegri upplýsingar um langtímaárangur (86, 89). Skurðaðgerðir koma einnig til greina til að bæta líðan sjúklinga, það er í líknandi tilgangi, til dæmis við meinvörpum í heila eða húð (89). Í þessum tilvikum verður að meta mögulegan ávinning aðgerðarinnar út frá hættu á fylgikvillum sem geta hlotist af aðgerðinni.
Lyfjameðferð
Meðferð með krabbameinslyfjum á fyrst og fremst við hjá sjúklingum með fjarmeinvörp. Almennt svarar nýrnafrumukrabbamein illa hefðbundnum krabbameinslyfjum og því er mikil þörf á öflugri krabbameinslyfjum í meðferð þessa sjúkdóms. Nýlega hafa komið á markað lyf sem virðast lofa góðu (sjá síðar). Ef þessi nýju lyf munu reynast jafn vel og fyrstu niðurstöður benda til getur verið um stórt framfaraskref í meðferð þessa sjúkdóms að ræða. Um er að ræða stóran hóp sjúklinga sem gætu haft ávinning af slíkri meðferð, en í kringum 20-30% sjúklinga reynast hafa fjarmeinvörp við greiningu (8, 39, 91). Síðar á ævinni bætast síðan við meinvörp hjá allt að 30% sjúklinga sem voru með staðbundinn sjúkdóm við greiningu (92).
Krabbameinslyf, hormóna- og geislameðferð
Eins og fyrr segir er svörun (response rates) nýrnafrumukrabbameins við hefðbundinni krabbameinslyfjameðferð léleg, eða í besta falli 6% (93). Ástæðan er talin vera myndun svokallaðs fjöllyfjaónæmis í erfðaefni æxlisfrumanna (multidrug resistance gene expression) (17). Geislameðferð sem meðferð við nýrnafrumukrabbameini reynist sjaldan árangursrík, ef frá er talin líknandi geislameðferð á meinvörp í beinum og heila (93). Hormónameðferð með prógesteróni getur reynst hjálpleg við lystarleysi og slappleika, en gallinn er sá að aðeins 2-15% sjúklinga hafa gagn af meðferðinni.
Lyf sem verka á ónæmiskerfið
Nýrnafrumukrabbamein er þekkt fyrir að valda ónæmissvörun sem er kröftugri en gildir um flest önnur krabbamein. Þetta kemur meðal annars fram í sjaldgæfum tilfellum af sjálfkrafa minnkun eða hvarfi meinvarpa (spontaneous regression). Þetta fyrirbæri getur sést hjá sjúklingum með nýrnafrumukrabbamein, en er einnig þekkt fyrir önnur krabbamein eins og sortuæxli (13). Sjálfkrafa hvarf meinvarpa er þó mjög sjaldgæft fyrirbæri (<1%), til dæmis greindust aðeins tvö tilfelli (0,3%) með vissu hér á landi á 30 ára tímabili (13). Annars vegar var um að ræða meinvarp í heila (7) og í hinu tilfellinu meinvarp í fleiðru (14).
Sá eiginleiki nýrnafrumukrabbameins að ræsa ónæmiskerfið og sú staðreynd að geisla- og krabbameinslyfjameðferð dugar skammt í meðferð sjúkdómsins hefur ýtt undir þróun lyfja sem verka á ónæmiskerfið. Þessi lyf annað hvort afhjúpa ónæmisvaka á yfirborði krabbameinsfrumnanna eða hvetja ónæmiskerfi sjúklingsins sjálfs (86). Í völdum tilvikum geta allt að 10-15% sjúklinga svarað þessari meðferð (86). Langtímahorfur eru hins vegar slæmar og flestir deyja úr sjúkdómnum innan fárra ára. Tvö lyf hafa mest verið rannsökuð, ?-interferon og interleukin-2. Síðarnefnda lyfið er talið áhrifaríkara og er viðurkennt af Lyfjaeftirliti Bandaríkjanna (FDA) sem staðalmeðferð við útbreiddu nýrnafrumukrabbameini (86). Bæði lyfin eru dýr og geta haft töluverðar aukaverkanir, ekki síst interleukin-2 sem aðeins er notað á fáeinum sjúkrahúsum í heiminum. Eins og fyrr segir getur meðferð með þessum lyfjum vel komið til greina í kjölfar æxlisminnkandi (cytoreductive) skurðaðgerðar (86, 90, 94).
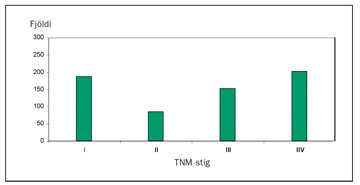
Mynd 10. Stigun* 629 sjúklinga sem greindust með nýrnafrumukrabbamein á Íslandi 1971-20009. * TNM-stigunarkerfi
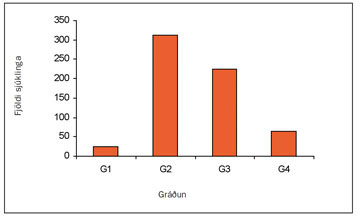
Mynd 11. Fuhrman-gráðun nýrnafrumukrabbameina sem greindust á Íslandi 1971-2000. (GX: ekki hægt að ákvarða gráðun, G1: vel þroskaðar frumur, G2: meðalþroskaðar frumur, G3-4: illa þroskaðar frumur.)
Ný krabbameinslyf og önnur meðferðarúrræði
Á síðustu árum hafa komið fram ný krabbameinslyf sem verka á annan hátt en eldri lyf (86). Af nýju lyfjunum eru mestar vonir bundnar við svokallaða tyrosine kinasa hemjara sem hamla vexti krabbameinsfrumna, meðal annars með því að hemja svokallaða EGF-viðtaka (epidermal growth factor receptors) eða viðtaka skylda þeim (95). Í þessum hópi eru lyf eins og erlotinib, temsirolimus, og sunitinib (96). Önnur lyf hafa áhrif á bæði vaxtarþætti og æðanýmyndun í æxlunum (angioneogensis) og hamla þannig vexti þeirra, til dæmis lyfið sorafenib (97). Sum þessara lyfja er hægt að gefa í töfluformi en sammerkt þeim öllum er að meðferð getur haft töluverða fylgikvilla. Nýlegar rannsóknir virðast staðfesta að hluti sjúklinga með útbreitt nýrnafrumukrabbamein svarar þessum lyfjum mun betur en meðferð með eldri krabbameinslyfjum. Sömu rannsóknir benda til þess að þessi lyfjameðferð bæti lífshorfur, að minnsta kosti þegar til skamms tíma er litið (95, 97, 98).
Á næstu árum má búast við að fjöldi nýrra krabbameinslyfja við nýrnafrumukrabbameini líti dagsins ljós. Einstofna mótefni, sem beint er gegn sértökum mótefnavökum á yfirborði krabbameinsfrumnanna, á eftir að þróa frekar og meðferð með ígræðslu stofnfruma er enn á tilraunastigi (86, 95).
Af öðrum meðferðarrúrræðum má nefna hitameðferð (percutaneous thermal ablation) sem hægt er að beita gegn litlum æxlum (<3cm) og þá í gegnum húð sjúklingsins (99). Útvarpsbylgjur eru þá notaðar til að hita æxlið og valda drepi í því. Einnig er hægt að kæla æxlin með köfnunarefni (cryoablation) með aðstoð kviðarholssjár (99). Bæði hita- og kælimeðferð eru enn á tilraunastigi en geta komið til greina hjá sjúklingum sem ekki þola brottnám á nýra (86 95).
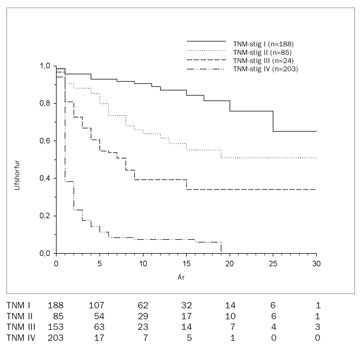
Mynd 12. Lífshorfur (estimated disease specific survival) sjúklinga á mismunandi TNM-stigum, greindum með nýrnafrumukrabbamein á Íslandi 1971-2000.
Horfur og forspárþættir lífshorfa
Horfur sjúklinga með nýrnafrumukrabbamein eru háðar fjölmörgum þáttum, enda hefur ekki enn ekki tekist að finna neinn einstakan þátt sem veitir áreiðanlega forspá um horfur þessara sjúklinga. Þættir eins og hár aldur við greiningu og einkenni meinvarpa skipta máli og eru tengdir lakari lífshorfum (71). Erlendis hefur verið sýnt fram á mismunandi horfur eftir kynjum (100) en ekki hér á landi (9, 12, 17). Hins vegar hefur í nýlegri íslenskri rannsókn verið sýnt fram á bættar lífshorfur sjúklinga sem greinast fyrir miðjan aldur (<50 ára) (22). Einnig hefur í íslenskum rannsóknum verið sýnt fram á lakari horfur ef sökk er hátt við greiningu og blóðrauði lágur (8, 9, 12).
Langmikilvægasti forspárþátturinn er stig sjúkdómsins (71). Þetta á jafnt við erlendis sem hér á landi og getur munur á lífshorfum á stigi I og IV verið allt að tífaldur (9). Þetta sást glögglega í íslenskri rannsókn þar sem fimm ára lífshorfur (disease specific survival) á stigi I voru 93% og 11% á stigi IV (mynd 12) (9). Lífshorfur á hinum stigunum tveimur eru þarna mitt á milli. Sjúklingar á stigi III, og þá sérstaklega sjúklingar með eitilmeinvörp (76), eru þó með umtalsvert lakari horfur en sjúklingar á stigi II. Í sömu rannsókn var einnig sýnt fram á að gráðun (Fuhrman) var sjálfstæður forspárþáttur, en vægi hennar var þó langtum minna en stigunar. Sama á við um mismunandi vefjagerðir, en þar reyndist munurinn enn minni. Tilhneiging til verri horfa sást fyrir tærfrumugerð en vefjagerð reyndist þó ekki sjálfstæður áhættuþáttur. Þetta er aðeins á skjön við sumar erlendar rannsóknir en ekki allar. Margar erlendu rannsóknanna hafa einnig sýnt fram á mikilvægi almenns líkamsástands sjúklinganna (Karnovski-index) en þetta hefur ekki verið kannað sérstaklega hérlendis.
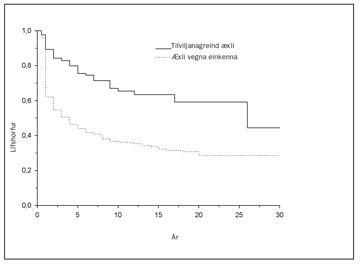
Mynd 13. Lífshorfur sjúklinga sem greindust með nýrnafrumukrabbamein á Íslandi 1971-2000. Sýndar eru lífshorfur (disease specific survival) fyrir þá sem greindust með einkenni og þeirra sem greindust fyrir tilviljun. Marktækur munur er á lífshorfum í þessum tveimur hópum.
Eins og áður hefur komið fram hefur tilviljanagreindum nýrnafrumukrabbameinum fjölgað mjög á síðustu tveimur áratugum. Ekki er séð fyrir endann á þessari aukningu og íslenskar rannsóknir hafa sýnt stöðuga aukningu, ekki síst hin síðari ár. Fjöldi rannsókna hefur staðfest að tilviljanagreindu æxlin eru á lægri stigum en hin sem greinast í sjúklingum með einkenni. Horfur þessara sjúklinga eru því marktækt betri eins og sést greinilega á mynd 13. Þessi þróun hefur bætt horfur hópsins í heild (sjá mynd 14).
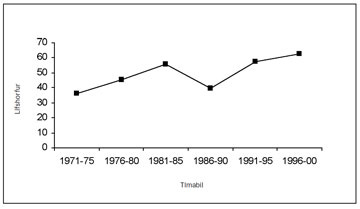
Mynd 14. Fimm ára lífshorfur (disease specific survival) á fimm ára tímabilum fyrir sjúklinga sem greindust með nýrnafrumukrabbamein á Íslandi 1971-2000.
Málið er þó aðeins flóknara en það sem sést best af því að dánarhlutfall (mortality) hefur víðast hvar staðið í stað (19), meðal annars hér á landi (12). Þess vegna vaknar sú spurning hvort bættar lífshorfur vegna tilviljanagreiningar séu raunverulegar eða skýrist að einhverju leyti af skekkju („lead-time“ og „stage migration bias“) (17). Enn er ekki hægt að fullyrða um slíkt. Íslensku rannsóknirnar hafa þó sýnt að tilviljanagreining er ekki sjálfstæður áhættuþáttur hjá þessum sjúklingum og bættar lífshorfur þeirra skýrast því fyrst og fremst af því að tilviljanagreindu æxlin eru á lægri stigum við greiningu (12).
Lokaorð
Nýrnafrumukrabbamein er ekki á meðal algengustu krabbameina á Íslandi. Hlutfallslegt nýgengi þess er þó óvíða hærra í heiminum. Ástæður fyrir þessu háa nýgengi á Íslandi eru ekki þekktar. Íslenskar rannsóknir hafa sýnt að sjúkdómurinn liggur oft í ættum. Engu að síður er ljóst að lítið er vitað um orsakir nýrnafrumukrabbameins, minna en fyrir flest önnur krabbamein. Stigun krabbameinsins við greiningu er langmikilvægasti forspárþáttur lífshorfa en gráðun, aldur og almennt ástand sjúkling við greiningu hafa einnig þýðingu. Tilviljanagreindum nýrnafrumukrabbameinum hefur fjölgað gífurlega á síðusta áratug og ekki er séð fyrir endann á þeirri þróun vegna vaxandi notkunar myndrannsókna á kviðarholi. Tilviljanagreindu æxlin eru á lægri stigum og gráðun við greiningu og horfur þessara sjúklinga því betri. Aukning tilviljanagreindu æxlanna hefur leitt af sér bættar lífshorfur fyrir hópinn í heild sem er mjög jákvæð þróun. Mikilvægt er að finna nýjar leiðir til að greina sjúkdóminn fyrr því einkenni nýrnafrumukrabbameins eru lúmsk og enn greinist stór hluti sjúklinga með útbreiddan sjúkdóm sem ekki er hægt að lækna með skurðaðgerð. Ný krabbameinslyf virðast lofa góðu fyrir þennan stóra hóp sjúklinga og munu sennilega bæta horfur þeirra í nánustu framtíð.
Þakkir
Þakkir fær Sverrir Harðarson fyrir aðstoð við gerð handrits og mynda. Ásamt honum hafa læknarnir Vigdís Pétursdóttir, Eiríkur Jónsson og Jónas Magnússon lagt mikið af mörkum til þeirra rannsókna sem kynntar eru í þessari grein. Ennfremur er læknunum Kjartani Magnússyni og Þorsteini Gíslasyni færðar þakkir að ógleymdum Helga Sigvaldasyni verkfræðingi.
Íslensku rannsóknirnar hafa verið styrktar af Vísindasjóði Landspítala, Minningarsjóði Bergþóru Magnúsdóttur og Jakobs J. Bjarnasonar, Minningarsjóði Margrétar Björgólfsdóttur og Rannsóknarsjóði Krabbameinsfélags Íslands.
Heimildir
1. Guðbjartsson T, Einarsson GV, Magnússon J. Nýrnafrumukrabbamein á Íslandi 1971-1990: Nýgengi og sjúkdómseinkenni - klínísk rannsókn á 408 tilfellum. Læknablaðið 1994; 80: 13-9.
2. Guðbjartsson T, Einarsson GV, Magnússon J. Nýrnafrumukrabbamein á Íslandi 1971-1990: Stigun og lífshorfur - klínísk rannsókn á 408 tilfellum. Læknablaðið 1994; 80: 49-56.
3. Jónasson JG, Tryggvadóttir L. Cancer in Iceland. The 50th Anniversary of The Icelandic Cancer Registry. Reykjavik: Icelandic Cancer Society, 2004.
4. Guðbjartsson T, Einarsson GV, Jacobsen E, Magnússon J. Krabbamein í nýrnaskjóðu og þvagleiðurum. Afturskyggn klínísk rannsókn. Læknablaðið 1994; 80: 115-23.
5. Einarsson I, Guðbjartsson T, Einarsson GV, Jóhannsson JH, Jónmundsson GK, Bjarnason G. Wilmsæxli á Íslandi. Afturskyggn rannsókn tímabilið 1961-1995. Læknablaðið 1998; 84: 118-24.
6. Þórhallsson P, Tulinius H. Tumours in Iceland. 3. Malignant tumours of kidney. A histological classification. Acta Pathol Microbiol Scand [A] 1981; 89: 403-10.
7. Guðbjartsson T, Gíslason T. Spontaneous regression of brain metastasis secondary to renal cell carcinoma. Scand J Urol Nephrol 1995; 29: 215-7.
8. Guðbjartsson T, Einarsson GV, Magnússon J. A population-based analysis of survival and incidental diagnosing of renal cell carcinoma patients in Iceland, 1971-1990. Scand J Urol Nephrol 1996; 30: 451-5.
9. Guðbjartsson T, Harðarson S, Pétursdóttir V, Thoroddsen Á, Magnússon J, Einarsson GV. Histological subtyping and nuclear grading of renal cell carcinoma and their implications for survival: a retrospective nation-wide study of 629 patients. Eur Urol 2005; 48: 593-600.
10. Guðbjartsson T, Harðarson S, Pétursdóttir V, Thoroddsen Á, Magnússon J, Einarsson GV. Renal oncocytoma: a clinicopathological analysis of 45 consecutive cases. BJU Int 2005; 96: 1275-9.
11. Guðbjartsson T, Jónasdóttir TJ, Thoroddsen Á, Einarsson GV, Jónsdóttir GM, Kristjánsson K, et al. A population-based familial aggregation analysis indicates genetic contribution in a majority of renal cell carcinomas. Int J Cancer 2002; 100: 476-9.
12. Guðbjartsson T, Thoroddsen Á, Pétursdóttir V, Harðarson S, Magnússon J, Einarsson GV. Effect of incidental detection for survival of patients with renal cell carcinoma: results of population-based study of 701 patients. Urology 2005; 66: 1186-91.
13. Guðbjartsson T, Thoroddsen Á, Gíslason T, Agnarsson BA, Magnússon K, Geirsson G, et al. Sjálfkrafa hvarf á meinvörpum nýrnafrumukrabbameins í heila og fleiðruholi. Tvö sjúkratilfelli. Læknablaðið 2002; 88: 829-31.
14. Thoroddsen Á, Guðbjartsson T, Geirsson G, Agnarsson BA, Magnússon K. Spontaneous regression of pleural metastases after nephrectomy for renal cell carcinoma--a histologically verified case with nine-year follow-up. Scand J Urol Nephrol 2002; 36: 396-8.
15. Thoroddsen Á, Guðbjartsson T, Jónsson E, Gíslason T, Einarsson GV. Operative mortality after nephrectomy for renal cell carcinoma. Scand J Urol Nephrol 2003; 37: 507-11.
16. Ferlay J, Bray P, Pisani P, Parkin D. GLOBOCAN 2000: Cancer Incidence, Mortality and Prevalence Worldwide. Version 1.0. IARC CancerBase No.5. Lyon: IARCPress, 2001.
17 Guðbjartsson T. Renal Cell Carcinoma in Iceland: Incidence, prognosis, inheritance and treatment. University of Iceland, Reykjavik 2005.
18. Mathew A, Devesa SS, Fraumeni JF Jr., Chow WH. Global increases in kidney cancer incidence, 1973-1992. Eur J Cancer Prev 2002; 11: 171-8.
19. Chow WH, Devesa SS, Warren JL, Fraumeni JF Jr. Rising incidence of renal cell cancer in the United States. JAMA 1999; 281: 1628-31.
20. Guðbjartsson T, Einarsson GV, Magnússon J. Nýrnafrumu-krabbamein eru óvenjualgeng á Íslandi. Heilbrigðismál 1995; 4: 27-8.
21. Landis SH, Murray T, Bolden S, Wingo PA. Cancer statistics, 1999. CA Cancer J Clin 1999; 49: 8-31, 1.
22. Thoroddsen Á, Harðarson S, Pétursdóttir V, Magnússon J, Einarsson GV, Guðbjartsson T. Renal cell carcinoma in young compared to older patients. Comparison of clinicopathological riskfactors and survival. Scand J Urol Nephrol (in press) 2007.
23 Dhote R, Pellicer-Coeuret M, Thiounn N, Debre B, Vidal-Trecan G. Risk factors for adult renal cell carcinoma: a systematic review and implications for prevention. BJU Int 2000; 86: 20-7.
24. Lindblad P. Epidemiology of renal cell carcinoma. Scand J Surg 2004; 93: 88-96.
25. Parker AS, Cerhan JR, Janney CA, Lynch CF, Cantor KP. Smoking cessation and renal cell carcinoma. Ann Epidemiol 2003; 13: 245-51.
26. Liehr JG. Hormone-associated cancer: mechanistic similarities between human breast cancer and estrogen-induced kidney carcinogenesis in hamsters. Environ Health Perspect 1997; 105 Suppl 3: 565-9.
27. Maisonneuve P, Agodoa L, Gellert R, Stewart JH, Buccianti G, Lowenfels AB, et al. Cancer in patients on dialysis for end-stage renal disease: an international collaborative study. Lancet 1999; 354: 93-9.
28. Kirkali Z, Lekili M. Renal cell carcinoma: new prognostic factors? Curr Opin Urol 2003; 13: 433-8.
29. Linehan WM, Walther MM, Zbar B. The genetic basis of cancer of the kidney. J Urol 2003; 170(6 Pt 1): 2163-72.
30. Kiuru M, Kujala M, Aittomaki K. Inherited forms of renal cell carcinoma. Scand J Surg 2004; 93: 103-11.
31. Turner KJ. Inherited renal cancer. BJU Int 2000; 86: I.
32. Lonser RR, Glenn GM, Walther M, Chew EY, Libutti SK, Linehan WM, et al. von Hippel-Lindau disease. Lancet 2003; 361: 2059-67.
33. Maher ER, Iselius L, Yates JR, Littler M, Benjamin C, Harris R, et al. Von Hippel-Lindau disease: a genetic study. J Med Genet 1991; 28: 443-7.
34. Eble JN, Sauter G, Epstein JI, Sesterhann IA, editors. World Health Organization International Classification of Tumours. Tumours of the urinary system and male genitial organs. IARC Press, Lyon 2004.
35. Zbar B, Glenn G, Lubensky I, Choyke P, Walther MM, Magnusson G, et al. Hereditary papillary renal cell carcinoma: clinical studies in 10 families. J Urol 1995; 153 (3 Pt 2): 907-12.
36. Pavlovich CP, Walther MM, Eyler RA, Hewitt SM, Zbar B, Linehan WM, et al. Renal tumors in the Birt-Hogg-Dube syndrome. Am J Surg Pathol 2002; 26: 1542-52.
37. Kim HL, Zisman A, Han KR, Figlin RA, Belldegrun AS. Prognostic significance of venous thrombus in renal cell carcinoma. Are renal vein and inferior vena cava involvement different? J Urol 2004; 171(2 Pt 1): 588-91.
38. Ficarra V, Righetti R, D?Amico A, Rubilotta E, Novella G, Malossini G, et al. Renal vein and vena cava involvement does not affect prognosis in patients with renal cell carcinoma. Oncology 2001 ;61: 10-5.
39. Ljungberg B, Landberg G, Alamdari FI. Factors of importance for prediction of survival in patients with metastatic renal cell carcinoma, treated with or without nephrectomy. Scand J Urol Nephrol 2000; 34: 246-51.
40. Kovacs G, Akhtar M, Beckwith BJ, Bugert P, Cooper CS, Delahunt B, et al. The Heidelberg classification of renal cell tumours. J Pathol 1997; 183: 131-3.
41. Cheville JC, Lohse CM, Zincke H, Weaver AL, Blute ML. Comparisons of outcome and prognostic features among histologic subtypes of renal cell carcinoma. Am J Surg Pathol 2003; 27: 612-24.
42. Beck SD, Patel MI, Snyder ME, Kattan MW, Motzer RJ, Reuter VE, et al. Effect of papillary and chromophobe cell type on disease-free survival after nephrectomy for renal cell carcinoma. Ann Surg Oncol 2004; 11: 71-7.
43. Ljungberg B, Alamdari FI, Stenling R, Roos G. Prognostic significance of the Heidelberg classification of renal cell carcinoma. Eur Urol 1999; 36: 565-9.
44. Amin MB, Tamboli P, Javidan J, Stricker H, de-Peralta Venturina M, Deshpande A, et al. Prognostic impact of histologic subtyping of adult renal epithelial neoplasms: an experience of 405 cases. Am J Surg Pathol 2002; 26: 281-91.
45. Zambrano NR, Lubensky IA, Merino MJ, Linehan WM, Walther MM. Histopathology and molecular genetics of renal tumors toward unification of a classification system. J Urol 1999; 162: 1246-58.
46. Gnarra JR, Tory K, Weng Y, Schmidt L, Wei MH, Li H, et al. Mutations of the VHL tumour suppressor gene in renal carcinoma. Nat Genet 1994; 7: 85-90.
47. Renshaw AA, Fletcher JA. Trisomy 3 in renal cell carcinoma. Mod Pathol 1997; 10: 481-4.
48. Schwerdtle RF, Storkel S, Neuhaus C, Brauch H, Weidt E, Brenner W, et al. Allelic losses at chromosomes 1p, 2p, 6p, 10p, 13q, 17p, and 21q significantly correlate with the chromophobe subtype of renal cell carcinoma. Cancer Res 1996; 56: 2927-30.
49. Storkel S, Eble JN, Adlakha K, Amin M, Blute ML, Bostwick DG, et al. Classification of renal cell carcinoma: Workgroup No. 1. Union Internationale Contre le Cancer (UICC) and the American Joint Committee on Cancer (AJCC). Cancer 1997; 80: 987-9.
50. Amin MB, Crotty TB, Tickoo SK, Farrow GM. Renal oncocytoma: a reappraisal of morphologic features with clinicopathologic findings in 80 cases. Am J Surg Pathol 1997; 21: 1-12.
51. Dechet CB, Bostwick DG, Blute ML, Bryant SC, Zincke H. Renal oncocytoma: multifocality, bilateralism, metachronous tumor development and coexistent renal cell carcinoma. J Urol 1999; 162: 40-2.
52. Perez-Ordonez B, Hamed G, Campbell S, Erlandson RA, Russo P, Gaudin PB, et al. Renal oncocytoma: a clinicopathologic study of 70 cases. Am J Surg Pathol 1997; 21: 871-83.
53. Romis L, Cindolo L, Patard JJ, Messina G, Altieri V, Salomon L, et al. Frequency, clinical presentation and evolution of renal oncocytomas: multicentric experience from a European database. Eur Urol 2004; 45: 53-7; discussion 57.
54. Ritchie AW, Chisholm GD. The natural history of renal carcinoma. Semin Oncol 1983; 10: 390-400.
55. Pantuck AJ, Zisman A, Belldegrun AS. The changing natural history of renal cell carcinoma. J Urol 2001; 166: 1611-23.
56. Sufrin G, Chasan S, Golio A, Murphy GP. Paraneoplastic and serologic syndromes of renal adenocarcinoma. Semin Urol 1989; 7: 158-71.
57. Autopsies in Iceland 1981-2002 by sex and age. www.hagstofa.is Statistics Iceland, Reykjavik 2005.
58. Bos SD, Mellema CT, Mensink HJ. Increase in incidental renal cell carcinoma in the northern part of the Netherlands. Eur Urol 2000; 37: 267-70.
59. Konnak JW, Grossman HB. Renal cell carcinoma as an incidental finding. J Urol 1985; 134: 1094-6.
60. Lee CT, Katz J, Fearn PA, Russo P. Mode of presentation of renal cell carcinoma provides prognostic information. Urol Oncol 2002; 7: 135-40.
61. Bretheau D, Koutani A, Lechevallier E, Coulange C. A French national epidemiologic survey on renal cell carcinoma. Oncology Committee of the Association Francaise d?Urologie. Cancer 1998; 82: 538-44.
62. Ficarra V, Righetti R, Pilloni S, D?Amico A, Maffei N, Novella G, et al. Prognostic factors in patients with renal cell carcinoma: retrospective analysis of 675 cases. Eur Urol 2002; 41: 190-8.
63. Frank I, Blute ML, Cheville JC, Lohse CM, Weaver AL, Zincke H. An outcome prediction model for patients with clear cell renal cell carcinoma treated with radical nephrectomy based on tumor stage, size, grade and necrosis: the SSIGN score. J Urol 2002; 168: 2395-400.
64. Gettman MT, Blute ML, Spotts B, Bryant SC, Zincke H. Pathologic staging of renal cell carcinoma: significance of tumor classification with the 1997 TNM staging system. Cancer 2001; 91: 354-61.
65. Robson CJ, Churchill BM, Anderson W. The results of radical nephrectomy for renal cell carcinoma. J Urol 1969; 101: 297-301.
66. Guinan P, Sobin LH, Algaba F, Badellino F, Kameyama S, MacLennan G, et al. TNM staging of renal cell carcinoma: Workgroup No. 3. Union International Contre le Cancer (UICC) and the American Joint Committee on Cancer (AJCC). Cancer 1997; 80: 992-3.
67. Greene FL, Page DL, Fleming ID, Fritz AG, Balch CM, Haller DG, et al., editors. AJCC Cancer Staging Manual. 6th ed. American Joint Committee on Cancer, Chicago 2002.
68. Bretheau D, Lechevallier E, de Fromont M, Sault MC, Rampal M, Coulange C. Prognostic value of nuclear grade of renal cell carcinoma. Cancer 1995; 76: 2543-9.
69. Ficarra V, Righetti R, Martignoni G, D?Amico A, Pilloni S, Rubilotta E, et al. Prognostic value of renal cell carcinoma nuclear grading: multivariate analysis of 333 cases. Urol Int 2001; 67: 130-4.
70. Fuhrman SA, Lasky LC, Limas C. Prognostic significance of morphologic parameters in renal cell carcinoma. Am J Surg Pathol 1982; 6: 655-63.
71. Ljungberg B. Prognostic factors in renal cell carcinoma. Scand J Surg 2004; 93: 118-25.
72. Ljungberg B, Mehle C, Stenling R, Roos G. Heterogeneity in renal cell carcinoma and its impact no prognosis--a flow cytometric study. Br J Cancer 1996; 74: 123-7.
73. Reznek RH. Imaging in the staging of renal cell carcinoma. Eur Radiol 1996; 6: 120-8.
74. Zagoria RJ. Imaging of small renal masses: a medical success story. AJR Am J Roentgenol 2000; 175: 945-55.
75. Choyke PL. Detection and staging of renal cancer. Magn Reson Imaging Clin N Am 1997; 5: 29-47.
76. Blom JH, van Poppel H, Marechal JM, Jacqmin D, Sylvester R, Schroder FH, et al. Radical nephrectomy with and without lymph node dissection: preliminary results of the EORTC randomized phase III protocol 30881. EORTC Genitourinary Group. Eur Urol 1999; 36: 570-5.
77. Mejean A, Oudard S, Thiounn N. Prognostic factors of renal cell carcinoma. J Urol 2003; 169: 821-7.
78. Tsui KH, Shvarts O, Barbaric Z, Figlin R, de Kernion JB, Belldegrun A. Is adrenalectomy a necessary component of radical nephrectomy? UCLA experience with 511 radical nephrectomies. J Urol 2000; 163: 437-41.
79. Nesbitt JC, Soltero ER, Dinney CP, Walsh GL, Schrump DS, Swanson DA, et al. Surgical management of renal cell carcinoma with inferior vena cava tumor thrombus. Ann Thorac Surg 1997; 63: 1592-600.
80. Mejean A, Vogt B, Quazza JE, Chretien Y, Dufour B. Mortality and morbidity after nephrectomy for renal cell carcinoma using a transperitoneal anterior subcostal incision. Eur Urol 1999; 36: 298-302.
81. Beisland C, Medby PC, Sander S, Beisland HO. Nephrectomy - indications, complications and postoperative mortality in 646 consecutive patients. Eur Urol 2000; 37: 58-64.
82. Uzzo RG, Novick AC. Nephron sparing surgery for renal tumors: indications, techniques and outcomes. J Urol 2001; 166: 6-18.
83. Lerner SE, Hawkins CA, Blute ML, Grabner A, Wollan PC, Eickholt JT, et al. Disease outcome in patients with low stage renal cell carcinoma treated with nephron sparing or radical surgery. J Urol 1996; 155: 1868-73.
84. Thoroddsen Á, Einarsson GV, Gíslason Þ, Geirsson G, Jónsson E, Guðbjartsson T. Hlutabrottnám á nýra vegna nýrnafrumukrabbameins á Íslandi. Læknablaðið 2002; 88: 311/E 04.
85. Licht MR, Novick AC, Goormastic M. Nephron sparing surgery in incidental versus suspected renal cell carcinoma. J Urol 1994; 152: 39-42.
86. Cohen HT, McGovern FJ. Renal-cell carcinoma. N Engl J Med 2005; 353: 2477-90.
87. Novick AC. Nephron-sparing surgery for renal cell carcinoma. Br J Urol 1998; 82: 321-4.
88. Dunn MD, Portis AJ, Shalhav AL, Elbahnasy AM, Heidorn C, McDougall EM, et al. Laparoscopic versus open radical nephrectomy: a 9-year experience. J Urol 2000; 164: 1153-9.
89. Swanson DA. Surgery for metastases of renal cell carcinoma. Scand J Surg 2004; 93: 150-5.
90. Mickisch GH, Garin A, van Poppel H, de Prijck L, Sylvester R. Radical nephrectomy plus interferon-alfa-based immunotherapy compared with interferon alfa alone in metastatic renal-cell carcinoma: a randomised trial. Lancet 2001; 358: 966-70.
91. Mickisch G, Carballido J, Hellsten S, Schulze H, Mensink H. Guidelines on renal cell cancer. Eur Urol 2001; 40: 252-5.
92. Levy DA, Slaton JW, Swanson DA, Dinney CP. Stage specific guidelines for surveillance after radical nephrectomy for local renal cell carcinoma. J Urol 1998; 159: 1163-7.
93. Yagoda A, Abi-Rached B, Petrylak D. Chemotherapy for advanced renal-cell carcinoma: 1983-1993. Semin Oncol 1995; 22: 42-60.
94. Flanigan RC, Salmon SE, Blumenstein BA, Bearman SI, Roy V, McGrath PC, et al. Nephrectomy followed by interferon alfa-2b compared with interferon alfa-2b alone for metastatic renal-cell cancer. N Engl J Med 2001; 345: 1655-9.
95. Collins S, McKiernan J, Landman J. Update on the epidemiology and biology of renal cortical neoplasms. J Endourol 2006; 20: 975-85.
96. Motzer RJ, Rini BI, Bukowski RM, Curti BD, George DJ, Hudes GR, et al. Sunitinib in patients with metastatic renal cell carcinoma. JAMA 2006; 295: 2516-24.
97. Escudier B, Eisen T, Stadler WM, Szczylik C, Oudard S, Siebels M, et al. Sorafenib in advanced clear-cell renal-cell carcinoma. N Engl J Med 2007; 356: 125-34.
98. Motzer RJ, Hutson TE, Tomczak P, Michaelson MD, Bukowski RM, Rixe O, et al. Sunitinib versus interferon alfa in metastatic renal-cell carcinoma. N Engl J Med 2007; 356: 115-24.
99. Mouraviev V, Joniau S, Van Poppel H, Polascik TJ. Current status of minimally invasive ablative techniques in the treatment of small renal tumours. Eur Urol 2007; 51: 328-36.
100. Beisland C, Medby PC, Beisland HO. Renal cell carcinoma: gender difference in incidental detection and cancer-specific survival. Scand J Urol Nephrol 2002; 36: 414-8.