06. tbl 92. árg. 2006
Fræðigrein
Algengi IgG mótefna gegn Toxoplasma gondii, Helicobacter pylori og lifrarbólguveiru A á Íslandi. Tengsl við ofnæmi og lungnaeinkenni
Foodborn infections in Iceland. Relationship to allergy and lung function
Læknablaðið 2006; 92: 437-44
Ágrip
Inngangur: Smit sem berst með fæðu eða saurmengun getur haft áhrif á heilsu einstaklinga með beinum áhrifum sýkingar eða óbeint gegnum ónæmiskerfi.
Tilgangur: Að rannsaka algengi og áhættuþætti fyrir smiti með bogfrymli, H. pylori og lifrarbólguveiru A meðal Íslendinga og jafnframt að kanna áhrif smits á ofnæmistengd lungnaeinkenni og lungnastarfsemi.
Efniviður og aðferðir: Blóðsýnum var safnað á árinu 1999-2001 frá 505 einstaklingum á aldrinum 28-52 ára. Rannsóknarþýðið var upphaflega valið með slembiúrtaki úr þjóðskrá. Mælingar á IgG mótefnum gegn bogfrymli, H. pylori og lifrarbólguveiru A var gerð með ELISA aðferð. Ofnæmistengd lungnaeinkenni voru metin með spurningalista og IgE miðlað ofnæmi og lungnastarfsemi mæld. X2 próf var notað fyrir leitni en óleiðrétt aðhvarfspróf til að bera saman mismun í algengi IgG mótefna. Fjölbreytuaðhvarf var notað til að reikna leiðrétt áhættuhlutfall og 95% öryggismörk fyrir mismunandi þætti sýkinganna.
Niðurstöður: Algengi mótefna var 9,8% fyrir bogfrymli, 36,3% fyrir H. Pylori og 4,9% fyrir lifrarbólguveiru A. Áhættuþáttur fyrir bogfrymli smiti var leikskólavist fyrir þriggja ára aldur. Áhættuþáttur fyrir H. pylori smiti var aldur og reykingar. IgG mótefni gegn hverjum einum þessara þriggja smitvalda eða öllum höfðu ekki áhrif á algengi astma eða bráðaofnæmis. Einstaklingar sem höfðu IgG mótefni gegn bogfrymli höfðu skerta lungnastarfsemi, sem kom fram í lækkuðu FEV/FVC hlutfalli.
Ályktun: Smit með bogfrymli, H. pylori og lifrarbólguveiru A hefur ekki fylgni við algengi bráðaofnæmis eða astma. Niðurstöður benda til að smit með bogfrymli hafi fylgni við skerta lungnastarfsemi.
Inngangur
Algengi smits með Helicobacter pylori (H. pylori), bogfrymilssótt (Toxoplasmosis) og lifrarbólguveiru A er breytilegt milli þjóða og innan þjóðlanda, en smit er yfirleitt mun algengara hjá vanþróuðum þjóðum en þeim sem þróaðri eru (1-3). Það er margt skylt með smitleiðum þessara sýkla en ennfremur eru nokkur atriði ólík og smitleiðir H. pylori eru að verulegu leyti óþekktar. Allir sýklarnir geta borist með fæðu en sennilega einnig með smitun frá munni til munns eða úr saur til munns. Algengi smits getur gefið vísbendingu um hreinlætisástand þjóða og/eða hópa. Smit með H. pylori og bogfrymli er vanalega landlægt og veldur ævilangri og oft einkennalausri smitun, en lifrarbólguveira A gengur mest í faröldrum og orsakar skammvinnan en stundum alvarlegan sjúkdóm. Smit með H. pylori og bogfrymli getur einnig haft alvarlegar afleiðingar. Bogfrymlasótt er sjúkdómur sem orsakast af sníkjudýri, bogfrymli, sem sest að inni í frumum þeirra sem fyrir smitinu verða. Bogfrymlasmit er ein algengasta sníkjudýrasmitun í heiminum og það er áætlað að um þriðjungur allra jarðarbúa séu smitaðir (2). Hjá einstaklingum með heilbrigt ónæmiskerfi gefur bogfrymlasmit engin einkenni í 80-90% tilfella (4), en dulið eða einkennalaust smit getur varað ævilangt. Hjá einstaklingum með skerta starfsemi ónæmiskerfisins og sérstaklega hjá þeim sem eru með AIDS getur bogfrymlasmit orsakað veikindi. Dýr af kattaætt eru einu hýslarnir þar sem bogfrymill getur klárað æxlunarhringinn (2). Þegar kettir hafa neytt bogfrymils í einhverju formi smitar sníkjudýrið slímhúð meltingarfæranna og framleiðir egg sem berast út með hægðunum. Ef aðrar dýrategundir, þar með talið maðurinn, neyta bogfrymilseggja fer sníkjudýrið í gegnum slímhúð meltingarfæra og dreifir sér út um allan líkamann. Þegar sníkillinn sest að í frumum líkamans ummyndast hann í örlitla blöðru sem liggur í dvala út líftíma hýsilsins. Neysla á hráu eða illa hituðu kjöti og meðhöndlun matar með óhreinum höndum eru ábyrg fyrir meirihluta smits af völdum bogfrymla í Frakklandi (5). Hjá vanþróuðum þjóðum er sýkingin hins vegar oftast vegna smits frá jarðvegi eða umhverfi því kjöt á þessum svæðum er sjaldan borðað hrátt eða illa matreitt.
H. pylori smit í slímhúð magans er til staðar hjá um það bil helmingi jarðarbúa (1) og langoftast (?85%) veldur smitið ævilangri vægri, einkennalausri magabólgu. Það er hins vegar orsakasamband á milli smits og ætisára (6), magakrabbameins (7) og eitlakrabbameins í slímhúð (8). Þverskurðarrannsóknir í þróuðum löndum hafa sýnt vaxandi algengi með aldri sem hefur verið skýrt sem kynslóðaáhrif vegna minnkandi smittíðni í yngri aldurshópum barna með auknu hreinlæti og batnandi lífskjörum (9-11).
Algengi mótefna gegn lifrarbólguveiru A er um 100% hjá vanþróuðum þjóðum (12) en meðal þróaðra þjóða er það mjög breytilegt milli landsvæða og aldurshópa og fer vaxandi með aldri. Í Evrópu er algengið lægst í Skandinavíu <10% en í Grikklandi var það um 100% (13). Smit með lifrarbólguveiru A hefur fyrst og fremst verið talið saur/munn smit og algengi lifrarbólguveiru A smitunar er mun næmari vísbending um hreinlætisástand hópa og þjóða heldur en smit með bogfrymli eða H. pylori.
Nýjar hliðar á hugsanlegum áhrifum fæðutengdra eða langvarandi meltingarfærasýkinga hafa komið í ljós á seinustu árum. Hreinlætiskenningin fjallar um það að breytingar í nánasta umhverfi manna vegna vaxandi hreinlætis og færri sýkinga hjá börnum hafi áhrif á ónæmiskerfið á þann hátt að Th 0 eitilfrumur þróist ekki yfir í Th1 frumur heldur yfir í Th2 frumur sem stuðla að bráðaofnæmi (10, 11, 14). Því hefur verið haldið fram að sýkingar sem berast með andrúmslofti eða öndunarfærasýkingar hafi minni áhrif á ónæmiskerfið heldur en fæðutengdar sýkingar (11). Bogfrymill (15), H. pylori (16) bakterían og lifrarbólguveira A (17) breyta ónæmissvari varanlega ef smit verður á barnsaldri, og þessar sýkingar hafa verið hluti af smitflórunni gegnum þróunarskeið mannsins. Minnkað algengi þessara sýkinga hjá þróuðum þjóðum hefur hugsanlega lagt sitt af mörkum varðandi þann ofnæmifaraldur sem nú herjar á þessar þjóðir (18, 19).
Tilgátur hafa komið fram um að langvarandi lágstillt bólga sem er mæld meðal annars með "high sensitive C-reactive protein (hs-CRP)", geti verið meðvirkandi í meingerð margra sjúkdóma (20), til dæmis hjarta- og æðasjúkdóma (21). Bólgan getur stafað af margvíslegum þekktum og óþekktum orsökum, meðal annars sýkingum. Fyrri rannsóknir okkar á núverandi efnivið hafa sýnt að hs-CRP hefur fylgni við jákvæð bogfrymilsmótefni (22). Ennfremur hafa rannsóknir á þessum efnivið sýnt fylgni hs-CRP við astma sem ekki tengist ofnæmi (23) og við skerta lungnastarfsemi (24).
Rannsókn okkar er byggð á gögnum sem safnað var í Evrópurannsókninni lungu og heilsa (ECRHS I & II) (25, 26) um bráðaofnæmi, lungnaeinkenni og lungnastarfsemi. Einnig var safnað sermissýnum. Rannsóknin vinnur eingöngu með gögn frá Íslandi. ECRHS gagnagrunnurinn gerir mögulegt að prófa tilgátur um samspil smits, bráðaofnæmis og lungnastarfsemi. Megintilgangur rannsóknarinnar var eftirfarandi:
1. Að finna með sermismælingum núverandi algengi smits með bogfrymli, H. pylori og lifrarbólguveiru A á Íslandi og jafnframt að kanna hverjir eru helstu áhættuþættir fyrir smiti.
2. Að kanna hugsanleg tengsl þessara sýkinga við lungnastarfsemi, bráðaofnæmi og ofnæmistengd lungnaeinkenni.
Efniviður og aðferðir
Evrópurannsóknin lungu og heilsa (ECRHS I) var verkefni sem lagt var í til að rannsaka landfræðilegan mun á tíðni astma og ofnæmissjúkdóma og áhættuþætti þeirra hjá ungu fullorðnu fólki (27). Yfirlit um rannsóknina er sýnt á mynd 1 og frekari upplýsingar á vefslóð www.ECRHS.org
Markhópurinn fyrir okkar rannsókn voru allir sem bjuggu á Reykjavíkursvæðinu og tóku þátt í ECRHS I og voru boðnir til endurrannsóknar á árunum 1999-2001 (ECRHS II) (25, 26). Miðgildi fyrir eftirfylgni var 8,4 ár. Blóðsýni til ákvörðunar á H. pylori, lifrarbólguveiru A og bogfrymils- mótefnum var safnað frá 505 einstaklingum og af þeim voru 442 frá slembihópnum og 63 frá einkennahópnum sem var tekinn með til að auka getu (power) rannsóknarinnar til að greina tengsl við ofnæmi og lungnastarfsemi. Algengi smits í einkennahópnum var ekki marktækt frábrugðið algengi í slembivalshóp. Tölfræðileg tengsl ættu ekki að skekkjast við að sameina þessa tvo hópa. Vísindasiðanefnd veitti samþykki fyrir rannsókninni.
Aðferðir til mælinga á mótefnum í sermi
Notuð var Enzyme-Linked Immunosorbent Assay (ELISA) til að mæla IgG mótefni fyrir bogfrymli (28). ELISA aðferðin notaði plötur, sem voru þaktar með óvirkum bogfrymilsmótefnavökum. Til stillingar var notaður bogfrymils IgG staðall, stilltur í samræmi við þriðju alþjóðlegu staðla WHO. Öll hvarfefni voru fengin frá Novatec Immunodiagnostica GmbH Dietzenbach, Þýskalandi. Sermi sýni með titra >35 IU/ml voru flokkuð sem jákvæð en sýni með gildi 30-35 IU/ml og sýni með gildi <30 IU/ml voru flokkuð sem neikvæð. Næmi og sértæki fyrir bogfrymils IgG ELISA aðferðina hefur sýnt sig að vera 96,8% og 100% fyrir hvort um sig (21). Tilvist H. pylori smitunar var fundin með mælingu á H. pylori IgG mótefnum. Notað var CapitaTM H. pylori IgG ELISA frá Trinity Biotech, Bray, Írlandi. Neikvæð og jákvæð viðmiðunarsýni fylgja hvarfefnum ásamt sérstökum staðli til að ákvarða viðmiðunarmörk. Sá staðall er búinn til með því að þynna jákvætt sermi þannig að niðurstöður mælinga gefi viðmiðunarmörk aðferðarinnar (cutoff value). Ónæmisstöðuhlutfall (Immune Status Ratio (ISR)) sjúklingasýna var reiknað samkvæmt leiðbeiningum frá framleiðanda hvarfefna. Reikningur fólst í að margfalda meðaltal ljósgleypnimælinga á staðli fyrir viðmiðunarmörk með sérstökum leiðréttingarfasa, sem framleiðandi hvarfefna gefur hverri hvarfefnalotu. Til þess að fá fram ISR var því margfeldi deilt upp í niðurstöður ljósgleypnimælingar á einstökum sjúklingasýnum. Sermi sýni með ISR > eða = og 1,1 voru flokkuð sem jákvæð en sermi sýni með gildi á bilinu 0,91-1,09 og sýni með ISR gildi < eða = 0,9 voru flokkuð sem neikvæð. Næmi er 89% og sértæki 78% fyrir H. pylori IgG ELISA aðferðina (29). Tilvist lifrarbólguveiru A mótefna var mæld með "competitive electrochemiluminescence immunoassay" með Elecsys 2010 automated instrument (Roche Switserland). Aðferðin er stöðluð með öðrum alþjóðlegum staðli fyrir "Anti-Hepatitis Human Immunoglobulin of the National Institute for Biological Standards and Control (NIBSC code 97/646)". Sermissýni með þéttni hærri en 20 IU/L voru flokkuð sem jákvæð en sýni með þéttni minna en 20 IU/L voru flokkuð sem neikvæð. Mælingin hefur 100% næmi og 99% sértæki (30).
Spurningalisti og viðtal
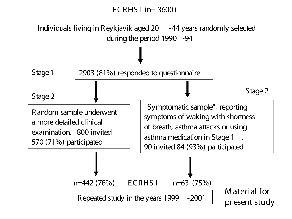
Figure 1. An overview of the ECHRS studies I & II. Percentage response rate shown in parenthesis.
Þátttakendur fóru í gegnum staðlað viðtal þar sem skráðar voru nákvæmar upplýsingar um einkenni frá lungum og fyrri greiningar, reykingasögu, starfsgrein og útsetningu fyrir áreitum frá barnsaldri. Astmi var skilgreindur sem astmi greindur af lækni og astmatengd einkenni eða astmaköst seinustu 12 mánuði (23). Samkvæmt svörum á spurningalista var þátttakendum raðað í þrjá reykingaflokka: Þeir sem aldrei höfðu reykt, fyrrverandi reykingamenn og núverandi reykingamenn. Eftirfarandi atriði eða áreiti fyrr á ævinni voru skráð: Spítalavist fyrir fimm ára aldur út af lungnasjúkdómi, aldur þegar einstaklingur var í dagvistum eða á barnaheimili, hvort hann deildi svefnherbergi með öðrum börnum fyrir fimm ára aldur, gæludýr á barnsaldri (hundur, köttur og fuglar) og uppvöxtur í sveit eða bæ fyrir fimm ára aldur (Table III). Efnahags- og þjóðfélagsstaða var skilgreind samkvæmt upplýsingum um starfsgrein þátttakenda sem kom fram í ECRHS I könnuninni og var notuð bresk skilgreining (31). Samkvæmt þessari skilgreiningu var þátttakendum skipt í: A Menntaðir sérfræðingar og stjórnendur. B Tæknimenntað verkafólk. D. Ómenntað verkafólk. E. Óskilgreint.
Öndunarmælingar
Öndunarpróf mældi hámarks fráblástur (FVC) (forced vital capasity)) og fráblástur á 1. sek. (FEV1). Rannsóknin var endurtekin fimm sinnum. Ennfremur var kannað hvort FEV1 og FVC uppfyllti skilmerki Ameríska lungnalæknafélagsins fyrir áreiðanleika (32). Hæð og þyngd voru mæld og líkamsþyngdarstuðull reiknaður eftir formúlunni þyngd/ hæð2.
Ofnæmispróf
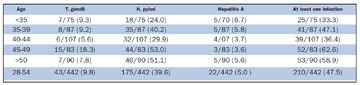
Table I. The prevalence of IgG antibodies to T. gondii, H. pylo
ri and Hepatitis A Virus by age and centre (n positive/ all (%)).
Heildar- og sértækt IgE í sermi var mælt með Pharmacia CAP System (Pharmacia Diagnostics, Uppsala, Sweden). Sértækt IgE var mælt fyrir dermatophagoides pteronyssinus, vallarfoxgrasi, köttum og Cladosporium herbarum í samræmi við rannsóknaráætlun Evrópurannsóknarinnar. Þátttakandi var talinn með ofnæmi ef hann hafði sértæk IgE mótefni (?0,35kU/L) fyrir einum eða fleiri ofnæmisvökum. Vallarfoxgras, kettir og rykmaurar eru mikilvægustu ofnæmisvakarnir á Íslandi (27). Aðferðafræði hefur verið nánar lýst í fyrri útgáfum í ECHRS I efnivið (33). Rétt er að taka fram að margar aðrar tegundir ofnæmis eru hér undanskildar og líklegt er að þó nokkur hluti einstaklinga með tegund I ofnæmis séu ekki greindir með þessari þröngu skilgreiningu. Þetta takmarkar nokkuð getu rannsóknar okkar til að prófa hreinlætiskenninguna.
Tölfræði
Tölfræðiúrvinnsla var gerð með hugbúnaðarforritinu Stata 8.0 (Stata Corporation, Collega Station, Texas). X2 próf var notað fyrir leitni (test for trend) en óleiðrétt aðhvarfspróf (unadjusted logistic regression) var notað til að bera saman mismun í algengi IgG mótefna milli karla og kvenna og milli aldurshópa. Fjölbreytuaðhvarf (multible logistic regression) var notuð til að reikna leiðrétt áhættuhlutfall og 95% öryggismörk fyrir mismunandi þætti sýkinganna. Greining á tengslum milli sýkingaþátta og lungastarfsemi og ofnæmis var gerð með því að nota bæði slembisýnið og einkennasýnið (n=63). Þetta var gert til að auka getu rannsóknarinnar til að greina samband smits og ofnæmis. Allir aðrir útreikningar voru gerðir á slembisýninu (n=442).
Lýsing á félagslegri- og efnahagslegri þróun
Í skýrslu Sameinuðu þjóðanna frá 2005 (34) eru 178 þjóðir flokkaðar í há-, meðal- eða lágþróunarstig samkvæmt "Human Development Index" (HDI) sem nær frá 0-1. HDI er samsettur mælikvarði sem metur meðaltalsárangur í hverju landi og byggist mælikvarðinn á þrem mælikvörðum á mannlega þróun: Löngu og heilbrigðu lífi og lífshorfum við fæðingu; þekkingu, mældri í hlutfalli læsis og síðan hlutfalli þeirra sem ljúka grunn-, framhalds- og háskólamenntun; góðum lífskjörum, mældum í þjóðarframleiðslu (gross domestic product) á íbúa og kaupgetu (purchasing power parity) miðað við gengi Bandaríkjadals. Öllum löndunum sem fá HDI mælingu er síðan skipt í þrjá flokka eftir þróunarstigi: Háþróuð (HDI 0,800 og yfir), meðalþróuð (HDI 0,500-0,799) og lágþróuð (HDI <0,500). Árið 2003 var Ísland í 2. sæti á heimslista yfir HDI með 0,956 stig, en árið 1975 var Ísland með 0,863 stig.
Niðurstöður
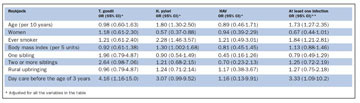
Table II. Age, sex, smoking and early life exposure variables and the risk of T. gondii, H. pylori and Hepatitis A Virus IgG antibodies in Reykjavík.
Algengi H. pylori mótefna og allra þriggja mótefnanna samanlagt jókst marktækt með aldri (P<0,001) (Table I). Algengi þeirra sem höfðu H. pylori mótefni og þeirra sem höfðu mótefni gegn að minnsta kosti einum smitvaldi, var marktækt meira í körlum en konum (45,8 á móti 32,9, P=0,005 og 52,3 á móti 43,0, P=0,049). Þátttakendur sem höfðu jákvæð H. pylori mótefni voru einnig oftar jákvæðir fyrir bogfrymilsmótefnum (P=0.04), en ekkert samband var á milli jákvæðra mótefna fyrir lifrarbólguveiru A og hinna tveggja (table I).
Áhætta á að hafa mótefni gegn H. pylori eða gegn að minnsta kosti einum smitvaldi (tafla II) var aukin hjá þeim sem höfðu verið eða voru reykingafólk. Mótefni gegn bogfrymli og lifrarbólguveiru A höfðu ein og sér ekki aukna fylgni við reykingar. Ekkert samband fannst milli þjóðfélagsstöðu og smits.
Áhættuþættir fyrir smiti snemma á ævinni og algengi bogfrymils, H. pylori og lifrarbólgu A IgG mótefna
Eftirfarandi áhættuþættir fyrir smiti snemma á ævinni voru metnir: Fjöldi systkina, dagvistun fyrir þriggja ára aldur og uppeldi í sveit eða borg. Bogfrymilsmótefni voru algengari hjá þátttakendum sem höfðu verið í dagvistun fyrir þriggja ára aldur en ekkert annað marktækt samband fannst milli mótefnagilda og þessara áhættuþátta. Sama gilti einnig um dýrahald í æsku (hunda, ketti og fugla), spítalavist vegna öndunarfærasýkinga fyrir fimm ára aldur, aldur móður og aldur við lok skólagöngu (table II).
Samband milli bogfrymils, H. pylori og lifrarbólguveiru A IgG mótefna og öndunarfæraeinkenna, astma og sértækra IgE mótefna
Þátttakendur með mótefni gegn að minnsta kosti einum smitvaldi höfðu marktækt minni líkur á að hafa urg eða urg þegar þeir voru ekki með öndunarfærasýkingu og það síðarnefnda var einnig marktækt fátíðara í einstaklingum með mótefni gegn H. pylori einum (table III). Þetta samband fannst ekki við mótefni gegn bogfrymli eða lifrarbólguveiru A ein og sér. Morgunhósti og uppgangur, sem tengjast berkjubólgu og lungnateppu voru algengari hjá þeim sem voru með IgG mótefni gegn lifrarbólguveiru A. Þátttakendur með mótefni gegn bogfrymli höfðu marktækt oftar FEV/FVC hlutfall undir 70%.
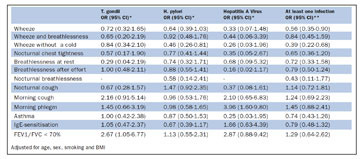
Table III. Association between T. gondii, H pylori and HAV and respiratory symptoms, asthma and IgE-sensitisation and lung function
Umræða
Rannsókn okkar notar eingöngu IgG mótefni sem mælikvarða á algengi smits af völdum þessara þriggja smitvalda sem rannsóknin beinist að. Við bogfrymilssmit koma fram IgG mótefni innan einnar eða tveggja vikna og ná þau hámarki á 6-8 vikum og lækka síðan á næstu tveimur árum en mótefnin eru greinanleg fyrir lífstíð (28). Bogfrymilssmit hverfur aldrei af sjálfu sér. Næmi og sértæki bogfrymils IgG mótefna er 100% og 97%. Við H. pylori smit koma IgG mótefni fram einni til tveim vikum síðar, ná hámarki á 6-8 vikum og halda áfram að vera hækkuð eins lengi og smitið varir. Sértæki og næmi H. pylori IgG ELISA er 89 % og 78% (29). Ef H. pylori sýking er upprætt með lyfjum eða hverfur af sjálfu sér þá lækka mótefni á næstu tveimur árum og hverfa síðan alveg á næstu 2-4 árum þar á eftir (35). Smit með H. pylori er vanalega ævilangt og það hverfur mjög sjaldan, sérstaklega hjá þeim aldurshópi sem var til skoðunar í okkar rannsókn (36). Smit með lifrarbólguveiru A gefur ævilangt IgG mótefnasvar (37) og næmi og sértæki ELISA prófsins eru 100% og 99%. Ef bólusett er við lifrarbólguveiru A fæst langvarandi ónæmi (38). Á Íslandi var fyrst bólusett við lifrarbólguveiru A 1999 og hafa áhættuhópar fyrst og fremst verið bólusettir og þá einkum þeir sem ferðast til áhættusvæða. Það er því ólíklegt að bólusetning eigi mikinn þátt í jákvæðum prófum í okkar rannsókn. Aðferðir sem notaðar voru í rannsókninni ættu að gefa tiltölulega nákvæma mynd um raunverulegt algengi smitunar. Þýðið af Reykjavíkursvæðinu var valið með slembiaðferð og þátttökuhlutfall var með því besta sem gerðist í Evrópurannsókninni lungu og heilsa. Sýnin sem notuð voru við rannsóknina ættu því að gefa rétta mynd af aldurshópnum sem skoðaður var.
Rannsókn okkar leiðir í ljós allsherjar smittíðni 47,5% í aldurshóp sem var 28-54 ára á árunum 1999-2001. Það er athyglisvert að sýkingartíðnin fellur með aldri frá 58,9% í aldurshópnum 50 ára og eldri niður í 33,3% hjá þeim sem eru 35 ára og yngri. Á því 15-20 ára tímabili sem rannsakað er þá hefur allsherjar algengi minnkað í aldurshópunum um 43%, fyrst og fremst vegna lækkunar á algengi H. pylori smits sem hefur minnkað um meira en helming. Þessar niðurstöður hafa töluverða þýðingu fyrir lýðheilsu og gefa vísbendingar um hreinlætisástand á Íslandi þar sem öll smitin eru tengd fæðu eða hafa smitleiðir sem eru frá munni til munns eða saur til munns. Rannsókn okkar sýnir marktæka fylgni milli H. pylori og bogfrymilssmits sem bendir til sameiginlegra smitleiða en engin fylgni var milli lifrarbólguveiru A smits og hinna tveggja. Algengi bogfrymilssmits var 9,8% og er engin marktæk breyting með aldri. Eina útsetningaráhættan í æsku sem marktækt tengdist bogfrymilssmiti var dagvistun fyrir þriggja ára aldur. Þetta bendir á jarðvegstengt smit sem er mest á barnsaldri og getur aukist við náið samneyti við önnur börn á sama aldri. Það er athyglisvert að heimiliskötturinn, hýsill fyrir bogfrymilssýkingu, er ekki áhættuþáttur fyrir smit í okkar rannsókn. Kötturinn er aðeins smitandi um það bil tvær vikur eftir smit (2) og kettir í borgum eru mun ólíklegri til þess að smitast heldur en kettir í sveit. Engar fyrri rannsóknir eru til frá Íslandi sem gerðar eru á slembiúrtaki en nokkrar rannsóknir eru til um algengi bogfrymilssmits í sérstökum hópum. Algengi sem komið hefur fram í fyrri rannsóknum er 11,1% 1956 (39) hjá blóðgjöfum, 36,4% hjá verkafólki í sláturhúsum 1965 (40), 18,3% hjá blóðgjöfum 1985 (34), 7,1% hjá konum í áhættu að fá bogfrymilssótt 1981-87 og 4,7% hjá konum sem prófaðar voru fyrir rauðum hundum á tímabilinu 1979-80 (41). Núverandi rannsókn og fyrri rannsóknir benda til að bogfrymilssmit sé landlægt á Íslandi með lágt algengi á bilinu 5-10%. Það er vel mögulegt að Íslendingar smitist í útlöndum af bogfrymli þar sem þeir ferðast mikið til landa þar sem smithætta er veruleg. Má þar nefna Miðjarðarhafslöndin og þá sérstaklega Frakkland sem hefur um 70% algengi (6). Rannsókn okkar sýndi að meðalalgengi fyrir H. pylori var 36,3% og fór tíðin vaxandi með aldri. Reykingar eru áhættuþáttur fyrir H. pylori sýkingu og þessi tengsl benda sterklega til smitleiðar frá munni til munns við samnotkun á sígarettum, pípum, og vindlum; handsnertingu og nánum tengslum við annað reykingafólk. Ein rannsókn frá Glasgow hefur sýnt það sama (42). Tekist hefur að einangra H. pylori frá skánum á tönnum og úr munnvatni (43) (44) og það styður möguleika á smitleiðum frá munni til munns.
Aðrar rannsóknir á aldursflokkum sem fæddust á fyrstu áratugum síðustu aldar sýna að algengi H. pylori smits var þá í kringum 80% (9). Algengi H. pylori smits hefur því farið minnkandi á seinustu 80 árum. Algengi H. pylori smits í 470 börnum sem voru magaspegluð á seinustu þremur árum (2003-2005) vegna meltingaróþæginda var <5% (Lúter Sigurðsson, óbirt gögn). Gera má ráð fyrir að algengi H. pylori smits í óvöldum hóp barna sé töluvert lægra.
HDI skalinn frá 1975 (27) og síðar gefur góða vísbendingu um lífsskilyrði Íslendinga síðustu áratugina. Ísland er í næstefsta sæti vel þróaðra þjóða 2003 og má gera ráð fyrir að gott hreinlætisástand fylgi þessu þróunarstigi. Hafa ber í huga að þau smit sem rannsökuð eru í okkar rannsókn gerast fyrst og fremst á barnsaldri og á það sérstaklega við um H. pylori. Tímabilið þegar rannsóknarhópurinn var á barnsaldri, 1946-1970, var mikið þróunartímabil á Íslandi og gera má ráð fyrir að Ísland hafi á þessum tíma farið úr miðflokki yfir í efsta flokk HDI hópsins. Hreinlætisástand var því ekki eins gott á fyrrihluta þessa tímabils og á það vafalítið þátt í tiltölulega hárri smittíðni á H. pylori. Margar rannsóknir hafa sýnt fylgni milli H. pylori smits og þjóðfélagshóps, húsnæðisþrengsla og fjölda systkina. Slík fylgni kom ekki fram í okkar rannsókn. Þetta bendir til að þjóðfélagsgerð á Íslandi 1950-60 hafi verið á þann veg að það misræmi sem ríkti innan rannsóknarhópsins á þessum tíma hafi ekki verið nógu mikið til þess að hafa áhrif á smittíðni á H. pylori. Það er athyglisvert að íbúðarhúsnæði Íslendinga í m2 á íbúa hefur vaxið úr 20 m2 1950 í 50 m2 árið 2003 (45). Rannsókn okkar bendir til að nýsmit á H. pylori sé svo fátítt á Íslandi að nýgengi og algengi smits muni halda áfram að minnka án sérstakra inngripa.
Rannsókn okkar sýnir að algengi lifrarbólguveiru A mótefna eru 4,9% og er engin breyting með aldri. Fyrri rannsókn á Íslandi sýndi 6% algengi í aldurshóp sem fæddur var 1950-59 (46). Seinasti marktæki faraldurinn af lifrarbólguveiru A var 1952 og algengi í aldursflokkum sem fæddir eru eftir 1960 eru í kringum 4,7% (46). Algengi lifrarbólguveiru A smits í aldurshópum sem voru fæddir í byrjun 20. aldar var hins vegar um 66% (47). Núverandi og fyrri rannsóknir sýna að smit á lifrarbólguveiru A er minniháttar heilbrigðisvandamál á Íslandi og vafalítið hafa nokkrir einstaklingar smitast erlendis af þeim sem fæddir eru eftir 1952.
Rannsókn okkar sýnir hærri smittíðni H. pylori hjá körlum en konum og eru ástæður þess óljósar en einn möguleiki er að það geti tengst reykingum sem eru algengari hjá körlum. Aðrar rannsóknir hafa sýnt það sama (42, 48, 49) og ein rannsókn hefur leitt í ljós að smitið hverfur frekar hjá konum en körlum (50) og getur það bent til erfðaþáttar sem snýr að svari hýsils við smiti.
Tilgátan um að smit með bogfrymli, H. pylori og lifrarbólguveiru A muni minnka algengi ofnæmis og astma í rannsóknarhópnum fær aðeins að hluta stuðning af niðurstöðum rannsókna okkar. Þátttakendur með IgG mótefni gegn einum eða fleiri sýkingarþáttum voru marktækt ólíklegri til þess að hafa urg eða urg þegar þeir voru ekki með öndunarfærasýkingu og önnur astmatengd einkenni gengu í sömu átt en náðu ekki marktækni. Urg er eitt af einkennum við astma en sýkingarnar þrjár, hvor fyrir sig eða sameiginlega, höfðu þrátt fyrir það ekki fylgni við algengi astma né ofnæmis. Þröng skilgreining á ofnæmi veikir hins vegar rannsókn okkar varðandi þennan þátt. Möguleiki á að smit með bogfrymli geti tengst lungnastarfsemi hefur ekki verið kannaður í fyrri rannsóknum. Okkar rannsókn bendir til að svo geti verið með því að sýna að IgG mótefni gegn bogfrymli voru marktækt tengd lækkun á FEV/FVC hlutfalli niður fyrir 70% sem bendir á skerta lungnastarfsemi. Reykingar eru ein algengasta orsök skertrar lungnastarfsemi en okkar rannsókn leiðrétti fyrir áhrifum reykinga. Þess ber þó að geta að þýðið í rannsókn okkar er það lítið að öll tengsl sem rannsóknin hefur leitt í ljós þarf að taka með fyrirvara og staðfesting í stærra þýði er nauðsynleg.
Þakkir
Rannsóknin var styrkt af Rannsóknasjóði (styrkur nr. 050405011), af Vísindasjóði Landspítala, Sænsku hjarta- og lungnastofnuninni og Vardal stofnuninni fyrir Heilbrigðisvísindi og ofnæmisrannsóknir og loks sænsku samtökunum gegn astma og ofnæmi. Lovísu Guðmundsdóttur og Kristínu Báru Jörundsdóttur er sérstaklega þökkuð aðstoð við gagnasöfnun. Það er enginn hagsmunaárekstur fyrir neinn af höfundum varðandi þessa rannsókn.
1. Pounder RE, Ng D. The prevalence of Helicobacter pylori infection in different countries. Aliment Pharmacol Ther 1995; 9 Suppl 2: 33-9.
2. Tenter AM, Heckeroth AR, Weiss LM. Toxoplasma gondii: from animals to humans. Int J Parasitol 2000; 30: 1217-58.
4. McCabe RE, Brooks RG, Dorfman RF, Remington JS. Clinical spectrum in 107 cases of toxoplasmic lymphadenopathy. Rev Infect Dis 1987; 9: 754-74.
5. Baril L, Ancelle T, Goulet V, Thulliez P, Tirard-Fleury V, Carme B. Risk factors for Toxoplasma infection in pregnancy: a case-control study in France. Scand J Infect Dis 1999; 31: 305-9.
6. Blaser MJ. Helicobacter pylori and the pathogenesis of gastroduodenal inflammation. J Infect Dis 1990; 161: 626-33.
7. Parsonnet J, Friedman GD, Vandersteen DP, Chang Y, Vogelman JH, Orentreich N, et al. Helicobacter pylori infection and the risk of gastric carcinoma. N Engl J Med 1991; 325: 1127-31.
8. Parsonnet J, Hansen S, Rodriguez L, Gelb AB, Warnke RA, Jellum E, et al. Helicobacter pylori infection and gastric lymphoma. N Engl J Med 1994; 330: 1267-71.
9. Bergenzaun P, Kristinsson KG, Thjodleifsson B, Sigvaldadottir E, Molstad S, Held M, et al. Seroprevalence of Helicobacter pylori in south Sweden and Iceland. Scand J Gastroenterol 1996; 31: 1157-61.
10. Strachan DP. Hay fever, hygiene, and household size. BMJ 1989; 299: 1259-60.
11. Matricardi PM, Rosmini F, Riondino S, Fortini M, Ferrigno L, Rapicetta M, et al. Exposure to foodborne and orofecal microbes versus airborne viruses in relation to atopy and allergic asthma: epidemiological study. BMJ 2000; 320: 412-7.
12. Steffen R, Kane MA, Shapiro CN, Billo N, Schoellhorn KJ, van Damme P. Epidemiology and prevention of hepatitis A in travelers. Jama 1994; 272 : 885-9.
13. Frosner GG, Papaevangelou G, Butler R, Iwarson S, Lindholm A, Courouce-Pauty A, et al. Antibody against hepatitis A in seven European countries. I. Comparison of prevalence data in different age groups. Am J Epidemiol 1979; 110: 63-9.
14. Martinez FD. The coming-of-age of the hygiene hypothesis. Respir Res 2001; 2: 129-32.
15. Denkers EY, Gazzinelli RT. Regulation and function of T-cell-mediated immunity during Toxoplasma gondii infection. Clin Microbiol Rev 1998; 11: 569-88.
16. Harris PR, Smythies LE, Smith PD, Dubois A. Inflammatory cytokine mRNA expression during early and persistent Helicobacter pylori infection in nonhuman primates. J Infect Dis 2000; 181: 783-6.
17. McIntire JJ, Umetsu SE, Macaubas C, Hoyte EG, Cinnioglu C, Cavalli-Sforza LL, et al. Immunology: hepatitis A virus link to atopic disease. Nature 2003; 425: 576.
18. Worldwide variation in prevalence of symptoms of asthma, allergic rhinoconjunctivitis, and atopic eczema: ISAAC. The International Study of Asthma and Allergies in Childhood (ISAAC) Steering Committee. Lancet 1998; 351: 1225-32.
19. Hopkin JM. Mechanisms of enhanced prevalence of asthma and atopy in developed countries. Curr Opin Immunol 1997; 9: 788-92.
20. Esch T, Stefano G. Proinflammation: a common denominator or initiator of different pathophysiological disease processes. Med Sci Monit 2002; 8: HY1-9.
21. Pepys MB, Hirschfield GM. C-reactive protein: a critical update. J Clin Invest 2003; 111: 1805-12.
22. Birgisdóttir A, Ásbjörnsdóttir H, Cook E, Gíslason D, Jansson C, Ólafsson Í, et al. Seroprevalence of Toxoplasma gondii in Sweden, Estonia and Iceland. Scand J Infect Dis 2006: In press.
23. Olafsdottir IS, Gislason T, Thjodleifsson B, Olafsson I, Gislason D, Jogi R, et al. C reactive protein levels are increased in non-allergic but not allergic asthma: a multicentre epidemiological study. Thorax 2005; 60: 451-4.
24. Gislason T, Olafsdottir IS, Thjodleifsson B, Olafsson Í, Gíslason D, Jõgi R, Janson C. Highly sensitivity C-reactive protein (Hs-CRP) is associated with COPD and a faster decline in FEV1 a multicenter epidemioæogical study. Eur Resp J 2005; 26(Supplement 49. P438): 51s.
25. Burney PG, Luczynska C, Chinn S, Jarvis D. The European Community Respiratory Health Survey. Eur Respir J 1994; 7: 954-60.
26. The European Community Respiratory Health Survey II. Eur Respir J 2002; 20: 1071-9.
27. Davíð Gíslason Unnur Steina Björnsdóttir, Þorsteinn Blöndal, Þórarinn Gíslason. Evrópurannsóknin Lungu og heilsa (ECRHS): Hverjar eru helstu niðurstöður fram að þessu í ljósi sérstöðu Íslands? Læknablaðið 2002; 88: 891-908.
28. Balsari A, Poli G, Molina V, Dovis M, Petruzzelli E, Boniolo A, et al. ELISA for toxoplasma antibody detection: a comparison with other serodiagnostic tests. J Clin Pathol 1980; 33: 640-3.
29. Laheij RJ, Straatman H, Jansen JB, Verbeek AL. Evaluation of commercially available Helicobacter pylori serology kits: a review. J Clin Microbiol 1998; 36: 2803-9.
30. Wiedmann M, Boehm S, Schumacher W, Swysen C, Zauke M. Evaluation of three commercial assays for the detection of hepatitis a virus. Eur J Clin Microbiol Infect Dis 2003; 22: 129-30.
31. Liberatos P, Link BG, Kelsey JL. The measurement of social class in epidemiology. Epidemiol Rev 1988; 10: 87-121.
32. Standardization of Spirometry, 1994 Update. American Thor- acic Society. Am J Respir Crit Care Med 1995; 152: 1107-36.
33. Jarvis D, Luczynska C, Chinn S, Potts J, Sunyer J, Janson C, et al. Change in prevalence of IgE sensitization and mean total IgE with age and cohort. J Allergy Clin Immunol 2005; 116: 675-82.
34. United Nations. Human development indicators. Human development report. hdr.undp.org 2005.
35. Kato S, Furuyama N, Ozawa K, Ohnuma K, Iinuma K. Long-term follow-up study of serum immunoglobulin G and immunoglobulin A antibodies after Helicobacter pylori eradication. Pediatrics 1999; 104: e22.
36. Xia HH, Talley NJ. Natural acquisition and spontaneous elimination of Helicobacter pylori infection: clinical implications. Am J Gastroenterol 1997; 92: 1780-7.
37. Davis JP. Experience with hepatitis A and B vaccines. Am J Med 2005; 118 Suppl 10A: 7S-15S.
38. Feldman HA. A Nationwide Serum Survey Of United States Military Recruits, 1962. Vi. Toxoplasma Antibodies. Am J Epidemiol 1965; 681: 385-91.
39. Pálsson PA. Ársskýrsla Tilraunastöðvar Háskólans í Meinafræði. Keldum. 1965.
40. Woodruff AW, de Savigny DH, Hendy-Ibbs PM. Toxocaral and toxoplasmal antibodies in cat breeders and in Icelanders exposed to cats but not to dogs. BMJ (Clin Res Ed) 1982; 284: 309-10.
41. Jónsdóttir KE, Árnadóttir T. Mælingar á mótefnum gegn bogfrymlum í nokkrum hópum Íslendinga. Læknablaðið 1988; 74: 279-84.
42. Woodward M, Morrison C, McColl K. An investigation into factors associated with Helicobacter pylori infection. J Clin Epidemiol 2000; 53: 175-81.
43. Ferguson DA, Jr., Li C, Patel NR, Mayberry WR, Chi DS, Thomas E. Isolation of Helicobacter pylori from saliva. J Clin Microbiol 1993; 31: 2802-4.
44. Li C, Ha T, Ferguson DA, Jr., Chi DS, Zhao R, Patel NR, et al. A newly developed PCR assay of H. pylori in gastric biopsy, saliva, and feces. Evidence of high prevalence of H. pylori in saliva supports oral transmission. Dig Dis Sci 1996; 41: 2142-9.
45. Borgarfræðasetur Háskóla Íslands og Reykjavíkurborgar. Húsnæði og búseta í 100 ár. http://www.borg.hi.is.
46. Briem H. Declining prevalence of antibodies to hepatitis A virus infection in Iceland. Scand J Infect Dis 1991; 23: 135-8.
47. Briem H, Weiland O, Fridriksson I, Berg R. Prevalence of antibody to hepatitis A in Iceland in relation to age, sex, and number of notified cases of hepatitis. Am J Epidemiol 1982; 116: 451-5.
48. Kosunen TU, Aromaa A, Knekt P, Salomaa A, Rautelin H, Lohi P, et al. Helicobacter antibodies in 1973 and 1994 in the adult population of Vammala, Finland. Epidemiol Infect 1997; 119: 29-34.
49. Ma JL, You WC, Gail MH, Zhang L, Blot WJ, Chang YS, et al. Helicobacter pylori infection and mode of transmission in a population at high risk of stomach cancer. Int J Epidemiol 1998; 27: 570-3.
50. Kikuchi S, Ohgihara A, Hasegawa A, Miki K, Kaneko E, Mizukoshi H. Seroconversion and seroreversion of Heli-cobacter pylori antibodies over a 9-year period and related factors in Japanese adults. Helicobacter 2004; 9: 335-41.
