Fræðigreinar
Talídómíð: Lyf hörmunga og hjálpræðis - Síðari hluti: Verkanir og verkunarhættir talídómíðs og notkun til lækninga
Rannsóknastofu í lyfja- og eiturefnafræði, Lyfjafræðistofnun Háskóla Íslands, Pósthólf 8216, 128 Reykjavík. Fax: 568 0872, dr.thorkell@simnet.is
Ágrip
Saga talídómíðs fram til 1964 eða þar um bil er rakin í fyrri hluta þessa yfirlits. Í síðari hluta er fjallað um rannsóknir á verkunum og verkunarháttum talídómíðs og rannsóknum á gildi þess til lækninga fram á þennan dag.
Árið 1964 fannst að talídómíð hafði óvænta verkun á húðhnútabólgu í holdsveiki (erythema nodosum leprosum). Skömmu síðar var og bent á hugsanlega gagnsemi talídómíðs við illkynja sjúkdóma. Vegna líkinda milli sameinda talídómíðs og gvanósíns er talið að sameindir talídómíðs skjóti sér inn í gvanósínríkar stýriraðir gena tiltekinna integrína, sem ráða æðamyndun og samhliða því myndun annarra vefja, einkum í útlimum, og hamli umritun þeirra. Þetta gæti skýrt fósturskemmandi verkun talídómíðs og að hluta, að minnsta kosti, verkun þess á illkynja sjúkdóma. Talídómíð hefur enn fremur marktæka hamlandi verkun á TNFa sem er miðsvæðis í verkun þess á bólgusjúkdóma á borð við húðhnútabólgu í holdsveiki og svæðisþarmabólgu (Crohnsjúkdóm). Talídómíð örvar jafnframt T lymfufrumur (T eitilfrumur) til þess að skipta sér og auka myndun á IL-2 og INFg. Kann það ásamt öðru að skýra verkun þess á illkynja sjúkdóma. Talídómíð er nú ásamt dexametasóni kjörlyf við meðferð á mergæxli (multiple myeloma). Talídómíð og afleiður þess, sem eiga að hafa öflugri og sértækari verkun en það, eru nú reynd til hlítar í vel skipulögðum klínískum rannsóknum við meðferð á erfiðum illkynja sjúkdómum. Þetta eru sjúkdómar þar sem fárra eða engra annarra kosta er völ.
Ferill talídómíðs er sérstakur: Frá því að vera lyf hörmunga er það nú 40 árum síðar stundum lyf hjálpræðis fyrir sárþjáða og langt leidda sjúklinga.
Í fyrri hluta þessa yfirlits er fjallað um tilurð talídómíðs, sameindargerð og fyrsta feril og er í stórum dráttum saga talídómíðs til 1963 eða þar um bil (1). Í þessum hluta verður fjallað um verkanir og verkunarhætti talídómíðs og notkun þess til lækninga og framtíðarhorfur í því efni.
Verkanir og verkunarhættir talídómíðs_>
Fósturskemmandi verkun talídómíðs og hömlun á myndun æða
Sænskur vísindamaður, Jönsson að nafni, benti árið 1972 á líkindi sem eru milli sameinda talídómíðs og gvanósíns (2). Til upprifjunar skal nefnt að gvanósín er gert úr gvaníni og ríbósa eða deoxíríbósa, og er (með áhengdum fosfathópi) að finna í sameindakeðjum kjarnasýra (RNA, DNA) (1). Jönsson áleit að talímíðhluti sameindarinnar gæti troðið sér inn í kjarnasýruraðirnar og myndaði tengsl við gvanósínhluta kjarnasýrusameindanna. Slík tengsl eru oft nefnd innskot (intercalation) og eru engan veginn óþekkt fyrirbæri í lyfjafræði. Innskot þurfa ekki að boða neitt sérstakt, nema efnahvörf in situ leiði af innskotinu. Jönsson gerði einmitt ráð fyrir því að efnahvörf yrðu milli glútarímíðhluta talídómíðsameindanna og deoxíríbósa í sameindum DNA annars vegar og milli talímíðhluta talídómíðs og gvaníns í sameindum DNA hins vegar. Þessi hugmynd sem í stórum dráttum var sett fram án meðfylgjandi rannsóknaniðurstaðna gerir ráð fyrir því að talídómíð verki sérhæft á DNA á afmörkuðum svæðum í líkamanum og það skýri fósturskemmandi verkun þess. Þetta myndi jafnframt skýra að talídómíð hefur ekki umtalsverð eiturhrif vegna kjarnaskemmda í frumum í blóðmerg (sjá á eftir).
Síðari rannsóknir hafa eindregið rennt stoðum undir þá kenningu að talídómíð geti haft sértæka verkun á viss gen í DNA sameindum og það skýri fósturskemmandi verkun þess. Má því segja að hugmynd Jönssons hafi verið stefnumarkandi í þessum efnum. Síðari rannsóknir staðfesta og að fósturskemmandi verkun talídómíðs og hömlun á myndun æða séu af sömu rót. Hið sama kann enn fremur að eiga við taugaskemmandi verkun talídómíðs þótt það sé lítt rannsakað. Verður nú að þessu vikið.
Tilraunir með myndun æða í slímhúð augna í kanínum bentu eindregið til þess að talídómíð hamli æðamyndun af völdum bFGF (basic fibroblast growth factor), vaxtarvaka bandvefs. Talídómíð hafði enga verkun staðlega í augunum heldur varð að gefa dýrunum það við inntöku til þess að það yrði virkt. Af þessu var ályktað að talídómíð sjálft væri ekki virkt heldur væri það umbrotsefni sem myndaðist in vivo. Rannsóknin leiddi einnig í ljós að verkunarháttur hömlunar á æðamyndun og fósturskemmda af völdum talídómíðs myndi vera hinn sami og óháður hamlandi verkun þess á myndun TNFa (sjá á eftir) (3). Í tilraunum með hænsnfóstur var og síðar sýnt fram á að talídómíð hamlaði marktækt örvandi verkun FGF-2, vaxtarvaka bandvefs-2, og IGF-1 (insulin-like growth factor 1), insúlínslíks vaxtarvaka-1 á vöxt útlima. Í þessum tilraunum höfðu afbrigði af talídómíði, sem valdið geta fósturskemmdum, sömu verkun. Afbrigði af talídómíði sem voru án fósturskemmandi verkunar heftu hins vegar ekki vöxt útlima í hænsnfóstrum (4). Tengslin milli hamlandi verkunar á myndun æða og hömlunar á vexti útlima og þar með fósturskemmda af völdum talídómíðs virðast því vera nokkuð ljós.
IGF-1 er einn svokallaðra vaxtarvaka sem myndast í vefjum fyrir tilstilli vaxtarhormónsins og miðlar, ásamt fleirum sams konar vaxtarvökum, verkunum hormónsins á vöxt og þroska (5). IGF-1 líkist insúlíni að gerð og bæði IGF-1 og FGF-2 verka á viðtæki, sem eru týrósínkínasar (sams konar og insúlínviðtæki) og eru misdreifð eftir vefjum (6). Áverkun á týrósínkínasaviðtæki sem þessi getur leitt af sér áberandi miklar breytingar í starfsemi hlutaðeigandi frumna (5).
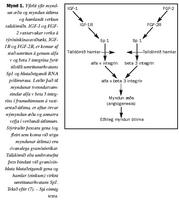
Ein meginafleiðing af áverkun IGF-1 og FGF-2 á hlutaðeigandi týrósínkínasaviðtæki er að koma af stað umritun á genum alfa v og beta 3 integrína með eftirfarandi myndun á tvenndarsameind alfa v beta 3 integríns á yfirborði frumna. Á vaxtarstað útlima hvetur þetta til æðamyndunar, brjóskmyndunar og annarra vefja í útlimum. Stýriraðir (promoter regions) gena þessara integrína eru ríkar af gvanósíni, öfugt við langflestar stýriraðir annarra gena í líkamanum. Sérstakur umritunarþáttur, Sp1 (stimulatory protein 1), binst við stýriraðir þessara gena og auðveldar verkun hlutaðeigandi RNA pólímerasa. Áverkun á þessar tiltölulega fáu gvanósínstýriraðir í líkamanum getur þannig verið forsenda mikillar sérvirkni. Talið er að fósturskemmandi verkun talídómíðs (og hamlandi verkun á myndun æða) sé einmitt fyrst og fremst fólgin í því að hamla tengingu Sp 1 á gvanósínstýriraðir þeirra gena, sem stjórna myndun og vexti útlima eða annarra líffæra og talídómíð verkar á (6, 7) (sjá mynd 1).
Þess skal hér getið að integrín myndast á yfirborði fjölda frumna og stuðla að tilfærslu frumnanna, meðal annars við íferð úr blóðbraut í vefi við bólgusvörun (8). Integrín eru hluti af svokölluðum hefti- og viðloðunarpróteinum (cellular adhesive molecules) (sjá einnig á eftir).
Rannsóknir Bauers (9) og Parmans (10) benda til þess að talídómíð sjálft sé ekki að baki hömlunar á myndun æða eða fósturskemmda, heldur eitthvert umbrotsefni þess sem myndast in vivo og verði ekki eingöngu til við vatnsrof (samanber (1) og á undan). Talídómíð hefur að jafnaði einungis fósturskemmandi verkun í mönnum, mannöpum og sumum tegundum kanína. Því verður að teljast líklegt að í þessum tegundum myndist eitthvert umbrotsefni sem endanlega veldur fósturskemmdum. Á hinn bóginn er þó ekki útilokað að í öllum öðrum tegundum en þeim þremur fyrrnefndu umbrotni talídómíð til slíkrar fullnustu að það skaði alls ekki fóstur (6). Í ljósi aukinnar notkunar talídómíðs, og hugsanlega á afbrigðum þess, er nauðsynlegt að finna sem fyrst lausn á þessum vafaatriðum.
Enda þótt fósturskemmandi verkun af völdum talídómíðs eða umbrotsefnis (umbrotsefna) þess sé með þeim hætti sem að framan greinir hefur aldrei sannast að það hafi genskemmandi (mútagen) verkun í venjulegum prófum sem ætluð eru til þess að sýna fram á slíkar skemmdir (7). Þetta er verðmætur eiginleiki ef nota á talídómíð við meðferð á illkynja sjúkdómum ásamt eða í stað venjulegra krabbameinslyfja.
Hamlandi verkun á myndun TNFa og bólgusvörun
Upp úr 1990 var staðfest að talídómíð gæti dregið marktækt úr myndun TNFa í einkyrningum (mónócýtum) frá mönnum og sú verkun virtist öðru fremur liggja að baki verkunar talídómíðs á húðhnútabólgu í holdsveiki (erythema nodosum leprosum) (11). Enginn efi er á því að hömlun á myndun TNFa af völdum talídómíðs er miðsvæðis í verkun þess á bólgusvörun við bólgusjúkdóma svo og að einhverju eða jafnvel að verulegu leyti í verkun þess á illkynja sjúkdóma. Hamlandi verkun á myndun TNFa er óháð fósturskemmandi verkunum talídómíðs og hamlandi verkun þess á myndun æða eins og áður greinir.
TNFa (á ensku: tumor necrosis factor a; eldra heiti er kakektín) fékk nafn af því að þetta prótein getur sundrað sumum illkynja æxlisfrumum, en engan veginn öllum illkynja frumum, í tilraunum in vitro og in vivo. Ef til vill mætti kalla TNFa æxlisdræpi á íslensku. Æxlisdræpir eða "tumor necrosis factor" er þó í raun rangnefni þar eð efnið hefur fjölda annarra verkana og áhrif þess á æxli eru sennilega minni háttar í því samhengi. Í þessum texta er því TNFa notað vegna skorts á öðru betra heiti. Eldra heitið, kakektín, er til þess að rekja að við langvarandi bólgusjúkdóma, til dæmis berkla, veldur TNFa "tæringu" eða langvinnri megrun vegna alvarlegra truflana á fituefnaskiptum. Skyld prótein að gerð og verkunum eru LTa og LTb (eitlatoxín a og b) sem myndast í eitlafrumunum og lymfufrumunum. TNFa myndast hins vegar fyrst og fremst í gleypifrumum (makrófögum) og öðrum einkyrningum (mónócýtum) fyrir tilstilli örvunar af völdum lípópólísakkaríða, glúkana, túberkúlíns, IL-1 eða annars. TNFa virðist þannig valda mestu um sýklalost af völdum gramneikvæðra baktería (12-14).
Gen TNFa er á litningi 6 hjá mönnum. Samsetning TNFa varð kunn um miðjan 9. áratug síðustu aldar. TNFa er, eins og það myndast, gert úr 233 amínósýrum. Við bólgusvörun klofnar þetta forstigsprótein (situr í frumuhimnunni) síðan fyrir tilstilli sérstaks ensíms (metallópróteinasa) og hið virka form TNFa, sem í eru 157 amínósýrur (17 kDa), myndast. Þetta fjölpeptíð dreifist eftir blóðbraut og verkar á tvenns konar viðtæki, TNF RI og TNF RII, sem er að finna víða í vefjum og miðla verkunum TNFa í hlutaðeigandi líffærum (12, 14, 15). Yfirlit yfir verkanir TNFa er í töflu I.
Venja er að telja TNFa hormón, enda þótt hann finnist ekki í mælanlegu magni í blóði nema við sjúklegt ástand (12). IL-1 (interlevkín-1) sem er náskylt TNFa að verkunum telst og fremur hormón en cýtókín. Önnur interlevkín myndu hins vegar flest fremur teljast cýtókín en hormónar. Með cýtókínum, frumuhreyfum (eintala frumuhreyfir), er átt við efni er fremur verka á eða "hreyfa við" nálægum frumum við myndunarstað ("staðbundnir hormónar") en berast að marki út í blóðbraut og dreifast þannig til þess að verka annars staðar í líkamanum (hormónar).
Umritunarþátturinn NF-kB binst við stýriraðir TNFa gensins og er nauðsynlegur til þess að hvata umritun þess og myndun á TNFa. TNFa getur sjálfur virkjað NF-kB til þess meðal annars að auka eigin myndun. NF-kB getur greinilega hvatað umritun annarra gena og kann það að skýra aukna myndun á IL-1, IL-6 og hefti- og viðloðunarpróteinum af völdum TNFa (16). TNFa og IL-1 geta enn fremur hvort um sig innleitt myndun hins.
Talídómíð getur hamlað myndun TNFa að minnsta kosti með tvennum hætti. Í fyrsta lagi hefur talídómíð sérhæfða verkun í þá veru að hraða sundrun á TNFa mRNA. Við það dregur úr myndun á TNFa, en hvorki úr myndun á IL-1 né IL-6. Svo virðist sem báðar handhverfur talídómíðs séu virkar í þessu tilliti (17). Í öðru lagi hamlar talídómíð verkun umritunarþáttarins NF-kB og þar með ósérhæft myndun á TNFa og fleiri lífefnum (IL-1 og fleirum) (16, 18).
Hefti- og viðloðunarprótein (aðlímingarprótein) skipta meginmáli fyrir bólgusvörun. TNFa (og IL-1) auka mjög myndun margra þessara próteina. Hamlandi verkun talídómíðs á myndun þeirra gæti endanlega verið kjarninn í bólgueyðandi verkun talídómíðs. Verður nú nokkru nánar að þessu vikið.
Við áreitingu í vefjum af hverjum sökum sem vera kann og sem er nægjanleg til þess að valda bólgusvörun losna svokallaðir bólguvakar (histamín, TNFa og fleiri). Bólguvakar stuðla að æðavíkkun og gisnun æða og búa þannig í haginn fyrir ferð bólgufrumna (kornafrumur, eitlafrumur, einkyrningar/gleypifrumur) úr blóðbraut og í hlutaðeigandi vefi til þess að vinna á áreitinu. Til þess að bólgufrumur komist út í vefina þurfa að koma til svokölluð hefti- og viðloðunarprótein sem "binda" frumurnar við æðaþelið og "þrýsta" þeim út í vefinn (8).
Í tilraunum með æðaþelsfrumur úr bláæðum í naflastreng frá mönnum óx magn E-selektína (hefti- og viðloðunarprótein í innþeli æða) fyrir tilstilli TNFa. Talídómíð dró mjög úr þeirri svörun. Hliðstæð selektín eru á bólgufrumunum, L-selektín. TNFa jók einnig magn þessara selektína (þau snurðast af) og talídómíð dró úr myndun þeirra. Við bólgusvörun "rúlla" bólgufrumur í fyrstu tiltölulega laust yfir innþel æða í hlutaðeigandi vefjum, áður en frumurnar festast og komast út um æðaveggina og í vefina í kring. Þessi lausu tengsl verða fyrir tilstilli selektína á yfirborði bólgufrumna og innþelsæða og talídómíð hemur þau augljóslega í tilraunum sem þessum (19). Önnur hefti- og viðloðunarprótein eru nauðsynleg til þess að festa bólgufrumur við æðaveggina og þrýsta þeim út fyrir. Þessi prótein eru annars vegar skyld ónæmisglóbúlínum: ICAM-1 (intercellular adhesion molecule 1) og VCAM-1 (vascular cell adhesion molecule 1), og hins vegar ákveðinn flokkur integrína (samanber á undan). ICAM-1 og VCAM-1 eru talin sértæk hefti- og viðloðunarprótein, það er að segja "hefta" saman vissar frumur, en ekki aðrar. TNFa jók á myndun VCAM-1 í tilraunum með naflastrengsæðar sem áður ræðir og talídómíð dró úr myndun þeirra. Talídómíð jók hins vegar fremur á verkun TNFa á ICAM-1 en dró úr. Í þessum tilraunum höfðu hvorki talídómíð né TNFa nokkur áhrif á integrín (integrín beta 2) (19). Af þessum tilraunum er því í heild ljóst að talídómíð hefur greinilega verkun á heftingu bólgufrumna við innþel æða af völdum TNFa og verkunin gæti að einhverju leyti verið sértæk.
Verkun talídómíðs á myndun hefti- og viðloðunarpróteina kann og að skipta máli fyrir verkun þess á mergæxli sem vaxið geta úr blóðmerg inn í bein og valdið erfiðum beinbrotum (sjá síðar).
Talídómíð og sykurvirkir sterar (prednisólón, dexametasón og fleiri) hafa samverkandi verkun. Verkun stera á TNFa er ekki síst til þess að rekja að þeir hamla tjáningu gens TNFa og draga þannig úr myndun hans. Verkun steranna er ósérhæfð og tekur einnig til myndunar IL-1, IL-6 og fleiri cýtókína (17).
Örvandi verkun á T eitlafrumur ("kóimmúnóstímúlerandi verkun")
Enda þótt talídómíð geti dregið úr myndun á IL-2 og INF-g með því að hamla verkunum TNFa (sjá töflu I), getur það einnig aukið myndun á þessum cýtókínum með því að örva T eitlafrumur. Verkunin er að nokkru sértæk og talídómíð getur þannig breytt innbyrðis hlutföllum milli undirflokka T eitlafrumna. Talídómíð getur þó ekki eitt sér virkjað T eitlafrumur til þess að skipta sér og auka framleiðslu cýtókína á borð við IL-2 og INF-g. Talídómíð getur hins vegar eflt örvun af völdum annarra efna sem virkja T eitlafrumur beint. Þetta nefnist "kóstímúlatíón" eða "kóimmúnóstímúlatíón" og er mikilvægt atriði til þess að virkja T-eitlafrumur til fullnustu (20).
IL-2 virkjar T drápsfrumur og náttúrlegar drápsfrumur (13) og kann það að skýra að einhverju leyti verkun talídómíðs á illkynja frumur. Talídómíð getur þannig valdið frumufelli (apoptosis) í mergæxlisfrumum sem eru ónæmar gegn öðrum lyfjum. Athygli vekur samt, að IL-6, sem talídómíð hemur (tafla I), örvar skiptingu á mergæxlisfrumum og getur komið í veg fyrir drepandi verkun talídómíðs á mergæxlisfrumurnar (21). Hamlandi verkun á myndun IL-6 gæti því vegið þungt í verkunum talídómíðs á mergæxli (sjá síðar).
INF-g hefur margháttaða verkun í þá veru að efla allar verkanir svarkerfisins (ónæmiskerfisins) og er greinilega mjög til hjástoðar við IL-2, sem líta má á sem aðalhvata svarkerfisins (13).
"Kóstímúlerandi verkun" á T-eitlafrumur samhliða hömlunum á verkunum TNFa veldur því að talídómíð hefur, eða getur haft, margþætta verkun á T-eitlafrumur.
Notagildi talídómíðs til lækninga
Notkun við bólgusjúkdóma
1. Holdsveiki: húðhnútabólga í holdsveiki (erythema nodosum leprosum; ENL).
Við alvarlegustu stig holdsveiki (sérstaklega lepra lepromatosa) kemur í að minnsta kosti 30% tilfella fyrir alvarlegt bólguástand í húð sem er óháð þeim sjúklegu breytingum af völdum holdsveiki er fyrir kunna að vera. Þetta sjúkdómsfyrirbæri sem nefnist á latínu erythema nodosum leprosum mætti kalla húðhnútabólgu í holdsveiki á íslensku. Áberandi í sjúkdómsmyndinni eru aumir, rauðleitir og vessandi hnútar í húðinni, oft með sárum, svo og verkir í liðum og víðar. Líkamshiti er hækkaður og sjúklingar eru slappir, sljóir og á allan hátt vesalir. Þeir megrast og mjög. Þetta sjúkdómsástand sem getur verið lífshættulegt er ekki fátíðara en svo að það er talið hrjá um eina milljón manna (11, 22). Elsta lýsing á húðhnútabólgu í holdsveiki og þeirri vesöld er með fylgir er væntanlega hin fræga lýsing úr biblíunni á Lazarusi sem hlaðinn kaunum hafði verið komið fyrir við fordyri ríka mannsins: " ... og girntist hann að seðja sig af því, er féll af borði ríka mannsins og jafnvel hundar komu og sleiktu kaun hans" (Lúkas 16:20). Kaun eins og stendur í biblíutextanum hittir sérlega vel í mark í lýsingunni því að kaun getur merkt allt í senn: hrúður, skeina, kýli og sár.
Húðhnútabólga í holdsveiki er algengust samfara gjöf holdsveikilyfja (sýklalyfja gegn holdsveiki), en kemur einnig fyrir eftir að lyfjagjöf hefur verið hætt og stundum einnig áður en meðferð hefst (11). Sjúkdómsfyrirbærið hefur yfirbragð ofnæmissvörunar af 3. gerð að því best er vitað. Við það ástand myndast mótefnafléttur með IgM og fulltingispróteinum (complement) í æðum. Talídómíð dregur úr myndun á IgM, en verkar samt mun hraðar á húðhnútabólgu í holdsveiki en svo að hömlun á IgM geti eingöngu skýrt verkun þess (22).
Jakob Sheskin hét maður og var læknir að mennt. Eftir heimsstyrjöldina síðari fór hann til Venezúela og sérhæfði sig í meðferð holdsveikra. Árið 1956 fluttist hann til Jerúsalem og starfaði þar áfram að lækningum á holdsveikum. Átta árum síðar fékk hann til meðferðar frá Frakklandi sjúkling sem var sérlega illa haldinn af húðhnútabólgu og meðfylgjandi sjúkdómseinkennum. Sjúklingurinn hafði verið rúmfastur í 19 mánuði. Hann var haldinn miklum verkjum og gat ekki sofið. Svefnlyf reyndust haldlítil. Sjúklingurinn var að dauða kominn. Sheskin fann á spítalanum glas með 20 talídómíðtöflum og: "With nothing to lose in this case, the patient was given two thalidomide tablets as a last resort". Og árangurinn var þessi: "He slept soundly for twenty hours, and, upon waking, felt well enough to get out of bed without assistance. After two more pills, his pain disappeared entirely and his sores began to heal. When treatment was stopped, the symptoms returned, and when it was resumed, his condition again improved dramatically. Six other patients in the hospital were then treated, with similar dramatic results" (15). Þetta var sannkallaður "dramatískur árangur" enda kalla Stephens og Brynner þann kafla í sinni bók þar sem um þetta er fjallað mjög svo hnyttilega "Lazarus Rises"!
Sheskin gerði svo árið eftir grein fyrir árangri af meðferð fyrrnefndra sex sjúklinga með talídómíði (23). Allmörgum árum síðar gerði Sheskin (24) grein fyrir árangri af meðferð með talídómíði við húðhnútabólgu í holdsveiki. Hann benti á að meðferðin gerði gagn í yfir 90% tilfella, stytti legutíma, auðveldaði meðferð með holdsveikilyfjum og flýtti fyrir því að sjúklingarnir gætu komist til vinnu.
Síðari rannsóknir hafa svo staðfest að hamlandi verkun talídómíðs á þéttni TNFa í blóði skýrir best hina miklu og skjótu verkun þess á húðhnútabólgu í holdsveiki og önnur einkenni henni samfara. INFg kemur hér líka við sögu (11). Trúlega verkar INFg fyrir tilstilli TNFa og öfugt.
Í júlí 1998 hlaut talídómíð (Thalomid®) viðurkenningu Fæðu- og lyfjamálastofnunar Bandaríkjanna (Food and Drug Administration) til notkunar gegn erythema nodosum leprosum. Notkun lyfsins er ströngum skilyrðum háð (15, 25).* Engu að síður hefur þetta auðveldað læknum að prófa lyfið við ýmsa aðra sjúkdóma, þar á meðal ýmsa bólgusjúkdóma á borð við Crohnsjúkdóm.
2. Svæðisþarmabólga (Morbus Crohn; Crohnsjúkdómur).
Svæðisþarmabólga getur verið hvar sem er í meltingarvegi, en kemur oftast fyrir neðarlega í mjógirni. Svæðisþarmabólga er einkum meðhöndluð með amínósalicýlsýru, sykurvirkum sterum, cýklósporíni eða öðrum svarbælandi lyfjum (auk sýklalyfja). Við alvarlega þarmabólgu er oftast byrjað með stóra skammta af sykurvirkum sterum. Öll þessi lyf eiga það sameiginlegt að hamla virkni umritunarþáttarins NF-kB (samanber á undan) og geta þannig hamlað myndun TNFa auk ýmissa annarra lífefna. Nýlegt lyf er infliximab sem er kímerískt (chimeric) mótefni gegn TNFa. Stungið var upp á því fyrir meira en 20 árum að nota talídómíð við erfið tilfelli af Crohnsjúkdómi (26).
Nýlegar rannsóknir bæði í mönnum og dýrum benda eindregið til þess að TNFa skipti meginmáli við uppkomu þarmabólgu. Það vekur samt athygli að talídómíð getur verið virkt í þeim tilvikum að sjúklingar svara ekki meðferð með infliximabi (sem er bæði erfið og dýr). Sama á einnig við um sjúklinga sem svara ekki meðferð með sykurvirkum sterum. Sá möguleiki er því fyrir hendi að talídómíð verki á svæðisbundna þarmabólgu bæði með því að hamla virkni TNFa (tvíþætt hamlandi verkun: á TNFa mRNA og NF-kB) og með öðrum hætti. Kemur þá einkum tvennt til. Í fyrsta lagi er misvægi milli undirflokka T eitlafrumna ríkjandi við Crohnsjúkdóm sem talídómíð gæti lagfært. Í öðru lagi er í Crohnsjúkdómi mjög aukin þéttni í blóði af vaxtarvaka bandvefs (bFGF) og af öðrum skyldum vaxtarvaka sem talídómíð hamlar (samanber á undan), en samband er milli þéttni þeirra og sjúkdómseinkennanna. Þetta gæti gert að verkum að talídómíð gagnast í raun sjúklingum með svæðisþarmabólgu, þótt hvorki infliximab né sykurvirkir sterar (sem hafa þó sannarlega breiða verkun á bólgusvörun!) verki á þá (26).
Talídómíð gæti þannig átt mikinn rétt á sér við erfið tilfelli af Crohnsjúkdómi þegar fokið er í flest skjól, svo og þegar fistlar myndast.
Þrálát sáramyndun í húð sjaldgæfrar tegundar sem nefnist pyoderma gangrenosum tengist oft Crohnsjúkdómi (eða annars konar þarmabólgum) og svarar meðferð með talídómíði mjög vel (15, 26).
3. Aðrir bólgusjúkdómar
Niðurstöður úr tvíloka rannsókn hafa sýnt að talídómíð er virkt við Behçetsjúkdómi (fjölkerfa sjúkdómur á grundvelli æðabólgu með einkennum frá húð og slímhúð (langvarandi sýkingar með sáramyndun), liðum, meltingarvegi og miðtaugakerfi). Allmargar opnar rannsóknir hafa sýnt mjög góðan árangur af meðferð á þessum sjúkdómi með talídómíði (27, 28).
Talídómíð hefur í tvíloka tilraun reynst vel virkt við stomatitis apthosa (hvítleit, verkjandi sár í munni af óþekktum toga) (28). Sömu höfundar benda einnig á notagildi talídómíðs við ýmsa þráláta kláðasjúkdóma í húð (prurigo).
TNFa skiptir miklu máli við liðbólgur og liðskemmdir við iktsýki (27) (tafla I). Gildi mótefna gegn TNFa við meðferð á alvarlegri iktsýki er og ótvírætt (29). Raunar var stungið upp á því að nota talídómíð gegn iktsýki þegar 1981. Staða talídómíðs við meðferð á alvarlegri iktsýki er þó enn óljós. Sama á við hryggikt (spondylitis ankylopoetica) (30).
Við klíníska notkun talídómíðs ber ætíð að hafa í huga hinar alvarlegu hjáverkanir sem vitað er frá fyrri tíð að geta verið samfara notkun þess. Á þetta sér í lagi við fósturskemmdir í meðgöngu og skemmdir í úttaugakerfi. Af öðrum algengum hjáverkunum má nefna syfju og hægðatregðu, auk fjölda annarra fátíðari hjáverkana, ekki síst frá húð (21). Talídómíð skal því í meginreglu aðeins nota þegar annarra lyfja er ekki völ.
Notkun við illkynja sjúkdóma
Olson og samstarfsmenn hans birtu árið 1965 (31) grein þar sem skýrt var frá notkun talídómíðs gegn margs konar alvarlegum illkynja sjúkdómum í samtals 21 sjúklingi. Í sjö tilvikum var talið að talídómíð gæti hafa haft einhverja verkun ("subjective improvement"). Það var í tveimur tilfellum (af fimm) af adenocarcinoma í nýra og í tveimur tilfellum (af tveimur) af mergæxli (multiple myeloma) auk þriggja annarra tilfella. Þrátt fyrir þennan fremur lélega árangur lögðu höfundarnir til að talídómíð yrði reynt frekar við illkynja sjúkdóma sem ónæmir væru fyrir annarri meðferð ("It is suggested that further trial of this drug in tumors not sensitive to other agents, ... , is warranted").
Tæplega 40 árum eftir að þessi orð voru rituð er ljóst að talídómíð (eða talídómíðlík lyf) hafa fengið fastan sess við meðferð á mergæxlum ásamt öðrum lyfjum (dexametasón og fleiri). Sérstaka athygli vekur að talídómíð og dexametasón hafa reynst hafa marktæka samverkandi verkun (21, 32-4). Mergæxli eru illkynja æxli sem eiga upphaf sitt í blóðmerg og langoftast á mörgum stöðum í senn (þar af enska heitið "multiple myeloma"). Sjúkdómurinn er illvígur, svarar illa meðferð, veldur sársaukafullum beinbrotum og er ævinlega banvænn (15). Í Bandaríkjunum er talið að mergæxli valdi um 2% af öllum dauðsföllum sem rakin eru til illkynja sjúkdóma. Ekki er endanlega vitað hver eða hverjar verkanir talídómíðs skipta meginmáli í lyfhrifum þess á mergæxli, þótt að framan hafi sérstaklega verið bent á verkun á IL-6 og á hefti- og viðloðunarprótein. Raunar gætu flestar eða allar verkanir talídómíðs átt hér hlut að máli eins og réttilega hefur verið bent á (35). Á árinu 2002 voru veittar 19 undanþágur til innflutnings og notkunar talídómíðs hér á landi. Voru 8 vegna notkunar við mergæxli, en hinar vegna notkunar við aðra illkynja sjúkdóma (36).
Orðið hefur vart sérstakrar hjáverkunar eftir gjöf talídómíðs ásamt öðrum lyfjum við meðferð á mergæxli. Er það aukin tíðni segamyndunar og blóðreks hjá þessum sjúklingum. Ástæða þessa er ekki ljós (21).
Talídómíð kann að hafa sértæka verkun á mergæxli. Á hinn bóginn er alveg ljóst, svo sem áður er rakið, að talídómíð virkjar svarkerfið (ónæmiskerfið), og þar með drápsfrumur þess, í þeim mæli að það gæti auk annarra lyfhrifa talídómíðs skipt máli við meðferð á illkynja sjúkdómum yfirleitt (13). Þessi skoðun er sett á oddinn í nýlegri grein í vikuritinu Time (37) með vísan til orða bresks vísindamanns (Keith Dredge): "Tumors seem to be able to hide from the immune system, preventing the body from fighting the invader itself". Höfundur hinna tilvitnuðu orða stundar einmitt rannsóknir á virkni tiltekins talídómíðafbrigðis á mergæxli og briskirtilskrabbamein sem er sömuleiðis lítt næmt gegn allri þekktri lyfjameðferð. Rannsókn er einnig hafin á gildi talídómíðs við meðferð á smáfrumukrabbameini í lungum. Alls er ætlað að rannsóknin nái til um 400 sjúklinga (38).
Af framansögðu er ljóst að notkun talídómíðs og talídómíðlíkra lyfja við illkynja sjúkdóma er í mikilli verðandi. Vonandi leiðir það til ávinnings í meðferð þessara sjúkdóma. Nýleg yfirlitsgrein sem tekur á þessu efni í víðum skilningi er grein Richardsons og fleiri (39).
Yfirlit yfir ábendingar á notkun talídómíðs eða talídómíðlíkra lyfja til lækninga er í töflu II.
Talídómíðlík lyf ("talídómíðanalógar")
Muller og samverkamenn (40) fundu að amínóafleiður af talídómíði (4-amínóafleiður) hefðu kröftuga hamlandi verkun á fosfódíesterasa 4 sem einkum kemur fyrir í einkyrningum og gleypifrumum. Þessar frumur mynda að undangenginni áreitingu meira af TNFa en aðrar frumur í líkamanum. Fosfódíesterasar kljúfa fosfattengi í hring-AMP (cAMP; cýklískt andenósínmónófosfat) og stýra þannig magni þessa frumuboðefnis, er aftur hefur áhrif á myndunarferli TNFa í frumunum. Eftir því sem virkni fosfódíesterasa er minni, því meira er af hring-AMP og minna af TNFa. Með því að blokka fosfódíesterasa má því minnka magn TNFa. Þessi talídómíðsambönd minnkuðu þannig magn TNFa marktækt í tilraunum, en með öðrum hætti en talídómíð sjálft (samanber á undan).
Fyrirtækið Celgene (Celgene Corporation, Warren, New Jersey, Bandaríkjunum), sem hefur á ný sett talídómíð á markað (Thalomid®), hefur jafnframt haft forgöngu um að samtengja afleiður (einkum amínó- og metýlafleiður) af talídómíði ("talídómíðanalógar"). Corral og félagar (20) skipta afleiðum þessum í tvo flokka. Efnasambönd í flokki 1 líkjast talídómíði mikið að verkunum, en verka yfirleitt kröftugar. Þessar afleiður hamla þannig myndun á TNFa, IL-1 og IL-6 og örva jafnframt T eitlafrumur og auka þannig myndun á IL-2 og IFNg. Afleiður í flokki 2 draga mjög úr myndun á TNFa með því að blokka fosfódíesterasa 4, en hafa væntanlega fremur litlar aðrar verkanir í líkingu við talídómíð. Afleiður í þessum flokki ættu fræðilega séð að geta orðið æskileg bólgueyðandi lyf. Klínísk reynsla af þessum efnum er samt ekki góð þar eð klígja og uppsölur hafa reynst vera þjakandi hjáverkanir. Efni í flokki 1 gætu hins vegar fengið varanlegt gildi í krabbameinslækningum. Þessi efni verka á mergæxli líkt og talídómíð (41).
Talídómíðafleiður í flokki 1 hafa verið kallaðar "immunomodulatory drugs (IMiDs)" og í flokki 2 "selected cytokine inhibitory drugs (SelCiDs)" (41). Vera má að þessi heiti festist í sessi þótt þau geti tæpast talist æskileg.
Þakkir
Tryggvi Ásmundsson læknir og dr. Haraldur Halldórsson lífefnafræðingur lásu textann yfir og gáfu höfundi góðar ábendingar. Elín Magnúsdóttir lyfjafræðingur og Óttar Kjartansson kerfisfræðingur veittu hjálp við gerð formúla og tölvumynda í fyrri hluta greinarinnar. Þessum einstaklingum svo og þeim sem svöruðu persónulegum fyrirspurnum, eru færðar kærar þakkir. Sérstakar þakkir færir höfundur ritara sínum, frú Jóhönnu Edwald, fyrir vinnslu handrits og vinnu við öflun heimilda.
Heimildir
1. Jóhannesson Þ. Talídómíð: lyf hörmunga og hjálpræðis. Yfirlitsgrein. - Fyrri hluti: Tilurð talídómíðs, sameindargerð og fyrsti ferill. Læknablaðið 2003; 89: 751-6.
2. Jönsson N. Chemical structure and teratogenic properties. IV. An outline of a chemical hypothesis for the teratogenic action of thalidomide. Acta Pharm Suec 1972; 9: 543-62.
3. D´Amato RJ, Loughnan MS, Flynn E, Fockman J. Thalidomide is an inhibitor of angiogenesis. Proc Natl Acad Sci 1994; 91: 4082-5.
4. Stephens TD, Bunde CJW, Torres RD, Hackett DA, Stark MR, Smith DM, et al. Thalidomide inhibits limb development through its antagonism of IGF-1 + FGF-2 + heparin. Teratology 1998; 57: 112 (abstract).
5. Jóhannesson Þ. Lyfjafræði innkirtla. Vítamín og járn. 2. útg. Reykjavík: Bóksala stúdenta 1992: 77, 163, 167.
6. Stephens TD, Fillmore BJ. Hypothesis: thalidomide embryopathy-proposed mechanism of action. Teratology 2000; 61: 189-95.
7. Stephens TD, Bunde CJ, Fillmore BJ. Mechanism of action in thalidomide teratogenesis. Biochem Pharmacol 2000; 59: 1489-99.
8. Jóhannesson Þ. Aspirín. Acetýlsalicýlsýra og önnur salílyf. Læknablaðið 2000; 86: 755-68.
9. Bauer KS, Dixon SC, Figg WD. Inhibition of angiogenesis by thalidomide requires metabolic activation, which is species-dependent. Biochem Pharmacol 1998; 55: 1827-34.
10. Parman T, Wiley MJ, Wells PG. Free radical-mediated oxidative DNA damage in the mechanism of thalidomide teratogenecity. Nature Medicine 1999; 5: 582-5.
11. Sampaio EP, Kaplan G, Miranda A, Nery JAC, Miguel CP, Viana SM, et al. The influence of thalidomide on the clinical and immunologic manifestation of erythema nodosum leprosum. J Infect Dis 1993; 168: 408-14.
12. Beutler B, Cerami A. Cachectin and tumor necrosis factor as two sides of the same biological coin. Nature 1986; 320: 584-8.
13. Jóhannesson Þ. Krabbameinslyf og svarbælandi lyf. Reykjavík: Háskólaútgáfan; 1994: 38-41.
14. Eigler A, Sinha B, Hartmann G, Endres S. Taming TNF: strategies to restrain this proinflammatory cytokine. Immunol Today 1997; 18: 487-92.
15. Stephens T, Brynner R. Dark Remedy. The impact of thalidomide and its revival as a vital medicine. Cambridge (Mass.): Perseus Publishing 2001: 121-3; 155-8; 161; 169; 186-9).
16. Raje N, Anderson KC. Thalidomide and immunomodulatory drugs as cancer therapy. Curr Opin Oncol 2002; 14: 635-40.
17. Moreira AL, Sampaio EP, Zmuidzinas A, Frindt P, Smith KA, Kaplan G. Thalidomide exerts its inhibitory action on tumor necrosis factor a by enhancing mRNA degradation. J Exp Med 1993; 177: 1675-80.
18. Jin SH, Kim TI, Han DS, Shin SK, Kim WH. Thalidomide suppresses the interleukin 1b-induced NFkB signalling pathway in colon cancer cells. Ann NY Acad Sci 2002; 973: 414-8.
19. Geitz H, Handt S, Zwingenberger K. Talidomide selectively modulates the density of cell surface molecules involved in the adhesion cascade. Immunopharmacol 1996; 31: 213-21.
20. Corral LG, Haslett PAJ, Muller GW, Chen R, Wong LM, Ocampo CJ, et al. Differential cytokine modulation and T cell activation by two distinct classes of thalidomide analogues that are potent inhibitors of TNF-a. J Immunol 1999; 163: 380-6.
21. Cavenagh JD, Oakervee H. Guideline. Thalidomide in multiple myeloma: Current status and future prospects. Brit J Haematol 2003; 120: 18-26.
22. Shannon EJ, Miranda RO, Morales MJ, Hastings RC. Inhibition of de novo IgM antibody synthesis by thalidomide as a relevant mechanism of action in leprosy. Scand J Immunol 1981; 13: 553-62.
23. Sheskin J. Thalidomide in the treatment of lepra reactions. Clin Pharmacol 1965; 6: 303-6.
24. Sheskin J. The treatment of lepra reaction in lepromatous leprosy. Fifteen years' experience with thalidomide. Int J Dermatol 1980; 19: 318-22
25. Zeldis JB, Williams BA, Thomas SD, Elsayed MF. S.T.E.P.S.: a comprehensive program for controlling and monitoring access to thalidomide. Clin Ther 1999; 21: 319-30.
26. Ginsburg PM, Dassopoulos T, Ehrenpreis ED. Thalidomide treatment for refractory Crohn's disease: a review of the history, pharmacological mechanisms and clinical literature. Ann Med 2001; 33: 516-25.
27. Ossandon A, Cassara EAM, Priori R, Valesini G. Thalidomide: focus on its employment in rheumatologic diseases. Clin Exper Rheumatol 2002; 20: 709-18.
28. Wines NY, Cooper AL, Wines MP. Thalidomide in dermatology. Austral J Dermatol 2002; 43: 229-40.
29. Elliott MS, Maini RN, Feldmann M, Kalden JR, Antoni C, Smolen JS, et al. Randomised double-blind comparison of chimeric monoclonal antibody to tumor necrosis factor a (cA2) versus placebo in rheumatoid arthritis. Lancet 1994; 344: 1105-10.
30. Huang F, Wei JCC, Breban M. Thalidomide in ankylosing spondylitis. Clin Exper Rheumatol 2002; 20 (Suppl. 28): S158-S161.
31. Olson KB, Hall TC, Horton J, Khung CL, Hoseley HF. Thalidomide (N-phthaloylglutarimide) in the treatment of advanced cancer. Clin Pharmaol 1965; 6: 292-7.
32. Singhal S, Mehta J, Desikan R, Ayers D, Roberson P, Eddelmon P, et al. Antitumor activity of thalidomide in refractory multiple myeloma. N Eng J Med 1999; 341: 1565-71.
33. Jaslow R, Kaplan G, Lyons L, Michaeli J, Coleman M. Thalidomide in multiple myeloma - from the clinic to the laboratory. Cancer Invest 2002; 20: 1051-8.
34. Weber D, Rankin K, Gavino M, Delasalle K, Alexanian R. Thalidomide alone or with dexamethasone for previously untreated multiple myeloma. J Clin Oncol 2003; 21: 16-9.
35. Thalidomide - a revival story (ritstjórnargrein). N Engl J Med 1999; 341: 1606-9.
36. Kjartansdóttir Þ (lyfjafræðingur, Lyfjastofnun). Bréfl. uppl. 21.11.2002 og 24.2.2003.
37. Noble K. Bad drug makes good. Thalidomide, once the most feared of medications, is now showing promise as a cancer treatment. Time 2003 (2.3.); 53.
38. Thalidomide trials to fight cancer. BBC News World Edition (28.1.2003).
39. Richardson P, Hideshima T, Anderson K. Thalidomide: Emerging role in cancer medicine. Ann Rev Med 2002; 53: 629-57.
40. Muller GW, Chen R, Huang SY, Corral LG, Wong LM, Patterson RT, et al. Amino-substituted thalidomide analogs: potent inhibitors of TNF-alpha production. Bioorg Med Chem Lett 1999; 9: 1625-30.
41. Hideshima T, Chauhan D, Shirma Y, Rate N, Davies FE, Tai YZ, et al. Thalidomide and its analogs overcome drug resistance of human multiple myeloma cells to conventional therapy. Blood 2000; 96: 2943-50.
Ágrip
Saga talídómíðs fram til 1964 eða þar um bil er rakin í fyrri hluta þessa yfirlits. Í síðari hluta er fjallað um rannsóknir á verkunum og verkunarháttum talídómíðs og rannsóknum á gildi þess til lækninga fram á þennan dag.Árið 1964 fannst að talídómíð hafði óvænta verkun á húðhnútabólgu í holdsveiki (erythema nodosum leprosum). Skömmu síðar var og bent á hugsanlega gagnsemi talídómíðs við illkynja sjúkdóma. Vegna líkinda milli sameinda talídómíðs og gvanósíns er talið að sameindir talídómíðs skjóti sér inn í gvanósínríkar stýriraðir gena tiltekinna integrína, sem ráða æðamyndun og samhliða því myndun annarra vefja, einkum í útlimum, og hamli umritun þeirra. Þetta gæti skýrt fósturskemmandi verkun talídómíðs og að hluta, að minnsta kosti, verkun þess á illkynja sjúkdóma. Talídómíð hefur enn fremur marktæka hamlandi verkun á TNFa sem er miðsvæðis í verkun þess á bólgusjúkdóma á borð við húðhnútabólgu í holdsveiki og svæðisþarmabólgu (Crohnsjúkdóm). Talídómíð örvar jafnframt T lymfufrumur (T eitilfrumur) til þess að skipta sér og auka myndun á IL-2 og INFg. Kann það ásamt öðru að skýra verkun þess á illkynja sjúkdóma. Talídómíð er nú ásamt dexametasóni kjörlyf við meðferð á mergæxli (multiple myeloma). Talídómíð og afleiður þess, sem eiga að hafa öflugri og sértækari verkun en það, eru nú reynd til hlítar í vel skipulögðum klínískum rannsóknum við meðferð á erfiðum illkynja sjúkdómum. Þetta eru sjúkdómar þar sem fárra eða engra annarra kosta er völ.
Ferill talídómíðs er sérstakur: Frá því að vera lyf hörmunga er það nú 40 árum síðar stundum lyf hjálpræðis fyrir sárþjáða og langt leidda sjúklinga.
Í fyrri hluta þessa yfirlits er fjallað um tilurð talídómíðs, sameindargerð og fyrsta feril og er í stórum dráttum saga talídómíðs til 1963 eða þar um bil (1). Í þessum hluta verður fjallað um verkanir og verkunarhætti talídómíðs og notkun þess til lækninga og framtíðarhorfur í því efni.
English Summary |
| Jóhannesson Þ Thalidomide: Drug of horror and last resort. A review. Part 2: Actions, mechanisms of actions and therapeutic uses of thalidomide Læknablaðið 2003; 89: 839-46 The story of thalidomide to 1964 or thereabout is the topic of Part 1 of this review. Part 2 deals with recent work on the actions and mechanisms of actions of thalidomide and clinical trials with the drug up to the present day. In 1964 it was found that thalidomide had an unexpected therapeutic effect on erythema nodosum leprosum. About the same time it was suggested that thalidomide might be effective against malignant diseases. Due to molecular similarities between thalidomide and guanosine it is considered likely that thalidomide molecules intercalate in guanosine-rich promoter regions in genes of certain integrins that steer vascularization, and at the same time formation of other tissues, especially in limbs of the fetus. This could interfere with transcription of particular genes and explain fetal damage due to thalidomide and in part, at least, its effect on neoplastic diseases. Thalidomide has a remarkable inhibitory effect on production of TNFa, which is central to its therapeutic effect on inflammatory diseases like erythema nodosum leprosum and Crohn's disease. Thalidomide also induces proliferation in T cells and increases their output of IL-2 and INFg. This could, along with other things, explain its effects on neoplastic diseases. Thalidomide, with dexamethasone, is now the drug of choice in treatment of multiple myeloma. Thalidomide and its derivatives (analogues), considered to have a more specific and intense effect than thalidomide itself, are now being tested in well planned clinical trials for treatment of neoplastic diseases. These are diseases where few or no other therapeutic options are present. The path of thalidomide through time is quite remarkable: From being the drug of sheer horror 40 years ago, it is now occasionally the drug of last resort for heavily suffering and often dying patients. Key words: multiple mode of action, erythema nodosum leprosum, Crohn's disease, multiple myeloma, diverse malignant and inflammatory diseases, thalidomide analogues, more specific activity. Correspondence: Þorkell Jóhannesson, dr.thorkell@simnet.is |
Verkanir og verkunarhættir talídómíðs_>
Fósturskemmandi verkun talídómíðs og hömlun á myndun æðaSænskur vísindamaður, Jönsson að nafni, benti árið 1972 á líkindi sem eru milli sameinda talídómíðs og gvanósíns (2). Til upprifjunar skal nefnt að gvanósín er gert úr gvaníni og ríbósa eða deoxíríbósa, og er (með áhengdum fosfathópi) að finna í sameindakeðjum kjarnasýra (RNA, DNA) (1). Jönsson áleit að talímíðhluti sameindarinnar gæti troðið sér inn í kjarnasýruraðirnar og myndaði tengsl við gvanósínhluta kjarnasýrusameindanna. Slík tengsl eru oft nefnd innskot (intercalation) og eru engan veginn óþekkt fyrirbæri í lyfjafræði. Innskot þurfa ekki að boða neitt sérstakt, nema efnahvörf in situ leiði af innskotinu. Jönsson gerði einmitt ráð fyrir því að efnahvörf yrðu milli glútarímíðhluta talídómíðsameindanna og deoxíríbósa í sameindum DNA annars vegar og milli talímíðhluta talídómíðs og gvaníns í sameindum DNA hins vegar. Þessi hugmynd sem í stórum dráttum var sett fram án meðfylgjandi rannsóknaniðurstaðna gerir ráð fyrir því að talídómíð verki sérhæft á DNA á afmörkuðum svæðum í líkamanum og það skýri fósturskemmandi verkun þess. Þetta myndi jafnframt skýra að talídómíð hefur ekki umtalsverð eiturhrif vegna kjarnaskemmda í frumum í blóðmerg (sjá á eftir).
Síðari rannsóknir hafa eindregið rennt stoðum undir þá kenningu að talídómíð geti haft sértæka verkun á viss gen í DNA sameindum og það skýri fósturskemmandi verkun þess. Má því segja að hugmynd Jönssons hafi verið stefnumarkandi í þessum efnum. Síðari rannsóknir staðfesta og að fósturskemmandi verkun talídómíðs og hömlun á myndun æða séu af sömu rót. Hið sama kann enn fremur að eiga við taugaskemmandi verkun talídómíðs þótt það sé lítt rannsakað. Verður nú að þessu vikið.
Tilraunir með myndun æða í slímhúð augna í kanínum bentu eindregið til þess að talídómíð hamli æðamyndun af völdum bFGF (basic fibroblast growth factor), vaxtarvaka bandvefs. Talídómíð hafði enga verkun staðlega í augunum heldur varð að gefa dýrunum það við inntöku til þess að það yrði virkt. Af þessu var ályktað að talídómíð sjálft væri ekki virkt heldur væri það umbrotsefni sem myndaðist in vivo. Rannsóknin leiddi einnig í ljós að verkunarháttur hömlunar á æðamyndun og fósturskemmda af völdum talídómíðs myndi vera hinn sami og óháður hamlandi verkun þess á myndun TNFa (sjá á eftir) (3). Í tilraunum með hænsnfóstur var og síðar sýnt fram á að talídómíð hamlaði marktækt örvandi verkun FGF-2, vaxtarvaka bandvefs-2, og IGF-1 (insulin-like growth factor 1), insúlínslíks vaxtarvaka-1 á vöxt útlima. Í þessum tilraunum höfðu afbrigði af talídómíði, sem valdið geta fósturskemmdum, sömu verkun. Afbrigði af talídómíði sem voru án fósturskemmandi verkunar heftu hins vegar ekki vöxt útlima í hænsnfóstrum (4). Tengslin milli hamlandi verkunar á myndun æða og hömlunar á vexti útlima og þar með fósturskemmda af völdum talídómíðs virðast því vera nokkuð ljós.
IGF-1 er einn svokallaðra vaxtarvaka sem myndast í vefjum fyrir tilstilli vaxtarhormónsins og miðlar, ásamt fleirum sams konar vaxtarvökum, verkunum hormónsins á vöxt og þroska (5). IGF-1 líkist insúlíni að gerð og bæði IGF-1 og FGF-2 verka á viðtæki, sem eru týrósínkínasar (sams konar og insúlínviðtæki) og eru misdreifð eftir vefjum (6). Áverkun á týrósínkínasaviðtæki sem þessi getur leitt af sér áberandi miklar breytingar í starfsemi hlutaðeigandi frumna (5).
Ein meginafleiðing af áverkun IGF-1 og FGF-2 á hlutaðeigandi týrósínkínasaviðtæki er að koma af stað umritun á genum alfa v og beta 3 integrína með eftirfarandi myndun á tvenndarsameind alfa v beta 3 integríns á yfirborði frumna. Á vaxtarstað útlima hvetur þetta til æðamyndunar, brjóskmyndunar og annarra vefja í útlimum. Stýriraðir (promoter regions) gena þessara integrína eru ríkar af gvanósíni, öfugt við langflestar stýriraðir annarra gena í líkamanum. Sérstakur umritunarþáttur, Sp1 (stimulatory protein 1), binst við stýriraðir þessara gena og auðveldar verkun hlutaðeigandi RNA pólímerasa. Áverkun á þessar tiltölulega fáu gvanósínstýriraðir í líkamanum getur þannig verið forsenda mikillar sérvirkni. Talið er að fósturskemmandi verkun talídómíðs (og hamlandi verkun á myndun æða) sé einmitt fyrst og fremst fólgin í því að hamla tengingu Sp 1 á gvanósínstýriraðir þeirra gena, sem stjórna myndun og vexti útlima eða annarra líffæra og talídómíð verkar á (6, 7) (sjá mynd 1).
Þess skal hér getið að integrín myndast á yfirborði fjölda frumna og stuðla að tilfærslu frumnanna, meðal annars við íferð úr blóðbraut í vefi við bólgusvörun (8). Integrín eru hluti af svokölluðum hefti- og viðloðunarpróteinum (cellular adhesive molecules) (sjá einnig á eftir).
Rannsóknir Bauers (9) og Parmans (10) benda til þess að talídómíð sjálft sé ekki að baki hömlunar á myndun æða eða fósturskemmda, heldur eitthvert umbrotsefni þess sem myndast in vivo og verði ekki eingöngu til við vatnsrof (samanber (1) og á undan). Talídómíð hefur að jafnaði einungis fósturskemmandi verkun í mönnum, mannöpum og sumum tegundum kanína. Því verður að teljast líklegt að í þessum tegundum myndist eitthvert umbrotsefni sem endanlega veldur fósturskemmdum. Á hinn bóginn er þó ekki útilokað að í öllum öðrum tegundum en þeim þremur fyrrnefndu umbrotni talídómíð til slíkrar fullnustu að það skaði alls ekki fóstur (6). Í ljósi aukinnar notkunar talídómíðs, og hugsanlega á afbrigðum þess, er nauðsynlegt að finna sem fyrst lausn á þessum vafaatriðum.
Enda þótt fósturskemmandi verkun af völdum talídómíðs eða umbrotsefnis (umbrotsefna) þess sé með þeim hætti sem að framan greinir hefur aldrei sannast að það hafi genskemmandi (mútagen) verkun í venjulegum prófum sem ætluð eru til þess að sýna fram á slíkar skemmdir (7). Þetta er verðmætur eiginleiki ef nota á talídómíð við meðferð á illkynja sjúkdómum ásamt eða í stað venjulegra krabbameinslyfja.
Hamlandi verkun á myndun TNFa og bólgusvörun
Upp úr 1990 var staðfest að talídómíð gæti dregið marktækt úr myndun TNFa í einkyrningum (mónócýtum) frá mönnum og sú verkun virtist öðru fremur liggja að baki verkunar talídómíðs á húðhnútabólgu í holdsveiki (erythema nodosum leprosum) (11). Enginn efi er á því að hömlun á myndun TNFa af völdum talídómíðs er miðsvæðis í verkun þess á bólgusvörun við bólgusjúkdóma svo og að einhverju eða jafnvel að verulegu leyti í verkun þess á illkynja sjúkdóma. Hamlandi verkun á myndun TNFa er óháð fósturskemmandi verkunum talídómíðs og hamlandi verkun þess á myndun æða eins og áður greinir.
TNFa (á ensku: tumor necrosis factor a; eldra heiti er kakektín) fékk nafn af því að þetta prótein getur sundrað sumum illkynja æxlisfrumum, en engan veginn öllum illkynja frumum, í tilraunum in vitro og in vivo. Ef til vill mætti kalla TNFa æxlisdræpi á íslensku. Æxlisdræpir eða "tumor necrosis factor" er þó í raun rangnefni þar eð efnið hefur fjölda annarra verkana og áhrif þess á æxli eru sennilega minni háttar í því samhengi. Í þessum texta er því TNFa notað vegna skorts á öðru betra heiti. Eldra heitið, kakektín, er til þess að rekja að við langvarandi bólgusjúkdóma, til dæmis berkla, veldur TNFa "tæringu" eða langvinnri megrun vegna alvarlegra truflana á fituefnaskiptum. Skyld prótein að gerð og verkunum eru LTa og LTb (eitlatoxín a og b) sem myndast í eitlafrumunum og lymfufrumunum. TNFa myndast hins vegar fyrst og fremst í gleypifrumum (makrófögum) og öðrum einkyrningum (mónócýtum) fyrir tilstilli örvunar af völdum lípópólísakkaríða, glúkana, túberkúlíns, IL-1 eða annars. TNFa virðist þannig valda mestu um sýklalost af völdum gramneikvæðra baktería (12-14).
Gen TNFa er á litningi 6 hjá mönnum. Samsetning TNFa varð kunn um miðjan 9. áratug síðustu aldar. TNFa er, eins og það myndast, gert úr 233 amínósýrum. Við bólgusvörun klofnar þetta forstigsprótein (situr í frumuhimnunni) síðan fyrir tilstilli sérstaks ensíms (metallópróteinasa) og hið virka form TNFa, sem í eru 157 amínósýrur (17 kDa), myndast. Þetta fjölpeptíð dreifist eftir blóðbraut og verkar á tvenns konar viðtæki, TNF RI og TNF RII, sem er að finna víða í vefjum og miðla verkunum TNFa í hlutaðeigandi líffærum (12, 14, 15). Yfirlit yfir verkanir TNFa er í töflu I.
Venja er að telja TNFa hormón, enda þótt hann finnist ekki í mælanlegu magni í blóði nema við sjúklegt ástand (12). IL-1 (interlevkín-1) sem er náskylt TNFa að verkunum telst og fremur hormón en cýtókín. Önnur interlevkín myndu hins vegar flest fremur teljast cýtókín en hormónar. Með cýtókínum, frumuhreyfum (eintala frumuhreyfir), er átt við efni er fremur verka á eða "hreyfa við" nálægum frumum við myndunarstað ("staðbundnir hormónar") en berast að marki út í blóðbraut og dreifast þannig til þess að verka annars staðar í líkamanum (hormónar).
Umritunarþátturinn NF-kB binst við stýriraðir TNFa gensins og er nauðsynlegur til þess að hvata umritun þess og myndun á TNFa. TNFa getur sjálfur virkjað NF-kB til þess meðal annars að auka eigin myndun. NF-kB getur greinilega hvatað umritun annarra gena og kann það að skýra aukna myndun á IL-1, IL-6 og hefti- og viðloðunarpróteinum af völdum TNFa (16). TNFa og IL-1 geta enn fremur hvort um sig innleitt myndun hins.
Talídómíð getur hamlað myndun TNFa að minnsta kosti með tvennum hætti. Í fyrsta lagi hefur talídómíð sérhæfða verkun í þá veru að hraða sundrun á TNFa mRNA. Við það dregur úr myndun á TNFa, en hvorki úr myndun á IL-1 né IL-6. Svo virðist sem báðar handhverfur talídómíðs séu virkar í þessu tilliti (17). Í öðru lagi hamlar talídómíð verkun umritunarþáttarins NF-kB og þar með ósérhæft myndun á TNFa og fleiri lífefnum (IL-1 og fleirum) (16, 18).
Hefti- og viðloðunarprótein (aðlímingarprótein) skipta meginmáli fyrir bólgusvörun. TNFa (og IL-1) auka mjög myndun margra þessara próteina. Hamlandi verkun talídómíðs á myndun þeirra gæti endanlega verið kjarninn í bólgueyðandi verkun talídómíðs. Verður nú nokkru nánar að þessu vikið.
Við áreitingu í vefjum af hverjum sökum sem vera kann og sem er nægjanleg til þess að valda bólgusvörun losna svokallaðir bólguvakar (histamín, TNFa og fleiri). Bólguvakar stuðla að æðavíkkun og gisnun æða og búa þannig í haginn fyrir ferð bólgufrumna (kornafrumur, eitlafrumur, einkyrningar/gleypifrumur) úr blóðbraut og í hlutaðeigandi vefi til þess að vinna á áreitinu. Til þess að bólgufrumur komist út í vefina þurfa að koma til svokölluð hefti- og viðloðunarprótein sem "binda" frumurnar við æðaþelið og "þrýsta" þeim út í vefinn (8).
Í tilraunum með æðaþelsfrumur úr bláæðum í naflastreng frá mönnum óx magn E-selektína (hefti- og viðloðunarprótein í innþeli æða) fyrir tilstilli TNFa. Talídómíð dró mjög úr þeirri svörun. Hliðstæð selektín eru á bólgufrumunum, L-selektín. TNFa jók einnig magn þessara selektína (þau snurðast af) og talídómíð dró úr myndun þeirra. Við bólgusvörun "rúlla" bólgufrumur í fyrstu tiltölulega laust yfir innþel æða í hlutaðeigandi vefjum, áður en frumurnar festast og komast út um æðaveggina og í vefina í kring. Þessi lausu tengsl verða fyrir tilstilli selektína á yfirborði bólgufrumna og innþelsæða og talídómíð hemur þau augljóslega í tilraunum sem þessum (19). Önnur hefti- og viðloðunarprótein eru nauðsynleg til þess að festa bólgufrumur við æðaveggina og þrýsta þeim út fyrir. Þessi prótein eru annars vegar skyld ónæmisglóbúlínum: ICAM-1 (intercellular adhesion molecule 1) og VCAM-1 (vascular cell adhesion molecule 1), og hins vegar ákveðinn flokkur integrína (samanber á undan). ICAM-1 og VCAM-1 eru talin sértæk hefti- og viðloðunarprótein, það er að segja "hefta" saman vissar frumur, en ekki aðrar. TNFa jók á myndun VCAM-1 í tilraunum með naflastrengsæðar sem áður ræðir og talídómíð dró úr myndun þeirra. Talídómíð jók hins vegar fremur á verkun TNFa á ICAM-1 en dró úr. Í þessum tilraunum höfðu hvorki talídómíð né TNFa nokkur áhrif á integrín (integrín beta 2) (19). Af þessum tilraunum er því í heild ljóst að talídómíð hefur greinilega verkun á heftingu bólgufrumna við innþel æða af völdum TNFa og verkunin gæti að einhverju leyti verið sértæk.
Verkun talídómíðs á myndun hefti- og viðloðunarpróteina kann og að skipta máli fyrir verkun þess á mergæxli sem vaxið geta úr blóðmerg inn í bein og valdið erfiðum beinbrotum (sjá síðar).
Talídómíð og sykurvirkir sterar (prednisólón, dexametasón og fleiri) hafa samverkandi verkun. Verkun stera á TNFa er ekki síst til þess að rekja að þeir hamla tjáningu gens TNFa og draga þannig úr myndun hans. Verkun steranna er ósérhæfð og tekur einnig til myndunar IL-1, IL-6 og fleiri cýtókína (17).
Örvandi verkun á T eitlafrumur ("kóimmúnóstímúlerandi verkun")
Enda þótt talídómíð geti dregið úr myndun á IL-2 og INF-g með því að hamla verkunum TNFa (sjá töflu I), getur það einnig aukið myndun á þessum cýtókínum með því að örva T eitlafrumur. Verkunin er að nokkru sértæk og talídómíð getur þannig breytt innbyrðis hlutföllum milli undirflokka T eitlafrumna. Talídómíð getur þó ekki eitt sér virkjað T eitlafrumur til þess að skipta sér og auka framleiðslu cýtókína á borð við IL-2 og INF-g. Talídómíð getur hins vegar eflt örvun af völdum annarra efna sem virkja T eitlafrumur beint. Þetta nefnist "kóstímúlatíón" eða "kóimmúnóstímúlatíón" og er mikilvægt atriði til þess að virkja T-eitlafrumur til fullnustu (20).
IL-2 virkjar T drápsfrumur og náttúrlegar drápsfrumur (13) og kann það að skýra að einhverju leyti verkun talídómíðs á illkynja frumur. Talídómíð getur þannig valdið frumufelli (apoptosis) í mergæxlisfrumum sem eru ónæmar gegn öðrum lyfjum. Athygli vekur samt, að IL-6, sem talídómíð hemur (tafla I), örvar skiptingu á mergæxlisfrumum og getur komið í veg fyrir drepandi verkun talídómíðs á mergæxlisfrumurnar (21). Hamlandi verkun á myndun IL-6 gæti því vegið þungt í verkunum talídómíðs á mergæxli (sjá síðar).
INF-g hefur margháttaða verkun í þá veru að efla allar verkanir svarkerfisins (ónæmiskerfisins) og er greinilega mjög til hjástoðar við IL-2, sem líta má á sem aðalhvata svarkerfisins (13).
"Kóstímúlerandi verkun" á T-eitlafrumur samhliða hömlunum á verkunum TNFa veldur því að talídómíð hefur, eða getur haft, margþætta verkun á T-eitlafrumur.
Notagildi talídómíðs til lækninga
Notkun við bólgusjúkdóma1. Holdsveiki: húðhnútabólga í holdsveiki (erythema nodosum leprosum; ENL).
Við alvarlegustu stig holdsveiki (sérstaklega lepra lepromatosa) kemur í að minnsta kosti 30% tilfella fyrir alvarlegt bólguástand í húð sem er óháð þeim sjúklegu breytingum af völdum holdsveiki er fyrir kunna að vera. Þetta sjúkdómsfyrirbæri sem nefnist á latínu erythema nodosum leprosum mætti kalla húðhnútabólgu í holdsveiki á íslensku. Áberandi í sjúkdómsmyndinni eru aumir, rauðleitir og vessandi hnútar í húðinni, oft með sárum, svo og verkir í liðum og víðar. Líkamshiti er hækkaður og sjúklingar eru slappir, sljóir og á allan hátt vesalir. Þeir megrast og mjög. Þetta sjúkdómsástand sem getur verið lífshættulegt er ekki fátíðara en svo að það er talið hrjá um eina milljón manna (11, 22). Elsta lýsing á húðhnútabólgu í holdsveiki og þeirri vesöld er með fylgir er væntanlega hin fræga lýsing úr biblíunni á Lazarusi sem hlaðinn kaunum hafði verið komið fyrir við fordyri ríka mannsins: " ... og girntist hann að seðja sig af því, er féll af borði ríka mannsins og jafnvel hundar komu og sleiktu kaun hans" (Lúkas 16:20). Kaun eins og stendur í biblíutextanum hittir sérlega vel í mark í lýsingunni því að kaun getur merkt allt í senn: hrúður, skeina, kýli og sár.
Húðhnútabólga í holdsveiki er algengust samfara gjöf holdsveikilyfja (sýklalyfja gegn holdsveiki), en kemur einnig fyrir eftir að lyfjagjöf hefur verið hætt og stundum einnig áður en meðferð hefst (11). Sjúkdómsfyrirbærið hefur yfirbragð ofnæmissvörunar af 3. gerð að því best er vitað. Við það ástand myndast mótefnafléttur með IgM og fulltingispróteinum (complement) í æðum. Talídómíð dregur úr myndun á IgM, en verkar samt mun hraðar á húðhnútabólgu í holdsveiki en svo að hömlun á IgM geti eingöngu skýrt verkun þess (22).
Jakob Sheskin hét maður og var læknir að mennt. Eftir heimsstyrjöldina síðari fór hann til Venezúela og sérhæfði sig í meðferð holdsveikra. Árið 1956 fluttist hann til Jerúsalem og starfaði þar áfram að lækningum á holdsveikum. Átta árum síðar fékk hann til meðferðar frá Frakklandi sjúkling sem var sérlega illa haldinn af húðhnútabólgu og meðfylgjandi sjúkdómseinkennum. Sjúklingurinn hafði verið rúmfastur í 19 mánuði. Hann var haldinn miklum verkjum og gat ekki sofið. Svefnlyf reyndust haldlítil. Sjúklingurinn var að dauða kominn. Sheskin fann á spítalanum glas með 20 talídómíðtöflum og: "With nothing to lose in this case, the patient was given two thalidomide tablets as a last resort". Og árangurinn var þessi: "He slept soundly for twenty hours, and, upon waking, felt well enough to get out of bed without assistance. After two more pills, his pain disappeared entirely and his sores began to heal. When treatment was stopped, the symptoms returned, and when it was resumed, his condition again improved dramatically. Six other patients in the hospital were then treated, with similar dramatic results" (15). Þetta var sannkallaður "dramatískur árangur" enda kalla Stephens og Brynner þann kafla í sinni bók þar sem um þetta er fjallað mjög svo hnyttilega "Lazarus Rises"!
Sheskin gerði svo árið eftir grein fyrir árangri af meðferð fyrrnefndra sex sjúklinga með talídómíði (23). Allmörgum árum síðar gerði Sheskin (24) grein fyrir árangri af meðferð með talídómíði við húðhnútabólgu í holdsveiki. Hann benti á að meðferðin gerði gagn í yfir 90% tilfella, stytti legutíma, auðveldaði meðferð með holdsveikilyfjum og flýtti fyrir því að sjúklingarnir gætu komist til vinnu.
Síðari rannsóknir hafa svo staðfest að hamlandi verkun talídómíðs á þéttni TNFa í blóði skýrir best hina miklu og skjótu verkun þess á húðhnútabólgu í holdsveiki og önnur einkenni henni samfara. INFg kemur hér líka við sögu (11). Trúlega verkar INFg fyrir tilstilli TNFa og öfugt.
Í júlí 1998 hlaut talídómíð (Thalomid®) viðurkenningu Fæðu- og lyfjamálastofnunar Bandaríkjanna (Food and Drug Administration) til notkunar gegn erythema nodosum leprosum. Notkun lyfsins er ströngum skilyrðum háð (15, 25).* Engu að síður hefur þetta auðveldað læknum að prófa lyfið við ýmsa aðra sjúkdóma, þar á meðal ýmsa bólgusjúkdóma á borð við Crohnsjúkdóm.
2. Svæðisþarmabólga (Morbus Crohn; Crohnsjúkdómur).
Svæðisþarmabólga getur verið hvar sem er í meltingarvegi, en kemur oftast fyrir neðarlega í mjógirni. Svæðisþarmabólga er einkum meðhöndluð með amínósalicýlsýru, sykurvirkum sterum, cýklósporíni eða öðrum svarbælandi lyfjum (auk sýklalyfja). Við alvarlega þarmabólgu er oftast byrjað með stóra skammta af sykurvirkum sterum. Öll þessi lyf eiga það sameiginlegt að hamla virkni umritunarþáttarins NF-kB (samanber á undan) og geta þannig hamlað myndun TNFa auk ýmissa annarra lífefna. Nýlegt lyf er infliximab sem er kímerískt (chimeric) mótefni gegn TNFa. Stungið var upp á því fyrir meira en 20 árum að nota talídómíð við erfið tilfelli af Crohnsjúkdómi (26).
Nýlegar rannsóknir bæði í mönnum og dýrum benda eindregið til þess að TNFa skipti meginmáli við uppkomu þarmabólgu. Það vekur samt athygli að talídómíð getur verið virkt í þeim tilvikum að sjúklingar svara ekki meðferð með infliximabi (sem er bæði erfið og dýr). Sama á einnig við um sjúklinga sem svara ekki meðferð með sykurvirkum sterum. Sá möguleiki er því fyrir hendi að talídómíð verki á svæðisbundna þarmabólgu bæði með því að hamla virkni TNFa (tvíþætt hamlandi verkun: á TNFa mRNA og NF-kB) og með öðrum hætti. Kemur þá einkum tvennt til. Í fyrsta lagi er misvægi milli undirflokka T eitlafrumna ríkjandi við Crohnsjúkdóm sem talídómíð gæti lagfært. Í öðru lagi er í Crohnsjúkdómi mjög aukin þéttni í blóði af vaxtarvaka bandvefs (bFGF) og af öðrum skyldum vaxtarvaka sem talídómíð hamlar (samanber á undan), en samband er milli þéttni þeirra og sjúkdómseinkennanna. Þetta gæti gert að verkum að talídómíð gagnast í raun sjúklingum með svæðisþarmabólgu, þótt hvorki infliximab né sykurvirkir sterar (sem hafa þó sannarlega breiða verkun á bólgusvörun!) verki á þá (26).
Talídómíð gæti þannig átt mikinn rétt á sér við erfið tilfelli af Crohnsjúkdómi þegar fokið er í flest skjól, svo og þegar fistlar myndast.
Þrálát sáramyndun í húð sjaldgæfrar tegundar sem nefnist pyoderma gangrenosum tengist oft Crohnsjúkdómi (eða annars konar þarmabólgum) og svarar meðferð með talídómíði mjög vel (15, 26).
3. Aðrir bólgusjúkdómar
Niðurstöður úr tvíloka rannsókn hafa sýnt að talídómíð er virkt við Behçetsjúkdómi (fjölkerfa sjúkdómur á grundvelli æðabólgu með einkennum frá húð og slímhúð (langvarandi sýkingar með sáramyndun), liðum, meltingarvegi og miðtaugakerfi). Allmargar opnar rannsóknir hafa sýnt mjög góðan árangur af meðferð á þessum sjúkdómi með talídómíði (27, 28).
Talídómíð hefur í tvíloka tilraun reynst vel virkt við stomatitis apthosa (hvítleit, verkjandi sár í munni af óþekktum toga) (28). Sömu höfundar benda einnig á notagildi talídómíðs við ýmsa þráláta kláðasjúkdóma í húð (prurigo).
TNFa skiptir miklu máli við liðbólgur og liðskemmdir við iktsýki (27) (tafla I). Gildi mótefna gegn TNFa við meðferð á alvarlegri iktsýki er og ótvírætt (29). Raunar var stungið upp á því að nota talídómíð gegn iktsýki þegar 1981. Staða talídómíðs við meðferð á alvarlegri iktsýki er þó enn óljós. Sama á við hryggikt (spondylitis ankylopoetica) (30).
Við klíníska notkun talídómíðs ber ætíð að hafa í huga hinar alvarlegu hjáverkanir sem vitað er frá fyrri tíð að geta verið samfara notkun þess. Á þetta sér í lagi við fósturskemmdir í meðgöngu og skemmdir í úttaugakerfi. Af öðrum algengum hjáverkunum má nefna syfju og hægðatregðu, auk fjölda annarra fátíðari hjáverkana, ekki síst frá húð (21). Talídómíð skal því í meginreglu aðeins nota þegar annarra lyfja er ekki völ.
Notkun við illkynja sjúkdóma
Olson og samstarfsmenn hans birtu árið 1965 (31) grein þar sem skýrt var frá notkun talídómíðs gegn margs konar alvarlegum illkynja sjúkdómum í samtals 21 sjúklingi. Í sjö tilvikum var talið að talídómíð gæti hafa haft einhverja verkun ("subjective improvement"). Það var í tveimur tilfellum (af fimm) af adenocarcinoma í nýra og í tveimur tilfellum (af tveimur) af mergæxli (multiple myeloma) auk þriggja annarra tilfella. Þrátt fyrir þennan fremur lélega árangur lögðu höfundarnir til að talídómíð yrði reynt frekar við illkynja sjúkdóma sem ónæmir væru fyrir annarri meðferð ("It is suggested that further trial of this drug in tumors not sensitive to other agents, ... , is warranted").
Tæplega 40 árum eftir að þessi orð voru rituð er ljóst að talídómíð (eða talídómíðlík lyf) hafa fengið fastan sess við meðferð á mergæxlum ásamt öðrum lyfjum (dexametasón og fleiri). Sérstaka athygli vekur að talídómíð og dexametasón hafa reynst hafa marktæka samverkandi verkun (21, 32-4). Mergæxli eru illkynja æxli sem eiga upphaf sitt í blóðmerg og langoftast á mörgum stöðum í senn (þar af enska heitið "multiple myeloma"). Sjúkdómurinn er illvígur, svarar illa meðferð, veldur sársaukafullum beinbrotum og er ævinlega banvænn (15). Í Bandaríkjunum er talið að mergæxli valdi um 2% af öllum dauðsföllum sem rakin eru til illkynja sjúkdóma. Ekki er endanlega vitað hver eða hverjar verkanir talídómíðs skipta meginmáli í lyfhrifum þess á mergæxli, þótt að framan hafi sérstaklega verið bent á verkun á IL-6 og á hefti- og viðloðunarprótein. Raunar gætu flestar eða allar verkanir talídómíðs átt hér hlut að máli eins og réttilega hefur verið bent á (35). Á árinu 2002 voru veittar 19 undanþágur til innflutnings og notkunar talídómíðs hér á landi. Voru 8 vegna notkunar við mergæxli, en hinar vegna notkunar við aðra illkynja sjúkdóma (36).
Orðið hefur vart sérstakrar hjáverkunar eftir gjöf talídómíðs ásamt öðrum lyfjum við meðferð á mergæxli. Er það aukin tíðni segamyndunar og blóðreks hjá þessum sjúklingum. Ástæða þessa er ekki ljós (21).
Talídómíð kann að hafa sértæka verkun á mergæxli. Á hinn bóginn er alveg ljóst, svo sem áður er rakið, að talídómíð virkjar svarkerfið (ónæmiskerfið), og þar með drápsfrumur þess, í þeim mæli að það gæti auk annarra lyfhrifa talídómíðs skipt máli við meðferð á illkynja sjúkdómum yfirleitt (13). Þessi skoðun er sett á oddinn í nýlegri grein í vikuritinu Time (37) með vísan til orða bresks vísindamanns (Keith Dredge): "Tumors seem to be able to hide from the immune system, preventing the body from fighting the invader itself". Höfundur hinna tilvitnuðu orða stundar einmitt rannsóknir á virkni tiltekins talídómíðafbrigðis á mergæxli og briskirtilskrabbamein sem er sömuleiðis lítt næmt gegn allri þekktri lyfjameðferð. Rannsókn er einnig hafin á gildi talídómíðs við meðferð á smáfrumukrabbameini í lungum. Alls er ætlað að rannsóknin nái til um 400 sjúklinga (38).
Af framansögðu er ljóst að notkun talídómíðs og talídómíðlíkra lyfja við illkynja sjúkdóma er í mikilli verðandi. Vonandi leiðir það til ávinnings í meðferð þessara sjúkdóma. Nýleg yfirlitsgrein sem tekur á þessu efni í víðum skilningi er grein Richardsons og fleiri (39).
Yfirlit yfir ábendingar á notkun talídómíðs eða talídómíðlíkra lyfja til lækninga er í töflu II.
Talídómíðlík lyf ("talídómíðanalógar")
Muller og samverkamenn (40) fundu að amínóafleiður af talídómíði (4-amínóafleiður) hefðu kröftuga hamlandi verkun á fosfódíesterasa 4 sem einkum kemur fyrir í einkyrningum og gleypifrumum. Þessar frumur mynda að undangenginni áreitingu meira af TNFa en aðrar frumur í líkamanum. Fosfódíesterasar kljúfa fosfattengi í hring-AMP (cAMP; cýklískt andenósínmónófosfat) og stýra þannig magni þessa frumuboðefnis, er aftur hefur áhrif á myndunarferli TNFa í frumunum. Eftir því sem virkni fosfódíesterasa er minni, því meira er af hring-AMP og minna af TNFa. Með því að blokka fosfódíesterasa má því minnka magn TNFa. Þessi talídómíðsambönd minnkuðu þannig magn TNFa marktækt í tilraunum, en með öðrum hætti en talídómíð sjálft (samanber á undan).Fyrirtækið Celgene (Celgene Corporation, Warren, New Jersey, Bandaríkjunum), sem hefur á ný sett talídómíð á markað (Thalomid®), hefur jafnframt haft forgöngu um að samtengja afleiður (einkum amínó- og metýlafleiður) af talídómíði ("talídómíðanalógar"). Corral og félagar (20) skipta afleiðum þessum í tvo flokka. Efnasambönd í flokki 1 líkjast talídómíði mikið að verkunum, en verka yfirleitt kröftugar. Þessar afleiður hamla þannig myndun á TNFa, IL-1 og IL-6 og örva jafnframt T eitlafrumur og auka þannig myndun á IL-2 og IFNg. Afleiður í flokki 2 draga mjög úr myndun á TNFa með því að blokka fosfódíesterasa 4, en hafa væntanlega fremur litlar aðrar verkanir í líkingu við talídómíð. Afleiður í þessum flokki ættu fræðilega séð að geta orðið æskileg bólgueyðandi lyf. Klínísk reynsla af þessum efnum er samt ekki góð þar eð klígja og uppsölur hafa reynst vera þjakandi hjáverkanir. Efni í flokki 1 gætu hins vegar fengið varanlegt gildi í krabbameinslækningum. Þessi efni verka á mergæxli líkt og talídómíð (41).
Talídómíðafleiður í flokki 1 hafa verið kallaðar "immunomodulatory drugs (IMiDs)" og í flokki 2 "selected cytokine inhibitory drugs (SelCiDs)" (41). Vera má að þessi heiti festist í sessi þótt þau geti tæpast talist æskileg.
Þakkir
Tryggvi Ásmundsson læknir og dr. Haraldur Halldórsson lífefnafræðingur lásu textann yfir og gáfu höfundi góðar ábendingar. Elín Magnúsdóttir lyfjafræðingur og Óttar Kjartansson kerfisfræðingur veittu hjálp við gerð formúla og tölvumynda í fyrri hluta greinarinnar. Þessum einstaklingum svo og þeim sem svöruðu persónulegum fyrirspurnum, eru færðar kærar þakkir. Sérstakar þakkir færir höfundur ritara sínum, frú Jóhönnu Edwald, fyrir vinnslu handrits og vinnu við öflun heimilda.Heimildir
1. Jóhannesson Þ. Talídómíð: lyf hörmunga og hjálpræðis. Yfirlitsgrein. - Fyrri hluti: Tilurð talídómíðs, sameindargerð og fyrsti ferill. Læknablaðið 2003; 89: 751-6.2. Jönsson N. Chemical structure and teratogenic properties. IV. An outline of a chemical hypothesis for the teratogenic action of thalidomide. Acta Pharm Suec 1972; 9: 543-62.
3. D´Amato RJ, Loughnan MS, Flynn E, Fockman J. Thalidomide is an inhibitor of angiogenesis. Proc Natl Acad Sci 1994; 91: 4082-5.
4. Stephens TD, Bunde CJW, Torres RD, Hackett DA, Stark MR, Smith DM, et al. Thalidomide inhibits limb development through its antagonism of IGF-1 + FGF-2 + heparin. Teratology 1998; 57: 112 (abstract).
5. Jóhannesson Þ. Lyfjafræði innkirtla. Vítamín og járn. 2. útg. Reykjavík: Bóksala stúdenta 1992: 77, 163, 167.
6. Stephens TD, Fillmore BJ. Hypothesis: thalidomide embryopathy-proposed mechanism of action. Teratology 2000; 61: 189-95.
7. Stephens TD, Bunde CJ, Fillmore BJ. Mechanism of action in thalidomide teratogenesis. Biochem Pharmacol 2000; 59: 1489-99.
8. Jóhannesson Þ. Aspirín. Acetýlsalicýlsýra og önnur salílyf. Læknablaðið 2000; 86: 755-68.
9. Bauer KS, Dixon SC, Figg WD. Inhibition of angiogenesis by thalidomide requires metabolic activation, which is species-dependent. Biochem Pharmacol 1998; 55: 1827-34.
10. Parman T, Wiley MJ, Wells PG. Free radical-mediated oxidative DNA damage in the mechanism of thalidomide teratogenecity. Nature Medicine 1999; 5: 582-5.
11. Sampaio EP, Kaplan G, Miranda A, Nery JAC, Miguel CP, Viana SM, et al. The influence of thalidomide on the clinical and immunologic manifestation of erythema nodosum leprosum. J Infect Dis 1993; 168: 408-14.
12. Beutler B, Cerami A. Cachectin and tumor necrosis factor as two sides of the same biological coin. Nature 1986; 320: 584-8.
13. Jóhannesson Þ. Krabbameinslyf og svarbælandi lyf. Reykjavík: Háskólaútgáfan; 1994: 38-41.
14. Eigler A, Sinha B, Hartmann G, Endres S. Taming TNF: strategies to restrain this proinflammatory cytokine. Immunol Today 1997; 18: 487-92.
15. Stephens T, Brynner R. Dark Remedy. The impact of thalidomide and its revival as a vital medicine. Cambridge (Mass.): Perseus Publishing 2001: 121-3; 155-8; 161; 169; 186-9).
16. Raje N, Anderson KC. Thalidomide and immunomodulatory drugs as cancer therapy. Curr Opin Oncol 2002; 14: 635-40.
17. Moreira AL, Sampaio EP, Zmuidzinas A, Frindt P, Smith KA, Kaplan G. Thalidomide exerts its inhibitory action on tumor necrosis factor a by enhancing mRNA degradation. J Exp Med 1993; 177: 1675-80.
18. Jin SH, Kim TI, Han DS, Shin SK, Kim WH. Thalidomide suppresses the interleukin 1b-induced NFkB signalling pathway in colon cancer cells. Ann NY Acad Sci 2002; 973: 414-8.
19. Geitz H, Handt S, Zwingenberger K. Talidomide selectively modulates the density of cell surface molecules involved in the adhesion cascade. Immunopharmacol 1996; 31: 213-21.
20. Corral LG, Haslett PAJ, Muller GW, Chen R, Wong LM, Ocampo CJ, et al. Differential cytokine modulation and T cell activation by two distinct classes of thalidomide analogues that are potent inhibitors of TNF-a. J Immunol 1999; 163: 380-6.
21. Cavenagh JD, Oakervee H. Guideline. Thalidomide in multiple myeloma: Current status and future prospects. Brit J Haematol 2003; 120: 18-26.
22. Shannon EJ, Miranda RO, Morales MJ, Hastings RC. Inhibition of de novo IgM antibody synthesis by thalidomide as a relevant mechanism of action in leprosy. Scand J Immunol 1981; 13: 553-62.
23. Sheskin J. Thalidomide in the treatment of lepra reactions. Clin Pharmacol 1965; 6: 303-6.
24. Sheskin J. The treatment of lepra reaction in lepromatous leprosy. Fifteen years' experience with thalidomide. Int J Dermatol 1980; 19: 318-22
25. Zeldis JB, Williams BA, Thomas SD, Elsayed MF. S.T.E.P.S.: a comprehensive program for controlling and monitoring access to thalidomide. Clin Ther 1999; 21: 319-30.
26. Ginsburg PM, Dassopoulos T, Ehrenpreis ED. Thalidomide treatment for refractory Crohn's disease: a review of the history, pharmacological mechanisms and clinical literature. Ann Med 2001; 33: 516-25.
27. Ossandon A, Cassara EAM, Priori R, Valesini G. Thalidomide: focus on its employment in rheumatologic diseases. Clin Exper Rheumatol 2002; 20: 709-18.
28. Wines NY, Cooper AL, Wines MP. Thalidomide in dermatology. Austral J Dermatol 2002; 43: 229-40.
29. Elliott MS, Maini RN, Feldmann M, Kalden JR, Antoni C, Smolen JS, et al. Randomised double-blind comparison of chimeric monoclonal antibody to tumor necrosis factor a (cA2) versus placebo in rheumatoid arthritis. Lancet 1994; 344: 1105-10.
30. Huang F, Wei JCC, Breban M. Thalidomide in ankylosing spondylitis. Clin Exper Rheumatol 2002; 20 (Suppl. 28): S158-S161.
31. Olson KB, Hall TC, Horton J, Khung CL, Hoseley HF. Thalidomide (N-phthaloylglutarimide) in the treatment of advanced cancer. Clin Pharmaol 1965; 6: 292-7.
32. Singhal S, Mehta J, Desikan R, Ayers D, Roberson P, Eddelmon P, et al. Antitumor activity of thalidomide in refractory multiple myeloma. N Eng J Med 1999; 341: 1565-71.
33. Jaslow R, Kaplan G, Lyons L, Michaeli J, Coleman M. Thalidomide in multiple myeloma - from the clinic to the laboratory. Cancer Invest 2002; 20: 1051-8.
34. Weber D, Rankin K, Gavino M, Delasalle K, Alexanian R. Thalidomide alone or with dexamethasone for previously untreated multiple myeloma. J Clin Oncol 2003; 21: 16-9.
35. Thalidomide - a revival story (ritstjórnargrein). N Engl J Med 1999; 341: 1606-9.
36. Kjartansdóttir Þ (lyfjafræðingur, Lyfjastofnun). Bréfl. uppl. 21.11.2002 og 24.2.2003.
37. Noble K. Bad drug makes good. Thalidomide, once the most feared of medications, is now showing promise as a cancer treatment. Time 2003 (2.3.); 53.
38. Thalidomide trials to fight cancer. BBC News World Edition (28.1.2003).
39. Richardson P, Hideshima T, Anderson K. Thalidomide: Emerging role in cancer medicine. Ann Rev Med 2002; 53: 629-57.
40. Muller GW, Chen R, Huang SY, Corral LG, Wong LM, Patterson RT, et al. Amino-substituted thalidomide analogs: potent inhibitors of TNF-alpha production. Bioorg Med Chem Lett 1999; 9: 1625-30.
41. Hideshima T, Chauhan D, Shirma Y, Rate N, Davies FE, Tai YZ, et al. Thalidomide and its analogs overcome drug resistance of human multiple myeloma cells to conventional therapy. Blood 2000; 96: 2943-50.