Fræðigreinar
Grundvallaratriði í meðferð líffæraþega
Ágrip
Á síðustu 40 árum hafa orðið miklar framfarir á sviði líffæraflutninga sem nú eru viðurkennd meðferð við lokastigssjúkdómi í hjarta, lifur, lungum og nýrum og við sykursýki. Stóraukinn skilningur á ónæmissvörun við ósamgena græðlingum hefur leitt til fjölbreyttari möguleika í ónæmisbælandi lyfjameðferð. Mestum straumhvörfum olli þó uppgötvun ónæmisbælandi lyfsins cýklósporíns sem farið var að nota við meðferð sjúklinga í upphafi níunda áratugarins. Skammtíma lifun ígræddra líffæra er nú mjög góð en hægfara tap græðlinga af völdum langvinnrar höfnunar er eitt stærsta vandamálið í dag. Margvíslegir fylgikvillar geta hrjáð líffæraþega og tengjast þeir flestir ónæmisbælandi lyfjameðferð. Meðal þeirra eru lífshættulegar sýkingar og krabbamein. Fjallað er um helstu atriði sem lúta að langtímameðferð líffæraþega.English Summary |
| Pálsson R Key issues concerning long-term management of transplant recipients Læknablaðið 2000; 86: 557-65 During the past 40 years, solid-organ transplantation has evolved into a routine clinical procedure for the management of end-stage heart, kidney, liver and lung disease as well as diabetes mellitus. This has mainly been accomplished through advances in understanding the molecular mechanisms involved in the rejection of allografts which has led to major improvements in immunosuppressive therapy. The discovery of the immunosuppressive drug cyclosporine which came into clinical use in the early eighties, revolutionized the field of transplantation. The short-term survival of allografts is now excellent but relentless loss of grafts over time due to chronic rejection remains a major problem. A number of complications can affect transplant recipients, most of which result from intensive immunosuppressive treatment. Among those are life-threatening infections and malignancies. The key issues concerning long-term management of transplant recipients are discussed. Key words: organ transplantation, rejection, immunosuppression. Correspondence: Runólfur Pálsson. E-mail: runolfur@rsp.is |
Inngangur
Á síðustu 40 árum hafa líffæraflutningar breyst frá því að vera tilraunameðferð þar sem nær eingöngu var um að ræða nýraígræðslur, yfir í að vera viðurkennd meðferð við sjúkdómi á lokastigi í hjarta, lifur, lungum og nýrum, og við sykursýki. Það var uppgötvun á hlutverki ónæmiskerfisins í höfnun ígræddra líffæra og tilkoma ónæmisbælandi lyfja sem gerði líffæraflutninga mögulega. Þeim áfanga var náð í upphafi sjöunda áratugarins með tilkomu azatíópríns sem var notað ásamt barksterum til að fyrirbyggja höfnun ígræddra nýrna (1). Þróun annarra líffæraflutninga hefur verið hægari en árangur þeirra hefur batnað mjög á undanförnum árum með betra vali og undirbúningi sjúklinga ásamt framförum í skurðtækni og gjörgæslumeðferð. Mestum straumhvörfum olli uppgötvun ónæmisbælandi lyfsins cýklósporíns sem komst í almenna notkun í upphafi níunda áratugarins (2,3). Líffæraflutningar eru þó engan veginn fullkomin lækning því hinu nýja líffæri fylgja margvísleg vandamál sem geta verið lífshættuleg. Flest tengjast þau ónæmisbælandi meðferð sem líffæraþegum er nauðsynleg. Má þannig segja að skipt hafi verið um sjúkdóm hjá þessum sjúklingum. Hér á eftir verður fjallað um helstu atriði sem snerta langtímameðferð líffæraþega. Val og undirbúningur væntanlegs líffæraþega
Meðferð líffæraþega hefst í raun með undirbúningi fyrir ígræðslu. Mikilvægt er að vanda vel val á líffæraþegum því margir þættir geta haft áhrif á hvernig þeim farnast. Þróaðar hafa verið leiðbeiningar þar að lútandi. Útiloka þarf langvinna sjúkdóma í öðrum líffærum sem takmarka lífshorfur. Stundum er þó brugðið á það ráð að græða fleiri en eitt líffæri í sama sjúkling, til dæmis hjarta og lungu eða hjarta og nýra. Sjúklinga með sögu um kransæðasjúkdóm eða verulega áhættuþætti hjarta- og æðasjúkdóma, þarf að meta gaumgæfilega, jafnvel með kransæðamyndatöku. Sérstaklega á þetta við um sjúklinga með sykursýki. Ef umtalsverður kransæðasjúkdómur er til staðar sem krefst aðgerðar, er mikilvægt að framkvæma hana áður en ígræðslan fer fram. Nauðsynlegt er að útiloka sýkingar sem geta verið frábendingar gegn ígræðslu, til dæmis berkla og alnæmi. Þegar saga er um krabbamein er yfirleitt gerð krafa um að minnsta kosti tvö sjúkdómsfrí ár (4). Þá er mikilvægt að meta geðrænt ástand, notkun vímuefna og líkur á meðferðarheldni. Ennfremur þarf að huga að þáttum sem tengjast ígræðsluaðgerðinni, til dæmis þvagvegum væntanlegs nýraþega og kransæðum og lungnablóðrás væntanlegs hjartaþega. Hjá væntanlegum nýra- og hjartaþegum þarf að kanna hvort mótefni gegn HLA-sameindum séu til staðar því þau takmarka val á líffærum.Tímasetning ígræðslu
Tímasetning ígræðsluaðgerðarinnar er mjög mikilvæg því ástand sjúklinga þegar til hennar kemur getur skipt sköpum varðandi árangur. Æskilegt er að framkvæma ígræðsluna þegar sjúklingurinn er nægilega hraustur til að þola aðgerðina en að sama skapi með svo langt genginn sjúkdóm að ólíklegt sé að hann lifi lengi án ígræðslu. Undantekning frá þessu eru sjúklingar með nýrnabilun á lokastigi þar sem einnig er völ á skilunarmeðferð. Hjá lífshættulega veikum sjúklingum er stundum beitt sérstakri hátæknimeðferð til að brúa stutt tímabil þar til unnt er að framkvæma ígræðslu. Dæmi um slíkt eru lífræn gervilifur (5) og vélræn blóðrásaraðstoð (6). Höfnun ósamgena (allogeneic) græðlinga
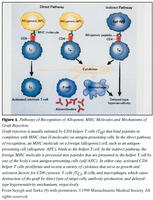
Hvers vegna höfnum við græðlingum?: Þegar líffæri er flutt á milli annarra einstaklinga en eineggja tvíbura er því umsvifalaust hafnað. Meginástæðan felst í genum sem eru mjög breytileg milli einstaklinga en þau tjá sameindir sem valda því að við myndum kröftugt ónæmissvar gegn líffærum frá gjöfum sem eru líffræðilega frábrugðnir okkur. Þau mikilvægustu eru svokölluð vefjaflokkagen (major histocompatibility complex, MHC) sem liggja nálægt hverju öðru á stutta armi litnings 6 og erfast saman, þannig að hver einstaklingur fær eina arfgerð (haplotype) frá hvoru foreldri. Prótínafurðir þessara gena eru svokallaðar vefjaflokkasameindir (HLA-sameindir, MHC-sameindir) sem skipt hefur verið í tvo flokka; í flokki I eru HLA-A, -B og -C sem finnast á öllum frumum og í flokki II eru HLA-DR, -DQ og -DP sem finnast einkum á B-eitilfrumum, gleypifrumum og sumum æðaþelsfrumum (7). Hlutverk þessara sameinda er að sýna T-eitilfrumum ónæmisvaka (antigen) og stjórna svörun við þeim.Miðpunktur ónæmissvörunar við græðlingum eru T-frumur sem þekkja framandi MHC-sameindir gjafans (7,8). Af því hlýst virkjun T-frumnanna sem hrindir af stað bólguviðbrögðum. T-frumur geta ýmist þekkt MHC-sameindir gjafa beint á frumum græðlingsins (direct allorecognition) eða þær geta þekkt MHC-peptíð frá græðlingnum sem eru bundin MHC-sameindum á sýnifrumum (antigen presenting cells) þega (indirect allorecognition) (mynd 1) (9). Ekki er fullkomnlega ljóst hver er hlutfallsleg þýðing beina og óbeina ferlisins en talið er að hið fyrrnefnda kunni að gegna meginhlutverki í bráðri höfnun og hið síðarnefnda í langvinnri höfnun. T-frumur hafa ýmist á yfirborði sínu CD4 eða CD8 prótín sem gegna mikilvægu hlutverki við virkjun þeirra (10). Tvenns konar samverkandi boð eru nauðsynleg til að T-frumur nái að virkjast að fullu. Annars vegar er um að ræða boð sem miðlað er af viðtæki T-frumunnar og er háð ónæmisvakanum. Hins vegar er hjálparboð (costimulatory signal) sem er ekki sértækt fyrir ónæmisvaka en ef það skortir lamast T-frumurnar (9). CD4+ T-frumur gegna lykilhlutverki við að koma af stað höfnun en þær seyta ýmsum eitilfrumuboðefnum (lymphokines) sem verka á ýmsar frumur og stýra þátttöku þeirra í ónæmissvarinu. Interleukín-2 (IL-2) er lykilboðefni sem virkjaðar CD4+ T-frumur losa og örvar það fjölgun og sérhæfingu T- og B-frumna (11). CD8+ drápsfrumur ásamt öðrum frumum, mótefnum og komplementþáttum, valda sköddun græðlingsins. Ónæmisbælandi lyf grípa inn í höfnunarferlið á ýmsum stigum.
Ofurbráð höfnun: Ofurbráð höfnun er nú afar sjaldgæf en hún orsakast af frumuskemmandi mótefnum gegn græðlingnum og einkennist af svæsnum æðaþelsskaða og segamyndun sem leiða til eyðileggingar græðlingsins á fyrstu dögunum eftir ígræðslu. Engin meðferð kemur að gagni. Þessi tegund höfnunar á sér stað þegar ABO-blóðflokkaósamræmi er milli þega og gjafa. Hún sést einnig í nýra- og hjartagræðlingum þegar mótefni gegn HLA-sameindum gjafans eru til staðar við ígræðslu (12). Slík mótefni geta myndast við meðgöngu og fæðingu, við blóðgjöf og við höfnun ígrædds líffæris. Til að hindra ofurbráða höfnun er ætíð tryggt að ABO-blóðflokkasamræmi sé fyrir hendi. Ennfremur er ávallt framkvæmt eitilfrumukrosspróf fyrir nýraígræðslu og hjá væntanlegum hjartaþegum er skimað fyrir þessum mótefnum og krossprófað fyrir ígræðslu ef þau reynast fyrir hendi.
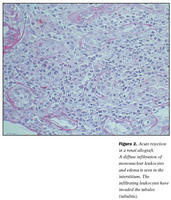
Bráð höfnun: Tíðni bráðrar höfnunar er talsvert mismunandi eftir tegund líffæris og er á bilinu 30-60%. Hún á sér oftast stað á fyrstu þremur mánuðunum eftir ígræðslu en getur komið fyrir á hvaða tíma sem er, einkum ef ónæmisbæling er minnkuð eða stöðvuð. Einkennandi fyrir bráða höfnun er íferð bólgufrumna, einkum eitilfrumna og gleypifrumna, sem oft er mest áberandi umhverfis æðar (mynd 2). Aðrar markverðar vefjabreytingar eru æðaþelsbólga í smáum æðum og sköddun í starfrænum vef, svo sem píplubólga í nýra, vöðvafrumudrep í hjarta og gallgangabólga í lifur. Bráð höfnun veldur röskun á starfsemi græðlings. Hún er oft einkennalaus og því erfið í greiningu, sérstaklega eftir tilkomu öflugra ónæmisbælandi lyfja sem draga úr einkennum bólgusvörunar. Vefjagreining er yfirleitt nauðsynleg forsenda réttrar meðferðar því aðrar orsakir geta legið að baki skertri starfsemi græðlings. Rannsóknir miða að því að þróa aðferðir sem gera kleift að greina bráða höfnun með einföldum og skjótum hætti.
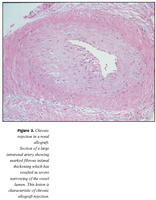
Langvinn höfnun: Langvinn höfnun er algengasta orsök þess að græðlingar tapast í tímans rás og er eitt stærsta vandamálið á sviði líffæraflutninga í dag. Þetta er hægfara ferli sem sést yfirleitt ekki fyrr en nokkrum mánuðum eða árum eftir ígræðslu og er álitið að orsökin felist í endurtekinni bráðri höfnun eða viðvarandi forklínískri (subclinical) höfnun (13). Einkennandi fyrir langvinna höfnun nýra- og hjartagræðlinga eru æðaskemmdir í græðlingnum sem finnast í slagæðum af öllum stærðum (mynd 3). Aðrar sjúklegar breytingar eru mismunandi eftir því hvaða líffæri á í hlut. Í nýravef sést millivefshersli, pípluvisnun og gauklahersli. Í lifur er mikil fækkun gallganga áberandi, í hjarta sést útbreiddur kransæðasjúkdómur og stíflumyndandi berkjungabólga í lunga. Vefjabreytingarnar sýna oftast lítil merki um ónæmissvörun og því óljóst að hve miklu leyti skemmdirnar eru á þeim grundvelli. Því er oft talað um langvinna græðlingsbilun fremur en langvinna höfnun. Margvíslegir þættir, bæði háðir og óháðir ónæmisvaka, virðast eiga þátt í meinmyndun langvinnrar græðlingsbilunar (14,15). Áhættuþættir af ónæmisfræðilegum toga eru bráð höfnun, HLA-ósamræmi, HLA-mótefni og ófullnægjandi ónæmisbæling. Aðrir mögulegir áhættuþættir langvinnrar græðlingsbilunar eru blóðþurrðarskaði á varðveislutíma líffærisins, lyf eins og cýklósporín og þekktir áhættuþættir æðakölkunar, svo sem reykingar, háþrýstingur og hækkuð blóðfita.
Ónæmisbælandi meðferð líffæraþega
Mikil þróun hefur orðið á sviði ónæmisbælandi meðferðar líffæraþega á undanförnum árum og hafa ný ónæmisbælandi lyf stöðugt verið að skjóta upp kollinum. Takrólímus og mýkófenólat mófetíl hafa þegar öðlast sess í viðhaldsmeðferð fyrir ýmsar tegundir líffæragræðlinga. Mörg lyf er nú verið að meta í klínískum tilraunum og er markmiðið að finna lyf sem eru virkari og jafnframt öruggari en þau sem nú eru í notkun.Helstu ónæmisbælandi lyf: Cýklósporín (Sandimmun®, Neoral®): Cýklósporín er lítið, hringlaga peptíð sem var einangrað úr sveppinum Tolypocladium inflatum (16). Það er lítt leysanlegt í vatni og frásog þess er háð gallsöltum. Lyfið blokkar virkni kalsíneuríns, sem er lykilensím í boðkerfi viðtækis T-frumna, og hamlar þannig umritun IL-2 og mögulega fleiri gena sem eiga þátt í virkjun T-frumna (17,18). Lyfið er því sértækur hemill T-frumu virkjunar og hefur kröftuga virkni gegn höfnun græðlinga. Mörg lyf hafa mikilvægar milliverkanir við cýklósporín en það er brotið niður af CYP3A ensímkerfinu í lifur. Lyf sem örva þetta ensímkerfi valda lækkun á blóðþéttni cýklósporíns en lyf sem hafa bælandi áhrif valda hækkun á blóðþéttni (16). Hið fyrrnefnda getur leitt til höfnunar og hinu síðarnefnda fylgir hætta á eiturhrifum á nýru eða óhóflegri ónæmisbælingu. Dæmi um lyf sem valda hækkun á blóðþéttni cýklósporíns eru verapamíl, diltíazem, erýtrómýcín og ketókónazól en lyf sem valda lækkun á blóðþéttni eru fenýtóín, karbamazepín og rífampín. Helsta aukaverkun cýklósporíns er eiturvirkni á nýru sem getur birst á margvíslegan hátt, meðal annars sem bráð starfræn skerðing á nýrnastarfsemi, bráður smáæðasjúkdómur (blóðrauðaleysandi-þvageitrunarheilkenni) eða óafturkræf langvinn nýrnabilun (16). Oftast er um að ræða afturkræfa skerðingu á nýrnastarfsemi sem stafar af herpingu í aðliggjandi slagæðlingum gaukla og svarar til 30-40% minnkunar á gaukulsíunarhraða. Aðrar aukaverkanir eru eiturvirkni á lifur og taugar, háþrýstingur, sykursýki og hvimleiðar aukaverkanir eins og ofvöxtur tannholds og óeðlilega mikill hárvöxtur (16). Vegna alvarlegra aukaverkana og tíðra milliverkana við önnur lyf er mikilvægt að hafa náið eftirlit með blóðþéttni cýklósporíns. Neoral er lyfjaform sem byggir á örfleytitækni (microemulsion) er gefur betra frásog og öruggara aðgengi (19).
Takrólímus (FK506, Prograf®): Takrólímus er hringlaga makrólíð og voru ónæmisbælandi áhrif þess uppgötvuð árið 1985 (20). Lyfið er fitusækið eins og cýklósporín en frásog þess er ekki háð galli. Það hefur margfalt kröftugri ónæmisbælandi virkni en cýklósporín. Verkunarmátinn er hinn sami, það er lyfið blokkar virkni kalsíneuríns og bælir þannig virkjun T-frumna (18). Þá er takrólímus brotið niður af sama ensímkerfi og milliverkanir eru að líkindum svipaðar þótt það sé ekki eins vel rannsakað. Samanborið við cýklósporín veldur takrólímus lægra nýgengi bráðrar höfnunar en áhrif á lifun græðlinga eru svipuð (21,22). Takrólímus hefur líkar aukaverkanir og cýklósporín og benda rannsóknir á lifrarþegum til að eiturvirkni á nýru sé ekki minni (23-25). Lyfið veldur þó ekki ofvexti tannholds eða óeðlilegum hárvexti en virðist hins vegar hafa meiri tilhneigingu til að valda sykursýki (24). Notkun lyfsins hefur farið vaxandi á undanförnum árum, einkum hjá lifrarþegum.
Azatíóprín (Imuran®, Imurel®): Azatíóprín er samtengd ímidazól afleiða 6-merkaptópúríns (6-MP) sem er umbreytt í 6-MP eftir inntöku (26). 6-MP veldur röskun á myndunarferli púrína og hamlar þannig frumufjölgun (26,27). Þessi áhrif eru ósértæk og því eru aukaverkanir vegna áhrifa á aðrar frumur í tíðri skiptingu, einkum beinmergsfrumur, nokkuð algengar. Azatíóprín er fremur veikt ónæmisbælandi lyf. Aukaverkanir eru meðal annars mergbæling, brisbólga og lifrarbólga.
Mýkófenólat mófetíl (Cellcept®): Notagildi ónæmisbælandi verkunar mýkófenólats fyrir líffæraþega var fyrst lýst 1989. Mýkófenólati er umbreytt í mýkófenólik sýru sem er sértækur hemill inósín mónófosfat dehýdrógenasa (IMPDH) en það er lykilensím í de novo ferli púrínmyndunar (28). Eitilfrumur eru háðar þessu ferli við myndun núkleótíða. Mýkófenólat hefur því sértækari áhrif gegn fjölgun eitilfrumna en azatíóprín. Meðferðartilraunir hafa sýnt að tíðni bráðrar höfnunar nýragræðlinga á fyrsta ári er lægri samanborið við azatíóprín en það hefur ekki leitt til marktækt betri lifunar græðlinga (29,30). Helstu aukaverkanir eru ógleði, niðurgangur og mergbæling.
Barksterar: Sterar hafa fremur veik ónæmisbælandi áhrif en kröftug bólgueyðandi áhrif. Nýlegar rannsóknir benda til að ónæmisbælandi verkun stera byggist á hömlun kjarnaþáttar kappa B (NF-kB) sem virkjar gen margra frumuboðefna (cytokines) við bólgusvörun (31,32). Sterar valda margvíslegum aukaverkunum, meðal annars háþrýstingi, sykursýki, beinþynningu og vaxtarseinkun hjá börnum.
Sírólímus (rapamýcín): Sírólímus er hringlaga makrólíð eins og takrólímus og binst sama prótíni (FKBP) innan frumna (33). Ónæmisbælandi áhrif þess eru þó með öðrum hætti en lyfið blokkar flutning boða sem er miðlað af IL-2 viðtæki og hefur þannig hamlandi áhrif á T- og B-frumusvörun gegn græðlingum (34,35). Sírólímus hefur öflug ónæmisbælandi áhrif. Lyfið hefur ekki eiturvirkni á nýru og því eru bundnar miklar vonir við það. Rannsóknir á notagildi þess hjá líffæraþegum standa nú yfir.
Fjölstofna andeitilfrumumótefni (anti-lymphocyte globulins, anti-thymocyte globulins): Þessi mótefni hafa verið notuð við meðferð líffæraþega síðan í lok sjöunda áratugarins. Þau beinast gegn margvíslegum sameindum á yfirborði T- og B-frumna (36). Áhrifin eru ósértæk en eru fyrst og fremst bundin við T-frumur sem hverfa fljótt úr blóðrásinni eftir gjöf, auk þess sem virkni þeirra er skert. Með hvaða hætti þetta gerist er ekki vitað. Þessi mótefni hafa kröftug ónæmisbælandi áhrif og eru einvörðungu notuð við innleiðslu ónæmisbælandi meðferðar og við meðferð bráðrar höfnunar. Myndun mótefna gegn þeim leiðir til minnkaðrar virkni. Helsta aukaverkun er hiti og kalda (75-80% tilfella) sem stafar af boðefnalosun en forgjöf stera kemur í veg fyrir þessi áhrif. Blóðvatnsveiki og blóðflögufæð koma einnig fyrir. Þá er aukin hætta á tækifærissýkingum og krabbameini vegna mikillar ónæmisbælingar.
Múrómónab-OKT3 (anti-CD3): Þetta einstofna mótefni er framleitt í músum og binst epsilón keðju CD3-sameindar T-frumna (37). Við gjöf þess hverfa T-frumur úr blóðrásinni innan 30-60 mínútna og þær missa hæfni til að geta brugðist við ónæmisvökum. Þetta mótefni hefur afar kröftug ónæmisbælandi áhrif og líkt og fjölstofna mótefnin er það einvörðungu notað við innleiðslu ónæmisbælandi meðferðar og meðferð bráðar höfnunar. Myndun mótefna dregur úr áhrifum lyfsins. Helsta aukaverkun þess er svæsið heilkenni sem samanstendur af hita, köldu, höfuðverk, uppköstum, niðurgangi og lágþrýstingi en það sést eftir fyrsta skammt og er álitið stafa af losun frumuboðefna eins og TNF og IL-2 (38). Forgjöf stera dregur verulega úr alvarleika heilkennisins (39). Aðrar svæsnar aukaverkanir eru lungnabjúgur og heilahimnubólga án sýkingar. Vegna hættu á lungnabjúg er mikilvægt að tryggja að sjúklingar séu ekki ofhlaðnir af vökva er lyfið er gefið. Meðferð með OKT3 getur leitt til alvarlegra sýkinga og myndunar illkynja æxla, einkum eitilfrumukrabbameins.
Mótefni gegn IL-2 viðtæki (anti-CD25): Þetta eru blendingsmótefni manna og músa. Tvö slík mótefni voru nýlega tekin í klíníska notkun, basilixímab (Simulect) sem inniheldur breytilega svæði músa en 70% þess er frá mönnum, og daklízúmab (Zenapax) sem hefur ofurbreytilega svæði músa en 90% er frá mönnum. Þau bindast a-keðju IL-2 viðtækis og blokka verkun IL-2. Álitið er mögulegt að þessi mótefni valdi sértækari ónæmisbælingu en önnur ónæmisbælandi lyf því aðeins virkjaðar T-frumur tjá IL-2 viðtæki. Bæði efnin hafa verið prófuð við innleiðslu ónæmisbælingar nýraþega og draga þau úr tíðni bráðra hafnana en ekki hefur verið sýnt fram á að þau bæti græðlingslifun (40,41). Aukaverkanir eru fáar.
Undirstöðuatriði ónæmisbælandi meðferðar: Helstu markmið eru að:
1. Fyrirbyggja bráða og langvinna höfnun.
2. Forðast óhóflega ónæmisskerðingu.
3. Takmarka óæskilega verkun ónæmis-
bælandi lyfja.
Venja er að nota saman nokkur ónæmisbælandi lyf sem verka á mismunandi stöðum í virkjunarferli T-frumna í því augnamiði að ná sterkum ónæmisbælandi áhrifum með sem minnstum aukaverkunum. Kalsíneurín hemlarnir cýklósporín og takrólímus, eru hornsteinar ónæmisbælandi meðferðar í dag. Algengast er að beitt sé þriggja lyfja meðferð og þá er oftast notað cýklósporín eða takrólímus ásamt azatíópríni eða mýkófenólati mófetíl og prednisólon. Fullkomin samstaða um hvaða samsetning ónæmisbælandi lyfja er ákjósanlegust liggur þó ekki fyrir. Cýklósporín er enn notað í meira mæli en takrólímus enda mun meiri reynsla af notkun þess. Mýkófenólat mófetíl er nú víða tekið fram yfir azatíóprín vegna kröftugri ónæmisbælandi áhrifa auk þess sem það er talið valda minni mergbælingu. Fyrst eftir ígræðslu er jafnan gefin kröftug ónæmisbælandi meðferð því þá er hættan á höfnun mest. Oftast eru notaðir hærri skammtar sömu lyfja og notuð eru í viðhaldsmeðferð. Á sumum ígræðslustofnunum eru fjölstofna andeitilfrumumótefni eða OKT3 notuð við innleiðslu ónæmisbælingar fyrstu 7-14 dagana og er þá beðið með að hefja gjöf cýklósporíns eða takrólímus í fáeina daga. Það hefur dregið mjög úr tíðni snemmkominnar bráðrar höfnunar en hefur ekki skilað sér í bættri langtíma græðlingslifun (42,43). Þessi meðferð kemur einkum að gagni fyrir sjúklinga sem fá nýru með langan kaldan blóðþurrðartíma og þola því illa háa skammta af cýklósporíni eða takrólímus sem álitið er að auki á blóðþurrðarskaða (41). Einnig er slík meðferð talin koma að gagni hjá nýraþegum sem hafa aukna hættu á að fá höfnun vegna HLA-mótefna eða fyrri ígræðslna (42,45,46). Þessi tegund innleiðslumeðferðar hefur þó ekki náð mikilli útbreiðslu vegna aukinnar tíðni alvarlegra aukaverkana, svo sem sýkinga og krabbameins. Á síðustu árum hafa basilixímab og daklízúmab víða verið notuð við innleiðslu ónæmisbælingar. Reynt hefur verið að ná líffæraþegum af sterameðferð og þótt það hafi tekist í völdum tilfellum, þá hefur það haft aukið nýgengi bráðrar höfnunar í för með sér og mögulega verri græðlingslifun (47).
Við meðferð bráðrar höfnunar er oftast beitt háskammtasterameðferð og fæst góð svörun í um 70-80% tilfella (48,49). Fáist ekki svörun við sterameðferð er hægt að grípa til meðferðar með OKT3 eða fjölstofna andeitilfrumumótefni. OKT3 snýr við 80-90% bráðra hafnana og meira en 50% bráðra hafnana sem ekki svara sterameðferð (48,50). Nýlegar rannsóknir benda til að sé skipt úr lyfinu cýklósporín yfir í takrólímus geti það komið að gagni við meðferð bráðrar höfnunar sem ekki svarar hefðbundinni meðferð (rescue therapy) (51-53). Þá eru vísbendingar um að mýkófenólat geti haft notagildi í meðferð bráðrar höfnunar sem svarar ekki hefðbundinni meðferð (54). Aukin ónæmisbæling hefur ekki komið að gagni við meðferð langvinnrar höfnunar. Miklar vonir eru bundnar við að nokkur af nýrri lyfjunum bæti úr því, einkum mýkófenólat mófetíl, sírólímus og mótefnin gegn IL-2 viðtæki. Þá er vonast til að unnt verði að komast hjá notkun kalsíneurín hemla og langvarandi sterameðferð í framtíðinni.
Fylgikvillar ónæmisbælandi lyfjameðferðar
Helstu fylgikvillar líffæraígræðslu eru sýkingar og krabbamein sem hvort tveggja má rekja til ónæmisbælingar. Ýmsir aðrir fylgikvillar geta komið fram og tengjast flestir aukaverkunum ónæmisbælandi lyfja.Sýkingar: Orsakir sýkinga eru margvíslegar, allt frá algengum bakteríum og veirum sem sýkja heilbrigða einstaklinga til tækifærissýkla sem einvörðungu hafa klíníska þýðingu hjá ónæmisbældum sjúklingum. Bólgusvörun líffæraþega er trufluð vegna ónæmisbælingar og hefur það í för með sér að klínísk teikn og breytingar á röntgenmyndum eru oft lítt áberandi. Þetta getur valdið töf á greiningu sem er lykill að árangursríkri meðferð. Meginmarkmið er að fyrirbyggja sýkingar.
Hættan á sýkingum ræðst einkum af tveimur þáttum, annars vegar þeim meinvöldum sem sjúklingurinn er útsettur fyrir og hins vegar öllum þeim þáttum sem leiða til aukins næmis fyrir sýkingum (55). Mögulegir meinvaldar finnast í samfélaginu, til dæmis inflúensuveira og salmónella, eða á sjúkrahúsum, til dæmis pseudómónas, vankómýcín-ónæmir enterókokkar, meticillín-ónæmir klasakokkar og legíónella. Einnig getur verið um gamalt smit að ræða, til dæmis berkla en sjaldgæft er að sýking berist með ígrædda líffærinu. Næmi fyrir sýkingum er ákvarðað af víxlverkunum nokkurra þátta. Meðal þeirra eru skammtar og tímalengd ónæmisbælandi lyfja, samverkandi sjúkdómar (til dæmis sykursýki), aðskotahlutir eða vefjaskemmdir (til dæmis æðaleggir og dauðir vefir), hlutleysiskyrningafæð (neutropenia) og sýkingar af völdum ónæmisbælandi veira til dæmis cýtómegalóveiru og Epstein-Barr veiru (55).
Ákveðnar sýkingar eiga sér einkum stað á mismunandi tímbilum eftir ígræðslu og kemur sú vitneskja að notum við mismunagreiningu sýkinga hjá líffæraþegum (56). Á fyrsta mánuðinum eru hefðbundnar bakteríusýkingar algengar og er oftast um að ræða sýkingar í lungum, kviðarholi, þvagvegum, skurðsárum eða í tengslum við æðaleggi. Tækifærissýkingar sjást einkum einum til sex mánuðum eftir ígræðslu og er cýtómegalóveira þá höfuðskaðvaldur en einnig má nefna listeríu, aspergillus og Cryptococcus neoformans. Eftir sex mánuði eru hefðbundnar samfélagsbakteríusýkingar algengastar meðal sjúklinga með stöðuga græðlingsstarfsemi. Slíkar sýkingar hafa þó tilhneigingu til að vera alvarlegri en hjá einstaklingum með heilbrigt ónæmiskerfi. Lítill hluti líffæraþega er með lélega græðlingsstarfsemi en þeir einstaklingar hafa oft sögu um endurtekna bráða höfnun sem þarfnast hefur kröftugrar ónæmisbælandi meðferðar. Þessir sjúklingar hafa aukna hættu á síðkomnum tækifærissýkingum. Veirur eru sérlega skæðar fyrir hina ónæmisbældu líffæraþega, einkum cýtómegalóveira sem getur orsakað margvísleg vandamál eins og fram kemur í töflu I (55). Veiran getur ýmist borist með ígrædda líffærinu eða blóðgjöf eða endurvakist fyrir tilstilli ónæmisbælandi lyfja. Cýtómegalóveiru-neikvæðir þegar líffæra frá cýtómegalóveiru-jákvæðum gjöfum eru í mestri hættu á að fá klíníska sýkingu (yfir 50%). Epstein-Barr veira hefur einnig mikla þýðingu vegna þáttar hennar í meinmyndun eitilfrumukrabbameins hjá líffæraþegum (post-transplant lymphoproliferative disease) (58). Líffæraþegar sem eru smitaðir af lifrarbólgu B og C hafa aukna hættu á virkri langvinnri lifrarbólgu eftir ígræðslu (55). Sveppasýkingar hafa tilhneigingu til að vera útbreiddar hjá líffæraþegum.
Sýklalyfjameðferð hjá líffæraþegum:
Meginreglur:
1. Áhersla á fyrirbyggjandi meðferð.
2. Breiðvirk beta-laktam lyf, quinólón og
flúkónazól eru gjarnan valin.
3. Forðast ber lyf sem geta haft eiturvirkni á nýru,
einkum amínóglýkósíð og amfóterícín B.
Fyrirbyggjandi sýklalyfjameðferð hefur skilað miklum ávinningi fyrir líffæraþega. Lágskammta trímetóprím-súlfametoxazól í 6-12 mánuði eftir ígræðslu hefur nær útrýmt lungnabólgu af völdum Pneumocystis carinii og dregið mjög úr sýkingum af völdum Nocardia asteroides, Listeria monocytogenes og Toxoplasma gondii (55). Þessi meðferð hefur einnig minnkað verulega nýgengi þvagfærasýkingar hjá nýraþegum (59). Mýkóstatín eða ketókónazól er gefið til að fyrirbyggja Candida sýkingar meðan á sýklalyfjameðferð stendur. Loks hefur fyrirbyggjandi meðferð gegn cýtómegalóveiru dregið mjög úr tíðni og alvarleika sýkinga af völdum veirunnar, sérstaklega eftir að farið var að nota gancíklóvír (60). Fyrirbyggjandi meðferð hefur einkum beinst að cýtómegalóveiru-neikvæðum þegum líffæra frá cýtómegalóveiru-jákvæðum gjöfum. Víða er nú farið að gefa öllum líffæraþegum gancíklóvír fyrstu þrjá mánuðina eftir ígræðslu. Þá hafa rannsóknir sýnt umtalsverða lækkun á nýgengi cýtómegalóveirusjúkdóms þegar gancíklóvír er gefið samfara meðferð með OKT3 eða andeitilfrumumótefni (preemptive- meðferð) (61). Loks er venja er að bólusetja líffæraþega gegn inflúensu, lungnabólgusýklum og lifrarbólgu B.
Illkynja sjúkdómar: Rannsókn á meira en 9000 krabbameinum sem skráð hafa verið í Krabbameinsskrá líffæraþega í Cincinnati í Bandaríkjunum (Cincinnati Transplant Tumor Registry), sem er alheimsgagnagrunnur, hefur varpað ljósi á tíðni krabbameina hjá þessum sjúklingum (62). Hætta líffæraþega á að fá krabbamein er um 100 sinnum meiri en hjá almennu þýði. Hjá nýraþegum er nýgengi krabbameina um 6% og um 1% deyja af völdum þeirra (63). Stór hluti krabbameina sem hrjá líffæraþega eru húðkrabbamein sem eru sérlega algeng á sólríkum svæðum. Meðal annarra krabbameina sem hafa aukna tíðni í þessum sjúklingahópi eru eitilfrumukrabbamein, Kaposi-sarkmein, krabbamein í leghálsi, krabbamein í sköpum og spöng, nýrnakrabbamein, getur verið í báðum nýrum krabbamein í lifur og gallvegum og ýmis sarkmein (64). Á hinn bóginn eru þau krabbamein sem eru algengust í almennu þýði, til dæmis krabbamein í lungum, blöðruhálskirtli og ristli, ekki algengari meðal líffæraþega og brjóstakrabbamein er fátíðara (65). Ljóst er að langvinn bæling ónæmiskerfisins veikir getu einstaklingsins til að bregðast við krabbameinsvöldum svo sem sólarljósi og krabbameinsvaldandi veirum.
Eitilfrumukrabbamein hjá líffæraþegum er verulegt vandamál en nýgengi þess er 30-50 sinnum algengara en í almennu þýði (60). Nýgengi þess er 1,0% hjá nýraþegum, 2,7% hjá lifrarþegum, 3,3% hjá hjartaþegum og 3,8% hjá lungna- eða hjarta- og lungnaþegum. Hærra nýgengi hjá þegum annarra líffæra en nýrna skýrist líklega af þörf fyrir meiri ónæmisbælandi meðferð sem endurspeglar nauðsyn þess að bæla niður höfnun til að bjarga lífi sjúklinga. Við svæsna höfnun nýragræðlinga kemur hins vegar til greina að stöðva ónæmisbælandi meðferð og setja sjúklinga í skilunarmeðferð. Sterk tengsl eru á milli Epstein-Barr veiru og meinmyndunar eitilfrumukrabbameins hjá líffæraþegum (58). Áhættan er meiri eftir því sem ónæmisbæling er kröftugri og eru það einkum hin öflugu ónæmisbælandi lyf, OKT3 og fjölstofna andeitilfrumumótefni sem valda verulega aukinni áhættu fyrir þennan sjúkdóm (66). Eitilfrumukrabbamein hjá líffæraþegum er fyrst og fremst B-frumu sjúkdómur sem getur verið allt frá góðkynja, fjölstofna eitilfrumufjölgun upp í einstofna eitilfrumukrabbamein (67). Sjúkdómur utan eitla finnst í um 70% tilfella, þar af finnast æxli í heila hjá 27% (62). Nákvæm vefjagreining og flæðissjárgreining er þungamiðja sjúkdómsgreiningar. Góðkynja eitilfrumufjölgun er meðhöndluð með minnkun ónæmisbælingar og veirulyfi (acýklóvír eða gancíklóvír) og svarar þeirri meðferð yfirleitt vel. Jafnvel stöku einstofna æxli svara slíkri meðferð en oftast þarf jafnframt að beita krabbameinslyfjameðferð, geislun eða skurðaðgerð. Aðrar veirur sem tengjast krabbameinsmyndun eru vörtuveira (human papilloma virus) sem veldur krabbameini í vör, leghálsi, sköpum, spöng og endaþarmi og lifrarbólguveirur B og C sem valda lifrarfrumukrabbameini (55). Þá hefur verið sýnt fram á tengsl milli Kaposi-sarkmeins og herpesveiru 8 (68).
Meðferð krabbameina er hin sama og hjá öðrum en framvinda er oft hraðari og horfur afar slæmar ef um langt genginn sjúkdóm er að ræða. Fyrirbyggjandi aðgerðir hafa mikla þýðingu. Mikilvægt er að forðast óþarflega mikla ónæmisbælingu, einkum andeitilfrumumótefni. Ennfremur er gagnlegt að verja húðina fyrir sólarljósi með klæðnaði og sólarvörn. Reglubundin húðskoðun, leghálsskoðun og brjóstamyndataka hafa einnig þýðingu.
Aðrir langvinnir fylgikvillar: Hjarta- og æðasjúkdómar: Hjarta- og æðasjúkdómar eru ein algengasta dánarorsök líffæraþega. Hefðbundnir áhættuþættir æðakölkunar varða mestu og er mikilvægt að meðhöndla þá kröftuglega. Mikilvægt er að huga að hjarta- og æðasjúkdómum fyrir ígræðslu.
Háþrýstingur: Um 60-80% líffæraþega hafa háþrýsting, enda algeng aukaverkun, sérstakleg cýklósporíns og takrólímus og í minna mæli stera (69,70). Meðferð beinist að skerðingu á inntöku salts, lækkun skammta cýklósporíns og takrólímus ef kostur er og notkun blóðþrýstingslækkandi lyfja. Kalsíum blokkar og beta blokkar eru heppileg lyf auk þess sem þvagræsilyf koma oft að gagni.
Hækkuð blóðfita: Hækkun á kólesteróli og þríglýceríðum finnst hjá mörgum líffæraþegum (71). Þá er HDL-kólesteról oft lækkað. Orsök blóðfituhækkunar er fjölþætt og meðal annars eiga sterar, cýklósporín og takrólímus þátt í henni (72). Takrólímus virðist þó hafa minni tilhneigingu í þessa átt en cýklósporín (73). Meðferð byggist á því að halda steraskammti í lágmarki, fitusnauðu fæði og kólesteróllækkandi lyfjameðferð (74). Statín eru kjörlyf sökum virkni þeirra og lítilla aukaverkana.
Nýrnabilun: Cýklósporín og takrólímus geta leitt til langvinnrar nýrnabilunar hjá líffæraþegum (75,76). Eldri rannsóknir á hjartaþegum sýndu að allt að 10% fengu lokastigsnýrnabilun eftir átta ára cýklósporínmeðferð (77). Nýlegri rannsóknir benda til mun lægri áhættu samfara lægri skömmtum cýklósporíns eða innan við 3% (78). Mikilvægt er að forðast önnur lyf sem geta haft skaðleg áhrif á nýru.
Beinsjúkdómar: Beinþynning er algengt vandamál meðal líffæraþega. Sterar valda minnkun beinmassa og cýklósporín og takrólímus hafa einnig áhrif í þá veru (77). Mikilvægt er að fylgjast með beinþéttni. Meðferð er svipuð og hjá öðrum sjúklingum með beinþynningu, það er kalsíum og D vítamín, bisfosfonöt, ásamt estrógen uppbótarmeðferð hjá konum eftir tíðahvörf. Beindrep, oftast í lærleggshaus, sést hjá allt að 15% líffæraþega og krefst yfirleitt ísetningar gerviliðs. Það er talið tengjast sterameðferð.
Niðurlag
Skammtíma lifun ígræddra líffæra er nú mjög góð en hægfara tap græðlinga af völdum langvinnrar höfnunar er mikið vandamál. Framfarir á sviði ónæmisbælandi meðferðar hafa ekki haft nein teljandi áhrif á það ferli. Nauðsynlegt er að finna sértækari ónæmisbælandi lyf sem fyrirbyggja höfnun hins ígrædda líffæris en hafa ekki í för með sér alvarlega fylgikvilla eins og sýkingar og krabbamein. Endanlegt markmið er að þróa aðferðir til að framkalla þol (tolerance) gegn ígræddum líffærum. Takist það verður ónæmisbælandi meðferð væntanlega óþörf og þá munu þær alvarlegu aukaverkanir sem henni fylgja verða úr sögunni. Heimildir
1. Murray J, Merrill J, Harrison J, Wilston R, Dammin G. Prolonged survival of human kidney homografts by immunosuppressive drug therapy. N Engl J Med 1963; 268: 1315-23.2. Borel J. Comparative study of in vitro and in vivo drug effects on cell-mediated cytotoxicity. Immunology 1976; 31: 631-41.
3. European Multicenter Trial Group. Cyclosporine in cadaveric renal transplantation: one year follow up of a multicenter trial. Lancet 1983; II: 986-9.
4. Penn I. The effect of immunosuppression on preexisting cancers. Transplantation 1993; 55: 742-7.
5. Watanabe F, Mullon C, Hewitt W, Arkadopoulos N, Kahaku E, Eguchi S, et al. Clinical experience with a bioartificial liver in the treatment of severe liver failure. A phase I clinical trial. Ann Surg 1997; 225: 484-91.
6. Scherr K, Jensen L, Koshal A. Mechanical circulatory support as a bridge to cardiac transplantation: toward the 21st century. Am J Crit Care 1999; 8: 324-37.
7. Krensky A, Weiss A, Crabtree G, Davis M, Parham P. T-lymphocyte-antigen interactions in transplant rejection. N Engl J Med 1990; 322: 510-7.
8. Germain R. MHC-dependent antigen processing and peptide presentation: providing ligands for T lymphocyte activation. Cell 1994; 76: 287-99.
9. Sayegh M, Turka L. The role of T cell costimulatory activation in transplant rejection. N Engl J Med 1998; 338: 1813-21.
10. Miceli M, Parnes J. The roles of CD4 and CD8 in T cell activation. Semin Immunol 1991; 3: 133-41.
11. Smith K. Interleukin-2: inception, impact and implication. Science 1988; 240: 1169-76.
12. Williams G, Hume D, Hudson RJ, Morris P, Kano K, Milgrom F. "Hyperacute" renal-homograft rejection in man. N Engl J Med 1968; 279: 611-8.
13. Rush D, Nickerson P, Gough J, McKenna R, Grimm P, Cheang M, et al. Beneficial effects of treatment of early subclinical rejection: a randomized study. J Am Soc Nephrol 1998; 9: 2129-34.
14. Tullius SG, Tilney NL. Both alloantigen-dependent and -independent factors influence chronic allograft rejection. Transplantation 1995; 59: 313-8.
15. Carpenter CB. Long-term failure of renal transplants: adding insult to injury. Kidney Int 1995; 48/Suppl. 50: S40-S44.
16. Kahan BD. Cyclosporine. N Engl J Med 1989; 321: 1725-38.
17. O'Keefe S, Tamura J, Kincaid R, Tocci M, O'Neill E. FK-506- and CsA-sensitive activation of the interleukin-2 promoter by calcineurin. Nature 1992; 357: 692-4.
18. Fruman D, Klee C, Bierer B, Burakoff S. Calcineurin phosphatase activity in T lymphocytes is inhibited by FK 506 and cyclosporin A. Proc Natl Acad Sci USA 1992; 89: 3686-90.
19. Kovarik J, Mueller E, van Bree J, Fluckiger S, Lange H, Schmidt B, et al. Cyclosporine pharmacokinetics and variability from a microemulsion formulation: multicenter investigation in kidney transplant patients. Transplantation 1994; 58: 658-63.
20. Sawada S, Suzuki G, Kawase Y, Takafu F. Novel immunosuppressive agent, FK506: in vitro effects on the cloned T cell activation. J Immunol 1987; 139: 1797-803.
21. Pirsch J, Miller J, Deierhoi M, Vincenti F, Filo R. A comparison of tacrolimus (FK506) and cyclosporine for immunosuppression after cadaveric renal transplantation. Transplantation 1997; 63: 977-83.
22. Mayer A, Dimetrewski J, Squifflet J, Besse T, Grabensee B, Klein B, et al. Multicenter randomized trial comparing tacrolimus (FK506) and cyclosporine in the prevention of renal allograft rejection. Transplantation 1997; 64: 436-43.
23. Textor S, Weisner R, Wilson D, Porayko M, Romero J, Burnett J Jr, et al. Systemic and renal hemodynamic differences between FK506 and cyclosporine in liver transplant recipients. Transplantation 1993; 55: 1332-9.
24. European FK506 Multicenter Liver Study Group. Randomized trial comparing tacrolimus (FK506) and cyclosporine in prevention of liver allograft rejection. Lancet 1994; 344: 423-8.
25. The US Multicenter FK506 Liver Study Group. A comparison of tacrolimus (FK506) and cyclosporine for immunosuppression in liver transplantation. N Engl J Med 1994; 331: 1110-5.
26. Elion G. Biochemistry and pharmacology of purine analogues. Fed Proc 1967; 26: 898-904.
27. Suthanthiran M, Strom TB. Renal Transplantation. N Engl J Med 1994; 331: 365-76.
28. Sievers T, Rossi S, Ghobrial R. Mycophenolate mofetil. Pharmacotherapy 1997; 17: 1178-97.
29. Sollinger H, for the US Renal Transplant Mycophenolate Mofetil Study Group. Mycophenolate mofetil for the prevention of acute rejection in primary cadaveric renal allograft recipients. Transplantation 1995; 60: 225-32.
30. The Tricontinental Mycophenolate Study Group. A blinded, long-term, randomized multicentre study of mycophenolate mofetil in cadaveric renal transplantation: results at three years. Transplantation 1998; 65: 1450-4.
31. Scheinman R, Cogswell P, Lofquist A, Baldwin AJ. Role of transcriptional activation of IkBa in mediation of immunosuppression by corticosteroids. Science 1995; 270: 283-6.
32. Auphan N, Di Donato J, Rosette C, Helmberg A, Karin M. Immunosuppression by glucocorticoids: inhibition of NF-kB activation through induction of IkBa. Science 1995; 270: 286-90.
33. Morris R. Rapamycins: antifungal, antitumor, antiproliferative, and immunosuppressive macrolides. Transplant Rev 1992; 6: 39-87.
34. Chung J, Kuo C, Crabtree G, Blenis J. Rapamycin-FKBP specifically blocks growth-dependent activation of and signaling by the 70 kd S6 protein kinases. Cell 1992; 69: 1227-36.
35. Brunn G, Hudson C, Sekulik A, Williams J, Hosoi H, Houghton PJ, et al. Phosphorylation of the translational repressor PHAS-1 by the mammalian target of rapamycin. Science 1997; 277: 99-101.
36. Helderman J. Review and preview of anti-T cell antibodies. Transplant Proc 1995; 7: 8-9.
37. Suthanthiran M, Morris R, Strom T. Immunosuppressants: Cellular and molecular mechanisms of action. Am J Kidney Dis 1996; 28: 159-72.
38. Abramowicz D, Aschandene L, Goldman M, Crusiaux A, Vereerstraten P, De Pauw L, et al. Release of tumor necrosis factor, interleukin-2, and gamma-interferon in serum after injection of OKT3 monoclonal antibody in kidney transplant recipients. Transplantation 1989; 47: 606-8.
39. Bemelman F, Buysman S, Surachno J, Wilmink J, Schellekens P, ten Berge I. Pretreatment with divided doses of steroids strongly decreases side effects of OKT3. Kidney Int 1994; 46: 1674-9.
40. Nashan B, Moore R, Amlot P, Schmidt A-G, Abeywickrama K, Soulillou J-P. Randomised trial of basiliximab versus placebo for control of acute cellular rejection in renal allograft recipients. Lancet 1997; 350: 1193-8.
41. Vincenti F, Kirkman R, Light S, Bumgardner G, Pescovitz M, Halloran P, et al. Interleukin-2 receptor blockade with daclizumab to prevent acute rejection in renal transplantation. Daclizumab Triple Therapy Study Group. N Engl J Med 1998; 338: 161-5.
42. Norman DJ, Kahana L, Stuart FPJ. A randomized clinical trial of induction therapy with OKT3 in kidney transplantation. Transplantation 1993; 55: 44-50.
43. Szczech L, Berlin J, Aradhye S, Grossman R, Feldman H. Effect of anti-lymphocyte induction therapy on renal allograft survival: a meta-analysis. J Am Soc Nephrol 1997; 8: 1771-7.
44. Novick A, Hwei H, Steinmuller D, Streem SB, Cunningham RJ, Steinhilber D, et al. Detrimental effect of cyclosporine on initial function of cadaver renal allografts following extended preservation: results of randomized prospective trial. Transplantation 1986; 42: 154-8.
45. Cecka JM, Yong WC, Terasaki PI. Analyses of the UNOS Scientific Renal Transplant Registry at three years - early events affecting transplant success. Transplantation 1992; 53: 59-64.
46. Opelz G. Efficacy of rejection prophylaxis with OKT3 in renal transplantation. Transplantation 1995; 60: 1220-4.
47. Hricik D, O'Toole M, Schulak J, Herson J. Steroid-free immunosuppression in cyclosporine-treated renal transplant recipients: a meta-analysis. J Am Soc Nephrol 1993; 4: 1300-5.
48. Ortho Multicenter Transplant Study Group. A randomized clinical trial of OKT3 monoclonal antibody for acute rejection of cadaveric renal transplants. N Engl J Med 1985; 313: 337-42.
49. Adams D, Neuberger J. Treatment of acute rejection. Semin Liver Dis 1992; 12: 80-8.
50. Solomon H, Gonwa T, Mor E, Holman MJ, Gibbs J, Watemberg I, et al. OKT3 rescue for steroid-resistant rejection in adult liver transplantation. Transplantation 1993; 55: 87-91.
51. Jordan M, Shapiro R, Vivas S, Scantlebury V, Rhandhawa P, Carrieri G, et al. FK506 "rescue" for resistant rejection of renal allografts under primary cyclosporine immunosuppression. Transplantation 1994; 57: 860-5.
52. Woodle E, Thistlethwaite J, Gordon J, Laskow D, Deierhoi MH, Burdick J, et al. A multicenter trial of FK506 (tacrolimus) therapy in refractory acute renal allograft rejection. Transplantation 1996; 62: 594-9.
53. Armitage J, Kormos R, Morita S, Fung J, Marrone G, Hardesty R, et al. The clinical trial of FK-506 as primary and rescue immunosuppression in adult cardiac transplantation. Ann Thor Surg 1992; 54: 205-10.
54. The Mycophenolate Mofetil Renal Transplantation Study Group. Mycophenolate mofetil for the treatment of a first acute renal allograft rejection. Transplantation 1998; 65: 235-41.
55. Fishman J, Rubin R. Infection in organ-transplant recipients. N Engl J Med 1998; 338: 1741-51.
56. Rubin R, Wolfson J, Cosimi A, Tolkoff-Rubin N. Infection in the renal transplant patient. Am J Med 1981; 70: 405-11.
57. Rubin R. Impact of cytomegalovirus infection on organ transplant recipients. Rev Infect Dis 1990; 12/Suppl. 7: S754-S766.
58. Patton D, Wilkowski C, Hanson C, Shapiro R. Epstein-Barr virus determines clonality in post-transplant lymphoproliferative disorders. Transplantation 1990; 49: 1080-4.
59. Tolkoff-Rubin N, Cosimi A, Russel P, Rubin R. A controlled study of trimethoprim-sulfamethoxazole prophylaxis of urinary tract infections in renal transplant recipients. Rev Infect Dis 1982; 4: 614-8.
60. Couchoud C, Cucherat M, Haugh M, Pouteil-Noble C. Cytomegalovirus prophylaxis with antiviral agents in solid organ transplantation: a meta-analysis. Transplantation 1998; 65: 641-7.
61. Hibberd P, Tolkhoff-Rubin N, Conti D, Stuart F, Thistlethwaite J, Neylan J, et al. Preemptive ganciclovir therapy to prevent cytomegalovirus disease in cytomegalovirus antibody-positive renal transplant recipients. Ann Int Med 1995; 123: 18-26.
62. First M, Peddi V. Malignancies complicating organ transplantation. Transplant Proc 1998; 30: 2768-70.
63. Penn I. Malignancy. Surg Clin North America 1994; 74: 1247-57.
64. Penn I. The changing patterns of posttransplant malignancies. Transplant Proc 1991; 23: 1101-3.
65. Penn I. Cancers complicating organ transplantation. N Engl J Med 1990; 232: 1767-8.
66. Swinnen L, Constanzo-Nordin M, Fisher S, O'Sullivan E, Johnson MR, Heroux AL, et al. Increased incidence of lymphoproliferative disorder after immunosuppression with the monoclonal antibody OKT3 in cardiac transplant recipients. N Engl J Med 1990; 323: 1723-8.
67. Nalesnik M, Jaffe R, Starzl T, Demetris AJ, Porter K, Burnham JA, et al. The pathology of posttransplant lymphoproliferative disorders occurring in the setting of cyclosporine A-prednisone immunosuppression. Am J Pathol 1988; 133: 173-92.
68. Quinbi W, Al-furayh O, Almeshari K, Lin SF, Sun R, Heston L, et al. Serologic association of human herpesvirus eight with posttransplant Kaposi's sarcoma in Saudi Arabia. Transplantation 1998; 65: 583-5.
69. First M, Neylan J, Rocher L, Tejani A. Hypertension after renal transplantation. J Am Soc Nephrol 1994; 4/Suppl. 1: S30-S36.
70. Textor S, Canzanello V, Taler S, Schwartz L, Augustine J. Hypertension after liver transplantation. Liver Transpl Surg 1995; 1: 20-8.
71. Kobashigawa J, Kasiske B. Hyperlipidemia in solid organ transplantation. Transplantation 1997; 63: 331-8.
72. Hohage H, Arlt M, Bruckner D, Dietl K, Zidek W, Spieker C. Effects of cyclosporine A and FK 506 on lipid metabolism and fibrinogen in kidney transplant recipients. Clin Transplant 1997; 11: 225-30.
73. Satterthwaite R, Aswad S, Sunga V, Shidban H, Bogaard T, Asai P, et al. Incidence of new-onset hypercholesterolemia in renal transplant patients treated with FK506 or cyclosporine. Transplantation 1998; 65: 446-9.
74. Arnadottir M, Berg A. Treatment of hyperlipidemia in renal transplant recipients. Transplantation 1997; 63: 339-45.
75. Pattison J, Petersen J, Kuo P, Valantine V, Robbins C, Theodore J. The incidence of renal failure in one hundred consecutive heart-lung transplant recipients. Am J Kidney Dis 1995; 26: 643-8.
76. Fisher N, Nightingale P, Gunson B, Lipkin G, Neuberger J. Chronic renal failure following liver transplantation. Transplantation 1998; 66: 59-66.
77. Myers B, Newton L. Cyclosporine-induced chronic nephropathy: An obliterative microvascular injury. J Am Soc Nephrol 1991; 2/Suppl. 1: S45-S52.
78. Gonwa T, Mai M, Pilcher J, Johnson C, Pierson S, Capehart J, et al. Stability of long-term renal function in heart transplant patients treated with induction therapy and low-dose cyclosporine. J Heart Lung Transplant 1992; 11: 926-8.
79. Cvetkovic M, Mann G, Romero D, Liang X, Ma Y, Jee WS, et al. The deleterious effects of long-term cyclosporine A, cyclosporine G, and FK506 on bone mineral metabolism in vivo. Transplantation 1994; 57: 1231-7.